扩展功能
文章信息
- 赵春云, 杨颂, 欧阳立明, 王永红
- ZHAO Chun-Yun, YANG Song, OUYANG Li-Ming, WANG Yong-Hong
- 高渗提高凝结芽孢杆菌P4-102B菌株的电击转化效率
- High osmolarity improves the electro-transformation efficiency of the gram-positive bacteria Bacillus coagulans P4-102B
- 微生物学通报, 2016, 43(6): 1388-1394
- Microbiology China, 2016, 43(6): 1388-1394
- DOI: 10.13344/j.microbiol.china.160097
-
文章历史
- 收稿日期: 2016-01-27
- 接受日期: 2016-03-10
- 优先数字出版日期(www.cnki.net): 2016-03-21
凝结芽孢杆菌(Bacillus coagulans)从变质的罐装牛奶中分离出来[1],它是一种能产乳酸的芽孢杆菌[2]。除了具有一般乳酸菌的特性外,还有一些非常有价值的特性:它的生长和发酵最适条件为50−55 °C,pH 5.0,底物利用率高[3]。另外,它还能利用不同生物质分解的糖发酵生产生物基化学品,如乳酸、乙醇等[4]。它的生长和发酵温度和工业上常用的真菌纤维素酶的最适温度相近。因此,在同步糖化发酵(SSF)中,利用凝结芽孢杆菌发酵能比利用嗜常温的酵母(30 °C)等菌株发酵纤维素酶的使用量要减少很多[5]。而且因为高的生长温度,低的生长pH,使其在工业上不用灭菌即可发酵生产L-乳酸,节省生产原料成本和时间[6]。
凝结芽孢杆菌具有很多巨大工业应用价值,但是目前在工业上对凝结芽孢杆菌的利用还很少[7],最主要的原因是外源DNA导入凝结芽孢杆菌的效率极低,严重制约着凝结芽孢杆菌的遗传操作和代谢工程的研究。限制转化的原因主要是两方面:(1) 宿主本身的限制修饰系统;(2) 宿主本身的细胞壁的结构。2007年,Rhee等[2]研究发现凝结芽孢杆菌P4-102B转化效率不受DNA的来源限制,即质粒DNA分离提取于甲基化缺陷的Escherichia coli GM272或分离提取于凝结芽孢杆菌P4-102B菌株都不会影响转化效率,即凝结芽孢杆菌P4-102B的限制修饰系统不会影响转化效率。因此,凝结芽孢杆菌P4-102B的低转化效率主要是因为凝结芽孢杆菌属于革兰氏阳性菌,细胞壁厚而致密[8]。电击转化方法由于操作简便省时,转化效率相对较高[9],因此目前凝结芽孢杆菌的转化方法主要是电转化法。电转化法是通过高压电击,在细胞壁和细胞膜
上产生瞬间空隙,使得外源DNA进入细胞[10-11]。Rhee等曾报道在低渗环境电转化B. coagulans P4-102B法获得成功[2],但作者经过多次实验,发现此方法重复性和稳定性差。在电击转化中,随着电场强度的增加,产生的疏水小孔越多,细胞膜通透性越好,外源DNA越容易进入细胞,但细胞的死亡率也会随着电场强度的增加而增加。所以要得到较高的电转化率,一方面要提高电场强度,另一方面又要尽量降低细胞死亡率。细胞在电击后很容易死亡,其主要原因是电击导致细胞膜穿孔,会使部分细胞壁和细胞膜重新复原的能力丧失以及细胞内容物流出导致细胞死亡。此时若高渗剂存在,由于能给细胞提供一个较细胞内胞质渗透压高的环境而且高渗剂能使细胞收缩,提高细胞膜的再密封能力,因此能降低细胞内容物的流出速度,提高细胞的存活率,最终提高电转化效率[9]。同时很多其它因素都能影响电击转化法的效率,包括生长培养基[12]、生长状态[13]、电场强度[14]、质粒的浓度、质粒的纯度[15]、电击缓冲液[16]、感受态细胞的数量[13]、复苏培养基[17]等。本研究首先采用添加高渗剂的LB培养基进行细胞培养,以提高感受态细胞对高渗环境适应能力,继而对菌体的生长状态和电击缓冲液中高渗剂的种类和组合、复苏培养基中山梨醇的浓度进行优化,从而提高凝结芽孢杆菌P4-102B的转化稳定性和转化效率。
1 材料与方法 1.1 菌株和质粒菌株:凝结芽孢杆菌(Bacillus coagulans) P4-102B由K. T. Shanmugam教授赠送;大肠杆菌(Escherichia coli) Top10,本实验室保存,用于扩增质粒。
质粒:穿梭质粒pNW33N (4 217 bp),K. T. Shanmugam教授赠送;氯霉素抗性质粒pIM1773-PRHIII-sfGFP-pNW33N (5 062 bp)购买于Addgene Vector Database;氯霉素抗性和荧光蛋白基因[18]。
1.2 培养基LB培养基(g/L)[18],固体培养基加入2%的琼脂糖(用于培养大肠杆菌pH 7.0,用于培养凝结芽孢杆菌pH 5.0)。
GM (Growth medium)培养基(g/L):NaCl 10,酵母提取物5,蛋白胨10,0.5 mol/L山梨醇,pH 5.0,用于培养凝结芽孢杆菌。
RGM1 (Re-growth medium)培养基(g/L):NaCl 10,酵母提取物5,蛋白胨10,甘露醇0.38 mol/L,山梨醇0.2 mol/L,pH 5.0,用于电击后凝结芽孢杆菌的复苏。RGM2 (Re-growth medium)培养基(g/L):NaCl 10,酵母提取物5,蛋白胨10,蔗糖0.5 mol/L,MgCl2 20 mmol/L,葡萄糖1%。
1.3 主要试剂和仪器氯霉素、蔗糖、山梨醇、甘露醇均购自上海生工生物工程有限公司;pfu DNA聚合酶购自天根生化科技(北京)有限公司;琼脂糖及DNA Marker购自宝生物(大连)有限公司;质粒DNA小量抽提试剂盒购自爱思进生物技术(杭州)有限公司。
氯霉素:储存浓度为7.5 g/L,工作浓度为7.5 mg/L。
基因导入仪(GenePulser Xcell),美国伯乐有限公司;荧光显微镜(M30C),万衡仪器有限公司。
1.4 电击缓冲液 (Electroporation medium,ETM)SMG电击缓冲液:0.5 mol/L山梨醇,0.5 mol/L甘露醇,10% (质量体积比)甘油。
MG电击缓冲液:0.5 mol/L甘露醇,10% (质量体积比)甘油。
SG电击缓冲液:0.5 mol/L山梨醇,10% (质量体积比)甘油。
SG1电击缓冲液:0.5 mol/L蔗糖,10% (质量体积比)甘油。
1.5 引物合成为了验证转化子,设计引物CAT F/R拷贝出质粒pNW33N的氯霉素抗性。引物合成由上海生工生物有限公司进行。引物:CATF:5′-CCCGGGTGA TTCTAATGAAGAAAGCAGACAAGTAAGCC-3′,CATR:5′-CCCGGGATTTCGAATCGTGCCAGCCC TTCAAACTTCCCA-3′。
1.6 凝结芽孢杆菌质粒的提取质粒的提取参照Rhee等[2]的碱裂解法,B. coagulans P4-102B转化子在4 mL LB液体培养基中50 °C、200 r/min培养过夜。培养好的菌体4 °C、10 000 r/min离心5 min收集菌体。菌体用500 μL SET (25%蔗糖,50 mmol/L EDTA,50 mmol/L Tris pH 8.0)试剂洗涤3次,将菌体悬浮在250 μL含有 1 g/L溶菌酶和40 g/L RNase的SET中,37 °C水浴30 min,直至菌液变澄清。加入250 μL碱裂解液 (0.2 mol/L NaOH,1% SDS),轻轻混匀,放置3 min,直到悬浮液变澄清。然后加入250 μL酸性中和试剂(3 mol/L K+-5 mol/LCOOH−),轻轻混匀,离心10 min。用苯酚抽提法去除蛋白(苯酚׃氯仿׃异戊醇= 25׃24׃1,体积比)。加入异丙醇沉淀质粒DNA,70%的乙醇洗涤质粒DNA,倒掉乙醇,晾干。加适量超纯水溶解质粒,−20 °C保存质粒。
1.7 凝结芽孢杆菌感受态的制备通过LB培养基划线纯化B.coagulans P4-102B,挑取单菌落接种于15 mL新鲜LB液体培养基中,50 °C静置培养过夜。从培养过夜的摇瓶中取750 μL菌液接种至含有50 mL新鲜GM培养基中,50 °C、200 r/min培养至OD600达到0.4时,将生长好的菌液转移至50 mL离心管中,4 °C、5 000 r/min离心10 min,去除上清,用预冷的30 mL电击缓冲液重复洗涤4次菌体,最后用4 °C预冷的电击缓冲液悬浮感受态细胞,使感受态细胞的数量为10×109-10×1010个/mL,并分装到预冷的1.5 mL无菌离心管中,每管80 μL,4 °C放置,待用。
1.8 质粒电击转化将50 ng质粒pNW33N加入80 μL凝结芽孢杆菌感受态细胞悬液中,并轻轻混合,4 °C放置10 min。用移液枪转移至预冷的1 mm电转杯中,将电转杯壁外擦拭干净,置于电穿孔仪中,设置参数14 kV/cm、5 ms进行电击。电击结束后,将1 mL复苏培养基RGM1立即加入电转杯中,把电转杯中的含菌液体转入至含有1 mL RGM1培养基的eppendorf管里,50 °C、100 r/min培养3 h。然后5 000 r/min离心10 min收集菌体,菌体重悬在0.2 mL RGM1中,菌液涂布于氯霉素抗性平板,50 °C培养48 h,挑取转化子验证。
1.9 转化子验证由于质粒pNW33N在B. coagulans P4-102B中的拷贝数很低,从转化子中提取质粒直接进行核酸凝胶电泳,在电泳结果所得凝胶中看不到条带。因此在转化子验证中首先提取转化子质粒,再利用提取质粒作为模板,通过质粒上氯霉素抗性基因上下游引物聚合酶链式反应(Polymerase chain reaction,PCR)扩增氯霉素抗性基因。
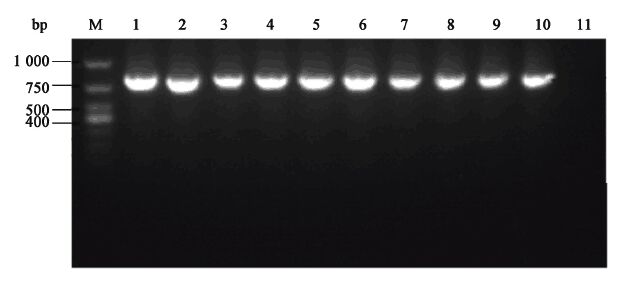
2 结果与分析 2.1 凝结芽孢杆菌转化子的验证随机挑取10个转化后长出来的单克隆,根据1.6节的操作步骤提取单克隆的质粒,并将其作为模板,通过氯霉素抗性基因上下游引物聚合酶链式反应(PCR)扩增氯霉素抗性基因。扩增产物以1%琼脂糖凝胶电泳检测分析,如在约810 bp处出现目的条带,则证明凝结芽孢杆菌P4-102B能在抗性平板上生长是由于转入氯霉素抗性基因所致:另外用原质粒pNW33N作为阳性对照,同时进行琼脂糖凝胶电泳检测,如二者条带位置一样则进一步证明质粒pNW33N已转化入凝结芽孢杆菌P4-102B,电泳结果如图 1所示。
|
| 图 1 转化子的验证 Figure 1 Verification of transformants A:B. coagulans P4-102B的生长曲线;B:菌体不同生长OD600对转化率的影响. M: Marker DL1000. 1−9: The PCR amplification of the plasmid isolation from transformants; 10: The PCR amplification of the plasmid pNW33N; 11: The PCR amplification of the plasmid isolation from negative strain. |
|
|
为了研究凝结芽孢杆菌不同的生长状态对感受态的制备和后期转化的影响,在培养细胞OD600值分别为0.4、0.6、0.8、1.0时,收集菌体,根据1.7节感受态的制备方法,获得不同生长时期的感受态细胞。将穿梭质粒pNW33N根据1.8的操作步骤转化至感受态细胞中,涂布于7.5 mg/L氯霉素抗性的LB固体培养基平板,计数转化菌落,计算转化率,其中电击缓冲液为SMG,再生培养基为RGM1。由图 2中B图可知:当OD600值为0.8时,转化率达到最高,平均为0.4×102 cfu/μg DNA,由图 2A可知,此时菌体为指数生长的中期阶段。当OD600小于0.8时,菌体处在指数生长前期,转化率变低,可能是因为菌体在指数生长前期时,菌体数量不多,在制备感受态时,菌体数量太少;当OD600大于0.8时,菌体在指数生长后期时,菌体过老,细胞壁较厚,细胞壁电穿孔效率降低。

|
| 图 2 菌体的生长状态对转化效率的影响 Figure 2 Effects of growth phase on the electroporation efficiency A:B. coagulans P4-102B的生长曲线;B:菌体不同生长OD600对转化率的影响. A: The growth curve of B. coagulans P4-102B; B: Effects of different OD600 on the electroporation efficiency. |
|
|
在OD600为0.8时,收集菌体制备感受态。制备感受态时用不同的电击缓冲液SMG、MG、SG、SG1洗涤细胞,电击感受态和质粒的混合物。电击后,立即加入含0.2 mol/L山梨醇和0.38 mol/L甘露醇的复苏培养基,48 h后观察转化结果。由图 3可知,在使用SMG制备感受态后立即进行电击转化,转化效率最高,转化率达到1.4×102 cfu/μg DNA。

|
| 图 3 电击缓冲液对转化率的影响 Figure 3 Effects of electroporation medium (ETM) on the electroporation efficiency |
|
|
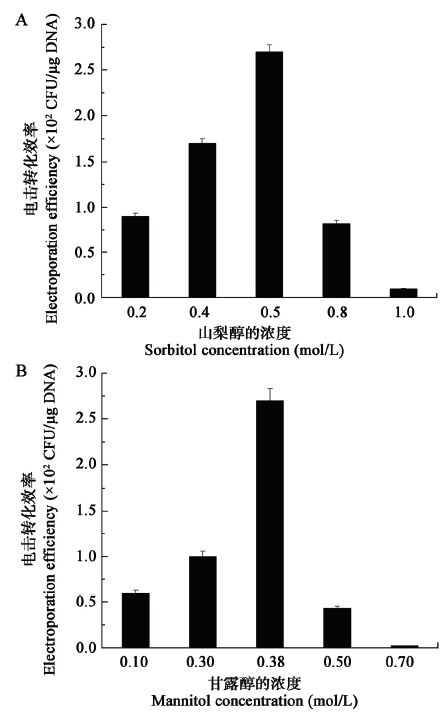
在菌体生长到OD600为0.8时,收集菌体制备感受态,并调节感受态的浓度OD600为20时,电击感受态和质粒的混合物。电击后,立即加入含不同浓度的山梨醇(0.2、0.4、0.5、0.8、1 mol/L)的复苏培养基并观察转化结果。由图 4 A可知,电击后加入含0.5 mol/L山梨醇的复苏培养基时,平均转化率最高达到2.7×102 cfu/μg DNA。为了研究甘露醇对转化效率的影响,在电击转化后立即加入含有0.5 mol/L山梨醇和不同浓度的甘露醇(0.1、0.3、0.38、0.5、0.7 mol/L)的复苏培养基并观察结果。由图 4可知,电击后加入含0.5 mol/L山梨醇和0.38 mol/L甘露醇的复苏培养基时,平均转化率最高达到2.7×102 cfu/μg DNA。电击后加入电击后的复苏培养基中山梨醇的浓度为0.5 mol/L,甘露醇的浓度为0.38 mol/L时,转化率最高;山梨醇的浓度高于0.5 mol/L,甘露醇的浓度高于0.38 mol/L时,转化率快速下降。这可能是因为山梨醇和甘露醇的浓度过大时,体系总渗透压过大影响了细胞的生长。
|
| 图 4 复苏培养基中添加高渗剂对转化效率的影响 Figure 4 Effects of osmotic stabilizers in regeneration media on the electroporation efficiency A:复苏培养基中山梨醇的浓度对转化效率的影响;B:复苏培养基中甘露醇的浓度对转化的影响. A: Effects of sorbitol concentrations in regeneration media on the electroporation efficiency; B: Effects of mannitol concentrations in regeneration media on the electroporation. |
|
|
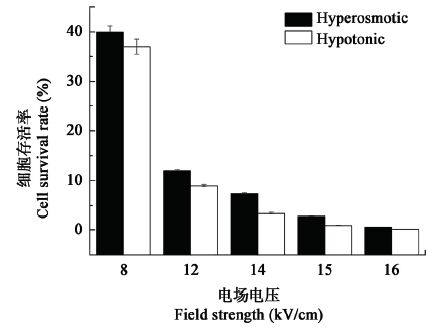
低渗法即根据Rhee等在2007年的报道[2],在低渗环境电击转化凝结芽孢杆菌P4-102B。菌体在LB中培养到细胞OD600为0.8时,根据1.7节感受态的制备方法,用SG1电击缓冲液制备感受态,电击后加入RGM2培养基。高渗法即根据本研究的结果电击转化P4-102B。P4-102B在GM中培养,在菌体细胞OD600值为0.8时,收集菌体,根据1.7节感受态的制备方法,用SMG缓冲液制备感受态,电击后立即加入含0.5 mol/L山梨醇和0.38 mol/L甘露醇的LB复苏培养基。对比两种方法的电击转化率和感受态细胞的存活率(表 1)可知,在相同的电击条件下,高渗条件下的转化率总体都要高于低渗条件下的转化率。在低电压下,高渗条件和低渗条件下的转化率相差不大,但是在高电压的条件下,高渗条件下的转化率要远远的高于低渗条件下的转化率;从表 1还可看到3组平行组的实验中,高渗条件下转化效率的稳定性要远远高于低渗条件。图 5所示细胞存活率研究结果为上述现象提供了支撑。在图 5中,可以看到在相同的电击条件下,高渗条件下细胞的存活率要高于低渗条件下细胞的存活率。在低的电压条件下这种高渗保护细胞作用不明显,但是在高电压条件下,渗透剂能大大提高细胞的存活率。另外,可以看到在高电压条件下,例如14 kV/cm,高渗条件下细胞存活率是低渗条件的2.5倍,可见渗透剂加入大大提高了细胞的存活率。在高渗条件下转化效率高于低渗条件并且高渗条件下的转化效率稳定性更好的的主要原因是:(1) 山梨醇和甘露醇能够使细胞收缩,提高细胞膜的再密封能力,使细胞膜的可逆性回复几率增大,提高了细胞的存活率,并且山梨醇和甘露醇能降低细胞表面的离子强度,减少细胞在电击时的击穿现象,从而提高了细胞的存活率;(2) 山梨醇和甘露醇能增加细胞膜的通透性,使得外界的DNA更容易进入到细胞内。因此经过这两方面的作用,提高了电击转化效率。
| 电场电压 Field strength (kV/cm) | 转化条件 Electroporation condition | 转化效率 Electroporation efficiency (×102 CFU/μg DNA) | ||
| 8 | 高渗 | 0.9 | 0.87 | 0.85 |
| 低渗 | 0.7 | 0.54 | 0.31 | |
| 12 | 高渗 | 1.8 | 1.75 | 1.69 |
| 低渗 | 1.3 | 0.90 | 0.52 | |
| 14 | 高渗 | 2.7 | 2.60 | 2.58 |
| 低渗 | 1.8 | 1.40 | 0.59 | |
| 15 | 高渗 | 1.2 | 1.09 | 1.05 |
| 低渗 | 0.5 | 0.32 | 0.15 | |
| 16 | 高渗 | 0.7 | 0.58 | 0.56 |
| 低渗 | 0.1 | 0.03 | 0 | |
|
| 图 5 渗透剂对电击后细胞存活率的影响 Figure 5 Cell survival rate of B. coagulans P4-102B after electroporation |
|
|
从已有文献[2]可知,本文首次研究了高渗剂对凝结芽孢杆菌电击转化的影响,并且从实际效果来看同一电场压力下高渗体系转化效率较低渗体系明显高,且稳定性和重复性都比较好。通过研究可知,菌体在含有0.5 mol/L山梨醇的高渗培养基中生长,并且在OD600约为0.8时收集,用含0.5 mol/L山梨醇和0.5 mol/L甘露醇的电击缓冲液洗涤菌体制备感受态,在固定电场强度14 kV/cm,脉冲时间5 ms,1 mm规格的电转杯电击转化,以含有0.5 mol/L山梨醇和0.38 mol/L甘露醇的LB复苏培养基培养,获得最佳的转化效率达2.7×102cfu/μg DNA,并且用质粒pIM1773-PRHIII-sfGFP-pNW33N验证了方法的可行性(数据没有列出)。本研究结果为凝结芽孢杆菌的电击转化提供了新的方法,也为凝结芽孢杆菌的基因转移和分子生物学操作奠定了基础。
| [1] | Nakamura LK, Blumenstock I, Claus D, et al. Taxonomic study of Bacillus coagulans Hammer 1915 with a proposal for Bacillus smithii sp[J]. International Journal of Systematic Bacteriology, 1988, 38 (1): 63–73. |
| [2] | Rhee MS, Kim JW, Qian YL, et al. Development of plasmid vector and electroporation condition for gene transfer in sporogenic lactic acid bacterium, Bacillus coagulans[J]. Plasmid, 2007, 58 (1): 13–22. |
| [3] | Wang QZ, Ingram LO, Shanmugam KT. Evolution of D-lactate dehydrogenase activity from glycerol dehydrogenase and its utility for D-lactate production from lignocellulose[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108 (47): 18920–18925. |
| [4] | Ou MS, Mohammed N, Ingram LO, et al. Thermophilic Bacillus coagulans requires less cellulases for simultaneous saccharification and fermentation of cellulose to products than mesophilic microbial biocatalysts[J]. Applied Biochemistry and Biotechnology, 2009, 155 (1/3): 76–82. |
| [5] | Ou MS, Ingram LO, Shanmugam KT. L(+)-Lactic acid production from non-food carbohydrates by thermotolerant Bacillus coagulans[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38 (5): 599–605. |
| [6] | Qin JY, Zhao B, Wang XW, et al. Non-sterilized fermentative production of Polymer-grade L-lactic acid by a newly isolated thermophilic strain Bacillus sp[J]. PLoS One, 2009, 4 (2): e4359. |
| [7] | Su F, Xu P. Genomic analysis of thermophilic Bacillus coagulans strains: efficient producers for platform bio-chemicals[J]. Scientific Reports, 2014, 4 : 3926. |
| [8] | Turgeon N, Laflamme C, Ho J, et al. Elaboration of an electroporation protocol for Bacillus cereus ATCC 14579[J]. Journal of Microbiological Methods, 2007, 67 (3): 543–548. |
| [9] | Xue GP, Johnson JS, Dalrymple BP. High osmolarity improves the electro-transformation efficiency of the gram-positive bacteria Bacillus subtilis and Bacillus licheniformis[J]. Journal of Microbiological Methods, 1999, 34 (3): 183–191. |
| [10] | Tsong TY. 4-Time sequence of molecular events in electroporation[J]. Guide to Electroportion and Electrofusion, 1992 : 47–61. |
| [11] | Zhang GQ, Bao P, Zhang Y, et al. Enhancing electro-transformation competency of recalcitrant Bacillus amyloliquefaciens by combining cell-wall weakening and cell-membrane fluidity disturbing[J]. Analytical Biochemistry, 2011, 409 (1): 130–137. |
| [12] | Peng D, Luo Y, Guo S, et al. Elaboration of an electroporation protocol for large plasmids and wild-type strains of Bacillus thuringiensis[J]. Journal of Applied Microbiology, 2009, 106 (6): 1849–1858. |
| [13] | Lu YP, Zhang C, Lyu FX, et al. Study on the electro-transformation conditions of improving transformation efficiency for Bacillus subtilis[J]. Letters in Applied Microbiology, 2012, 55 (1): 9–14. |
| [14] | Mcdonald IR, Riley PW, Sharp RJ, et al. Factors affecting the electroporation of Bacillus subtilis[J]. Journal of Applied Bacteriology, 1995, 79 (2): 213–218. |
| [15] | Dorella FA, Estevam EM, Cardoso PG, et al. An improved protocol for electrotransformation of Corynebacterium pseudotuberculosis[J]. Veterinary Microbiology, 2006, 114 (3/4): 298–303. |
| [16] | Schlaak C, Hoffmann P, May K, et al. Desalting minimal amounts of DNA for electroporation in E[J]. Biotechnology Letters, 2005, 27 (14): 1003–1005. |
| [17] | Zhang S, Xue ZL, Chen H, et al. Optimization of a Method about electro-transformation in Bacillus subtilis[J]. Journal of Chongqing University of Technology (Natural Science), 2014, 28 (8): 60–63. (in chinese) 张爽, 薛正莲, 陈环, 等. 一种电击转化枯草芽孢杆菌方法 的优化[J]. 重庆理工大学学报: 自然科学版, 2014, 28 (8):60–63. |
| [18] | Kristen B, Srebrenka R, Ichiro M. Transformable facultative thermophile Geobacillus stearothermophilus NUB3621 as a host strain for metabolic engineering[J]. Applied Microbiology and Biotechnology, 2014, 98 (15): 6715. |
 2016, Vol. 43
2016, Vol. 43




