扩展功能
文章信息
- 燕彩玲, 李博, 顾悦, 贾原博, 刘亚东, 贺银凤
- YAN Cai-Ling, LI Bo, GU Yue, JIA Yuan-Bo, LIU Ya-Dong, HE Yin-Feng
- 信号分子AI-2 的检测方法研究进展
- Methods for the determination of autoinducer-2—a review
- 微生物学通报, 2016, 43(6): 1333-1338
- Microbiology China, 2016, 43(6): 1333-1338
- DOI: 10.13344/j.microbiol.china.150514
-
文章历史
- 收稿日期: 2015-07-07
- 接受日期: 2015-08-28
- 优先数字出版日期(www.cnki.net): 2015-11-17
许多细菌在生长过程中会合成、释放并感知到一种自诱导信号分子。当菌体达到一定浓度,这种信号分子会积累到一个阈值,就会调控特定基因的表达,这种现象称为群体感应(Quorum sensing,QS)现象。目前所知,QS可以介导调控细菌一系列的重要功能,如生物发光性、孢子形成、DNA转移、生物膜形成以及抗生素生成、毒力因子形成等[1]。虽然某些群体感应信号分子具有种特异性,如革兰氏阴性(G−)菌通常利用酰基高丝氨酸内酯类(AHLs)作为信号分子,而革兰氏阳性(G+)菌则利用一些自诱导肽类物质作为其信号分子。但近年来发现,另一种信号分子AI-2存在于许多革兰氏阴性菌和革兰氏阳性菌中。还有一些病原菌,如弧菌属和沙门氏菌,也利用AI-2感知细胞浓度[2]。这种特殊的可以作为种间交流的信号分子引起了极大的关注。事实上,AI-2极有可能参与调控细菌重要生理功能相关基因的表达。有研究报道,LuxS基因参与金黄色葡萄球菌的药物敏感性的调控,这很有可能是AI-2的介导作用[3];一些双歧杆菌中由LuxS基因调控产生的AI-2信号分子参与其生物膜形成过程[4],我们也对植物乳杆菌HE-1的生物膜形成与AI-2/LuxS介导的群体感应之间的关系进行了研究,结果显示,植物乳杆菌HE-1生物膜生成时间和生成量与AI-2信号分子的产生时间和产生量非常吻合[5]。
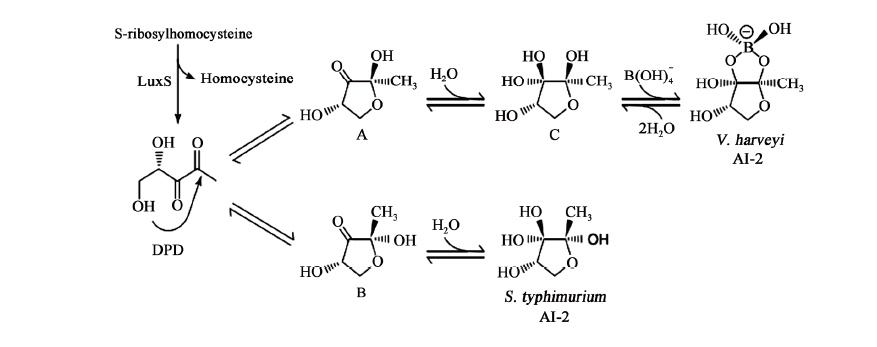
AI-2是由S-腺苷同型半胱氨酸(SAH)经过高半胱氨酸核苷酶(Pfs)和S-腺苷同型半胱氨酸核苷酶(LuxS)的一系列反应被分解转化成腺嘌呤、同型半胱氨酸和4,5-二羟基-2,3-戊二酮(4,5-Dihydroxy-2,3-pentanedione,简称DPD[6])。DPD不稳定,能自发环化形成不同的呋喃化合物,作为AI-2信号分子或AI-2的前体物质。DPD在溶液中形成的不同异构体中,哪种形式的物质才能用来检测AI-2确实是个问题。随后,研究者们利用哈维氏弧菌(Vibrio harveyi)中AI-2的接收蛋白LuxP与配体结合的性质确定出AI-2的活性结构为含硼形式的呋喃酰硼酸二酯,它由(4S)-4,5-二羟基-2,3-戊二酮(4S-DPD)与硼酸分子自动缩合而成,可以使该细菌自发产生荧光。利用鼠伤寒沙门氏菌(Salmonella typhimurium)中AI-2的接收蛋白LrsB确定出AI-2的第二种活性形式不含硼元素,它直接由4,5-二羟基-2,3-戊二酮(DPD)与水缩合环化而成,即(2R,4S)-四羟基四氢呋喃[7-9]。到目前为止,已知的生物体内具有活性的AI-2只有这两种形式。不同细菌中AI-2分子的结构并不一定相同,但是许多学者认为AI-2可能都是DPD的衍生物。所以,一般以DPD为研究对象研究AI-2的合成与降解。作为一种细菌的信号分子,DPD在细胞内的生理浓度非常低,所以提取非常困难,主要以化学合成DPD为主。其中,利用Baylis-Hillman反应化学合成DPD是一种较为简单易行的合成途径[10]。生理条件下的DPD分子以多种形式存在,3种异构体、2种水合物以及与硼酸分子结合等,见图 1[11]。
在V. harveyi中,BAI-2的接收器是LuxP蛋白,LuxP蛋白是细菌周质结合蛋白(bPBPs)中的一种。LuxP/BAI-2复合物与LuxQ蛋白相互作用,LuxQ蛋白是一种双组份磷酸感应激酶,磷酸转移酶蛋白LuxU识别LuxPQ并将之传递给下游反应调节蛋白LuxO,LuxO根据是否处于磷酸化状态决定开启或关闭LuxCDABE启动子的表达。像其它bPBPs一样,LuxP由两个区域组成,两区域由枢纽区联接,在这两个区域的接触面上存在有配体结合区,当BAI-2与之结合,两区域关闭,完全卷入配体。在Salmonella typhimurium菌中,LrsB蛋白识别R-THMF异构体将其吸收到细胞质中,LrsB蛋白也是一种bPBP,结构类似于LuxP[12]。
基于AI-2可能参与细菌细胞中重要的生理生化作用,对其进行定量检测是必不可少的。目前,研究者们在已有方法的基础上仍然在不断地进行优化与探索。本文对典型的检测AI-2的方法进行综述,比较每一种方法的优缺点,为以后能准确定量检测AI-2以及深入研究AI-2的作用机理提供参考。
1 信号分子AI-2的定量检测方法 1.1 V. harveyi BB170生物学发光法这是由Bassler等构建的,也是最早用来检测AI-2的方法[13],是目前使用最普遍最常用的的方法。该方法需要利用V. harveyi BB170 (一种突变菌株,其发出的荧光只受AI-2信号分子的调控)作为报告菌株。首先要收集待测菌的培养上清液,加入到V. harveyi报告菌株的稀释液(将V. harveyi BB170 接种到AB培养基,30 °C通气培养过夜至OD600值为0.7−1.2,然后以1:5 000比例稀释到新鲜AB培养基中),以AB培养基作为阴性对照,细菌生长培养基作为介质对照,V. harveyi BB152 (AI-2+)上清液作为阳性对照。使用光度计,在490 nm处测量每个样品的发光情况(还有一些光度计,这一步设置为化学发光模式)。外源添加含有AI-2的样品溶液后,报告菌株诱导发光的时间会提前,根据V. harveyi BB170诱导发光强度计算AI-2的活性[11]。
这个方法主要用于检测目标菌株培养液中的AI-2,也能够比较不同菌株变异体产生AI-2的相对浓度。同时,这是一种简单、方便、廉价的检测AI-2的方法,能够筛选大量样品。但是,该方法对实验条件非常敏感,培养基中所有成分都会影响V. harveyi BB170报告菌株的生长和发光,比如pH、 蔗糖以及高浓度的AI-2本身等,从而影响AI-2的检测,出现假阳性或假阴性的结果,不能作为准确定量AI-2的方法。
但基于该方法的优点及应用的普遍性,并且当时由于AI-2浓度低且不稳定,利用高效液相色谱(HPLC)和气谱(GC)检测还比较困难,有研究者对其进行了优化修饰,并系统分析了影响诱导发光的一些参数。结果表明,一些微量元素对实验有很大的影响。特别地,Fe3+显著促进了V. harveyi BB170的生长和发光,还有一些微量元素和维生素具有抑制作用。可以通过对报告菌株生长的AB培养基中补充Fe3+,培养至OD600值为1.0−1.1,与新鲜AB培养基稀释比例为1:5 000,此时可以产生最大的诱导发光强度,提高实验的可重复性[14]。我们也在前期研究中对应用该方法(使用多功能酶标仪化学发光模式)检测荧光强度检测坚强肠球菌SQ-3-2中AI-2信号分子的条件进行了优化,证明最佳检测条件为待测样品pH为7.0,加样比例为1:100。以便更准确检测乳酸菌产AI-2信号分子的规律[15]。
1.2 基于LuxP的荧光共振能量转移(LuxP- FRET)报告系统检测法主要是对AI-2的接收蛋白LuxP进行修饰,在LuxP的N端和C端融合CFP蛋白 (蓝绿色荧光蛋白)和YEP蛋白(黄色荧光蛋白),融合蛋白称为CLPY。当AI-2与其结合,会诱导两个荧光基团之间发生荧光共振能量转移(FRET),AI-2浓度的增加导致FRET比值(OD527/OD485)减少[11],根据这种剂量依赖型的减少来定量检测样品中AI-2的浓度。样品和CLPY一起孵育,最后用光度计测量FRET比值。AI-2的浓度可以从FRET比与体外AI-2已知浓度的标准曲线中进行计算。这个试验需要对CLPY蛋白进行纯化,一旦纯化完成,便可以更快、更有效的检测大量样品。
该方法相比于报告菌株的方法,速度较快,且不受AI-2高浓度(<10 µmol/L)的影响,能在微摩尔水平上检出AI-2。既可以应用于细胞培养液中AI-2的检测,也可以用于被感染组织液中AI-2浓度检测[16]。但是FRET在结合AI-2和未结合AI-2两种状态下的总体改变是很小的,对于复杂的生物样品较敏感,而且检测限还不足以应用于临床样品(如唾液、血清)中AI-2的检测。该方法主要针对于含硼形式的AI-2,对硼离子敏感。
1.3 群体感应工程蛋白检测法由于AI-2在人体以及通过食物传播的很多病原菌(包括沙门氏菌、各种致病性大肠杆菌)的群体感应系统中具有特别重要的作用,检测生理学样品中AI-2浓度对于检测细菌感染和监测抗菌治疗的功效是非常有意义的。所以,最近有研究者在前人的研究基础上报道了一种迅速、高灵敏度、有选择性的基于蛋白质的生物感受系统,能够在低于纳摩尔水平上检测出AI-2,并成功用于检测唾液、血清等临床样品中的AI-2。
这个生物感受系统仍然是以荧光能量共振转移(FRET)原理为基准的。首先制备LuxP-EGFP融合蛋白,EGFP是一种增强的绿色荧光蛋白,再将一个荧光基团MDCC (香豆素衍生物)连接到LuxP上作为能量供体,融合蛋白上的荧光蛋白(EGFP)作为能量受体。MDCC在425 nm处受到激发,将能量转移给EGFP,且EGFP在507 nm的发射能量达到峰值。添加BAI-2会引起剂量依赖型的FRET减小,导致在507 nm处发射的荧光能量减少。实验还表明当MDCC和融合蛋白浓度分别为2.5×10S mol/L和5×10−9 mol/L时可以导致最大的FRET比。这种生物感受系统能在低于纳摩尔水平上检测出BAI-2,检测限(LOD)为1×10−10 mol/L,是目前利用基于LuxP生物检测系统中检测限最低的。另外,通过实验证明,该方法同样可以检测无硼形式的AI-2,LOD=1×10−9 mol/L[17]。
群体感应工程蛋白检测法速度快、检测限低,更重要的是,除了检测含硼形式的AI-2,还能够检测无硼形式的AI-2,这对于检测人体病原菌(如沙门氏菌)是很有意义的,在临床上有很大的潜在应用价值。但是,实验过程中仍然需要复杂的前处理过程,尚没有大量的实际应用。
1.4 气质联用(GC-MS)检测法相比于前面的几种方法,这是一种能直接分析并准确定量AI-2前体物质DPD的方法。用GC-MS分析DPD需要两步衍化过程。首先,添加过量的1,2-苯二胺至细菌上清液中,形成对应的喹喔啉衍生物。这步美拉德反应需要30 min来完成,由1H核磁共振谱[18]检测。添加1,2-苯二胺后,上清液pH由6.5升至8.5,这会诱导基质中其它化合物的副反应。用磷酸钾缓冲液调节pH至7.2,避免其它化合物生成DPD。为了对具有极性的喹喔啉衍生物进行分析,必需要对其极性羟基进行修饰。所以通过Extrelut NT液液萃取,二氯甲烷作为洗脱液,同时除去水分,过滤掉某些不溶性物质。第二步衍化反应是将二氯甲烷提取物用N-甲基三甲基硅基三氟乙酰胺(MSTFA)处理,将20 μL二氯甲烷提取液注入气相色谱中,利用全扫描EI源(70 eV)进行检测[19]。再利用质谱根据关键片段的特征确定该衍生物。采用同位素稀释内标法对DPD进行定量检测,从而使结果更准确。有试验表明,硼离子的有无并不会影响实验结果,当信噪比(S/N)为5时,检测限为0.7×10−3 mg/L,定量限为2.1×10−3 mg/L,该浓度下,分析物的相对标准偏差小于7.5%。
利用气质联用(GC-MS)的方法可以直接分析目标分子,且检测限低,灵敏度接近甚至高于生物感受系统的方法,可以满足很多条件下的AI-2检测。但是由于工序复杂,需要两步衍化过程,操作起来比较困难。
1.5 液相色谱-串联质谱(HPLC-MS/MS)检测法HPLC-MS/MS检测AI-2时,主要是利用一系列功能化的邻苯二胺标记试剂与DPD反应,所有的这些标记试剂在检测DPD衍化物时都有益。对DPD进行衍化后,通过液相色谱分离,再通过串联质谱的选择反应监测(SRM)方式进行检测。同时监控第一个质量分析器对特定起源离子质荷比的分析和后续质量分析器对大量碎片离子质荷比的分析。利用这样的技术,就算是具有相同标称质量的混合物(如柠檬酸盐和异柠檬酸盐)也可以通过其独特的碎片模式被区分开而无需使用色谱。Campagna等首先检测细菌产生的AI-2对该方法进行了概念验证,之后又对临床相关样品唾液中的AI-2进行了定量检测[20],结果表明唾液中的DPD平均为526 nmol/L,该浓度足以介导口腔细菌的繁殖。
HPLC-MS/MS检测法能对多种来源样品中的AI-2进行定量检测,特别是对复杂基质的临床样品,影响因素少。但是,该方法中功能化的衍化试剂具有复杂的结构,需要很多合成程序,这就限制了它的广泛使用。此外,设备昂贵。
1.6 柱前衍生化高效液相色谱荧光检测器(HPLC-FLD)检测法目前,能较灵敏检测AI-2都需要精密的仪器或复杂的工序,最近有研究者建立了一种简单、灵敏的定量检测AI-2的方法。利用2,3-二氨基萘(DAN)和DPD反应生成一种新的荧光物质(图 2[21]),这种物质具有特定的激发波长和发射波长[21]。然后利用HPLC-FLD检测AI-2的浓度。首先,将DPD稀释到0.01−14.00 mg/L的浓度范围作为标准溶液。将10 mg DAN溶解于50 ml 0.1 mol/L HCl中。再将400 μL标准溶液或上清液与等体积的DAN溶液在2 ml管形瓶里混合2 min,90 °C水浴40 min。冷却后,用HPLC-FLD进行分析。上样20 μL,用反相C18色谱柱分离30 min。0.1%甲酸(溶剂A)和乙腈(溶剂B)作为移动相,流速为0.1 ml/min。洗脱程序设置如下:t=0 min,70%溶剂A,30%溶剂B;t=4 min,70%溶剂A,30%溶剂B;t=12 min,35%溶剂A,65%溶剂B;t=27 min,70%溶剂A,30%溶剂B。荧光检测器的激发波长和发射波长分别设置为271 nm和503 nm。用质谱进一步确定衍生物的结构。标准曲线线性变化,相关系数为0.999 9,检测限为1.0×10−3mg/L,相对标准偏差小于6%。多数G+菌都能满足这个条件适合生物样品中AI-2的定量分析。
HPLC-FLD检测法程序较简单,灵敏度高,硼离子对其也无影响,适合定量检测微生物样品中的AI-2,但是还没有对更多样品进行检测,有待于进一步探究。
2 结束语国内外对群体感应的研究已有几十年,对AI-2的定量检测方法取得了很大进展。目前,以上几种方法是定量检测AI-2的最基本方法,还有一些研究者在这些方法的基础上进行了优化或者探索了新的方法。如Wattanavanitchakorn等报告了一种简单、快速的比色法定量检测鼠伤寒沙门氏菌中的AI-2[22],但是该方法适合检测菌体上清液中的AI-2,且需要做更多样品的验证试验;而且由于AI-2含量低、不稳定,很多细菌中的AI-2活性形式并不确定,使得各种方法在实际应用中存在一定的局限性。有的方法不能够准确定量,有的方法只能检测含硼形式的AI-2,还有些方法检测范围较窄等。然而,AI-2的作用受到越来越多的关注,其在生物体内的作用机制有待深入研究,而且化学合成的AI-2活性较生物体内的低,因此,寻找一种更加灵敏、迅速、有效的定量检测AI-2的方法依然会是研究群体感应的一个重要方向。
| [1] | Raut N, Pasini P, Daunert S. Deciphering bacterial universal language by detecting the quorum sensing signal, autoinducer-2,with a whole-cell sensing system[J]. Analytical Chemistry, 2013, 85 (20): 9604–9609. |
| [2] | Christiaen SEA, O’Connell Motherway M, Bottacini F, et al. Autoinducer-2 plays a crucial role in gut colonization and probiotic functionality of bifidobacterium breve UCC2003[J]. PLoS One, 2014, 9 (5): e98111. |
| [3] | Xue T, Zhao LP, Sun BL. LuxS/AI-2 system is involved in antibiotic susceptibility and autolysis in Staphylococcus aureus NCTC 8325[J]. International Journal of Antimicrobial Agents, 2013, 41 (1): 85–89. |
| [4] | Sun ZK, He X, Brancaccio VF, et al. Bifidobacteria exhibit LuxS-dependent autoinducer 2 activity and biofilm formation[J]. PLoS One, 2014, 9 (2): e88260. |
| [5] | Zhang T, Tian JJ, Li ZY, et al. Research of the relationship between AI-2/LuxS quorum sensing system and biofilm formation in Lactobacillus plantarum HE-1[J]. Science and Technology of Food Industry, 2014, 35 (5): 130–132. (in chinese) 张腾, 田建军, 李梓媛, 等. 植物乳杆菌HE-1由AI-2/LuxS 介导的群体感应与生物膜形成关系的研究[J]. 食品工业科技, 2014, 35 (5):130–132. |
| [6] | Schauder S, Shokat K, Surette MG, et al. The LuxS family ofbacterial autoinducers: biosynthesis of a novel quorum-sensingsignal molecule[J]. Molecular Microbiology, 2001, 41 (2): 463–476. |
| [7] | Pereira CS, Thompson JA, Xavier KB. AI-2-mediated signallingin bacteria[J]. FEMS Microbiology Reviews, 2013, 37 (2): 156–181. |
| [8] | Miller ST, Xavier KB, Campagna SR, et al. Salmonellatyphimurium recognizes a chemically distinct form of thebacterial quorum-sensing signal AI-2[J]. Molecular Cell, 2004, 15 (5): 677–687. |
| [9] | Chen X, Schauder S, Potier N, et al. Structural identification of abacterial quorum-sensing signal containing boron[J]. Nature, 2002, 415 (6871): 545–549. |
| [10] | Frezza M, Soulère L, Queneau Y, et al. ABaylis-Hillman/ozonolysis route towards (±) 4, 5-dihydroxy-2,3-pentanedione (DPD) and analogues[J]. Tetrahedron Letters, 2005, 46 (38): 6495–6498. |
| [11] | Taga ME, Xavier KB. Methods for analysis of bacterialautoinducer-2 production[J]. Current Protocols in Microbiology, 2011 : . |
| [12] | Zhu J, Pei DH. A LuxP-based fluorescent sensor for bacterialautoinducer II[J]. ACS Chemical Biology, 2008, 3 (2): 110–119. |
| [13] | Bassler BL, Wright M, Silverman MR. Multiple signalingsystems controlling expression of luminescence in Vibrioharveyi: sequence and function of genes encoding a secondsensory pathway[J]. Molecular Microbiology, 1994, 13 (2): 273–286. |
| [14] | Vilchez R, Lemme A, Thiel V, et al. Analysing traces ofautoinducer-2 requires standardization of the Vibrio harveyibioassay[J]. Analytical and Bioanalytical Chemistry, 2007, 387 (2): 489–496. |
| [15] | Zhang T, He YF. Detection of the Lux S-mediatedquorum-sensing system signal autoinducer-2 of Enterococcusdurans SQ-3-2 and optimize the methods[J]. Food andFermentation Industries, 2013, 39 (2): 168–173. (in chinese) 张腾, 贺银凤. 坚强肠球菌SQ-3-2基于Lux S 群体感应系统信号分子AI-2的检测及方法优化[J]. 食品与发酵工业, 2013, 39 (2):168–173. |
| [16] | Rajamani S, Zhu J, Pei DH, et al. A LuxP-FRET-based reporterfor the detection and quantification of AI-2 bacterialquorum-sensing signal compounds[J]. Biochemistry, 2007, 46 (13): 3990–3997. |
| [17] | Raut NG, Joel S, Pasini P, et al. Bacterial autoinducer-2detection via an engineered quorum sensing protein[J]. Analytical Chemistry, 2015, 87 (5): 2608–2614. |
| [18] | Meijler MM, Hom LG, Kaufmann GF, et al. Synthesis andbiological validation of a ubiquitous quorum-sensingmolecule[J]. Angewandte Chemie International Edition, 2004, 43 (16): 2106–2108. |
| [19] | Thiel V, Vilchez R, Sztajer H, et al. Identification, quantification,and determination of the absolute configuration of the bacterialquorum-sensing signal autoinducer-2 by gaschromatography-mass spectrometry[J]. ChemBioChem, 2009, 10 (3): 479–485. |
| [20] | Campagna SR, Gooding JR, May AL. Direct quantitation of thequorum sensing signal, autoinducer-2, in clinically relevantsamples by liquid chromatography–tandem massspectrometry[J]. Analytical Chemistry, 2009, 81 (15): 6374–6381. |
| [21] | Song XN, Qiu HB, Xiao X, et al. Determination ofautoinducer-2 in biological samples by high-performance liquidchromatography with fluorescence detection using pre-columnderivatization[J]. Journal of Chromatography A, 2014, 1361 : 162–168. |
| [22] | Wattanavanitchakorn S, Prakitchaiwattana C, Thamyongkit P. Rapid and simple colorimetric method for the quantification ofAI-2 produced from Salmonella Typhimurium[J]. Journal ofMicrobiological Methods, 2014, 99 : 15–21. |
 2016, Vol. 43
2016, Vol. 43