扩展功能
文章信息
- 卓萍, 刘威, 刘君琴, 赵鹏花, 崔方慧, 李志强
- ZHUO Ping, LIU Wei, LIU Jun-Qin, ZHAO Peng-Hua, CUI Fang-Hui, LI Zhi-Qiang
- 一株人消化道中韦荣氏球菌的分离、鉴定及其代谢特性研究
- Isolation, identification and metabolism of a Veillonella strain in human gut
- 微生物学通报, 2016, 43(6): 1253-1261
- Microbiology China, 2016, 43(6): 1253-1261
- DOI: 10.13344/j.microbiol.china.150932
-
文章历史
- 收稿日期: 2015-11-16
- 接受日期: 2016-02-04
- 优先数字出版日期(www.cnki.net): 2016-02-23
2. 山西医科大学汾阳学院医学检验系 山西 汾阳 032200 ;
3. 山西医科大学汾阳学院护理学系 山西 汾阳 032200
2. Department of Medical Laboratory Science, Fenyang College of Shanxi Medical University, Fenyang, Shanxi 032200, China ;
3. Department of Nursing, Fenyang College of Shanxi Medical University, Fenyang, Shanxi 032200,China
人肠道内栖息着大量微生物,数量高达1014,微生物与宿主间、微生物与微生物间存在复杂的互作,显著地影响人类生理功能[1]。肠道微生态不仅是一个理论科学,与人类许多疾病紧密相关,研究表明微生态失衡会导致腹泻、哮喘、衰老、孤独症、肥胖等疾病[2]。
乳酸菌是人肠道数量庞大、功能重要的一类细菌,它们通常被视为益生菌的主要群体[3],也是目前市场上最常见的一类主要益生素,如双歧杆菌和乳杆菌等。这些乳酸菌利用碳水化合物产生大量的乳酸,成为肠道内乳酸的主要来源。然而研究发现,只有少量的乳酸被人肠道吸收和利用,而人粪便中乳酸含量又极少[4],说明乳酸可作为一种代谢中间物(Metabolic intermediate)被利用,而不是以代谢终产物的形式排出体外。McLean等发现,葡萄糖很快转化为乳酸,乳酸浓度起始会升高,但是随后被利用而略有降低,并最终达到稳定[5]。Bourriaud等利用同位素标记乳酸,发现乳酸可能被某些细菌利用转化为甲酸、乙酸、丙酸、丁酸等短链脂肪酸[6]。以上结果表明,人体内存在着许多乳酸利用菌,它们通过交互饲喂(Cross-feeding),即一群微生物产生的代谢中间产物能够作为另一群微生物利用的碳源和能源,与乳酸菌一起维护肠道内乳酸生成和利用的动态平衡。在某些病理条件下,在腹泻病人粪便中乳酸含量增高,浓度可达20 mmol/g[4],说明乳酸菌群耐受性强,乳酸的产生受到影响较小,而乳酸利用菌群容易紊乱,容易导致乳酸积累,乳酸积累又进一步地加重恶化肠炎,并且可能诱发其他疾病。因此,乳酸利用菌是一种潜在的益生菌,可作为目前广泛使用的乳酸菌有益组合,与乳酸菌一起组合调控和改善宿主的后肠环境,但目前未引起人们的广泛重视,研究甚少。
我们验证了乳酸可作为代谢中间物被人肠道混合菌群利用,主要生产乙酸、丙酸和丁酸等短链脂肪酸。利用Hungate滚管技术分离到了一株高效利用乳酸的菌株,对其进行鉴定,该株菌与小韦荣球菌(Veillonella parvula)亲缘关系最近。进一步研究了它的体外利用乳酸的性质,并让其与乳酸菌混合培养,来了解二者交互饲喂的关系。
1 材料与方法 1.1 实验材料和仪器本文所用的菌株均为本实验室分离、鉴定和保存。
所用的主要试剂和仪器为:乳酸试剂盒和葡萄糖试剂盒购自南京建成生物工程研究所;MRS琼脂培养基购自北京奥博星生物技术有限公司。PCR仪,Thermo Fisher Scientific PX2;pH酸度计,Sartorius Stedim Biotech PB-10;紫外可见分光光度仪,岛津公司UV-1800;气相色谱仪,Thermo Fisher Scientific TRACE 1300;恒温培养箱,上海新苗医疗器械制造有限公司GNP9080BS-Ⅲ;厌氧装置系统和冷冻离心机购自上海力申科学仪器有限公司Neofuge 13R。
1.2 人体混合菌体外利用乳酸检测取2个月内未服用抗生素及毒品的3名健康人(2女1男)新鲜粪便,称取1 g样品,边通CO2边用10 mL 1×磷酸盐缓冲液(g/L,磷酸二氢钾0.27,磷酸氢二钠1.42,氯化钠8.00,氯化钾0.20,pH 7.4)稀释,之后用3层纱布过滤掉残渣,注射器抽取1 mL滤液接种到7 mL含葡萄糖0.25% (质量体积比)的YCFA[7] (pH约为5.8-6.1)滚管中,于37 ℃静置培养16 h,成为肠道混合菌接种液。按照2.5% (体积比)比例接种到添加1.5% (质量体积比)的乳酸YCFA的发酵瓶内进行体外发酵,在0、2、4、6、9、12、24 h取样,检测OD580和pH值,留样待测短链脂肪酸。
1.3 短链脂肪酸的测定利用气相色谱仪检测短链脂肪酸产量[8],方法如下:1 mL上述发酵液加入0.2 mL 25% (质量体积比)的偏磷酸巴豆酸混合溶液,以巴豆酸作为内标,冰水浴30 min,12 000 r/min离心5 min,取100 μl上清液通过0.22 μm针式滤器,2 μl滤液直接进样。色谱条件为柱温140 ℃,汽化温度180 ℃,采用氢离子火焰检测器,检测温度220 ℃,氢气和压力氧气均为0.05×105 Pa,载气为氮气,压力为0.05×105 Pa。根据乙酸、丙酸、丁酸、戊酸、异戊酸、巴豆酸的峰面积计算短链脂肪酸各组分浓度。
1.4 乳酸利用菌的分离10-4-10-9梯度稀释1.2中获得的滤液,参照刘威等[8]用Hungate滚管技术分离细菌,培养基为补充乳酸0.25% (质量体积比)的LH培养基[9],方法如下:取6支已制备好的固体培养基融化,分别向每个培养基中注入已稀释好的混合菌稀释液,放入已制备好的冰槽中快速滚动,使培养基均匀附着在管壁上。平置于37 ℃恒温培养箱培养16 h,挑取单克隆菌落。按照同样方法纯化细菌,最终获得纯菌株。同时,我们使用MRS琼脂培养基从人粪样中分离一株乳酸菌。
1.5 细菌的鉴定1.5.1 形态和生化鉴定:革兰氏染色法;LH培养基补充不同碳源,通过OD580检测细菌生长状况,判断对葡萄糖、乳酸、果糖、纤维二糖、麦芽糖、甘露醇、葡萄糖酸、乳糖、木糖等利用各种碳源的能力。
1.5.2 分子生物学鉴定:菌株DNA提取及PCR扩增和测序16S rRNA基因参见文献[8]。所用引物:5´-AAAGATGGCATCATCATTCAAC-3´和5´-TACC GTCATTATCTTCCCCAAA-3´,PCR扩增反应条件为:95 ℃ 10 min;94 ℃ 10 s,56 ℃ 15 s,72 ℃ 80 s,25个循环;72 ℃ 10 min。将16S rRNA基因序列递交GenBank,获取登录号。从GenBank数据库中下载相关9株菌的16S rRNA基因序列,使用MEGA 6.0软件进行比对,然后用MEGA软件中Neighbour-Joining法绘制进化树。乳酸菌16S rRNA基因序列经过比对,与肠球菌亲缘关系最近,其GenBank登录号为KU664323。
1.6 纯培养与共培养实验使用添加0.5% (质量体积比)乳酸和0.25% (质量体积比)葡萄糖的LH培养基,检测乳酸利用菌纯菌株乳酸代谢性质,以研究体外代谢乳酸性质。选择乳酸菌和乳酸利用菌进行共培养试验,研究二者共培养状况。按照上述方法取样,检测OD580和pH值,留样检测乳酸、葡萄糖和挥发性脂肪酸。
1.7 乳酸和葡萄糖测定按照乳酸试剂盒提供的方法检测乳酸浓度,其方法参照下述:首先,需要测定的样品经过适当稀释,分别取20 μl样品稀释液、乳酸标准样与空白对照样添加到反应小管内,37 ℃水浴10 min,随后加入终止液终止反应,测量OD530值,然后根据公式计算出乳酸浓度。
按照葡萄糖试剂盒提供的方法检测葡萄糖浓度,其方法参照下述:首先,样品经过适当稀释,取10 μl样品稀释液与葡萄糖标准样到反应液小管内,37 ℃水浴15 min,测量OD505值,然后根据公式计算出葡萄糖浓度。
1.8 统计方法实验重复3次,以每组数据的平均值进行数据统计,采用单因素方差分析。
2 结果与分析 2.1 肠道混合菌利用乳酸利用体外发酵实验,检测乳酸是否会作为代谢中间物被肠道菌进一步利用。结果显现,3个个体P1、P2和P3的肠道混合菌在补充乳酸作为唯一碳源的YCFA培养基上体外培养,其生长曲线均呈S型增长,其中4 h到8 h处于对数生长期,12 h之后开始处于稳定阶段,说明了乳酸可以作为能源和底物支持肠道细菌的生长(图 1A)。乳酸浓度结果显示,乳酸随着培养时间而浓度降低(图 1B),从起始75 mmol/L下降到24 h时5.5 mmol/L,说明肠道菌生长消耗了乳酸。气象色谱分析短链脂肪酸的结果显示,3个个体的发酵液中主要物质是乙酸、丙酸和丁酸(表 1),但是其三者比例在不同个体之间存在着差异(P<0.05)。综述所得,乳酸可作为一种中间代谢物,能够被肠道混合菌作为能源和碳源而进一步地利用,并转化其为短链脂肪酸。
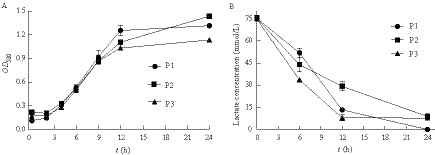
|
| 图 1 人肠道混合菌代谢乳酸情况 Figure 1 The utilization of lactate by human intestinal microflora A:混合菌生长曲线图;B:乳酸浓度对发酵时间的曲线图. A: The curve of growth to fermentation time; B: The concentrate curve of lactate to fermentation time. |
|
|
| 个体/菌株 Individuals/Strain | 乙酸 Acetate (mmol/L) | 丙酸 Propionate (mmol/L) | 丁酸 Butyrate (mmol/L) |
| P1 | 28.95 | 29.00 | 8.33 |
| P2 | 32.71 | 19.38 | 16.90 |
| P3 | 22.15 | 9.82 | 10.50 |
| FY8 | 29.09 | 53.83 | 0.49 |
上述结果表明,人体肠道内存在着乳酸利用菌,与乳酸菌一起调控乳酸的动态平衡,但是目前人们对这些乳酸利用菌的种类和功能的认识甚少,为此我们尝试利用补充乳酸的LH培养基分离这类细菌。我们共计挑菌21株,依照乳酸检测试剂盒方法,检测每株菌24 h内乳酸消耗情况。经检测,大部分细菌不利用乳酸,或者利用乳酸能力微弱,通常小于10 mmol/L,但是有一株细菌可以高效利用乳酸,消耗乳酸高达50 mmol/L,将这株细菌命名为FY8。
2.3 细菌鉴定2.3.1 形态与生化鉴定:菌株FY8为革兰氏阴性球菌,专性厌氧菌;生化鉴定结果,能有效地利用葡萄糖、乳酸、果糖、纤维二糖、麦芽糖、甘露醇等碳源,几乎不利用葡萄糖酸、乳糖、木糖等。形态和生化特征与韦荣球菌属(Veillonella)特征一致。
2.3.1 分子生物学鉴定:菌株FY8的16S rRNA基因有效长度为840 bp,在GenBank中登录号为KU057378。16S rRNA基因比对结果表明,菌株FY8属于小韦荣球菌属,与亲缘关系较近的9株细菌的系统进化树见图 2。菌株FY8与从瘤胃中分离到可培养的菌株Veillonella parvula ML1关系最紧密,位于同一分支中,一致性高达99.8% (817/819),同时与已测出全基因组菌株Veillonella parvula strain DSM2008较近,一致性为99.5% (815/819),与Veillonella atypica和Veillonella dispar关系也比较近,说明菌株FY8属于韦荣球菌属。与目前已知的主要乳酸利用菌巨球型菌Megasphaera,月形单胞菌Selenomonas,丙酸杆菌Proionibacterium和厌氧弧菌Anaerovibrio具有比较远的亲缘关系,与乳酸菌Enterococcus亲缘关系也很远。
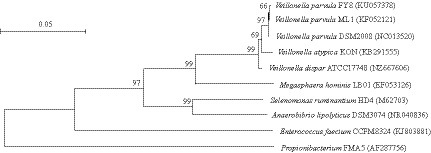
|
| 图 2 乳酸利用菌FY8 的系统进化树 Figure 2 Phylogenetic tree of lactate-utilizing strain FY8 标尺:表示序列差异的分支长度;发育树节点的数值表示Brootstrap 值;括号内为GenBank 数据库的登录号. Bar: Nucleotide divergence; Number at notes present bootstrap percentages; Those in parentheses are GenBank accession No. |
|
|
菌株FY8在只含乳酸的LH培养基上迅速生长(图 3A),说明乳酸支持菌株FY8的生长。进一步测定乳酸利用情况,结果显示乳酸浓度随着培养时间延长而降低,几乎在12 h内耗尽所添加的乳酸,说明菌株FY8的生长消耗了乳酸(图 3B)。有趣地,pH值随着发酵进行而降低(图 3C),气相色谱分析主要产物为乙酸和丙酸等(表 1)。为了研究菌株FY8是否对乳酸利用具有偏好性,比较了它对葡萄糖和乳酸的利用情况,结果显示(图 3D),葡萄糖和乳酸随着发酵进行而浓度均降低,但是乳酸的利用速率比葡萄糖快,并且最终剩余的葡萄糖浓度高于乳酸浓度,说明菌株FY8对乳酸利用具有偏爱性。
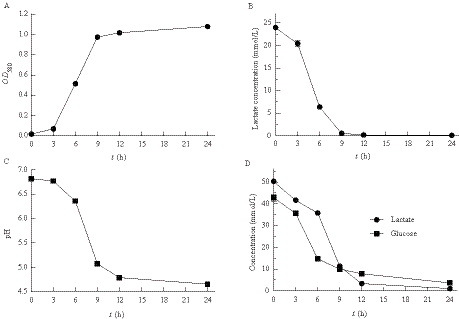
|
| 图 3 菌株FY8 利用乳酸的代谢特性 Figure 3 The metabolic traits of strain FY8 to consume lactate. A:生长OD 值对时间曲线图;B:乳酸浓度对时间曲线图;C:pH 对时间曲线图;D:葡萄糖浓度对时间曲线图. A: The curve of growth OD value to time; B: The curve of lactate concentration to time; C: The curve of pH value to time; D: The curve of glucose concentration to time. |
|
|
在正常情况下,大部分人后肠维持一种微酸的环境,pH通常介于5.0-7.0之间,因此我们检验该菌株能否耐受生理pH。以乳酸为主要碳源,体外模拟后肠不同pH环境,分别设定5.0、6.0、6.5和7.5 4个梯度,以研究菌株FY8的生长特性。结果如图 4所示,菌株FY8在设定的梯度下均能很好地生长,说明菌株FY8适应肠道生理pH,为这株菌作为益生菌的开发提供了潜在的可能性。
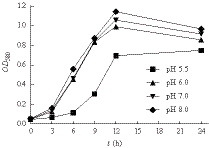
|
| 图 4 在不同pH 条件下菌株FY8 生长曲线图 Figure 4 The curve of growth FY8 in different pH conditions |
|
|
产乳酸菌是能利用可发酵碳水化合物产生大量乳酸一类细菌的通称,以双歧杆菌、屎肠球菌等为代表。以本实验室分离到的一株屎肠球菌E7 (Enterococcus faecium,其登录号为KU664323)作为乳酸菌的代表,以研究乳酸菌与乳酸利用菌之间交叉饲喂。在添加0.8% (质量体积比)葡萄糖的LH培养基上分别接种菌株FY8、菌株E7及二者组合,按照每瓶细菌最终接种密度相同的要求接种(1.5×106 CFU/mL)。0 h和3 h时,无论纯培养还是混合培养OD值相当,但是混合菌OD值在6h时为1.35,E7和FY8纯培养OD值分别为0.81和0.65,混合培养组OD值明显高于纯培养(P<0.01),9 h之后纯培养的OD才与混合培养OD值相当,均达到1.6左右,说明混合菌生长速度比两株菌纯培养的快(图 5A),体现出互相促进生长作用。菌株E7纯培养,乳酸浓度随着发酵进行而升高,从起始6.4 mmol/L逐步升高,24 h时产生高达77.1 mmol/L乳酸(图 5B),与此同时pH不断地降低(图 5C),从起始的6.7下降到24 h时4.8,说明E7是一株乳酸菌的代表菌株[10]。然而,菌株FY8与E7共培养,乳酸浓度呈现先升高后降低趋势(图 5B),最终把乳酸降低到本底水平。6 h之前,混合培养乳酸浓度升高,6 h时达到顶峰43 mmol/L,比菌株E7纯培养高(P<0.01)。6 h之后,乳酸浓度开始下降,特别12 h之后乳酸浓度9.6 mmol/L,和本底水平乳酸相当,比菌株E7纯培养低(P<0.01),说明菌株FY8利用乳酸能力很强。前期混合菌液乳酸浓度较高,可能是因为菌株FY8促进了菌株E7快速生长,乳酸产生速率超过利用速率。随着乳酸浓度达到一定阈值,又进一步地促进了菌株FY8的快速生长,6 h之后乳酸利用速率超过产生速率,乳酸逐步被消耗,12 h之后几乎被耗尽。与此同时,3组均能降低pH值和消耗葡萄糖,无特别显著差异(图 5C和D)。因此,这些结果说明了菌株FY8与菌株E7体现出很好的交叉饲喂关系,促进了二者的生长,有效地减少了乳酸菌代谢出乳酸积累。

|
| 图 5 菌株FY8 和E7 共培养分析 Figure 5 The analysis of the cocultivation of strain FY8 and E7 A:菌株纯培养与共培养的细菌生长OD 值对时间曲线图;B:共培养及菌株E7 纯培养乳酸浓度对时间曲线图;C:共培养及菌株纯培养pH 对时间曲线图;D:共培养及菌株纯培养葡萄糖浓度对时间曲线图. A: The curves of growth OD value to time in pure culture and coculture; B: The curves of lactate concentration to time in strain E7 pure culture and coculture; C: The curves of pH value to time in pure culture and coculture; D: The curves of glucose concentration to time in pure culture and coculture. |
|
|
菌株FY8分离于人粪便中,16S rRNA基因序列与V. palur的同源性最高;纯培养时有效地消耗乳酸,并生成乙酸和丙酸等短链脂肪酸;当它和肠球菌共培养时,高效地利用肠球菌产生的乳酸,显著地减缓乳酸在培养基内积累。V. palur是一种正常细菌,在动物和人的自然腔道中大量存在,如口腔、咽部、消化道等[11-12]。目前已有报道,V. palur对口腔健康有重要的调控作用,主要是因为其有效消耗乳酸,防止乳酸在口腔内积累,对龋齿的预防有重要功能等[13-14],但是对于这种分布在人肠道内乳酸利用菌及代谢特征鲜有报道。本研究发现菌株FY8的代谢特征与口腔中V. palur相似,推测它在肠道内有效利用乳酸,防止乳酸在肠道内的累积,维持肠道内乳酸动态平衡。
乳酸利用菌种类比较繁多,目前已经发现主要有Megasphaera、Veillonella、Selenomonas、Proionibacterium和Anaerovibrio,并且在高等哺乳动物肠道内均发现了乳酸利用菌,如牛、猪和马等家畜动物,说明了乳酸利用菌物种多样性和功能保守性,应该是肠道菌一类核心细菌[1, 15]。作者前期工作也分离到一株乳酸利用菌菌株LB01[8],而且这株菌代谢乳酸过程能减缓pH值的降低,产生大量的丁酸。与LB01相比,菌株FY8利用乳酸的能力更强,特别当与乳酸菌混合培养时,高效地消耗乳酸菌产生的乳酸,把乳酸浓度降低到15 mmol/L之下,非常有效地防止乳酸的积累,但菌株FY8利用乳酸会进一步降低发酵液pH,不能产生丁酸。菌株FY8利用乳酸时pH降低,可能归因于这株菌能产生了大量的甲酸,我们可以找到间接的证据支持这一个观点。McLean等利用核磁共振方法发现,乳酸不仅转化为乙酸,而且更多地转化为甲酸。由于甲酸酸性比乳酸强,所以发酵后的pH值会降低[5]。我们的结果也显示,菌株FY8随着发酵时间延长,pH会降低,间接说明菌株FY8也可能利用乳酸产生大量的甲酸。有趣地,我们发现混合培养24 h发酵产物中乙酸、丙酸和丁酸的含量很低,几乎检测不出来(数据未显示),但是pH显著地下降,同时产生大量的气体,我们推测可能产生了甲酸。微酸的后肠环境对动物健康是有利的,大部分高等哺乳类动物后肠在pH 5.0-7.0时可有效吸收钠离子,分泌钾离子等维持了肠道正常的吸收和分泌功能。总之,上面说明了肠道内乳酸利用菌具有多样性,也说明其代谢产物具有多样性,共同调控着肠道乳酸和短链脂肪酸的平衡,增进人体健康。
肠道微生物群由至少500种微生物构成,通过宿主-微生物和微生物-微生物间的关系网,显著地影响人类生理功能。不同的微生物居于不同的生态位,某些菌群间存在着复杂的交叉饲喂[16],保持了系统物种的稳定性和多样性。乳酸菌利用葡萄糖等生成乳酸,为乳酸利用菌提供了能源物质,会促进乳酸利用菌的生长,如本文混合培养9 h之后,菌株FY8大量生长代谢消耗乳酸;同时乳酸利用菌消耗了乳酸,减少了乳酸对乳酸菌的抑制作用,也可以促进乳酸菌的生长,最终结果是促进二者共同的生长[17]。同时有研究表明,某些细菌生成以乙酸和丙酸为主等短链脂肪酸,能降低体系pH,也会为乳酸菌提供了更适宜的微酸环境[18],体现出其与乳酸菌的共栖互生关系。
上述结果表明菌株FY8是一株可与乳酸菌共同发挥作用的潜在益生菌。菌株FY8有效地利用乳酸,可以与乳酸菌共同添加,以调控和改善宿主的后肠环境,表明了菌株FY8是一株具有开发潜力的益生菌。然而,肠道内环境极其复杂,菌株FY8能否有效地在体内调节后肠道功能尚需要动物模型及临床试验来进一步地验证,这也是我们要深入要做的工作。
| [1] | Tremaroli V, Bäckhed F. Functional interactions between the gut microbiota and host metabolism[J]. Nature, 2012, 489 (7415): 242–249. |
| [2] | McKenney P, Pamer E. From hype to hope: the gut microbiota in enteric infectious disease[J]. Cell, 2015, 163 (6): 1326–1332. |
| [3] | Douillard FP, de Vos WM. Functional genomics of lactic acid bacteria: from food to health[J]. Microbial Cell Factories, 2014, 13 (Suppl 1): S8. |
| [4] | Hove H, Nordgaard-Andersen I, Mortensen PB. Faecal DL-lactate concentration in 100 gastrointestinal patients[J]. Scandinavian Journal of Gastroenterology, 1994, 29 (3): 255–259. |
| [5] | McLean JS, Fansler SJ, Majors PD, et al. Identifying low pH active and lactate-utilizing taxa within oral microbiome communities from healthy children using stable isotope probing techniques[J]. PLoS One, 2012, 7 (3): e32219. |
| [6] | Bourriaud C, Robins RJ, Martin L, et al. Lactate is mainly fermented to butyrate by human intestinal microfloras but inter-individual variation is evident[J]. Journal of Applied Microbiology, 2005, 99 (1): 201–212. |
| [7] | Barcenilla A, Pryde SE, Martin JC, et al. Phylogenetic relationships of butyrate-producing bacteria from the human gut[J]. Applied and Environmental Microbiology, 2000, 66 (4): 1654–1661. |
| [8] | Liu W, Zhu WY, Yao W, et al. Isolation and identification of a lactate-utilizing,butyrate-producing bacterium and its primary metabolic characteristics[J]. Acta Microbiologica Sinica, 2007, 47 (3): 435–440. (in chinese) 刘威, 朱伟云, 姚文, 等. 一株乳酸利用丁酸产生菌的分离与鉴定及代谢特性的初步研究[J]. 微生物学报, 2007, 47 (3):435–440. |
| [9] | Mackie RI, Heath S. Enumeration and isolation of lactate-utilizing bacteria from the rumen of sheep[J]. Applied and Environmental Microbiology, 1979, 38 (3): 416–421. |
| [10] | Arias CA, Murray BE. The rise the Enterococcus: beyond vancomycin resistance[J]. Nature Reviews Microbiology, 2012, 10 (4): 266–278. |
| [11] | Ng SKC, Hamilton IR. Lactate metabolism by Veillonella parvula[J]. Journal of Bacteriology, 1971, 105 (3): 999–1005. |
| [12] | van den Bogert B, Boekhorst J, Smid EJ, et al. Draft genome sequence of Veillonella parvula HSIVP1,isolated from the human small intestine[J]. Genome Announcements, 2013, 1 (6): e00977. |
| [13] | Egland PG, Palmer RJ, Kolenbrander PE. Interspecies communication in Streptococcus gordonii-Veillonella atypica biofilms: signaling in flow conditions requires juxtaposition[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101 (48): 16917–16922. |
| [14] | Washio J, Shimada Y, Yamada M, et al. Effects of pH and lactate on hydrogen sulfide production by oral Veillonella spp.[J]. Applied and Environmental Microbiology, 2014, 80 (14): 4184–4188. |
| [15] | Su Y, Li B, Zhu WY. Fecal microbiota of piglets prefer utilizing DL-lactate mixture as compared to D-lactate mixture as compared to D-lactate and L-lactate in vitro[J]. Anaerobe, 2013, 19 : 27–33. |
| [16] | Backhed F, Ley RE, Sonnenburg JL, et al. Host-bacterial mutualism in the human intestine[J]. Science, 2005, 307 (5717): 1915–1920. |
| [17] | Kaiko GE, Stappenbeck TS. Host-microbe interactions shaping the gastrointestinal environment[J]. Trends in Immunology, 2014, 35 (11): 538–548. |
| [18] | Belenguer A, Duncan SH, Calder AG, et al. Two routes of metabolic cross-feeding between Bifidobacterium adolescentis and butyrate-producing anaerobes from the human gut[J]. Applied and Environmental Microbiology, 2006, 72 (5): 3593–3599. |
 2016, Vol. 43
2016, Vol. 43




