扩展功能
文章信息
- 晋婷婷, 付正伟, 沈萍, 陈向东
- JIN Ting-Ting, FU Zheng-Wei, SHEN Ping, CHEN Xiang-Dong
- 枯草芽孢杆菌携带PBSX 类缺陷性原噬菌体的普遍性调查
- General investigation of PBSX-like defective prophages resident in Bacillus subtilis strains
- 微生物学通报, 2016, 43(6): 1244-1252
- Microbiology China, 2016, 43(6): 1244-1252
- DOI: 10.13344/j.microbiol.china.160152
-
文章历史
- 收稿日期: 2016-02-22
- 接受日期: 2016-04-20
- 优先数字出版日期(www.cnki.net): 2016-04-21
2. 武汉大学生命科学学院 病毒学国家重点实验室 湖北 武汉 430072
2. State Key Laboratory of Virology, College of Life Sciences, Wuhan University, Wuhan, Hubei 430072, China
PBSX是存在于枯草芽孢杆菌(Bacillus subtilis) 168中的一种特殊的缺陷性原噬菌体,在正常情况下它的编码基因整合在宿主细胞基因组上,并随着宿主细胞基因组一同复制[1]。当宿主细胞受到外界环境刺激,如丝裂霉素C (MMC)、紫外线(UV)或过氧化氢[2]等因素的诱导时[3],PBSX便会在宿主细胞中大量合成[4-5],并通过裂解宿主细胞而释放到胞外[6-8]。成熟的PBSX噬菌体颗粒为头尾状,其头部直径约为45 nm,尾部长200 nm[9-10]。较为特殊的是,PBSX衣壳蛋白中包裹的并非自身编码基因,而是一段只有13 kb的、来源于宿主基因组各个区段的、具有随机序列的DNA片段[11-14]。因此PBSX不能像普通噬菌体一样通过侵染敏感菌株而大量繁殖[15],也因此而得名为缺陷性原噬菌体。但PBSX可以通过自外裂解的方式攻击那些基因组上不含PBSX的B. subtilis菌株[16-17],且攻击过程中其头部DNA不会注射到敏感菌株细胞中[9]。
缺陷性原噬菌体PBSX最初由Seaman等在B. subtilis模式菌株168中发现[15]。之后,在一些其它B. subtilis菌株中也发现了PBSX或是与PBSX类似的缺陷性原噬菌体,它们在形态上十分类似[18-20]。其敏感菌攻击范围也呈现出丰富的多样性。关于缺陷性原噬菌体存在的意义至今不明,曾有人推测它通过对非自身溶源菌的杀伤作用而对自身宿主菌起保护作用[1, 21]。2003年,Westers等人为地将PBSX编码基因进行缺失后,发现其宿主菌的运动性受到了很大程度的影响[22]。Piggot等的研究也发现,PBSX的部分基因缺失突变后其宿主菌在基本培养基中的生长速度会大大降低[23],这说明缺陷性原噬菌体PBSX的存在有利于宿主菌在营养贫瘠条件下的正常生长。此外,也有实验证明,存在于缺陷性原噬菌体中的DNA具有转化活性[3, 9, 12]。因此,缺陷性原噬菌体也可以充当DNA仓库,为水平基因转移过程的进行提供源源不断的供体DNA资源。
以往的研究普遍推测B. subtilis携带PBSX类的缺陷性原噬菌体[6],目前已经在NCBI上公布全基因组序列的16株B. subtilis均携带PBSX类缺陷性原噬菌体相关基因,但迄今为止尚无研究者通过具体实验进行这方面的普遍性调查工作。对B. subtilis携带PBSX类原噬菌体普遍性情况的调查,无疑将有助于理解PBSX类原噬菌体的生物学意义。由于PBSX类缺陷性原噬菌体的特殊性,不能通过常规的噬菌体效价测定法检测其存在及浓度。在前期研究中,我们成功地使用MMC诱导菌体,通过细胞裂解液上清中13 kb DNA条带的检测,及其对PBSX敏感菌株B. subtilis W23的攻击能力来进行PBSX类缺陷性原噬菌体的检测[24]。本文利用中国典型培养物保藏中心(CCTCC)的菌种保藏优势,对其保藏的39株B. subtilis菌株中的PBSX类缺陷性原噬菌体的存在情况进行普遍性调查,从而为进一步揭示其存在的意义提供更多理论依据。
1 材料与方法 1.1 菌株和培养基供试菌株见表 1,B. subtilis 168和W23由本实验室保藏,其余39株B. subtilis全部由CCTCC提供,各菌株来源详见表 1。
| 枯草芽孢杆菌菌株 Bacillus subtilis strains | 菌株数量 Number of strains | 来源 Resource |
| 168,W23a | 2 | 本实验室 |
| AB91021b | 1 | 武汉大学医学部 |
| AB92005,AB92006,AB92007 | 3 | 美国俄亥俄州立大学枯草杆菌保藏中心 |
| AB92009,AB92011,AB92012 | 3 | 湖北天门制药厂 |
| AB93007,AB93010,AB93013,AB93014,AB93015,AB93016,AB93019,AB93020,AB93021,AB93022,AB93023,AB93024,AB93025,AB93026,AB93036 | 15 | 英国纽卡素大学医学院微生物系 |
| AB92053,AB93089,AB93090,AB93091,AB93108,AB93150,AB93151,AB93174,AB93177 | 9 | 陕西省微生物研究所 |
| AB90008,AB98014,AB98015,AB98016 | 4 | 中国科学院微生物研究所 |
| AB93213 | 1 | 湖北神农架杉树坪土壤 |
| AB93215 | 1 | 湖北神农架木鱼坪土壤 |
| AB93219 | 1 | 湖北神农架九冲土壤 |
| AB93221 | 1 | 湖北神农架送郎山土壤 |
| 注:a:B. subtilis 168和W23由本实验室保藏;b:CCTCC保藏编号. Note: a: B. subtilis 168 and W23 are preserved by the laboratory; b:The preservation number in CCTCC. | ||
细菌培养所用培养基为LB培养基(g/L,胰蛋白胨10,酵母粉5,NaCl 5,pH 7.4),培养条件:37 ℃、200 r/min。
1.2 主要试剂和仪器丝裂霉素C (MMC),美国罗氏公司;无菌滤器,美国Milipore公司;DNA产物纯化试剂盒,天根生化科技有限公司;真空浓缩仪,湖南赫西仪器公司;中文数显酶标仪,美国赛默飞世尔公司;超速离心机,美国Beckman公司;透射电镜(Tecnai G2 20 TWIN),美国FEI公司。
1.3 PBSX类缺陷性原噬菌体的诱导挑取受试菌株单菌落,接种于5 mL LB培养基中,37 ℃、200 r/min过夜培养,1%转接至5 mL LB培养基中,摇床培养2.5-3.0 h [活菌数达到(2-3)×107 CFU/mL]。加入终浓度为4 mg/L的MMC,迅速摇动。待充分混匀后,立即将上述5 mL菌液全部加入离心管中,12 000 r/min室温离心4 min。离心结束后去上清,菌体沉淀用2 mL新鲜LB洗涤2次,最终用50 μL LB重悬菌体,全部加入5 mL LB培养基中,37 ℃、200 r/min摇床培养3 h。对照组用等量无菌水替代MMC进行相同操作。3 h培养结束后菌体会裂解,菌液变澄清,取裂解液12 000 r/min离心10 min,取上清,并用孔径为0.45 μm的无菌滤器过滤,得到无细胞裂解液上清。
1.4 细胞裂解液上清中 13 kb DNA 片段的检测取2 mL细胞裂解液上清,在45 ℃条件下真空浓缩10倍后,使用DNA产物纯化试剂盒提取DNA。取上述样品进行琼脂糖凝胶电泳,检测13 kb DNA片段的存在情况。
1.5 细胞裂解液上清对 PBSX 敏感菌 W23 的攻击实验挑取B. subtilis W23单菌落进行活化后(详见方法1.3),1%接种量转接至5 mL LB培养基中培养过夜。裂解液上清与B. subtilis W23菌液100 μL+100 μL等体积混合并加入酶标板中,使用Thermo中文数显酶标仪立即测其OD630值。之后将酶标板放置于37 ℃温室中静置1 h后,再次测定其OD630值。根据裂解液上清与B. subtilis W23菌液混合1 h后OD630值的降低情况,判断相应菌株裂解液上清对B.subtilis W23的攻击能力。168菌体裂解液上清和LB培养基分别与B. subtilis W23菌液100 μL+100 μL等体积混合,分别作为阳性和阴性对照。
1.6 细胞裂解液上清中 PBSX 类缺陷性原噬菌体的电镜观察取制备好的裂解液上清进行超速离心(Beckman 70 Ti转子,25 000 r/min,4 ℃,2 h)。离心后沉淀中加入TMK buffer (Tris-HCl 0.01 mol/L,MgCl2 5 mmol/L,KCl 0.3 mol/L,pH 7.2)置于冰上过夜重悬。噬菌体样品使用2% PTA负染后,进行透射电镜(FEI Tecnai G2 20 TWIN)观察。
2 结果与分析 2.1 39 株枯草芽孢杆菌裂解液上清中 PBSX 类缺陷性原噬菌体的检测对39株B. subtilis裂解液上清中13 kb DNA片段及其对菌株W23攻击作用进行检测后(图 1、2,表 2),我们发现,24株菌(来源于英国纽卡素大学医学院微生物系的全部15株菌株,美国俄亥俄州立大学枯草杆菌保藏中心的AB92006和AB92007,陕西省微生物研究所的AB92053和AB93174,中国科学院微生物研究所的全部4株菌,以及来源于湖北神农架土壤中的AB93221),裂解液上清中不仅含有13 kb DNA片段,同时对B. subtilis W23也具有较强的攻击能力,初步确定为PBSX类缺陷性原噬菌体溶原菌。其中,有2株菌(AB93174和AB90008)裂解液上清中除了13 kb DNA片段,还能检测到一条分子量大于13 kb的DNA片段。1株菌(AB93150)裂解液中含有13 kb DNA片段,但不能攻击B. subtilis W23。5株菌(湖北天门制药厂的AB92009、AB92011、AB92012,陕西省微生物研究所的AB93091和AB93177)裂解液中不含13 kb DNA片段,但依然对B. subtilis W23具有一定的攻击能力,说明其裂解液中可能含有不同于PBSX但能攻击B. subtilis W23的杀菌性物质。另外9株菌(武汉大学医学部的AB91021,美国俄亥俄州立大学枯草杆菌保藏中心的AB92005,陕西省微生物研究所的AB93089、AB93090、AB93108、AB93151,以及湖北神农架土壤的AB93213、AB93215、AB93219)裂解液中既不含13 kb DNA片段,同时对B. subtilis W23也不具备任何攻击能力。此外,AB91021、AB92009、AB92011、AB92012、AB93091、AB93108和AB93215,这7株菌种的裂解液上清中虽然不含13 kb DNA片段,但它们均含有一条分子量大于13 kb的DNA片段。
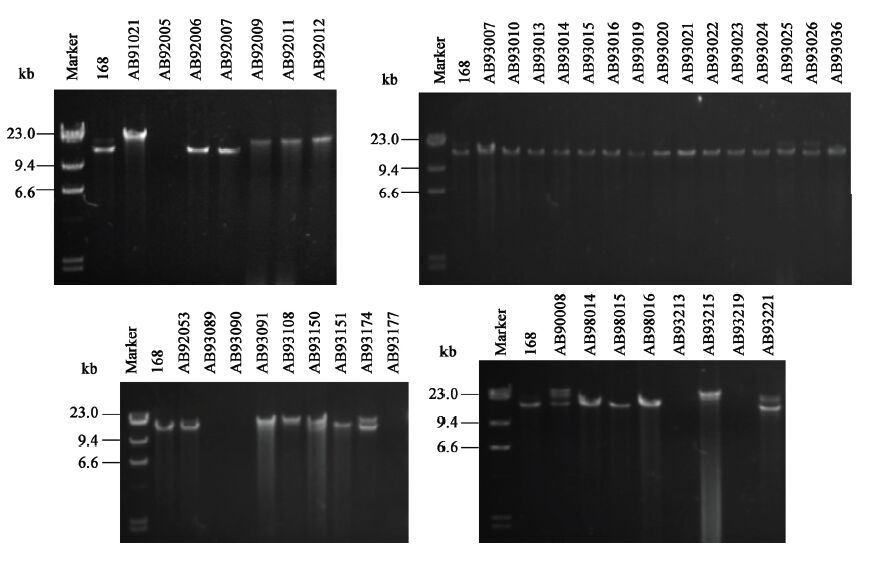
|
| 图 1 裂解液上清中13 kb DNA 片段检测 Figure 1 Detection of 13 kb DNA fragments in cell lysate supernatants |
|
|
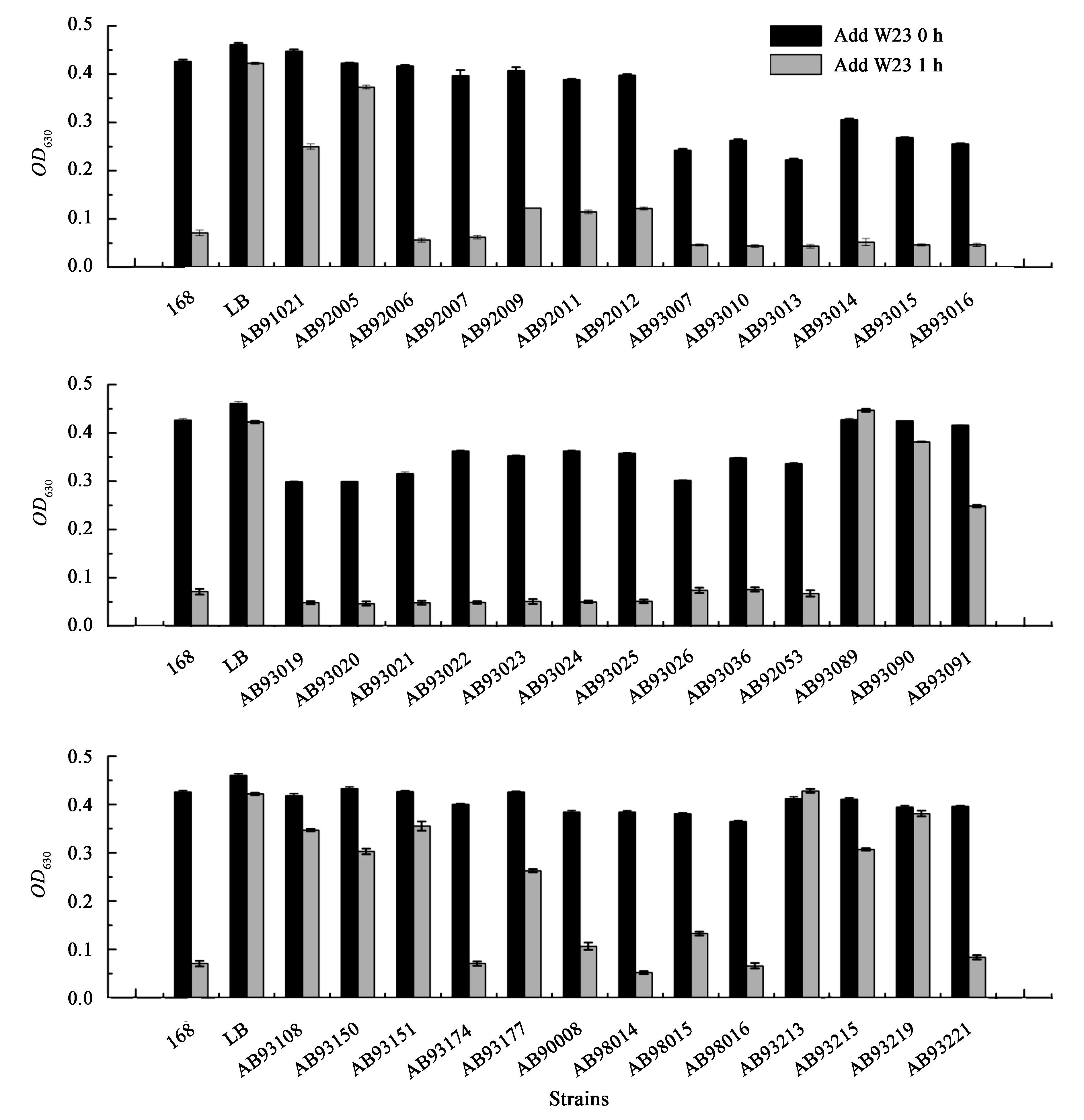
|
| 图 2 裂解液上清对B. subtilis W23 的攻击性 Figure 2 Killing activity of cell lysate supernatants against B. subtilis W23 |
|
|
| 枯草芽孢杆菌菌株 Bacillus subtilis strains | 来源 Resource | 13 kb DNA片段检测a Detection of 13 kb DNA fragmenta | 对W23的攻击性b Killing activity against W23b |
| 168 | 本实验室 | + | ++ |
| W23 | 本实验室 | / | / |
| AB91021 | 武汉大学医学部 | - | - |
| AB92005 | 美国俄亥俄州立大学枯草杆菌保藏中心 | - | - |
| AB92006 | 美国俄亥俄州立大学枯草杆菌保藏中心 | + | ++ |
| AB92007 | 美国俄亥俄州立大学枯草杆菌保藏中心 | + | ++ |
| AB92009 | 湖北天门制药厂 | - | + |
| AB92011 | 湖北天门制药厂 | - | + |
| AB92012 | 湖北天门制药厂 | - | + |
| AB93007 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93010 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93013 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93014 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93015 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93016 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93019 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93020 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93021 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93022 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93023 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93024 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93025 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93026 | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB93036 (BR151) | 英国纽卡素大学医学院微生物系 | + | ++ |
| AB92053 | 陕西省微生物研究所 | + | ++ |
| AB93089 | 陕西省微生物研究所 | - | - |
| AB93090 | 陕西省微生物研究所 | - | - |
| AB93091 | 陕西省微生物研究所 | - | + |
| AB93108 | 陕西省微生物研究所 | - | - |
| AB93150 | 陕西省微生物研究所 | + | - |
| AB93151 | 陕西省微生物研究所 | - | - |
| AB93174 | 陕西省微生物研究所 | + | ++ |
| AB93177 | 陕西省微生物研究所 | - | + |
| AB90008 | 中国科学院微生物研究所 | + | ++ |
| AB98014 | 中国科学院微生物研究所 | + | ++ |
| AB98015 | 中国科学院微生物研究所 | + | + |
| AB98016 | 中国科学院微生物研究所 | + | ++ |
| AB93213 | 湖北神农架杉树坪土壤 | - | - |
| AB93215 | 湖北神农架木鱼坪土壤 | - | - |
| AB93219 | 湖北神农架九冲土壤 | - | - |
| AB93221 | 湖北神农架送郎山土壤 | + | ++ |
| 注:a:凡是裂解液上清中能检测到13 kb DNA片段的,即表示为“+”,反之则表示为“-”. b:“+”的数量表示裂解液上清对W23的攻击程度. ++:具有较强的攻击能力;+:具有微弱的攻击能力;-:不具备攻击能力. Note: a: +:13 kb DNA fragments could be detected in the cell lysate supernatants,-: 13 kb DNA fragments could not be detected in the cell lysate supernatants. b: The number of “+” indicates the degree of killing activity. ++: high; +: low; -: no killing activity. | |||
在实验过程中,我们挑选了3株初步断定未携带PBSX类缺陷性原噬菌体的菌株AB93213、AB93215和AB93219,对其裂解液上清进行电镜观察。结果意外发现,尽管这3株菌裂解液上清中不含13 kb DNA片段,同时也不能攻击B. subtilis W23,但它们的裂解液上清中均能检测到类似于噬菌体的颗粒(图 3)。在AB93213裂解液上清中(图 3A),观察到两种大小不同的头尾状颗粒,它们的头部直径分别为65 nm和37 nm,尾长分别为124 nm和204 nm。这两种噬菌体状颗粒的形态尺寸均不同于PBSX。在AB93215裂解液上清中(图 3B),也存在两种形态的噬菌体状颗粒,一种为头尾状,头部直径和尾长分别为40 nm和127 nm,其尾长远远小于PBSX;另一种噬菌体状颗粒为球状,直径约为40 nm;而在AB93219裂解液上清中(图 3C),观察到一种头尾状噬菌体状颗粒,头部直径和尾长分别为51 nm和218 nm,均高于PBSX。以上结果说明,这3株菌株均携带有基本特性有别于PBSX的噬菌体状颗粒。
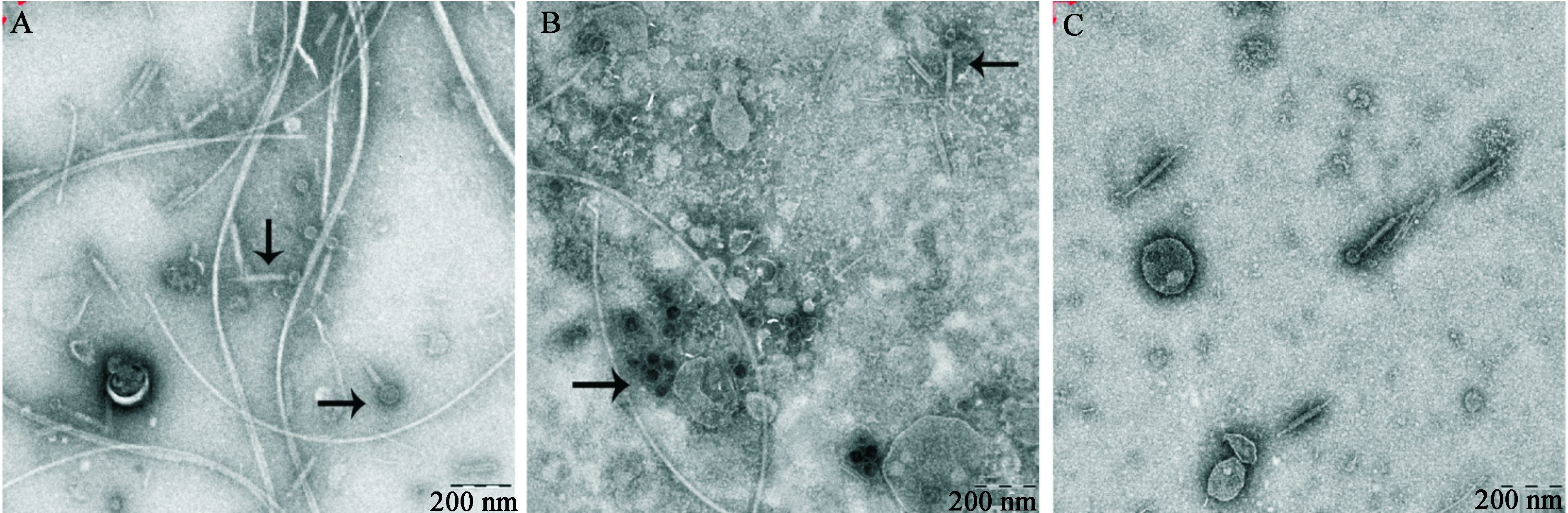
|
| 图 3 B. subtilis AB93213 (A)、AB93215 (B)和AB93219 (C)裂解液上清中噬菌体颗粒电镜观察 Figure 3 Transmission electron micrographs of phage-like particles in cell lysate supernatants of B. subtilis AB93213 (A), AB93215 (B), and AB93219 (C) |
|
|
本文所使用并建立了初步检测PBSX类缺陷性原噬菌体的方法,即利用MMC诱导后裂解液上清中13 kb特征性DNA条带的检测,以及使用酶标仪测定菌液OD630来验证裂解液对PBSX敏感菌W23的攻击作用。该方法快速简便,可以在短时间内初步检测到PBSX类缺陷性原噬菌体的存在情况。该方法对于其它类型缺陷性原噬菌体的检测也同样具有借鉴和应用价值。利用该方法,我们对中国典型培养物保藏中心所保藏的39株具有不同来源的B. subtilis菌株,进行了PBSX类缺陷性原噬菌体携带情况的普遍性调查。含有PBSX类缺陷性原噬菌体的菌株占到了61.5%,说明PBSX溶源菌在B. subtilis中具有普遍性。此外,PBSX溶源菌在受试菌株中占如此高的比例,结合Westers[22] (PBSX有利于宿主菌维持正常运动性)和Piggot[23]等(PBSX有利于宿主菌在基本培养基中生长)的研究结果,这暗示了PBSX的存在对于宿主适应环境是有利的。本文结果为进一步揭示PBSX存在的意义,及其对宿主菌的作用提供了更多的理论依据。
在普查的这39株B. subtilis菌株中,来源于湖北天门制药厂的全部3株菌的裂解液都可以攻击B. subtilis W23,但未检测到PBSX特征性13 kb DNA条带的存在,推测这3株菌可能携带能够攻击B. subtilis W23,但不同于PBSX的噬菌体类似物质。分离自湖北神农架土壤的4株菌株,有3株菌(AB93213、AB93215和AB93219)的裂解液上清既不含13 kb DNA,也不能攻击B. subtilis W23;但在这3株菌的裂解液上清中,通过电镜观察到类似于噬菌体的颗粒(图 3);而且在AB93213和AB93215裂解液上清中均检测到了两种形态的噬菌体状颗粒;这3株菌裂解液上清中的噬菌体状颗粒的形态大小均不同于PBSX。因此我们推测,这3株分离自神农架土壤中的野生菌株,携带有不同于PBSX的噬菌体状颗粒;但这些噬菌体状颗粒究竟与PBSX之间是否存在联系,有多大差别,还需要通过实验进一步验证。从本文实验数据来看,工业菌株和野生菌株中含有丰富的噬菌体资源,这为进一步研究B. subtilis中的PBSX类以及其它相关噬菌体提供了丰富的研究资源。
| [1] | Wood HE, Dawson MT, Devine KM, et al. Characterization of PBSX,a defective prophage of Bacillus subtilis[J]. Journal of Bacteriology, 1990, 172 (5): 2667–2674. |
| [2] | Hartford OM, Dowds BC. Cloning and characterization of genes induced by hydrogen peroxide in Bacillus subtilis[J]. Journal of General Microbiology, 1992, 138 (10): 2061–2068. |
| [3] | Siegel EC, Marmur J. Temperature-sensitive induction of bacteriophage in Bacillus subtilis 168[J]. Journal of Virology, 1969, 4 (5): 610–618. |
| [4] | Thurm P, Garro AJ. Bacteriophage-specific protein synthesis during induction of the defective Bacillus subtilis bacteriophage PBSX[J]. Journal of Virology, 1975, 16 (1): 179–183. |
| [5] | McDonnell GE, Wood H, Devine KM, et al. Genetic control of bacterial suicide: regulation of the induction of PBSX in Bacillus subtilis[J]. Journal of Bacteriology, 1994, 176 (18): 5820–5830. |
| [6] | Longchamp PF, Mauel C, Karamata D. Lytic enzymes associated with defective prophages of Bacillus subtilis: sequencing and characterization of the region comprising the N-acetylmuramoyl-L-alanine amidase gene of prophage PBSX[J]. Microbiology, 1994, 140 (8): 1855–1867. |
| [7] | Krogh S, JØrgensen ST, Devine KM. Lysis genes of the Bacillus subtilis defective prophage PBSX[J]. Journal of Bacteriology, 1998, 180 (8): 2110–2117. |
| [8] | Ward JB, Curtis CA, Taylor C, et al. Purification and characterization of two phage PBSX-induced lytic enzymes of Bacillus subtilis 168: an N-acetylmuramoyl-L-alanine amidase and an N-acetylmuramidase[J]. Journal of General Microbiology, 1982, 128 (6): 1171–1178. |
| [9] | Okamoto K, Mudd JA, Mangan J, et al. Properties of the defective phage of Bacillus subtilis[J]. Journal of Molecular Biology, 1968, 34 (3): 413–428. |
| [10] | Mauël C, Karamata D. Characterization of proteins induced by mitomycin C treatment of Bacillus subtilis[J]. Journal of Virology, 1984, 49 (3): 806–812. |
| [11] | Anderson LM, Bott KF. DNA packaging by the Bacillus subtilis defective bacteriophage PBSX[J]. Journal of Virology, 1985, 54 (3): 773–780. |
| [12] | Hirokawa H, Kadlubar F. Length of deoxyribonucleic acid of PBSX-like particles of Bacillus subtilis induced by 4-nitroquinoline-1-oxide[J]. Journal of Virology, 1969, 3 (2): 205–209. |
| [13] | Okamoto K, Mudd JA, Marmur J. Conversion of Bacillius subtilis DNA to phage DNA following mitomycin C induction[J]. Journal of Molecular Biology, 1968, 34 (3): 429–437. |
| [14] | Shingaki R, Kasahara Y, Inoue T, et al. Chromosome DNA fragmentation and excretion caused by defective prophage gene expression in the early-exponential-phase culture of Bacillus subtilis[J]. Canadian Journal of Microbiology, 2003, 49 (5): 313–325. |
| [15] | Seaman E, Tarmy E, Marmur J. Inducible phages of Bacillus subtilis[J]. Biochemistry, 1964, 3 (5): 607–613. |
| [16] | Steensma HY. Adsorption of the defective phage PBS Z1 to Bacillus subtilis 168 Wt[J]. Journal of General Virology, 1981, 52 (1): 93–101. |
| [17] | Steensma HY. Effect of defective phages on the cell membrane of Bacillus subtilis and partial characterization of a phage protein involved in killing[J]. Journal of General Virology, 1981, 56 (2): 275–286. |
| [18] | Steensma HY, Robertson LA, van Elsas JD. The occurrence and taxonomic value of PBS X-like defective phages in the genus Bacillus[J]. Antonie van Leeuwenhoek, 1978, 44 (3/4): 353–366. |
| [19] | Haas M, Yoshikawa H. Defective bacteriophage PBSH in Bacillus subtilis. I. Induction, purification,and physical properties of the bacteriophage and its deoxyribonucleic acid[J]. Journal of Virology, 1969, 3 (2): 233–247. |
| [20] | Huang WM, Marmur J. Characterization of inducible bacteriophages in Bacillus licheniformis[J]. Journal of Virology, 1970, 5 (2): 237–246. |
| [21] | Buxton RS. Selection of Bacillus subtilis 168 mutants with deletions of the PBSX prophage[J]. Journal of General Virology, 1980, 46 (2): 427–437. |
| [22] | Westers H, Dorenbos R, van Dijl JM, et al. Genome engineering reveals large dispensable regions in Bacillus subtilis[J]. Molecular Biology and Evolution, 2003, 20 (12): 2076–2090. |
| [23] | Piggot PJ, Buxton RS. Bacteriophage PBSX-induced deletion mutants of Bacillus subtilis 168 constitutive for alkaline phosphatase[J]. Journal of General Microbiology, 1982, 128 (4): 663–669. |
| [24] | Jin TT, Zhang XM, Zhang Y, et al. Biological and genomic analysis of a PBSX-like defective phage induced from Bacillus pumilus AB94180[J]. Archives of Virology, 2014, 159 (4): 739–752. |
 2016, Vol. 43
2016, Vol. 43




