扩展功能
文章信息
- 高媛, 雷旗, 蒋维, 孔玉珊, 薛艳红, 刘士平
- GAO Yuan, LEI Qi, JIANG Wei, KONG Yu-Shan, XUE Yan-Hong, LIU Shi-Ping
- 一株高抗氧化活性内生真菌的分子鉴定及产酚酸类物质研究
- Molecular characterization and phenolic acids analysis of an endophytic fungus with high antioxidant activity
- 微生物学通报, 2016, 43(6): 1235-1243
- Microbiology China, 2016, 43(6): 1235-1243
- DOI: 10.13344/j.microbiol.china.150534
-
文章历史
- 收稿日期: 2015-07-15
- 接受日期: 2015-10-30
- 优先数字出版日期(www.cnki.net): 2016-02-01
植物内生菌(Endophyte)是一类广泛分布于健康植物组织内部的微生物,近年来在医药、食品、农业和林业领域显示出越来越大的应用前景[1]。许多内生菌可帮助宿主植物应对各种生物和非生物胁迫环境,如病虫害、干旱、高温、低营养和高盐等胁迫[2]。特别是处于特殊生境下的植物,其体内的内生菌在协助寄主度过胁迫期中发挥着重要作用,如从海洋植物红树林中分离的内生菌,可提高植物对盐碱的抵抗能力[3];从沙漠地区麻黄中分离的内生菌Chaetomium chiversii,可显著提高寄主拟南芥对高温和干旱的耐受能力[4]。
疏花水柏枝(Myricaria laxiflora)是一种特异分布在三峡河岸带地区珍稀濒危物种,系柽柳科(Tamaricaceae)水柏枝属(Myricaria)多年生灌木,民间常用于消炎和治疗烫伤[5]。疏花水柏枝每年要承受4-6个月的淹水胁迫,因此对水淹进化出极强的适应能力。由于在淹水环境下植物体的供氧量减少,不完全氧化将会产生O2-等氧化自由基,从而引起膜脂发生过氧化,致使植物生长发育受阻[6]。在长期对抗水淹胁迫的生态适应过程中,疏花水柏枝进化出极强的抗氧化能力。本实验室从疏花水柏枝中分离出一种叫3,4-二甲氧基-5-羟基苯甲酸甲酯的酚酸类物质,具有极强的抗氧化能力,表明酚酸类物质在疏花水柏枝抗氧化代谢过程中发挥着重要作用[7]。
内生菌通过与宿主植物的共生,提高宿主植物对氧化胁迫的抵抗能力,增强对逆境的适应性[8]。Huang等从29种传统中草药中分离出了292种不同形态类型的内生真菌,65%以上的内生真菌表现出很强的抗氧化作用[9]。本实验室从疏花水柏枝中分离到163株内生真菌,大多数都显示出较强的抗氧化能力,而且以曲霉属、青霉属和链格孢菌属占的比例最高[10]。有些内生真菌可产生醌类、生物碱类、肽类、萜类、酚酸类、异香豆类等抗氧化物质,特别是香草酸、肉桂酸等酚酸类物质,可能起到了主导作用[9]。一方面它们自身具有较强的抗氧化能力,另一方面还可以提高宿主抗氧化酶系的活性,抑制宿主植物发生过氧化作用[8]。
为探讨疏花水柏枝的内生真菌是否可以通过抗氧化途径协助宿主度过氧化胁迫期,并分析内生菌可能的抗氧化物质基础,本研究从一株来自于疏花水柏枝根部、具有高抗氧化活性的内生真菌SG17出发,对其进行了形态特征观察和分子鉴定,利用总抗氧化试剂盒鉴定了其在胞外的抗氧化能力,并分析了其发酵液中可能的酚酸类物质,这些研究对新型抗氧化剂的筛选与研发、明确特殊生境下内生真菌协助宿主抵抗非生物胁迫作用等方面有一定的积极意义。
1 材料与方法 1.1 菌株和培养基实验所用的内生真菌SG17分离自疏花水柏枝的根部[10],4 °C石蜡保藏;实验中所使用的培养基有PDA固体培养基[8]和SDA液体培养基[10]。
1.2 菌株的分子鉴定将4 °C保藏的SG17接种于PDA固体培养基中,28 °C培养5 d。活化后接种到装有200 mL PDA液体培养基的500 ml三角瓶中,28 °C、140 r/min培养7 d。发酵液5 000 r/min离心5 min收集菌体后进行液氮研磨,利用Ezup柱式真菌基因组DNA抽提试剂盒(上海生工)提取总DNA。
以总DNA为模板,以真菌ITS特异性引物对ITS1 (5´-TCCGTAGGTGAACCTGCGG-3´)和ITS4 (5´-TCCTCCGCTTATTGATATGC-3´)对nrDNA的内转录间隔区进行PCR扩增[11]。反应体系共20 μL:模板DNA 1.0 μL,正向引物(10 μmol/L) 1.0 μL,反向引物(10 μmol/L) 1.0 μL,dNTP mixture (2.5 mmol/L) 2.0 μL,Taq DNA聚合酶(2 U/μL) 0.2 μL,10×Buffer 2 μL,ddH2O 12.8 μL。PCR扩增条件:95 °C 5 min;94 °C 1 min,60 °C 30 s,72 °C 1 min,33个循环;72 °C 10 min;4 °C保存[11]。
将扩增获得的DNA片段用PCR纯化试剂盒(TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0)回收,然后委托上海生工公司采用ABI-3730 DNA测序仪进行测序,重复2次,然后在GenBank中进行Blast比对分析。
1.3 发酵液抗氧化活性分析将活化后的菌株分别接种到SDA和PDA液体培养基中,采用总抗氧化试剂盒(T-AOC,南京建成生物工程研究所) 每天测定其发酵液的总抗氧化能力[10]。具体方法:发酵菌悬液先用纱布过滤除去菌体,滤液10 000 r/min离心10 min,将所获得的上清液按照试剂盒介绍的的方法反应后在520 nm处测定吸光值。
| $T-AOC\text{ }(\text{U/mL})=\frac{(O{{D}_{\text{U}}}-O{{D}_{\text{C}}})\times N}{0.3n}$ |
ODU:测定管吸光度值;ODC:对照管吸光度值;N:反应体系稀释倍数(反应液总体积/取样量);n:样本测试前稀释倍。
为分析不同盐碱条件下SG17的抗氧化能力,用1 mol/L氢氧化钠溶液将SDA液体培养基pH分别调节至6.9和7.4,氯化钠浓度为100 mmol/L和200 mmol/L,28 °C、150 r/min培养14 d后测定抗氧化活性。
1.4 粗提物酚酸类物质含量测定及抗氧化活性分析为进一步确定其发酵液的抗氧化能力及可能的物质基础,对SG17的发酵液进行了浓缩和粗提。先用抽滤将菌体与发酵液分离后,50 °C减压浓缩至黏稠状,用等量乙酸乙酯萃取浓缩后的发酵液3次,合并后加入50 mL蒸馏水,40 °C旋转蒸发后进行冷冻干燥。将粗提物采用Folin-Ciocalteu法测定总多酚含量,以没食子酸为标准溶液作标准曲线[12]。以0.8 mg/g的抗坏血酸作为正对照测定其抗氧化能力,其他方法如1.3所述。
1.5 HPLC和TLC分析HPLC分析以没食子酸和绿原酸作为标准品,色谱条件:流动相甲醇(A)-水(B) (水相中含0.1%醋酸),梯度洗脱0-30 min,浓度梯度为10%-100% A[13]。利用Shimadzu CBM-10A分析型高效液相色谱系统,LC-6AD二元梯度泵,SPD-20AV紫外检测器进行分析。分析柱为COSMOSIL·MS-II RP-C18色谱柱(5 μm,250 mm× 4.6 mm分析型)。没食子酸检测波长为273 nm,绿原酸检测波长为326 nm。加标HPLC分析取绿原酸作为标准品。
TLC分析以绿原酸作为标准品。用乙酸乙酯׃丙酮׃甲酸׃水=7׃3׃1׃1.2的体积比展开,取出晾干,在波长为354 nm紫外光下观察[13]。
2 结果与分析 2.1 SG17的生物学鉴定内生菌SG17分离自健康疏花水柏枝的根部,菌落在PDA上生长迅速,近圆形,丝绒状,灰橄榄绿色,边缘不整齐(图 1A),背面灰白色(图 1B);菌丝无色透明,具隔膜;分生孢子淡绿色(图 1C)。

|
| 图 1 SG17 的菌落及显微形态 Figure 1 Morphology of colony, hyphae and conidia of SG17 A:菌落形态;B:背面形态;C:菌丝和分生孢子. A: Morphology of colony; B: Back of the dish; C: Hyphae and conidia. |
|
|
将SG17的总DNA提取后,以其为模板,使用通用上游引物ITS1和ITS4进行PCR扩增,回收产物后送Sangon公司测序。获得18S rRNA基因的ITS序列通过EditSeq软件拼接,结果如下:
AGGGGCATCCTACCTGATCGAGGTCACCTTAGAAAAATAAAGTTGGGTGTCGGCTGGCGCCGGCCGGGCCTACAGAGCAGGTGACAAAGCCCCATACGCTCGAGGACCGGACGCGGTGCCGCCGCTGCCTTTCGGGCCCGTCCCCCGGGAGAGGGGGACGGGGGCCCAACACACAAGCCGTGCTTGAGGGCAGCAATGACGCTCGGACAGGCATGCCCCCCGGAATACCAGGGGGCGCAATGTGCGTTCAAAGACTCGATGATTCACTGAATTCTGCAATTCACATTACTTATCGCATTTCGCTGCGTTCTTCATCGATGCCGGAACCAAGAGATCCGTTGTTGAAAGTTTTAACTGATTACGATAATCAACTCAGACTGCATACTTTCAGAACAGCGTTCATGTTGGGGTCTTCGGCGGGCGCGGGCCCGGGGGCGCAAGGCCTCCCCGGCGGCCGTCGAAACGGCGGGCCCGCCGAAGCAACAAGGTACGATAGACACGGGTGGGAGGTTGGACCCAGAGGGCCCTCACTCGGTAATGATCCTTCCGCAGGCCGACCCTACAGA。
将序列结果输入GenBank数据库进行比对分析,相似性最高的5株菌结果如表 1所示。
| 检索物种 Possible source | 登录号 Accession No. | 覆盖度 Query cover (%) | 相似性 Identity (%) | 总分数 |
| Aspergillus fumigatus | KP317993.1 | 99 | 99 | 1 013 |
| KJ001801.1 | 97 | 99 | 1 013 | |
| FJ214371.1 | 97 | 99 | 1 007 | |
| KF201647.1 | 96 | 100 | 1 005 | |
| KF577886.1 | 97 | 99 | 1 002 |
测序结果通过NCBI中Blast比对分析表明,疏花水柏枝内生真菌SG17与烟曲霉(Aspergillus fumigatus)相似性极高,达到99%-100% (表 1)。为进一步判断SG17是否是烟曲霉,对照《真菌鉴定手册》[14],比较了SG17和烟曲霉的孢子形态等识别特征。根据文献[14]的描述,烟曲霉仅上半部产球形分生孢子,颜色为深浅不同的绿色,分生孢子梗光滑,顶囊为烧瓶状,这些特征与疏花水柏枝内生真菌SG17 的形态特征完全相同,说明SG17 是一株烟曲霉。
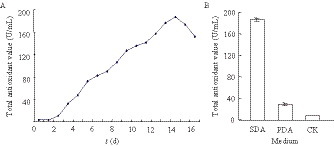
2.2 SG17 发酵液抗氧化活性分析为明确SG17 发酵液抗氧化能力大小,将活化后的菌株分别接种到SDA 液体培养基中,采用总抗氧化试剂盒(T-AOC)每天测定其发酵液的总抗氧化能力。检测结果(图 2A)表明,SG17 发酵液的抗氧化能力在培养第14 天时达到最大值,总抗氧化值达到186.87 U/mL,随后开始下降。进一步的分析表明,SG17 在SDA 中的抗氧化能力远高于其在PDA 中的相应值(图 2B)。同以14 d 为例,其在PDA中的抗氧化值仅为29.70 (各分5 次重复),说明SDA培养基更有利于其抗氧化活性物质的生产。
|
| 图 2 SG17 发酵液的抗氧化能力测定 Figure 2 Determination of SG17 fermentation broth antioxidant capacities A:SG17 在SDA 中不同发酵时间中的抗氧化能力;B:SG17 在不同培养基中的抗氧化能力. A: The antioxidant capacity curve in SDA medium; B: Antioxidant value in different medium. |
|
|
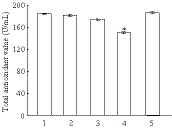
由于SG17 的宿主疏花水柏枝生长在一种轻度盐碱的环境条件下[5],为模拟其自然环境,我们测定了SG17 在不同盐碱条件下抗氧化能力的变化。将SG17 分别置于pH 6.9 和pH 7.4,以及100 mmol/L和200 mmol/L NaCl 浓度条件下的SDA培养基进行培养,14 d 后分5 次重复测定其抗氧化能力。结果表明(图 3),SG17 发酵液在轻度盐碱条件下依旧显示出较强的抗氧化能力。除了在200 mmol/L NaCl浓度条件下,其抗氧化能力有所下降外,其他差异均不显著,说明SG17 适应了一种轻度盐碱环境,因此在该环境条件下还具有较高的抗氧化能力。
|
| 图 3 SG17 发酵液在盐碱条件下的抗氧化能力(P <0.05) Figure 3 The antioxidant capacity of SG17 fermentation broth under saline or alkaline conditions (P <0.05) 1: pH 6.9; 2: pH 7.4; 3: 100 mmol/L NaCl; 4: 200 mmol/L NaCl; 5: SDA. |
|
|
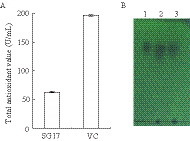
将SG17 的发酵液干燥后的粗提物用无水甲醇稀释成0.8 mg/g,与同浓度的抗坏血酸一起测定其抗氧化能力。结果表明SG17 发酵液的粗提物同样具有很高的抗氧化能力,总抗氧化值达到62.56 U/mL,达到0.8 mg/g 抗坏血酸(196.33 U/mL)的31.86% (图 4A),说明SG17 的发酵产物中含有大量的高抗氧化活性的物质。
|
| 图 4 SG17 发酵液提取物分析 Figure 4 Analysis of extract from fermentation broth A:总抗氧化值分析,SG17 表示其发酵液,以VC 作为对照;B:绿原酸的薄层色谱,1 号样点为绿原酸标准品,2 号样点为绿原酸与发酵液粗提物混合样,3 号点为发酵液粗提物. A: Total antioxidant value analysis, SG17 means the fermentation broth with a control of VC; B: TLC of chlorogenic acid. Sample 1 represents the standard of chlorogenic acid, sample 2 was the mixture of both, and sample 3 was the extract from the fermentation broth. |
|
|
由于酚酸类物质(代表化合物为没食子酸和绿原酸)在SG17 的宿主植物疏花水柏枝的抗氧化代谢过程中发挥着重要作用[7],采用福林酚法分析了其菌体和发酵液中的酚酸类物质的含量。结果表明其菌体酚酸类物质含量达到8.03 mg/g,发酵液中酚酸类物质含量达到64.43 μg/g (表 2)。尤其是其发酵液中的酚酸含量,较文献中报道的桦褐孔菌要高[15],也比我们从疏花水柏枝中分离的37 个高抗氧化活性内生真菌的平均值要高。
| 菌株 Isolates | 菌体 Thallus (mg/g) | 发酵液 Fermentation broth (μg/g) |
| SG17 | 8.03 | 64.43 |
| 桦褐孔菌[15] Inonotus obliquus | 12.47 | 34.7 |
| 忍冬木层孔菌[16] Phellinus lonicerinus | 15.6 | 106.76 |
| 疏花水柏枝内生真菌a Endophytic fungi from M. laxiflora | 7.15 | 52.61 |
| 注:a:从疏花水柏枝中分离的37 个高抗氧化活性真菌的平均值. Note: a: The average contents of the 37 relatively high antioxidant endopgytes from M. laxiflora. | ||
实验采用TLC 技术对SG17 发酵液产物进行了定性检测,如图 4B 所示。1 号样点为绿原酸标准品,2 号样点为绿原酸与发酵液粗提物混合样,3 号点为发酵液粗提物。绿原酸的Rf 值为0.648,2 号点和3 号点的Rf 值范围为0.644-0.648,TLC 结果推测发酵液粗提物中可能含有绿原酸成分或其类似物。
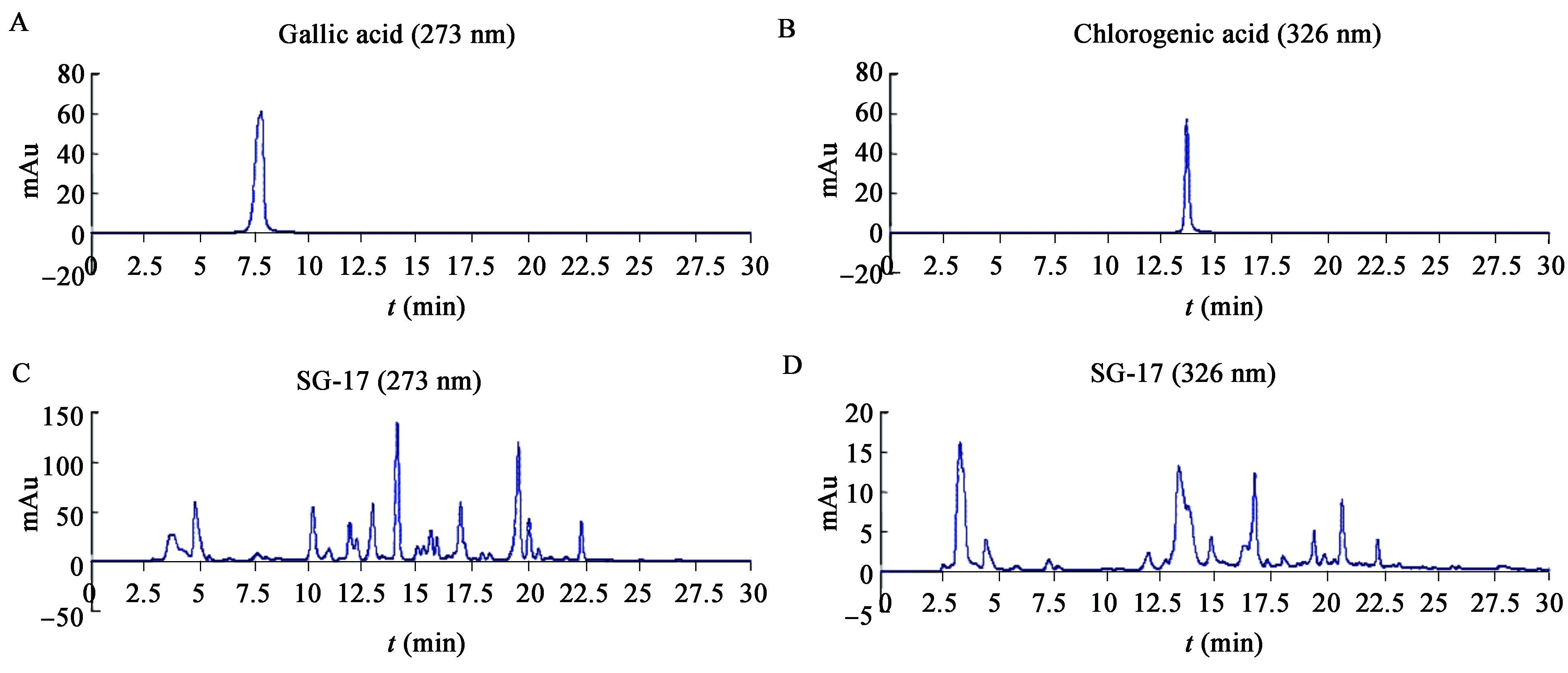
为了进一步佐证上述论断,我们利用HPLC 技术对发酵液粗提物进行了化学组分分析。没食子酸标准品检出的保留时间在tR=7.5 min (图 5A),在该时间SG17 发酵液产物样品也有明显的色谱峰(图 5B),说明SG17 次级代谢产物中含有没食子酸成分,通过加标实验,进一步证实了该结论。图 5D在tR=12.5−14 min 有明显的色谱叠加峰,而绿原酸标准品检出的保留时间刚好位于该区域(图 5C),说明SG17 次级代谢产物中可能含有绿原酸成分。
|
| 图 5 没食子酸和绿原酸的HPLC 分析 Figure 5 HPLC analyses of gallic acid and chlorogenic acid A 和B:没食子酸分析;C 和D:绿原酸分析. A and B: Gallic acid analyses; C and D: Chlorogenic acid analyses. |
|
|
为了进一步验证绿原酸是否存在,将TLC 板上的对应的样品收集后,用甲醇浸泡,然后进行HPLC内标分析。结果显示(图 6A−C),绿原酸与测试样品的保留时间相近,但在色谱柱上可分离,暗示样品1 中的分析成分不是绿原酸。通过对该样品进行紫外-可见光谱分析,该样品具有绿原酸的紫外吸收特征,暗示该样品可能为绿原酸一种衍生物。关于具体化合物结构,目前正在纯化与鉴定中。

|
| 图 6 绿原酸的内标HPLC 分析 Figure 6 Internal standard HPLC analysis of chlorogenic acid |
|
|
植物内生菌以其丰富的资源、多样的次生代谢产物及广谱的生物活性,近年来被越来越多的微生物学研究者所关注。本研究从能抵抗淹水胁迫的植物疏花水柏枝的内生真菌出发,选择了一株具有高抗氧化活性的菌株SG17 作为研究对象,对其进行了生物学鉴定、抗氧化能力评价和产酚酸类物质分析。分子和形态鉴定表明SG17 是一株烟曲霉,它具有很高的抗氧化活性,其发酵液粗提物的抗氧化活性达到同浓度抗坏血酸的31.86%,其酚酸类物质含量丰富,HPLC 能检测到含有没食子酸和绿原酸的类似物。这一系列结果表明,菌株SG17 是一种具有潜在开发价值的抗氧化剂资源。
前人的研究表明,特殊生境植物的内生菌往往具有特殊的活性[3-4]。SG17 的宿主疏花水柏枝特异性分布在三峡流域一带,每年要受到近半年的淹水胁迫,在氧气供应不充足的环境下,其生长必须要遭受长时间的氧化胁迫。疏花水柏枝的内生真菌是否参与了宿主植物的抗氧化胁迫代谢?虽然这一假说还缺乏直接的证据,但我们从疏花水柏枝分离的165株内生菌中,有37株具有强抗氧化活性[10],不论是内生菌所占的比例还是内生菌的抗氧化活性(表 3),明显较从其他物种中分离的内生菌高[17,18]。另外,表 3中列举出的总抗氧化能力大多是在PDA液体培养基发酵培养的条件下测定的,但是本次实验中所用到的SDA液体培养基,所测出的总抗氧化能力最高值远大于表中所示PDA液体培养基培养所得的发酵液的最高抗氧化能力,说明使用SDA液体培养基可能更有利于抗氧化活性物质的产生。
研究表明,植物内生菌的抗氧化活性与酚酸类物质的含量有一定的关系[10],本实验室探讨了疏花水柏枝37株高抗氧化活性内生真菌的酚酸含量,其相关性接近0.5[10]。就SG17这一内生真菌而言,没食子酸和绿原酸衍生物可能是SG17高抗氧化活性的重要原因,但是未来还需明确其起抗氧化作用的物质基础,根据活性跟踪的方法分离得到高抗氧化活性的单体化合物,为进一步发挥其高抗氧化功效、筛选与研发新型抗氧化剂等奠定基础。
| [1] | Wang LH. Research advance on plant endophyte[J]. Chemistry and Bioengineering, 2011, 28 (3): 5–7. (in chinese) 王莉衡. 植物内生菌的研究进展[J]. 化学与生物工程, 2011, 28 (3):5–7. |
| [2] | Ji XL, Lu GB, Gai YP, et al. Colonization of Morus alba L. by the plant-growth-promoting and antagonistic bacterium Burkholderia cepacia strain Lu10-1[J]. BMC Microbiology, 2010, 10 : 243. |
| [3] | Weyens N, van der Lelie D, Taghavi S, et al. Phytoremediation: plant-endophyte partnerships take the challenge[J]. Current Opinion in Biotechnology, 2009, 20 (2): 248–254. |
| [4] | McLellan CA, Turbyville TJ, Wijeratne EMK, et al. A rhizosphere fungus enhances Arabidopsis thermotolerance through production of an HSP90 inhibitor[J]. Plant Physiology, 2007, 145 (1): 174–182. |
| [5] | Liu YF, Wang Y, Huang HW. Species-level phylogeographical history of Myricaria plants in the mountain ranges of western China and the origin of M. laxiflora in the Three Gorges mountain region[J]. Molecular Ecology, 2009, 18 (12): 2700–2712. |
| [6] | Zhang Y, Li RL, Zhang DS, et al. Research progress of waterlogging to plants[J]. Crop Research, 2011, 25 (2): 420–424. (in chinese) 张阳, 李瑞莲, 张德胜, 等. 涝渍对植物影响研究进展[J]. 作物研究, 2011, 25 (2):420–424. |
| [7] | Tian W, Bi YT, Zhou QL, et al. Effects of gallate esters on antioxidation of nerve cells[J]. Natural Product Research and Development, 2013, 25 (10): 1423–1427. (in chinese) 田伟, 毕玉婷, 周启龙, 等. 没食子酸酯对神经细胞的抗氧化保护作用研究[J]. 天然产物研究与开发, 2013, 25 (10):1423–1427. |
| [8] | Ye YH, Xiao Y, Ma L, et al. Flavipin in Chaetomium globosum CDW7, an endophytic fungus from Ginkgo biloba, contributes to antioxidant activity[J]. Applied Microbiology and Biotechnology, 2013, 97 (16): 7131–7139. |
| [9] | Huang WY, Cai YZ, Xing J, et al. A potential antioxidant resource: endophytic fungi from medicinal plants[J]. Economic Botany, 2007, 61 (1): 14–30. |
| [10] | Zeng W, Qin W, Tian W, et al. Antioxidant activity in vitro of endophytic fungi from Myricaria laxiflora, a riparian plant with strong tolerance ability of flooding[J]. Journal of Pure and Applied Microbiology, 2015, 9 (1): 87–95. |
| [11] | Wäli PR, Ahlholm JU, Helander M, et al. Occurrence and genetic structure of the systemic grass endophyte Epichloë festucae in fine fescue populations[J]. Microbial Ecology, 2007, 53 (1): 20–29. |
| [12] | Gall EA, Lelchat F, Hupel M, et al. Extraction and purification of phlorotannins from brown algae[A]//Stengel DB, Connan S. Natural Products From Marine Algae: Methods in Molecular Biology[M]. New York: Springer, 2015, 1308: 131-143 |
| [13] | Fu X, Yin ZP, Chen JG, et al. Production of chlorogenic acid and its derivatives in hairy root cultures of Stevia rebaudiana[J]. Journal of Agricultural and Food Chemistry, 2015, 63 (1): 262–268. |
| [14] | Wei JC. Fungi Identification Manual[M]. Shanghai: Shanghai Science and Technology Press, 1979: 90 -121. (in chinese) 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979: 90 -121. |
| [15] | Zhang MM, Wei ZW, Liu YB, et al. Optimization on determination of polyphenols from Inonotus obliquus by Folin-Ciocalteu colorimetry[J]. Mycosystema, 2011, 30 (2): 295–304. (in chinese) 张梅梅, 魏志文, 刘玉冰, 等. Folin-Ciocalteu比色法测定桦褐孔菌多酚的条件优化[J]. 菌物学报, 2011, 30 (2):295–304. |
| [16] | Yu HY, Cao CL, Cui BK. Polyphenol content and antioxidant ctivities of Phellinus lonicericola in liquid culture[J]. Mycosystema, 2012, 31 (6): 933–939. (in chinese) 余海尤, 曹春蕾, 崔宝凯. 忍冬木层孔菌液体培养过程中多酚含量及抗氧化活性研究[J]. 菌物学报, 2012, 31 (6):933–939. |
| [17] | Xie H, Li L, Wu MQ, et al. Antioxidant activity analysis and identification of an endophytic fungal strain from Eucommia ulmoides Oliv[J]. Journal of Anhui Agricultural Sciences, 2009, 37 (1): 230–232. (in chinese) 谢辉, 李莉, 吴鸣谦, 等. 1株杜仲内生真菌的抗氧化活性分析和菌种鉴定[J]. 安徽农业科学, 2009, 37 (1):230–232. |
| [18] | Shi JQ, Zhou SL, Wang MX, et al. Preliminary study on antioxid ativity of endophytic fungi isolated from Sophora japonica L.[J]. Food Science, 2007, 28 (8): 250–253. (in chinese) 史佳琴, 周松林, 王梅霞, 等. 槐树内生真菌抗氧化活性的初步研究[J]. 食品科学, 2007, 28 (8):250–253. |
 2016, Vol. 43
2016, Vol. 43




