扩展功能
文章信息
- 薛婷婷, 付瑞敏, 谷亚楠, 郭彦钊, 杜茂林, 陈五岭
- XUE Ting-ting, FU Rui-Min, GU Ya-Nan, GUO Yan-Zhao, DU Mao-Lin, CHEN Wu-Ling
- 一株产甘露糖赤藓糖醇脂菌株的筛选及其产物分析
- Screening and product characterization of a mannosylerythritol lipids producing strain
- 微生物学通报, 2016, 43(6): 1210-1217
- Microbiology China, 2016, 43(6): 1210-1217
- DOI: 10.13344/j.microbiol.china.150509
-
文章历史
- 收稿日期: 2015-07-05
- 接受日期: 2015-09-18
- 优先数字出版日期(www.cnki.net): 2015-11-06
2. 河南教育学院人口与生命科学系 河南 郑州 450046
2. Department of Population and Life Science, Henan Institute of Education, Zhengzhou, Henan 450046, China
生物表面活性剂是由不同种微生物在一定培养条件下产生的具有表面活性物质的混合物,由于其独特的性质(可降解能力、温和生产条件和毒性低等优点),近几年备受关注[1, 2]。根据亲水基结构的不同主要分为糖脂类、脂肽和脂蛋白类、磷脂和脂肪酸类、聚合表面活性剂和微粒表面活性剂等五大类[3]。甘露糖赤藓糖醇脂(Mannosylerythritol lipids,MELs)与槐糖脂[4]和鼠李糖脂[5]一样,都属于糖脂类生物表面活性剂。与后两者相比,MELs虽目前在国内研究较少,但作为一种新型的非离子型生物表面活性剂,它可乳化石油、降解石油烷烃类物质,在环保领域具有广泛的应用前景。此外,MELs杰出的免疫学特征使其在食品、医疗等行业也具有巨大的应用潜力[6, 7, 8, 9, 10, 11]。
当前,国内外关于MELs及其产生菌的报道较少,缺乏对MELs产生菌的筛选及改造等研究。基于此,本研究结合多种筛选方法以期获得产MELs的目标菌株:(1) 前人报道MELs产生菌广泛存在于果皮、蔬菜等植物叶片中[9],因此通过血平板、油平板等方法从葡萄皮表面分离到6株产糖脂真菌;(2) 根据MELs合成过程中的关键基因emtl (合成MELs必需的基因,编码的糖基转移酶催化甘露糖和赤藓糖醇发生缩合反应)设计引物,对所筛菌株进行基因检测,并结合TLC和HPLC对该菌株所产代谢物进行分析,确定糖脂类型;(3) 对菌株所产糖脂的乳化性能和降解石油烃能力进行测定,为该菌在环保领域的应用提供理论依据。
1 材料与方法 1.1 样品葡萄样品是由陕西渭南渭北葡萄种植园惠赠的巨峰、户太8号和红地球3种葡萄。
1.2 培养基YM琼脂培养基(g/L):葡萄糖10.0,蛋白胨5.0,酵母粉3.0,麦芽浸出粉3.0,琼脂20.0,加入链霉素和氯霉素各0.05,加蒸馏水至1 L,调节pH 7.2。
无机盐溶液参见文献[12]。血平板、油平板参见文献[13]。种子培养基参见文献[14]。发酵培养基(g/L):磷酸二氢钾3.0,硝酸钠6.0,硫酸镁2.0,酵母粉10.0,氯化钠5.0,牛肉膏3.0,加蒸馏水至1 L,调节pH 7.2。
所有培养基1×105 Pa灭菌20 min。
1.3 主要试剂和仪器常用培养基所需试剂皆为分析纯,购于天津市科密欧化学试剂有限公司;PCR扩增引物、DNA提取试剂盒,购于上海生工有限公司。
WZY-1表面张力仪,上海衡平制造厂生产;C1000 Thermal Cycler PCR仪,Bio-Rad公司;SF-TDL-5A离心机;上海菲恰尔分析仪器有限公司。
1.4 实验方法1.4.1 菌株筛选: 将葡萄皮切碎,在YM培养基上25 °C培养48 h。挑取生长旺盛的菌落经过反复分离纯化得到单菌落,用血平板[15]筛选具有产表面活性剂能力的菌株。用油平板进一步筛选,排除溶菌酶的干扰,只有产生表面活性剂才能够乳化碳氢化合物形成噬油斑。挑取有噬油斑的菌落接种于YM液体培养基中25 °C恒温培养2 d。取2 mL菌液接种到种子培养基中,25 °C、200 r/min摇床培养3 d。再将种子菌液加到发酵培养基中,25 °C、200 r/min摇床培养5 d。
1.4.2 表面张力测定: 将培养5 d后的发酵液4 000 r/min离心10 min,取上清液,用WZY-1表面张力仪在25 °C测定其表面张力。以不加菌种的发酵培养基作对照。每组实验均做3组平行。
1.4.3 emtl基因的PCR扩增及测序: 使用上海生工有限公司的DNA提取试剂盒提取功能菌株的总DNA,以DNA为模板进行PCR,使用引物5′-ATGAAGTTTACGGAATTTA-3′和5′-TTTTATA AGTTATTAATACG-3′进行PCR扩增。PCR反应体系(25 μL)为:模板DNA (50 mg/L) 1 μL,引物(10 mmol/L)各0.5 μL,2×Taq PCR MasterMix 12.5 μL,加双蒸水至25 μL。反应条件为:94 °C 5 min;94 °C 1 min,52 °C 30 s,72 °C 1 min,30个循环。目的片段经Sanprep柱式PCR试剂盒(上海生工有限公司)纯化后,提交至上海生工进行序列测定。
1.4.4 ITS1、ITS2、5.8S基因序列测定和分子系统发育分析: 使用上海生工有限公司的DNA提取试剂盒提取总DNA,以提取的基因组DNA为模板,使用通用引物[16]ITS1 (5′-TCCGTAGGTGAACCT GCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATATG C-3′),扩增核糖体间隔区ITS1区、5.8S rRNA基因以及ITS2区的基因序列。将扩增出来的目的核酸片段送至上海生物工程技术服务有限公司纯化后进行测序。所得序列运用BLAST在GenBank数据库中分别进行同源比对,并采用MEGA 5.05软件构建系统发育树。
1.4.5 糖脂的定性分析: 经培养后的发酵液10 000 r/min离心20 min取上清液,用等体积的乙酸乙酯萃取糖脂。用薄层色谱法(TLC)[17]分析乙酸乙酯的提取物,用氯仿-甲醇-NH4OH (65:15:2,体积比)作为展开剂。喷洒蒽酮-硫酸后90 °C烘箱加热5 min显色,若显绿色或蓝色则为糖脂[15]。
根据显色斑点计算Rf值(Rf=原点到层析斑点中心的距离/原点到溶剂前沿的距离)。以P. antarctica T-34所产生的纯MEL-A、MEL-B和MEL-C作为标样。
1.4.6 纯化糖脂: 分离浓缩含有糖脂的乙酸乙酯提取物。浓缩的糖脂溶于氯仿中,用硅胶柱(HG/T 2354-92,200目;青岛海洋化学品有限公司)层析法进行纯化,使用氯仿/丙酮(10:0-0:10,体积比)混合溶剂梯度洗脱[18]。纯化的糖脂用于后续实验。
1.4.7 高效液相色谱定量糖脂: 使用高效液相色谱法-低温蒸发光散射检测分析法,Inertsil C18硅胶柱(5 μm×4.6 mm×250 mm),检测器(ELSD-LT,Shimadzu),不同浓度比的氯仿和甲醇(从100:0-0:100,体积比)以1 mL/min的流量梯度洗脱[19]。以P. antarctica T-34所产MEL为标样[20],根据标准曲线得出糖脂含量。
1.4.8 糖脂结构分析: 纯化的糖酯GL-1和GL-2分别在30 °C溶于CD3OD溶液,1H核磁共振(NMR)用Varian INOVA 400 (400 MHz)成像,以纯的MEL-A作参考。
1.4.9 石油降解率的测定: 取一环菌株K6接种于500 mL液体发酵液中,30 °C、200 r/min培养48 h。K6发酵液接入石油含量4 g/L[21]的无机盐溶液中,接种量为5%,30 °C、200 r/min摇床培养。每隔2 d取样,采用崔丽虹等[22]的方法计算降解率。
2 结果与分析 2.1 产糖脂类生物表面活性剂的菌株筛选根据产糖脂类生物表面活性剂的能力筛选新的菌株,从3个品种的葡萄皮中分离得到的K4、K5、K6、K7、K8和K9共6株菌株。血平板和油平板检测结果显示6株菌都可产生糖脂,但根据噬油斑的大小可以看出,K6糖脂的产量相对较大。测定培养5 d后各自培养液的表面张力(表1)。如表1所示,菌株K6和K9的发酵液表面张力较小,因此将K6和K9挑选出来进行后续研究。
| Strains | Surface tension (mN/m) |
| CK | 63.23 |
| K4 | 37.19 |
| K5 | 34.44 |
| K6 | 28.67 |
| K7 | 33.58 |
| K8 | 35.04 |
| K9 | 29.81 |
将菌株K6和K9的基因组DNA作为模板,分别进行PCR扩增,以产MEL的菌株P. antarctica T-34为阳性对照,以蒸馏水为阴性对照。结果发现只有菌株K6可以扩增出371 bp的特异性条带(图1),电泳结果显示与阳性对照菌株P. antarcticaT-34一致,初步确认是emtl基因,将PCR产物纯化后送至上海生物工程技术服务有限公司测序,所得序列与NCBI公布的emtl基因相似性高达99%,确定K6具有emtl基因。因此将K6挑选出来进行后续研究。
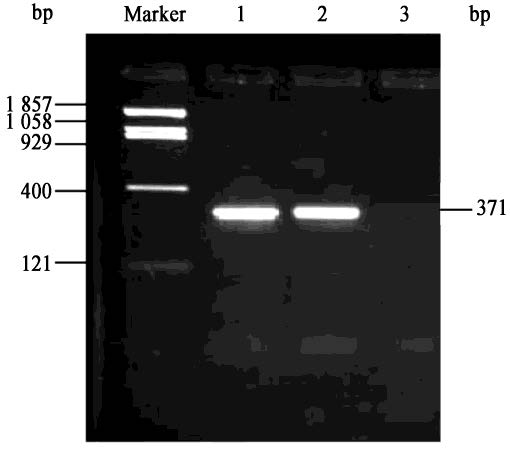
|
| 图 1 菌株K6的emtl基因PCR扩增结果 Figure 1 The PCR amplification result of emtl in strain K6 Note: 1: P. antarctica T-34; 2: K6; 3: Distilled water. |
|
|
形态学研究结果表明,菌株K6的菌落形态中间平滑,边缘处有放射状菌丝,整体呈粉红色。生长初期菌落形态与酵母相似,两端芽殖。随着菌株的老龄化,菌落看起来似马蹄纹形状。通过显微观察,菌体呈梭状,大小不一;菌丝透明有隔芽分生孢子,出现短的气生菌丝链,部分气生菌丝有分枝。由于气生菌丝的出现,其菌落表面会出现绒毛。
将所获菌株K6的ITS1、ITS2和5.8S rRNA基因序列提交至NCBI (登录号:KR233973),将其同临近种属进行比对分析,应用BioEdit 7.0进行多重比较,分析其同源性,构建系统发育树,结果如图2所示,经分析,所得序列与Pseudozyma churashimaensis显示了99%的一致性,根据其系统进化特征,可确定菌株K6为Pseudozyma churashimaensis。

|
| 图 2 菌株K6系统进化树 Figure 2 The phylogenetic tree of strain K6 注:参与比对的序列的GenBank登录号列于括号中,分支处标注有自展值,标尺所示长度为0.005核苷酸置换率. Note: The GenBank accession numbers of aligned sequences were shown in the brackets. the bootstrap values are shown at the node. bar 0.005 means the nucleotide substitution rate of 0.005. |
|
|
将菌株K6在分别以葡萄糖、蔗糖、半乳糖、果糖、甘露糖为碳源的培养基中25 °C培养5 d,产物由乙酸乙酯萃取,然后用TLC分析。所得结果如图3所示,每种糖作为碳源均出现了两个糖脂条带,且其迁移率为GL-1 (Rf=0.66)和GL-2 (Rf=0.61),这与标准的MEL-A (Rf=0.67)和MEL-B (Rf=0.59)非常相似,初步判定其为MELs的同系物。
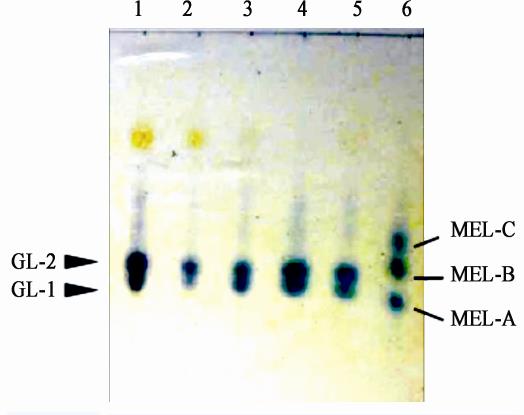
|
| 图 3 TLC结果 Figure 3 The results of TLC 注:1:甘露糖;2:果糖;3:半乳糖;4:蔗糖;5:葡萄糖;6:标样. Note: 1: Mannose; 2: Fructose; 3: Galactose; 4: Sucrose; 5: Glucose; 6: Standard sample. |
|
|
所得糖脂样品经HPLC与标样进行比对,在同一洗脱条件下,所得结果如图4所示。图4A中标样MEL-A在保留时间8.27 min出现特征峰,而图4B显示GL-1和GL-2都是在保留时间8.39 min出现特征峰,该峰位于标准峰附近。因此推测GL-1和GL-2是MEL-A的同系物。采用HPCL对糖脂粗品中MEL-A (GL1+GL2)的产量进行测定,测得菌株K6中MELs的产量为3.6±0.2 g/L。
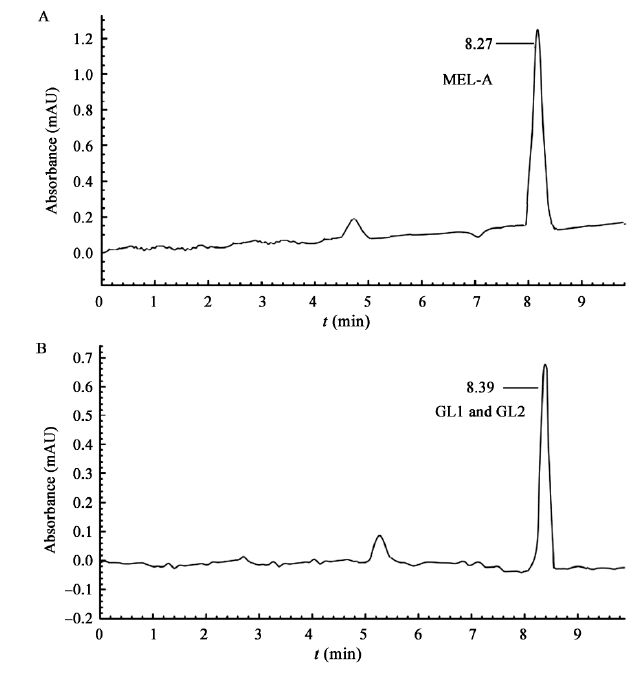
|
| 图 4 MEL-A标样和菌株K6发酵液高效液相色谱图 Figure 4 HPLC spectra of standard MEL-A and fermentation broth of strain K6 |
|
|
为确定糖脂(GL-1和GL-2)的结构,将纯化后的糖脂用核磁共振(NMR)法分析研究。GL-1和GL-2的1H核磁共振波谱出现一个与P. antarctica T-34产生的已知MEL-A类似的峰(图5)。GL-1和GL-2亲水部分的化学键如下:甘露糖的H-1′峰在4.73处,H-2′的峰在5.52处,H-3′的峰在5.07处,H-4′的峰在5.26处,H-5′的峰在3.70处,H-6′的峰在4.22处,赤藓糖醇的H-1-3的峰大约在3.68-3.80之间,H-4的峰在3.84和4.01。另外,在2.10 (d)和2.05 (e)处的两个峰是甘露糖部分C6′和C4′位置上的乙酰基。
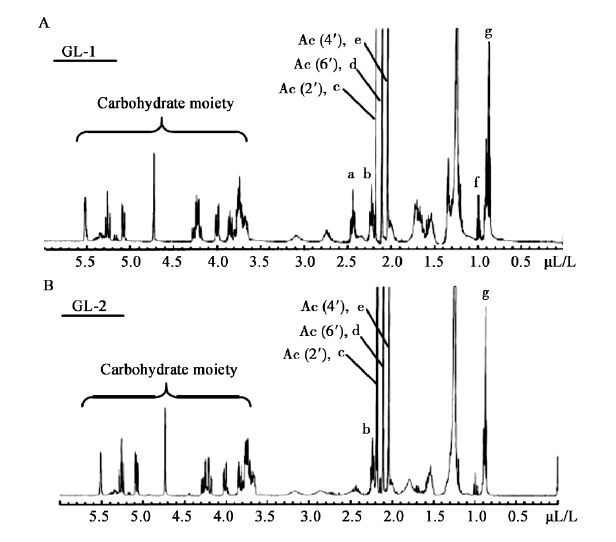
|
| 图 5 GL-1和GL-2的1 H核磁共振谱 Figure 5 1H NMR spectra of GL-1 and GL-2 Note: A: GL-1; B: GL-2. |
|
|
比较光谱图发现糖脂GL-1和GL-2存在差异。例如,GL-1和GL-2均在2.18 (c)处有峰;GL-1在2.44 (a)和2.24 (b)处分别有一个峰,而GL-2只在2.24 (b)处出峰。这可能是由于两者结构中某个基团差异导致,具体研究后续报道。
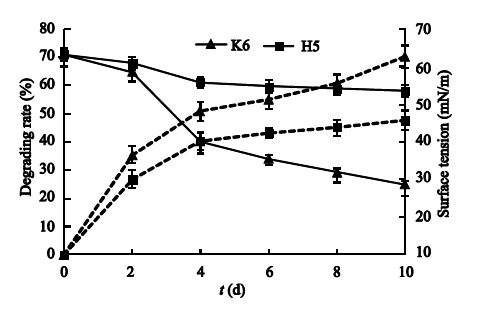
2.7 菌株K6对石油的降解率测定及降解过程中表面张力的变化生物表面活性剂对石油等疏水性化合物的增溶起到很好的促进作用,它们通过降低液体表面张力,从而促进微生物对这些疏水性化合物的吸收,并加快烃类物质的降解。以实验室内不产表面活性剂的石油降解菌H5为对比,通过测定两株菌表面张力的变化和该过程中菌株对石油的降解情况,以考察表面活性剂菌株石油烃降解能力的影响,所得结果如图6所示。
|
| 图 6 菌株K6和H5降解石油烃的能力 Figure 6 The ability of strain K6 and H5 on degrading petroleum hydrocarbon 注:虚线代表降解率;实线代表表面张力. Note: The dotted lines stand for degrading rate; the solid lines stand for surface tension. |
|
|
从图6可以看出,K6菌株降低液体表面张力和降解石油的能力明显高于H5,这是由于菌株K6产生的表面活性剂减小了石油烃和水的界面张力,增加了石油烃的溶解性,使石油烃类物质更容易进入微生物细胞膜内,进而在酶的作用下被降解[23]。
3 讨论本研究通过血平板、油平板、液体表面张力检测与PCR相结合的方法,筛选出一株产甘露糖赤藓糖醇脂(MELs)的菌株。在实验中建立了完整的筛选和鉴定体系。所选筛选和鉴定体系涵盖宏观和微观两个方面,相对比单纯的用排油圈或检测液体表面张力的传统方法,本法更为全面,所得结果可信度更高。本研究先后采用了TLC定性和HPLC定量相结合的鉴定方法,对所选菌株的代谢产物进行了分析,最终鉴定菌株所产物质为MEL-A的同系物,其产量为3.6±0.2 g/L。对所选菌株的表面活性和降解石油烃的能力进行了研究,其对石油的降解率为70.17%。章慧等[24]从炼油厂附近石油污染土壤中筛选出的产表面活性剂的菌株其产量为2.27 g/L,对石油的降解率为54.7%;杨乐[25]从新疆油田土壤中筛选出的高效烃降解菌,其生物表面活性剂的产量为2.25 g/L,对石油烃的降解率为63.78%。对比发现,本研究筛选出的K6菌高产、高效,在石油环保领域具有很大的发展潜力。
大量研究表明,糖脂类生物表面活性剂在石油污染环境的生物修复中起着至关重要的作用。与一般化学表面活性剂相比,糖脂类生物表面活性剂既可以有效降低液体表面张力,还具有无毒和生物可降解[26]等特点。当前,国外学者对MELs展开了部分研究。Konishi等[27]探索了MELs产生菌的最适生长条件;Faria等[28]研究了MELs的产生及转化过程。而国内针对糖脂类生物表面活性剂的研究主要集中于鼠李糖脂和海藻糖脂,对甘露糖赤藓糖醇脂的研究较少。本研究分离、筛选出一株MELs产生菌K6,并对菌株的代谢产物进行定性、定量和降解石油特性等研究。研究结果表明,菌株K6 MELs产率高,且能够有效降解石油烃。然而菌株生产表面活性剂还需要一定的环境条件,培养基C/N、pH和培养温度等都对其MELs的合成有重要影响[29],因此下一步研究将着重于其生产糖脂的工艺优化及井场中试,以期更好地发挥其在石油污染环境中的生物修复作用。
| [1] | He HY, Lu LX, Yao LL, et al. Properties of glycolipid biosurfactants and their potential applications[J]. Chemical Industry and Engineering Progress, 2011, 30 (3): 607–615. (in chinese) 何海洋, 陆利霞, 姚丽丽, 等. 糖脂类生物表面活性剂的性质及其潜在应用进展[J]. 化工进展, 2011, 30 (3):607–615. |
| [2] | Wang YJ, Bi SN, Zuo YH, et al. Isolation and antifungal activity of a biosurfactant-producing bacterium[J]. Microbiology China, 2012, 39 (3): 353–360. (in chinese) 王彦杰, 毕思宁, 左豫虎, 等. 一株表面活性剂产生菌的分离及抑菌活性[J]. 微生物学通报, 2012, 39 (3):353–360. |
| [3] | Shi QS, Chen YB, Ouyang YS. Glycolipids biosurfactants via microorganisms synthesis[J]. Fine and Specialty Chemicals, 2006, 14 (20): 1–5. (in chinese) 施庆珊, 陈仪本, 欧阳友生. 微生物合成的糖脂类生物表面活性剂[J]. 精细与专用化学品, 2006, 14 (20):1–5. |
| [4] | Song DD, Liang SK, Wang JT. Structure characterization and physi-chemical properties of sophorolipid biosurfactants[J]. Environmental Chemistry, 2011, 30 (8): 1474–1479. (in chinese) 宋丹丹, 梁生康, 王江涛. 槐糖脂生物表面活性剂的结构特征及理化性质初探[J]. 环境化学, 2011, 30 (8):1474–1479. |
| [5] | Jiang PP, Guo CL, Dang Z, et al. Interrelationships of rhamnolipids, hydrophobic substrate and degrading bacteria[J]. Environmental Science, 2011, 32 (7): 2144–2151. (in chinese) 姜萍萍, 郭楚玲, 党志, 等. 鼠李糖脂与疏水底物及其降解菌的相互作用[J]. 环境科学, 2011, 32 (7):2144–2151. |
| [6] | Zhu SM, Yu SJ, Yang LS. Mannosylerythritol lipid—a new biosurfactant[J]. China Food Additives, 2005 (1): 64–69. (in chinese) 朱思明, 于淑娟, 杨连生. 甘露糖赤藓糖醇脂—一种新的微生物表面活性剂[J]. 中国食品添加剂, 2005 (1):64–69. |
| [7] | Zhao XX, Geltinger C, Kishikawa S, et al. Treatment of mouse melanoma cells with phorbol 12-myristate 13-acetate counteracts mannosylerythritol lipid-induced growth arrest and apoptosis[J]. Cytotechnology, 2000, 33 (1/3): 123–130. |
| [8] | Im JH, Yanagishita H, Ikegami T, et al. Mannosylerythritol lipids, yeast glycolipid biosurfactants, are potential affinity ligand materials for human immunoglobulin G[J]. Journal of Biomedical Materials Research Part A, 2003, 65 (3): 379–385. |
| [9] | Fan LL, Zhang J, Cai J, et al. Advance in glycolipid biosurfactants—mannosylerythritol lipids[J]. Chinese Journal of Biotechnology, 2013, 29 (9): 1223–1233. (in chinese) 范琳琳, 张俊, 蔡瑾, 等. 糖脂生物表面活性剂—甘露糖赤藓糖醇酯的研究进展[J]. 生物工程学报, 2013, 29 (9):1223–1233. |
| [10] | Gu XN, Chen H, Li SS, et al. Biosurfactant production and its application in the environmental pollution control[J]. Environmental Science & Technology, 2012, 35 (6I): 155–162. (in chinese) 顾信娜, 陈辉, 李珊珊, 等. 生物表面活性剂的产生及其在环境污染治理中的应用[J]. 环境科学与技术, 2012, 35 (6I):155–162. |
| [11] | Chen J, Hua ZL, Lun SY. Application of biosurfactants in environmental biotechnology[J]. Environmental Science, 1996, 17 (4): 84–87. (in chinese) 陈坚, 华兆伦, 伦世仪. 生物表面活性剂在环境生物工程中的应用[J]. 环境科学, 1996, 17 (4):84–87. |
| [12] | Du ML, Fu RM, Gu YN, et al. Isolation, identification and breeding of petroleum-degrading bacteria in oilfield produced water by UV-plasma complex mutagenesis[J]. Microbiology China, 2015, 42 (6): 1001–1009. (in chinese) 杜茂林, 付瑞敏, 谷亚楠, 等. 油田采出水石油烃降解菌分离、鉴定及高通量选育复合诱变菌株[J]. 微生物学通报, 2015, 42 (6):1001–1009. |
| [13] | Ye HS, Sheng XF, Jiang CY, et al. The isolation of biosurfactant-producing bacteria and their effect on the availability of lead in soil[J]. Acta Scientiae Circumstantiae, 2006, 26 (10): 1631–1636. (in chinese) 叶和松, 盛下放, 江春玉, 等. 生物表面活性剂产生菌的筛选及其对土壤重金属铅的活化作用[J]. 环境科学学报, 2006, 26 (10):1631–1636. |
| [14] | Huang L, Li D, Sun D, et al. Isolation and identification of a low temperature hydrocarbon-degrading strain and its degradation characteristics[J]. Environmental Science, 2007, 28 (9): 2101–2105. (in chinese) 黄磊, 李丹, 孙丹, 等. 1株低温石油烃降解菌的分类鉴定及降解特性研究[J]. 环境科学, 2007, 28 (9):2101–2105. |
| [15] | Wang Y. Production of rhamnolipid bio-surfactantsants separation of pseudomonas[J]. Surface Technology, 2006, 35 (5): 69–70. (in chinese) 王琰. 鼠李糖脂表面活性剂的制备及产生菌的筛选[J]. 表面技术, 2006, 35 (5):69–70. |
| [16] | Yan Y, Li WP, Gao WJ, et al. Application of rDNA ITS sequence analysis in fungus identification[J]. Chinese Journal of Health Laboratory Technology, 2009, 18 (10): 1958–1961. (in chinese) 燕勇, 李卫平, 高雯洁, 等. rDNA-ITS序列分析在真菌鉴定中的应用[J]. 中国卫生检验杂志, 2009, 18 (10):1958–1961. |
| [17] | Pan BF, Xu GL, Shi YP, et al. Screening of biological surfactant producing bacteria[J]. Acta Microbiologica Sinica, 1999, 39 (3): 264–267. (in chinese) 潘冰峰, 徐国梁, 施邑屏, 等. 生物表面活性剂产生菌的筛选[J]. 微生物学报, 1999, 39 (3):264–267. |
| [18] | Morita T, Konishi M, Fukuika T, et al. Discovery of Pseudozyma rugulosa NBRC 10877 as a novel producer of the glycolipid biosurfactants, mannosylerythritol lipids, based on rDNAsequence[J]. Applied Microbiology and Biotechnology, 2006, 73 (2): 305–313. |
| [19] | Rau U, Nguyen LA, Schulz S, et al. Formation and analysis of mannosylerythritol lipids secreted by Pseudozyma aphidis[J]. Applied Microbiology and Biotechnology, 2005, 66 (5): 551–559. |
| [20] | Fukuoka T, Morita T, Konishi M, et al. Characterization of new glycilipid biosurfactants, tri-acylated mannosylerythritol lipids, produced by Pseudozyma yeasts[J]. Biotechnology Letters, 2007, 29 (7): 1111–1118. |
| [21] | Zheng JX, Peng Q, Zhang JY, et al. Study on characteristics of degradation of petroleum degradation bacteria produce surfactants[J]. Environmental Science & Technology, 2007, 30 (1): 5–7. (in chinese) 郑金秀, 彭祺, 张甲耀, 等. 产表面活性剂的石油降解菌降解特性研究[J]. 环境科学与技术, 2007, 30 (1):5–7. |
| [22] | Cui LH, Guo P, Li BM, et al. The screening and identification of total petroleum hydrocarbon degrading bacteria[J]. Biotechnology Bulletin, 2009 (9): 143–147. (in chinese) 崔丽虹, 郭萍, 李宝明, 等. 石油烃降解菌的筛选与鉴定[J]. 生物技术通报, 2009 (9):143–147. |
| [23] | Hao DH. Studies on the screening or MEOR microbial strain, rhamnolipid performance, andrhamnosyltransferase gene cloningand expression[D]. Ji’nan: Doctoral Dissertation of Shandong University, 2008 (in Chinese) 郝东辉. 采油微生物筛选、鼠李糖脂产脂性能及关键酶基因克隆与表达研究[D]. 济南: 山东大学博士学位论文, 2008 |
| [24] | Zhang H, Guo CL, Lu GN, et al. Screening and fermentation optimization of a biosurfactant-producing oil-degrading bacterium[J]. Journal of Agro-Environment Science, 2013, 32 (11): 2185–2191. (in chinese) 章慧, 郭楚玲, 卢桂宁, 等. 具有产表面活性剂功能石油降解菌的筛选及其发酵条件优化[J]. 农业环境科学学报, 2013, 32 (11):2185–2191. |
| [25] | Yang L. Screening of biosurfactant-producing bacteria for degradation of petroleum hydrocarbon and its degradation conditions[J]. Environmental Engineering, 2015, 33 (6): 153–157. (in chinese) 杨乐. 产表面活性剂解烃菌的筛选及其降解条件研究[J]. 环境工程, 2015, 33 (6):153–157. |
| [26] | Liu L, Liu LL, Liu JH. The research progress of glycolipid biosurfactants[J]. West Leahter, 2009, 31 (13): 33–37. (in chinese) 刘伦, 刘浪浪, 刘军海. 糖脂类生物表面活性剂的研究进展[J]. 西部皮革, 2009, 31 (13):33–37. |
| [27] | Konishi M, Nagahama T, Fukuoka T, et al. Yeast extract stimulates production of glycolipid biosurfactants, mannosylerythritol lipids, by Pseudozyma hubeiensis SY62[J]. Journal of Bioscience and Bioengineering, 2011, 111 (6): 702–705. |
| [28] | Faria NT, Marques S, Fonseca C, et al. Direct xylan conversion into glycolipid biosurfactants, mannosylerythritol lipids, by Pseudozyma antarctica PYCC 5048T[J]. Enzyme and Microbial Technology, 2015, 71 : 58–65. |
| [29] | Zhang N, Zheng QS, Liu L, et al. Isolation of oil-degrading bacteria with biosurfactant production and its fermentation condition optimization[J]. Journal of Nanjing Agricultural University, 2011, 34 (4): 133–137. (in chinese) 张娜, 郑青松, 刘玲, 等. 产表面活性剂石油降解菌的筛选及发酵条件优化[J]. 南京农业大学学报, 2011, 34 (4):133–137. |
 2016, Vol. 43
2016, Vol. 43




