扩展功能
文章信息
- 蒋晓艳, 李雁群, 吉宏武, 张茜, 胡雪琼, 朱国萍, 卢虹玉, 钟敏
- JIANG Xiao-Yan, LI Yan-Qun, JI Hong-Wu, ZHANG Xi, HU Xue-Qiong, ZHU Guo-Ping, LU Hong-Yu, ZHONG Min
- 裂殖壶菌Schizochytrium sp. 20888产DHA培养条件优化
- Optimization of cultivation conditions for DHA production by Schizochytrium sp. 20888
- 微生物学通报, 2016, 43(6): 1199-1209
- Microbiology China, 2016, 43(6): 1199-1209
- DOI: 10.13344/j.microbiol.china.150462
-
文章历史
- 收稿日期: 2015-06-14
- 接受日期: 2015-11-13
2. 广东省水产品加工与安全重点实验室 广东 湛江 524088 ;
3. 水产品深加工广东普通高等学校重点实验室 广东 湛江 524088 ;
4. 英格尔检测技术服务(上海)有限公司 上海 201109
2. Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety, Zhanjiang, Guangdong 524088, China ;
3. Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution, Zhanjiang, Guangdong 524088, China ;
4. ICAS Testing Technology Services (Shanghai) Co., Ltd., Shanghai 201109, China
二十二碳六烯酸(DHA)是一种重要的ω-3多不饱和脂肪酸(PUFAs),具有预防和治疗心血管疾病、健脑益智、改善视网膜功能、抗炎、抗癌等重要生理功能[1, 2]。
海洋微生物作为海洋生物食物链的初级生产者,是DHA的最原始来源。一些海洋微生物油脂的DHA含量[3, 4]远高于常见用于生产DHA的鱼油中的含量[5]。微生物油脂具有种质资源丰富、生长周期短、培养简单可控、DHA含量高、脂肪酸组成相对简单、分离纯化较鱼油容易、不含鱼腥味等优点。微生物油脂生产不受地域的影响,季节和气候变化等对其影响也较小,是可再生资源。裂殖壶菌,是球形单细胞海洋真菌,在特定的条件下其细胞内可累积大量油脂,而且积累的油脂中DHA含量很高,目前已经被用作工业化生产DHA油脂的菌种。为了进一步提高裂殖弧菌细胞产量、油脂产量和DHA含量,研究人员针对培养基配方、培养条件、发酵工艺策略等开展了研究[6, 7]。
近年来,我国也开展相关研究,并且已经利用裂殖弧菌工业化生产DHA藻油,但在DHA产量和质量上仍有很大的改进空间[8]。研究不同的培养条件对裂殖壶菌的生物量、总脂和DHA含量的影响具有一定的理论和现实意义,旨在优化培养条件,探索裂殖壶菌的生长特性以及油脂变化规律。
1 材料与方法 1.1 实验材料1.1.1 菌种: 试验所用菌株为裂殖壶菌Schizochytrium sp. 20888,广东省微生物保藏中心。
1.1.2 试剂: 葡萄糖、蔗糖、甘油、硫酸铵、硝酸铵、硝酸钠、谷氨酸钠、尿素、正己烷、氢氧化钾、无水甲醇、无水硫酸钠、硫酸氢钠,以上均为分析纯试剂;酵母粉、蛋白胨、牛肉膏为生化试剂;异辛烷为色谱纯试剂;DHA甲酯标准品:美国色谱科(Supelco)公司,货号为47570-U。
1.1.3 培养基:种子培养基(g/L):葡萄糖20.0,酵母粉5.0,蛋白胨5.0。用1.0 L天然海水配制,自然pH。发酵培养基(g/L):葡萄糖80.0,酵母粉4.0,蛋白胨4.0,用1.0 L天然海水配制,自然pH。培养基均在1×105 Pa压力下灭菌30 min。2 mol/L氢氧化钾甲醇溶液[9]:在100 mL无水甲醇中溶解13.11 g氢氧化钾,超声10 min,加入无水硫酸钠干燥,过滤,得到澄清溶液,储存待用。
1.2 主要仪器HZQ-F280全温振荡培养箱,金坛市万华实验仪器厂;CR22G日立高速冷冻离心机,天美科技有限公司;Trace GC ultra气相色谱仪,Thermo Electron Corporation公司。
1.3 实验方法1.3.1 培养方法:(1) 种子发酵培养:一级液体种子发酵培养:100 mL种子培养基装于250 mL三角瓶中,1×105 Pa灭菌30 min,冷却,从斜面保藏菌种挑取4环左右接种于液体培养基,23 °C、150 r/min培养3 d。二级液体种子发酵培养:100 mL种子培养基装于250 mL三角瓶中,1×105 Pa灭菌30 min,冷却,从一级种子液中按照接种量为5% (体积比)取液体菌种,接种于新灭菌的液体培养基中,23 °C、150 r/min培养3 d。
(2) 摇瓶发酵培养:按5% (体积比)的接种量,从二级种子培养液中取种子液,接种于装有50 mL发酵培养基的100 mL三角瓶中,25 °C、150 r/min培养6 d,并绘制生长曲线;按5% (体积比)的接种剂量,从二级种子培养液中取种子液,接种于装有100 mL发酵培养基的250 mL三角瓶中,25 °C、150 r/min培养4 d,用于培养条件的优化。
1.3.2 分析方法:(1) 生物量的测定:取一定量的发酵液置于离心管中,4 000 r/min离心15 min,蒸馏水洗涤2次,105 °C烘干至恒重后称重,得细胞干重,即得生物量(Dry cell weight,DCW)。
| $生物量\left( \text{g/L} \right)\text{ = }\frac{\text{细胞干重}}{发酵液样品体积}\circ$ |
(2) 总脂含量的测定:发酵液经离心得菌体,烘干至恒重后研细,将研细的菌体置于脱脂滤纸筒中,用正己烷做溶剂进行索氏抽提,抽提温度为80-90 °C,抽提时间6-7 h,回收正己烷;将抽提得到的油脂转移至2 mL离心管中,60 °C驱除残余溶剂至恒重,称重,得总脂含量(Total lipid content,TLC)。
| $总脂含量\left( \text{g/L} \right)\text{ = }\frac{提取的油脂重}{发酵液样品体积}\circ $ |
(3) 气相色谱分析DHA含量:精确量取0.060 g提取的裂殖壶菌油脂置于5 mL带塞试管中,取4 mL异辛烷溶解样品。继续注入氢氧化钾甲醇溶液200 μL,密封猛烈振摇30 s,静置至澄清。继续加入硫酸氢钠约1 g,剧烈摇晃以中和氢氧化钾。当盐沉淀后,将上层液倒入待用容器中,先用异辛烷适度稀释再于气相色谱仪进样分析[9, 10]。
气相色谱条件:色谱柱:PEG-20M毛细管色谱柱(50 m×0.20 mm×0.25 μm);检测器:FID (氢火焰离子化检测器);气化室温度:250 °C;检测器温度:260 °C;柱温:程序升温:起始温度150 °C,维持5 min,以6 °C/min的升温速率上升至220 °C,维持2 min;220-230 °C升温6.5 °C/min,230 °C维持35 min;助燃气流量(空气):350 mL/min;燃气流量(H2):35 mL/min;尾吹气流量(N2):30 mL/min;分流比:20:1。
DHA的定性分析:在上述气相色谱条件下,用已知的DHA甲酯(Docosahexaenoic acid methyl ester,DHA-ME)标准品色谱峰的保留时间与样品甲酯化后脂肪酸甲酯各组分色谱峰的保留时间对照进行分析。
DHA的定量分析:先配制一系列不同质量浓度的DHA-ME标准溶液,进样进行气相色谱分析,测出各标准溶液中DHA-ME所对应的峰面积,以组分浓度CDHA-ME为横坐标、峰面积ADHA-ME为纵坐标,绘出标准曲线,并进行线性拟合。
样品中DHA-ME含量的测定采用外标标准曲线法。根据所测样品在气相色谱图中的峰面积ADHA-ME,由拟合公式计算出样品中DHA-ME的质量浓度,进而计算出DHA含量。总脂中DHA含量计算如下:
| $\text{DHA}\left( % \right)\text{ = }\frac{{{C}_{\text{DNA}-\text{ME}}}\times 0.004\times \frac{328}{342}}{称取油脂重}\times 100$ |
式中,0.004、328和342分别为加入异辛烷体积(L)、DHA与DHA-ME的分子量。
1.3.3 数据分析:实验数据使用DPS 7.05软件进行统计分析。
2 结果与分析 2.1 裂殖壶菌的生长特性按照1.3.1的培养条件接种发酵培养基培养,细胞生长曲线如图1所示。由图1可以看出,培养期第1天细胞生长缓慢,第2天生长速率明显加快,到第4天基本达到稳定,继续培养细胞又呈现下降趋势,这说明培养4 d营养耗尽,细胞衰老和死亡增加。因此,后续实验选择的培养周期为4 d。

|
| 图 1 裂殖壶菌生长曲线 Figure 1 The growth curve of Schizochytrium sp. 20888 |
|
|
温度是影响裂殖壶菌生物量、总脂及DHA积累的重要因素。为了确定最适的生长和产物合成温度,实验分别考察了15、19、23、27和31 °C培养温度下,裂殖壶菌生物量、总脂及DHA含量的变化。其中,以60 g/L葡萄糖作为碳源,以4 g/L酵母粉和4 g/L蛋白胨作为氮源,按照1.3.1的培养条件接种培养,测定细胞生物量、总脂及DHA含量,结果如图2所示。

|
| 图 2 温度对 DHA 发酵的影响 Figure 2 The effects of temperature on DHA fermentation performance |
|
|
由图2可以看出,当温度在15-23 °C范围内时,细胞生物量及总脂含量随着温度的升高而增加,而当其温度在23-31 °C时,细胞生物量及总脂含量呈下降趋势;另外,细胞DHA含量随着温度的升高呈现不规律的变化趋势,31 °C时其含量最高,23 °C时次之,且相对较高。文献[11, 12]报道,微藻在低温条件下有利于DHA合成,本文31 °C时的DHA含量数据出现跳跃性变化可能含有较大误差。从总的DHA产量(细胞生物量、总脂含量和DHA含量之积)考虑,宜将发酵温度确定为23 °C。
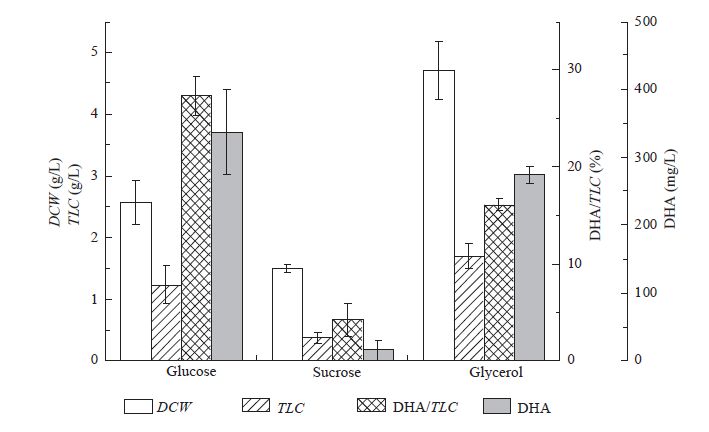
2.3 碳源对菌株生物量、总脂及DHA含量的影响2.3.1 碳源种类对菌株生物量、总脂及DHA含量的影响: 实验分别以80 g/L葡萄糖、甘油、蔗糖作为碳源,考察不同种类的碳源对裂殖壶菌生物量、总脂及DHA百分含量的影响,按照1.3.1的培养条件接种培养,测定细胞生物量、总脂及DHA百分含量,结果如图3所示。
|
| 图 3 碳源种类对DHA发酵的影响 Figure 3 The effects of carbon sources on DHA fermentation performance |
|
|
由图3可以看出,葡萄糖和甘油相对更有利于裂殖壶菌的生物量、油脂及DHA积累,而蔗糖作为碳源得到的菌株生物量、油脂及DHA较少。许石雄[13]的研究也表明裂殖壶菌不能利用二糖或多糖。结果还表明,甘油有利于促进生物量及总脂含量增长,而葡萄糖有利于促进DHA含量增加。
2.3.2 碳源浓度对菌株生物量、总脂及DHA含量的影响: 通过碳源种类对菌株生物量、总脂及DHA含量的影响研究,可知葡萄糖和甘油为较优碳源,因此有必要考察一下这两种碳源在不同浓度下对裂殖壶菌发酵产DHA的影响。
(1) 葡萄糖浓度对菌株生物量、总脂及DHA含量的影响。实验分别以40、60、80、100、120 g/L葡萄糖作为碳源,考察不同浓度的葡萄糖对裂殖壶菌生物量、总脂及DHA含量的影响,按照1.3.1的培养条件接种培养,测定细胞生物量、总脂及DHA含量,结果如图4A所示。由图4A可以看出,当葡萄糖浓度在40-120 g/L范围内时,细胞生物量、总脂及DHA含量变化不大,在60 g/L时各项指标相对较高,选择60 g/L为后续实验的葡萄糖浓度。

|
| 图 4 碳源浓度对DHA发酵的影响 Figure 4 The effects of carbon concentrations on DHA fermentation performance 注:A:碳源为葡萄糖;B:碳源为甘油. Note: A: The carbon source was glucose; B: The carbon source was glycerol. |
|
|
(2) 甘油浓度对菌株生物量、总脂及DHA含量的影响。分别以40、60、80、100、120 g/L甘油作为碳源,考察不同浓度的甘油对裂殖壶菌生物量、总脂及DHA含量的影响,按照1.3.1的培养条件接种培养,测定细胞生物量、总脂及DHA含量,结果如图4B所示。由图4B可知,当甘油浓度在40-100 g/L时,细胞生物量随着浓度的增加而增多,当甘油浓度在100-120 g/L时,细胞生物量呈下降趋势;当甘油浓度在40-80 g/L时,细胞总脂及DHA含量随浓度的增加而增多,当甘油浓度在80-120 g/L时,细胞总脂及DHA含量随着浓度的增加而减少。由于实验的最终目标是提高所培养菌株的DHA产量,而80 g/L时细胞生物量也较高,因此80 g/L为裂殖壶菌发酵产DHA的最适甘油浓度。
2.4 氮源对菌株生物量、总脂及DHA含量的影响2.4.1 氮源种类对菌株生物量、总脂及DHA含量的影响: 氮源分为有机和无机氮源,其中无机氮源包括铵基氮、硝基氮和铵硝基复合氮,因此实验选择5种有机氮源(蛋白胨、酵母粉、牛肉膏、尿素、谷氨酸钠)和3种无机氮源[(NH4)2SO4、NH4NO3、NaNO3]进行了研究。
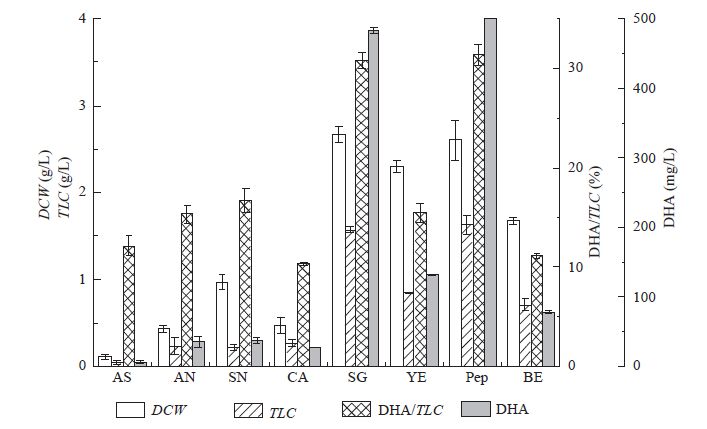
实验分别以8 g/L (NH4)2SO4、NH4NO3、NaNO3、尿素、谷氨酸钠、酵母粉、蛋白胨、牛肉膏作为氮源,考察不同种类的氮源对裂殖壶菌生物量、总脂及DHA积累的影响。其中,以60 g/L葡萄糖作为碳源,按照1.3.1的培养条件接种培养,测定细胞生物量、总脂及DHA含量,结果如图5所示。
|
| 图 5 氮源种类对DHA发酵的影响 Figure 5 The effects of nitrogen sources on DHA fermentation performance 注:AS:硫酸铵;AN:硝酸铵;SN:硝酸钠;CA:尿素;SG:谷氨酸钠;YE:酵母粉;Pep:蛋白胨;BE:牛肉膏. Note: AS: Ammonium sulfate; AN: Ammonium nitrate; SN: Sodium nitrate; CA: Carbamide; SG: Sodium glutamate; YE: Yeast extract; Pep: Peptone; BE: Beef extract. |
|
|
由图5可以看出,蛋白胨、谷氨酸钠及酵母粉对生物量、总脂及DHA含量影响较大,硫酸铵、硝酸铵、硝酸钠、尿素及牛肉膏对生物量、总脂及DHA含量的影响相对较小,因此需对蛋白胨、酵母粉和谷氨酸钠的浓度进行进一步的优化实验。
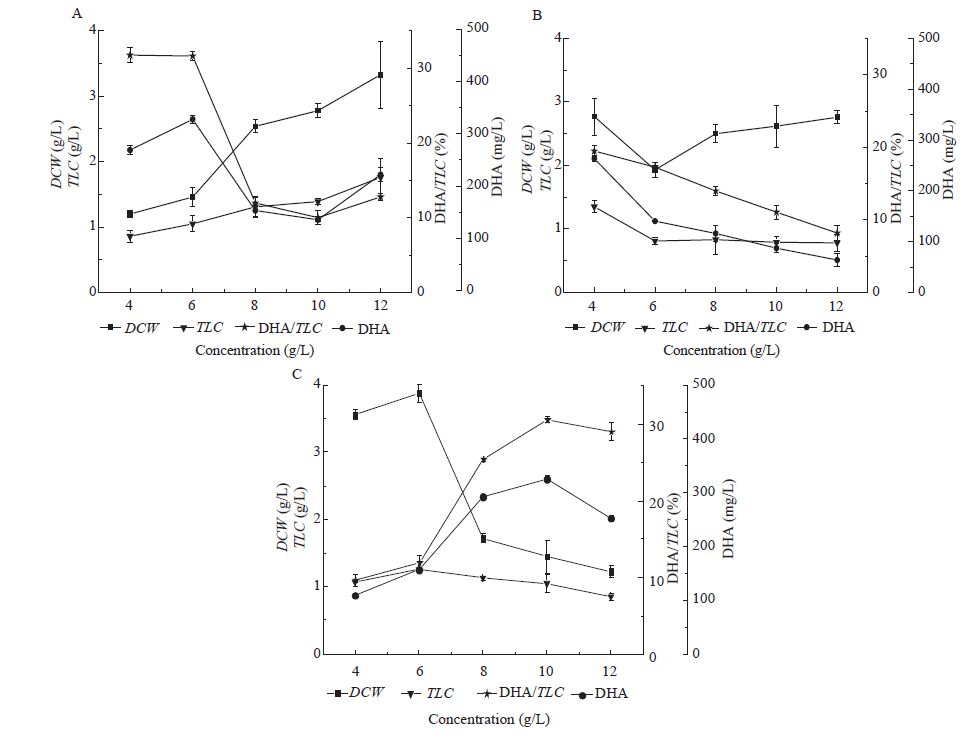
2.4.2 氮源浓度对菌株生物量、总脂和DHA含量的影响: (1) 蛋白胨浓度对菌株生物量、总脂和DHA含量的影响。实验分别以4、6、8、10、12 g/L蛋白胨作为氮源,考察不同浓度的蛋白胨对裂殖壶菌生物量、总脂及DHA含量的影响。其中,以60 g/L葡萄糖作为碳源,按照1.3.1的培养条件接种培养,测定细胞生物量、总脂及DHA含量(图6A)。由图6A可以看出,随着蛋白胨浓度的上升,细胞生物量及总脂含量均呈现上升趋势,但总脂含量变化不大;当蛋白胨浓度在4-6 g/L时,DHA含量相近且均比高浓度氮源条件下要高很多,而当蛋白胨浓度在6-12 g/L时,DHA含量相对较少。由于实验的最终目的是为了提高细胞中的DHA含量,因此确定6 g/L为裂殖壶菌发酵产DHA的最适蛋白胨浓度。
|
| 图 6 氮源浓度对DHA发酵的影响 Figure 6 The effects of nitrogen concentrations on DHA fermentation performance 注:A:氮源为蛋白胨;B:氮源为酵母粉;C:氮源为谷氨酸钠. Note: A: The nitrogen source was peptone; B: The nitrogen source was yeast extract; C: The nitrogen sourch was sodium glutamate. |
|
|
(2) 酵母粉浓度对菌株生物量、总脂和DHA含量的影响。实验分别以4、6、8、10、12 g/L酵母粉作为氮源,考察不同浓度的酵母粉对裂殖壶菌生物量、总脂及DHA含量的影响。其中,以60 g/L葡萄糖作为碳源,按照1.3.1的培养条件接种培养,测定细胞生物量、总脂及DHA含量(图6B)。由图6B可以看出,随着酵母粉浓度的上升,细胞总脂及DHA含量均呈现下降的趋势;当酵母粉浓度在4-6 g/L时,细胞生物量降低,而当其浓度在6-12 g/L时,细胞生物量呈现上升趋势。因此,采用4 g/L为裂殖壶菌发酵产DHA的最适酵母粉浓度。
(3) 谷氨酸钠浓度对菌株生物量、总脂和DHA含量的影响。实验分别以4、6、8、10、12 g/L谷氨酸钠作为氮源,考察不同浓度的谷氨酸钠对裂殖壶菌生物量、总脂及DHA含量的影响。其中,以60 g/L葡萄糖作为碳源,按照1.3.1的培养条件接种培养,测定细胞生物量、总脂及DHA含量,结果如图6C所示。
由图6C可以看出,当谷氨酸钠浓度在4-6 g/L范围内时,细胞生物量及总脂含量随着浓度的增加而增加,而当其浓度在6-12 g/L时,细胞生物量及总脂含量呈下降趋势;当谷氨酸钠浓度在4-10 g/L范围内时,细胞DHA含量随着浓度的增加而增加,而当其浓度在10-12 g/L时,细胞DHA含量随着浓度的增加而降低;另外,当其浓度在8-12 g/L时,细胞DHA含量相近且较高,而当其浓度在4-6 g/L时,细胞DHA含量较低。由于实验的最终目标是提高所培养菌株的DHA产量,综合考虑可以得到8 g/L为裂殖壶菌发酵产DHA培养的最适谷氨酸钠浓度。
2.5 碳氮源正交优化实验在实验中,根据培养基中葡萄糖、甘油、蛋白胨、酵母粉和谷氨酸钠这5个主要单因子实验结果,选用了6因素5水平L25(56)的正交表,对用于产DHA的裂殖壶菌发酵培养基组成进行正交优化实验,继而确定了最佳发酵培养基配比。碳氮源正交优化实验因素水平编码表及实验设计与结果如表1、表2所示。
| 水平Levels | 因素Factors | ||||
| A 葡萄糖 Glucose (g/L) | B 甘油 Glycerol (g/L) | C 蛋白胨 Peptone (g/L) | D 酵母粉 Yeast extract (g/L) | E 谷氨酸钠 Sodium glutamate (g/L) | |
| 1 | 50 | 70 | 5.0 | 3.0 | 7.0 |
| 2 | 55 | 75 | 5.5 | 3.5 | 7.5 |
| 3 | 60 | 80 | 6.0 | 4.0 | 8.0 |
| 4 | 65 | 85 | 6.5 | 4.5 | 8.5 |
| 5 | 70 | 90 | 7.0 | 5.0 | 9.0 |
| 序号 No. | 因素Factors | DHA含量 The DHA/TLC (%) | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | ||||
| A | B | C | D | E | |||||
| 1 | 1 | 1 | 1 | 1 | 1 | 1 | 8.20 | 6.71 | 7.12 |
| 2 | 1 | 2 | 2 | 2 | 2 | 2 | 7.48 | 6.45 | 6.70 |
| 3 | 1 | 3 | 3 | 3 | 3 | 3 | 33.01 | 34.15 | 32.47 |
| 4 | 1 | 4 | 4 | 4 | 4 | 4 | 3.35 | 3.63 | 4.27 |
| 5 | 1 | 5 | 5 | 5 | 5 | 5 | 18.67 | 20.95 | 21.81 |
| 6 | 2 | 1 | 2 | 3 | 4 | 5 | 25.28 | 29.57 | 21.24 |
| 7 | 2 | 2 | 3 | 4 | 5 | 1 | 19.92 | 22.76 | 21.40 |
| 8 | 2 | 3 | 4 | 5 | 1 | 2 | 28.49 | 22.28 | 22.76 |
| 9 | 2 | 4 | 5 | 1 | 2 | 3 | 20.76 | 18.17 | 18.45 |
| 10 | 2 | 5 | 1 | 2 | 3 | 4 | 18.37 | 13.00 | 19.08 |
| 11 | 3 | 1 | 3 | 5 | 2 | 4 | 27.61 | 28.57 | 29.32 |
| 12 | 3 | 2 | 4 | 1 | 3 | 5 | 19.05 | 19.42 | 15.64 |
| 13 | 3 | 3 | 5 | 2 | 4 | 1 | 18.44 | 19.05 | 18.15 |
| 14 | 3 | 4 | 1 | 3 | 5 | 2 | 25.08 | 26.48 | 25.82 |
| 15 | 3 | 5 | 2 | 4 | 1 | 3 | 25.95 | 27.80 | 28.20 |
| 16 | 4 | 1 | 4 | 2 | 5 | 3 | 27.16 | 29.54 | 26.87 |
| 17 | 4 | 2 | 5 | 3 | 1 | 4 | 26.37 | 26.35 | 25.68 |
| 18 | 4 | 3 | 1 | 4 | 2 | 5 | 23.62 | 24.77 | 23.17 |
| 19 | 4 | 4 | 2 | 5 | 3 | 1 | 30.78 | 27.00 | 26.84 |
| 20 | 4 | 5 | 3 | 1 | 4 | 2 | 26.06 | 25.28 | 24.90 |
| 21 | 5 | 1 | 5 | 4 | 3 | 2 | 27.45 | 24.63 | 22.47 |
| 22 | 5 | 2 | 1 | 5 | 4 | 3 | 24.59 | 23.84 | 21.65 |
| 23 | 5 | 3 | 2 | 1 | 5 | 4 | 23.82 | 13.45 | 20.88 |
| 24 | 5 | 4 | 3 | 2 | 1 | 5 | 25.30 | 22.95 | 23.50 |
| 25 | 5 | 5 | 4 | 3 | 2 | 1 | 22.64 | 22.62 | 22.35 |
利用DPS 7.05统计软件对表2碳氮源正交优化实验结果进行方差统计分析,分析结果如表3和表4所示。
| 序号 No. | 因素Factors | ||||
| 1 | 2 | 3 | 4 | 5 | |
| A | B | C | D | E | |
| K1 | 222.98 | 341.75 | 291.52 | 267.90 | 327.68 |
| K2 | 321.56 | 307.30 | 341.44 | 302.06 | 322.68 |
| K3 | 354.56 | 358.53 | 397.22 | 399.12 | 363.37 |
| K4 | 394.40 | 302.38 | 290.07 | 303.40 | 289.30 |
| K5 | 342.14 | 325.70 | 315.40 | 363.17 | 332.62 |
| k1 | 14.87 | 22.78 | 19.44 | 17.86 | 21.85 |
| k2 | 21.44 | 20.49 | 22.76 | 20.14 | 21.51 |
| k3 | 23.64 | 23.90 | 26.48 | 26.61 | 24.23 |
| k4 | 26.29 | 20.16 | 19.34 | 20.23 | 19.29 |
| k5 | 22.81 | 21.71 | 21.03 | 24.21 | 22.18 |
| 极差Range | 11.43 | 3.74 | 7.14 | 8.75 | 4.94 |
| 较优水平The better level | A4 | B3 | C3 | D3 | E3 |
| 变异来源Source | 平方和SS | 自由度df | 均方MS | F值F value | P值P value | 显著性significant level |
| A | 1 092.19 | 4 | 273.05 | 22.56 | 0.000 1 | *** |
| B | 147.17 | 4 | 36.79 | 3.04 | 0.025 5 | * |
| C | 526.41 | 4 | 131.60 | 10.87 | 0.000 1 | *** |
| D | 745.36 | 4 | 186.34 | 15.40 | 0.000 1 | *** |
| E | 186.32 | 4 | 46.58 | 3.85 | 0.008 4 | ** |
| 空白Blank | 501.08 | 4 | 125.27 | |||
| 模型误差Model error | 501.08 | 4 | 125.27 | 10.35 | 0.016 9 | |
| 重复误差Repeat error | 605.10 | 50 | 12.10 | |||
| 合并误差Combined error | 1 106.18 | 54 | 20.49 | |||
| 注:***:P<0.001,表明差异极显著;**:P<0.01,表明差异非常显著;*:P<0.05,表明差异显著. | ||||||
| Note: ***: P<0.001,Stand for most significant level variance; **: P<0.01,Stand for more significant level variance; *: P<0.05,Stand for significant level variance. | ||||||
对于裂殖壶菌碳氮源正交优化实验结果,对其DHA含量作极差分析,得到每个指标的较优参数组合,结果如表3所示。由表3可知因素影响的主次为A>D>C>E>B,较优参数组合为A4B3C3D3E3。
另外,利用DPS 7.05统计软件对细胞DHA含量进行方差分析,结果如表4所示。由表4可以看出A、C、D、E 4因素的显著性水平P<0.01,则他们在α=0.01下是显著的,差异非常显著;因素B的显著性水平0.01<P<0.05,则其在α=0.05下是显著的,差异显著。
综合方差分析结果可以看出,A、B、C、D、E这5个因素对实验结果在α=0.05下均具有显著性的影响,因此实验中这5种因素的选取具有可行性。
对A4B3C3D3E3这个较优参数组合进行验证实验,结果如表5所示。
| 编号 No. | DHA含量 The DHA/TLC (%) | 平均DHA含量 The average DHA/TLC (%) | RSD (%) |
| 1 | 32.65 | ||
| 2 | 33.60 | 33.68 | 3.21 |
| 3 | 34.81 |
相对标准偏差RSD表示实验的离散程度,其值越低,实验结果越集中,实验越可靠。由表5可以看出,实验中RSD值为3.21,较低,说明实验操作可靠,因此参数组合A4B3C3D3E3即葡萄糖65、甘油80、蛋白胨6、酵母粉4、谷氨酸钠8为裂殖壶菌发酵产DHA的最优培养基碳氮源(g/L)组成,此时的细胞DHA含量为33.68%。
单因素实验得到培养基配方各营养素的最优范围,在局部也可能得到了较好的实验结果,但是正交实验的目的是进一步确定单因素实验的结果,把各种营养源的配方更加明确具体地得到确定。虽然正交实验的结果没有比单因素实验结果出现大幅度的提高,但是通过正交实验明确了该菌种在所试验的培养基条件下所能达到的最好水平,避免了重要的高产培养基配方条件的遗漏。
在单因素实验中,各配方条件对生物量、总脂含量和DHA含量(即DHA/TLC)做了观察,根据单因素实验选取的正交实验各因素水平已经考虑到在生物量和总脂含量2个指标上的相对较高水平,也就是具有较高DHA浓度,因此正交实验重点观察DHA的含量。DHA含量高低是藻油的一个十分重要的质量指标,DHA含量高对于藻油的应用具有极大的优势。
3 结论对于裂殖壶菌Schizochytrium sp. 20888发酵生产DHA,葡萄糖、甘油、蛋白胨、酵母粉、谷氨酸钠为较适合的培养基,而蔗糖、(NH4)2SO4、NH4NO3、NaNO3、尿素、牛肉膏效果相对较差。对于分批发酵的方式,最适宜的发酵时间为4 d,最适宜的发酵温度为23 °C;最优的培养基碳氮源组成为(g/L):葡萄糖65、甘油80、蛋白胨6、酵母粉4、谷氨酸钠8;按此优化培养基配方可达到的细胞油脂DHA含量为33.68%。
| [1] | Nie J. Screening of Schizochytrium SL1101 and studies on its identification, mutation breeding and fermentation[D]. Haikou: Master’s Thesis of Hainan University, 2011 (in Chinese) 聂娟. 裂殖壶菌SL1101的分离鉴定, 诱变育种与发酵优化[D]. 海口: 海南大学硕士学位论文, 2011 |
| [2] | Chen LZ. Production of DHA by means of high cell density cultivation of Schizochytrium sp.[D]. Xiamen: Master’s Thesis of Xiamen University, 2008 (in Chinese) 陈丽珠. 高密度培养裂殖壶菌生产二十二碳六烯酸[D]. 厦门: 厦门大学硕士学位论文, 2008 |
| [3] | Rong H. Breeding of Crypthecodinium cohnii and fermentation optimization[D]. Haikou: Master’s Thesis of South China University of Tropical Agriculture, 2007 (in Chinese) 荣辉. 隐甲藻藻种的选育及其发酵条件的优化[D]. 海口: 华南热带农业大学硕士学位论文, 2007 |
| [4] | Henderson RJ. The production of n-3 poly unsaturated fatty acids in marine organisms[J]. Lipids Technology, 1999, 11 (1): 5–10. |
| [5] | Li LY, Yu FC, Li GY. A comparative study of high unsaturated fatty acids of several marine organisms[J]. Acta Oceanologica Sinica, 1994, 16 (1): 105–113. (in chinese) 李烈英, 于富才, 李光友. 几种海洋生物高度不饱和脂肪酸的比较研究[J]. 海洋学报, 1994, 16 (1):105–113. |
| [6] | Chang GF, Wu J, Jiang CH, et al. The relationship of oxygen uptake rate and kLa with rheological properties in high cell density cultivation of docosahexaenoic acid by Schizochytrium sp. S31[J]. Bioresource Technology, 2014, 152: 234-240 |
| [7] | Ling XP, Guo J, Liu XT, et al. Impact of carbon and nitrogen feeding strategy on high production of biomass and docosahexaenoic acid (DHA) by Schizochytrium sp. LU310[J]. Bioresource Technology, 2015, 184: 139-147 |
| [8] | Wei P, Ma XC, Ren LJ, et al. Research progress on DHA production by Schizochytrium[J]. Science and Technology of Food Industry, 2010, 31 (10): 398–401. (in chinese) 魏萍, 马小琛, 任路静, 等. 裂殖壶菌发酵生产DHA研究进展[J]. 食品工业科技, 2010, 31 (10):398–401. |
| [9] | AQSIQ. GB/T 17376-2008/ISO 5509:2000, Animal and vegetable fats and oils-preparation of methyl esters of fatty acids[S]. Beijing: China Standard Publishing House, 2009 (in Chinese) 国家质量监督检验检疫总局. GB/T 17376-2008/ISO 5509:2000, 动植物油脂脂肪酸甲酯制备[S]. 北京: 中国标准出版社, 2009 |
| [10] | AQSIQ. GB/T 17377-2008/ISO 5508:1990, Animal and vegetable fats and oils-analysis by gas chromatography of methyl esters of fatty acids[S]. Beijing: China Standard Publishing House, 2009 (in Chinese) 国家质量监督检验检疫总局. GB/T 17377-2008/ISO 5508:1990, 动植物油脂脂肪酸甲酯的气相色谱分析[S]. 北京: 中国标准出版社, 2009 |
| [11] | Zhu LY, Zhang XC, Ji L, et al. Changes of lipid content and fatty acid composition of Schizochytrium limacinum in response to different temperatures and salinities[J]. Process Biochemistry, 2007, 42 : 210–214. |
| [12] | Liu J, Gao YY, Jiang XZ, et al. Effects on docosahexaenoic acid biosynthesis and expression of superoxide dismutase in Schizochytrium at low temperature[J]. Pharmaceutical Biotechnology, 2010, 17 (1): 50–55. (in chinese) 刘静, 高媛媛, 江贤章, 等. 低温胁迫对裂殖壶菌DHA生物合成及SOD表达的影响[J]. 药物生物技术, 2010, 17 (1):50–55. |
| [13] | Xu SX. Breeding of Schizochytrium sp. for docosahexenoic acid production and optimization of its fermentation conditions[D]. Wuxi: Master’s Thesis of Jiangnan University, 2013 (in Chinese) 许石雄. 二十二碳六烯酸高产菌株的选育与发酵工艺研究[D]. 无锡: 江南大学硕士学位论文, 2013 |
 2016, Vol. 43
2016, Vol. 43




