扩展功能
文章信息
- 刘丽君, 刘双江, 姜成英
- LIU Li-Jun, LIU Shuang-Jiang, JIANG Cheng-Ying
- 嗜热微生物及在高温生物冶金过程中的应用
- Thermophiles and their application in high temperature-biomining processes
- 微生物学通报, 2016, 43(5): 1101-1112
- Microbiology China, 2016, 43(5): 1101-1112
- DOI: 10.13344/j.microbiol.china.160184
-
文章历史
- 收稿日期: 2016-03-01
- 接受日期: 2016-03-23
- 优先数字出版日期(www.cnki.net): 2016-03-24
2. 中国科学院微生物研究所微生物资源前期开发国家重点实验室 北京 100101 ;
3. 环境微生物技术联合实验室 北京 100101
2. State Key Laboratory of Microbial Resources, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China ;
3. IMCAS-RCEECAS Joint-Lab of Microbial Technology for Environmental Science, Beijing 100101, China
生物冶金(Biomining或biohydrometallurgy)是指利用微生物对金属矿物进行氧化或者分解,使一些可溶的金属(如铜、锌等)以离子形式进入溶液,不溶的金属(如金和银)从包裹它们的硫化矿中暴露出来,通过进一步分离、富集、纯化而提取金属的过程。目前,生物冶金已广泛应用于金、银、铜、钴、镍、锌和铀等金属的提取过程中。与传统冶金过程相比,生物冶金技术具有工艺装备简单、耗能少、成本低、生态友好以及能够处理低品位、难处理矿等优点[1-3]。生物浸出(Bioleaching)和生物氧化(Biooxidation)是生物冶金技术应用于硫化矿处理的 两个生物提取过程。生物浸出过程中,需要提取的金属从矿物中以可溶的状态被释放出来,如铜、锌、镍等。然而在生物氧化过程中,微生物首先破坏矿物表面结构,从而暴露出矿物内部的金属,之后再利用化学方法将内部的金属(如金和银)提取出来,如通常使用氰化物或者硫代硫酸盐来提取包裹在矿物内部的金[4-5]。
应用于生物冶金的嗜热微生物(thermophiles)包括中度嗜热微生物(moderate thermophiles)和极端嗜热微生物(Extreme thermophiles),其中中度嗜热微生物的最适生长温度通常为40−60 °C,极端嗜热微生物的最适生长温度通常高于60 °C。他们是高温环境中存在的主要微生物类群[6]。高温环境在地球上的多个区域广泛存在,包括火山喷气孔、热泉、间歇喷泉、深海热液喷口等;还有一些人为制造的高温环境,比如高温反应器、堆肥设施等[7]。
对于嗜酸性微生物及其在生物冶金中的应用,以及生物冶金技术方面的综述比较多见,而系统地介绍嗜热微生物及其对于极端环境的耐受机制,及其在高温生物冶金中的应用的综述比较有限。为此,本文针对生物冶金中使用的主要嗜热微生物种类,它们的主要耐热机制和对金属离子的耐受机制,以及在高温生物冶金中的应用优势进行总结。
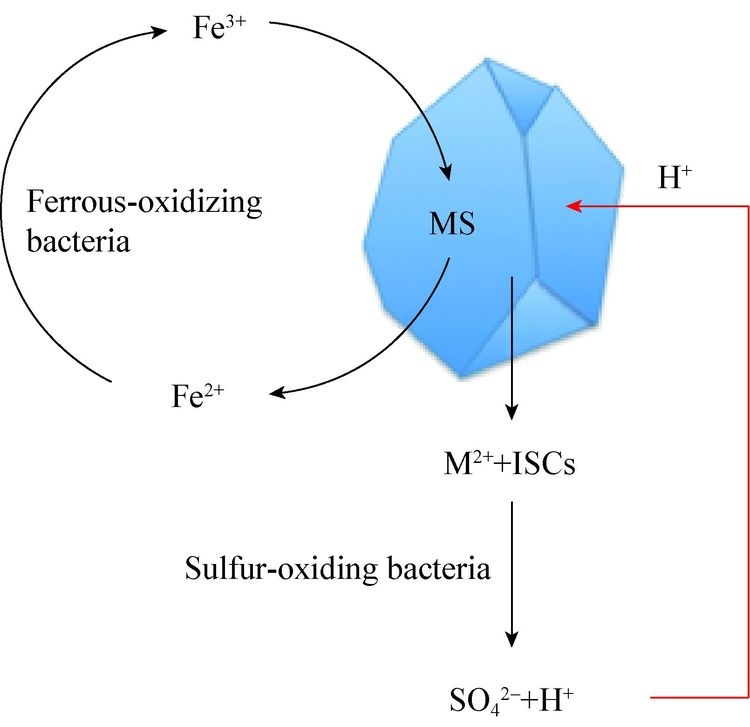
1 生物冶金中的嗜热微生物硫化矿物的氧化包括非生物作用和生物作用两个过程。Fe3+通过非生物作用氧化溶解酸溶性矿(如黄铜矿CuFeS2)和非酸溶性矿(如黄铁矿FeS2),会生成Fe2+和无机硫化合物(inorganic sulfur compounds,ISCs)。而生成的Fe2+被铁氧化微生物氧化为Fe3+后再次用于矿物溶解,ISCs则被硫氧化微生物氧化生成H+和硫酸根,H+也可再次用于矿物的溶解(图 1)。由此可见,生物冶金体系通常都呈强酸性,所以冶金微生物大都是嗜酸微生物,根据它们所利用电子供体的不同被分为三类:(1) 氧化Fe2+生成Fe3+的铁氧化自养微生物,用于矿物的氧化;(2) 氧化无机硫化物产生硫酸的硫氧化自养微生物,用于维持矿物氧化过程中所需的低pH环境;(3) 异养或者混合营养型微生物,用于利用环境中或者铁氧化和硫氧化微生物产生的有机物,从而避免其可能对自养微生物造成伤害。当然,有的微生物可能兼具上述三类中的多种生理特征[5, 8]。
|
| 图 1 硫化矿物的氧化过程 Figure 1 Oxidation process of sulfide ores MS:金属硫化矿物. 黑色箭头:非酸溶性矿和酸溶性矿共有的氧化过程;红色:酸溶性矿特有的反应过程. MS: sulfide mineral. Black arrows: The common oxidation process for both acid-non-soluble ores and acid-soluble ores; Red arrows: the specific oxidation process for acid-soluble ores. |
|
|
应用于生物冶金中的中度嗜热细菌主要有Acidithiobacillus (At.) caldus[9-10]、Acidimicrobium (Am.) ferrooxidans[11]、Leptospirillum (L.) ferriphilum[12]和Sulfobacillus (Sb.)属的成员[13]等,中度嗜热古菌主要有Acidiplasmaspp.[14]和Ferroplasma (F.) acidarmanus[15]等。目前发现的具有浸矿作用的极端嗜热菌均为古菌,属于泉古菌门(Crenarchaeota),包括Acidianus (Ac.) spp.、Sulfolobus (S.) metallicus、Metallosphaera (M.) spp.、Sulfurisphaera ohwakuensis和Stygiolobus azoricus [5, 16]等,这些古菌能够在更为极端的条件下浸出矿物,如近年发现Acidianus属的Ac.sulfidivorans可以在pH 0.35−3.00,温度45−83 °C时从多种硫化矿中浸出金属,如黄铁矿、砷黄铁矿和黄铜矿,这一发现使生物冶金可能实现在酸性更强、温度更高的环境下进行[17]。这些参与生物冶金过程的嗜热菌的生理特点描述见表 1[5, 18]。
| 嗜热微生物 Thermophiles | 生长(最适)温度及最适pH optimal temperature and pH | 电子供体 electron donor | 营养类型 nutritional type | G+C百分含量 G+C content (%) | 参考文献 Reference |
| 细菌 Bacteria | |||||
| Acidithiobacillus caldus | 中度嗜热,45 °C,pH 2.0−2.5 | ISCs | 自养 | 63.1−63.9 | [19, 20] |
| Acidimicrobium ferrooxidans | 中度嗜热,45−50 °C,pH 2.0 | Fe2+ | 自养 | 68.3 | [11] |
| Leptospirillum ferriphilum | 中度嗜热,45 °C,pH 1.4−1.8 | Fe2+ | 自养 | 55.0−58.0 | [12] |
| Sulfobacillus spp. | 中度嗜热,40−55 °C,pH 1.5−2.5 | Fe2+/S | 混养 | 47.2−56.7 | [13] |
| 古菌 Archaea | |||||
| Acidiplasma cupricumulans | 中度嗜热,54 °C,pH 1.0−1.2 | Fe2+ | 异养 | 34.0 | [21] |
| Acidiplasma aeolicum | 中度嗜热,45 °C,pH 1.4−1.6 | 氧化S | 异养 | 36.0 | [14] |
| Ferroplasma acidarmanus | 中度嗜热,42 °C,pH 1.2 | 氧化Fe2+ | 异养 | 37.0 | [15] |
| Acidianus spp. | 极端嗜热,65−90 °C,pH 1.5−2.5 | 氧化/还原S,氧化Fe2+ | 自养 | 31.0 | [22] |
| Sulfolobus metallicus | 极端嗜热,50−75 °C,pH 1.0−4.5 | 氧化S/硫化矿 | 自养 | 38.0 | [23] |
| Metallosphaera spp. | 极端嗜热,65−75 °C,pH 1.3−3.0 | 氧化Fe2+/S/硫化矿 | 混养 | 40.0−46.0 | [24] |
| Sulfurisphaera ohwakuensis | 极端嗜热,84 °C,pH 2.0 | 氧化S,兼性厌氧 | 混养 | 33.0 | [25] |
| Stygiolobus azoricus | 极端嗜热,80 °C,pH 2.5−3.0 | 还原S,严格厌氧 | 自养 | 38.0 | [26] |
为了适应高温生存环境,嗜热微生物从基因到蛋白水平都展现了与中温微生物不同的特点。(1) 基因组大小:嗜热微生物的基因组中,基因间的间隔DNA (intergenic DNA)往往较少,使其具有更为紧凑的基因组结构,这样的基因组特征有利于缩短细胞的分裂时间而加快增殖速度,也能减少核酸合成过程中的能量消耗。通过比较1 553株原核微生物的基因组信息,发现生长温度低于45 °C的微生物,其基因组通常大于6 Mb,而嗜热微生物的基因组往往小于4 Mb,最适生长温度越高的微生物似乎拥有越小的基因组,尤其是对于嗜热细菌Aquificae和嗜热古菌而言,它们的基因组一般小于3 Mb[6, 27]。(2) 基因组G+C含量:随着越来越多微生物的G+C含量被测定,有研究认为高的基因组G+C含量尤其是蛋白编码区的高G+C含量有利于保护DNA免遭高温(≥83−100 °C)损伤;但也有研究认为G+C含量的高低与微生物的耐热性并没有直接的关系[28],比如,最适生长温度为95 °C的极端嗜热细菌Aquifex aeolicus(43.4%)和Pyrococcus abyssi (45%)的G+C含量均低于50%[29-31],前面提到的极端嗜热古菌如Acidianus (30%−33%)、Metallosphaera (45%−47%)、Sulfolobus (34%−39%)的G+C含量也低于50%[29-30],相反一些中温菌如分枝杆菌等的G+C含量则大于50%[28]。相比于中温浸矿菌At.ferrooxidans (56.1%−58.1%)[32]和At.thiobacillus (46.9%−53.1%)[33],中高温浸矿细菌如At.caldus (63.1%−63.9%),Am. ferrooxidans (68.3%)的G+C含量略高[19, 34],这可能说明尽管G+C含量是保护DNA稳定的重要因子,但是对于不同的微生物,G+C含量并不能独立地为DNA提供热稳定性[35]。
与非嗜热菌相比,由于嗜热菌的基因组结构更加紧凑,相应地,它们所含的蛋白质因可变区数量较少而具有较短的氨基酸序列,所含的蛋白家族种类也较少。其次,嗜热微生物在核苷酸组成、排列、密码子偏好性以及氨基酸组成方面都具有其独特的特征[36-37]。当环境温度升高时,从转录组水平和蛋白质组水平上检测到一些重要的生物大分子的上调表达,如热休克蛋白、伴侣蛋白以及一些抗氧化蛋白等,它们有助于增加嗜热微生物的蛋白质在高温环境下的稳定性[6]。此外,一些嗜热微生物利用二硫键[38]或形成复合物(包括同源、异源或者超级复合物)[39]来增加其蛋白质在高温环境下的稳定性[40]。这些嗜热机制是否在高温浸矿微生物中适用还待进一步分析研究。
2.2 嗜热微生物对金属离子的耐受机制生物冶金过程中由于发生了矿物的溶解,原本呈不溶状态的金属会以可溶的状态释放到冶金反应体系中,高浓度的金属离子往往会对微生物造成一定的伤害,因此微生物需要具备对金属离子较强的耐受能力。
微生物对高浓度金属离子的耐受机制分为被动和主动两种,见图 2。

|
| 图 2 冶金微生物耐受金属离子的机制 Figure 2 Tolerance mechanisms on metal ions of biomining microorganisms R:位于细胞膜上的受体;M+:金属离子;ox/re:氧化/还原反应;Mhi-T:金属的高毒性形式;Mlo-T:金属的低毒性形式;EPS:胞外多糖. R: Acceptor on cell membrane; M+: metal ion; ox/re: oxidation/reduction reaction; Mhi-T: high toxicity form of metal; Mlo-T: low toxicity form of metal; EPS: Extracellular polymeric substances. |
|
|
被动机制包括以下4个方面:(1) 硫化矿浸出液中产生的高浓度硫酸根离子,可以结合自由金属离子,从而降低浸出液中自由金属离子的浓度[41]; (2) 嗜酸性微生物内层带正电的细胞膜跨膜电势通过形成化学渗透压梯度阻止阳离子进入细胞,从而降低细胞内自由金属离子的浓度[42];(3) 质子与金属阳离子竞争微生物表面的金属结合位点,研究表明在低pH的条件下可以降低锌离子对细胞的毒性[43-44];(4) 微生物吸附在矿石表面形成生物膜,生物膜中的胞外多糖可以吸附金属,从而降低环境中金属离子的浓度[45]。
耐受金属离子的主动机制包括:(1) 通过依赖于ATP的外排泵或者质子梯度将金属离子运输出细胞外。(2) 多聚磷酸机制:细胞内的无机化合物(如多聚磷酸盐polyP)与金属离子(如铜)结合,使金属离子在细胞内失去生物学活性[46]或通过相应的转运蛋白将产生的金属-磷酸复合物排出细胞外。(3) 微生物体内的酶类(如细胞色素氧化酶)将毒性高的金属离子转化为毒性低的形式,如将高毒性的Hg2+还原为低毒性的Hg0,后者可以以蒸气的形式被去除[47]。(4) 获得性抗性机制:从环境中获得其他微生物中的抗性基因也是冶金微生物增强抗性的手段。
2.2.1 铁耐受性:如前所述,生物冶金过程中Fe3+通过非生物过程启动硫化矿物的溶解而被还原为Fe2+,Fe2+被铁氧化微生物氧化为Fe3+后再次用于矿物溶解,因此体系中会产生大量的游离铁离子,但是如果细菌细胞内自由存在的Fe2+浓度过高,则会与过氧化氢发生Fenton反应,生成氢氧自由基而对细胞内的生物分子造成氧化伤害,而若Fe2+浓度过低,会造成细胞内电子供体的缺乏,因此,用于冶金工业的微生物需要具备耐受及平衡铁离子的能力。基因组分析发现,中度嗜热冶金微生物At.caldus与L.ferriphilum基因组中都存在与铁吸收、铁外排、铁储存及铁代谢相关的基因,但由于所含基因不同,它们平衡铁的机制不同。At.caldus通过FeoB-like Fe(II)和Nramp-like Fe(II)-Mn(II)转运酶吸收可溶性Fe(II)离子;同时,它们含有7个TonB-依赖的外膜Fe(III)载体转移系统,以及柠檬酸盐合成系统用以形成Fe3+-柠檬酸型的铁载体复合物,通过TonB外膜受体蛋白与“Fe3+-柠檬酸铁载体”复合物结合,完成将Fe3+转运至细胞内的过程,从而使它们更容易在较高pH条件下生存。与At.caldus不同,L.ferriphilum只有一个FtrI-Fet3P-like的渗透酶和3个TonB-依赖的Fe3+-柠檬酸型铁载体系统,Fe2+吸收系统的缺少使它们更适应低pH条件下的高Fe(II)浓度[48]。除了At. caldus具有的铁储存蛋白bacterioferritin外,L.ferriphilum和At.caldus都具有多磷酸铁积累功能和FieF-like扩散辅因子,表明这些中度嗜热冶金微生物具有去除或存储铁离子的能力,从而减少铁对于细胞的毒害[49-50]。此外,对Fe(II)强的氧化能力是L.ferriphilum化解高铁浓度压力的策略。
生物信息学分析发现,F.acidarmanus的基因组中也具有一系列与铁吸收、铁载体生物合成及铁排出相关的基因,包括与Fe2+吸收相关的Nramp转运体,以及一个依赖于铁载体的Fe3+转运系统,和一个专一的铁载体Fhu-hydroxamate转运系统,该系统包括通透酶FhuB、ATP酶FhuC和周质空间组分FhuD。当F. acidarmanus在铁离子浓度有限的环境中生长时,检测到与铁载体合成相关的假想异分支酸酶(isochorismatase)的编码基因上调表达[51]。
关于极端嗜热古菌铁耐受的研究目前报道较少,但是我们对基因组分析发现在极端嗜热古菌M.sedula、M.cuprina、S.acidocaldarius、S.tokodaii、S.solfataricus、S.islandicus、Acidianus hospitalis等的基因组中存在编码FeoA的基因,但未发现FeoB和FeoC的编码基因。存在于细菌中的Feo (FeoABC)蛋白已被证明与Fe2+转运相关[49-50],因此进一步对嗜热古菌中FeoA蛋白及对其他铁代谢及转运相关蛋白进行功能鉴定,有助于对嗜热古菌铁耐受机制的认识。
2.2.2 铜耐受性:生物浸出硫化铜矿会产生大量铜离子,堆浸反应体系中的铜离子浓度通常为2−6 g/L (30−90 mmol/L),而搅拌槽浸反应池中的铜离子浓度则可以达到19 g/L (约为300 mmol/L)甚至更高[52]。铜离子会破坏细胞膜和DNA的结构,干扰酶的专一性,还会对细胞造成氧化伤害[41],因此,应用于生物冶金的嗜热微生物需要具备对高浓度铜离子的耐受能力。
L.ferriphilum ML-04菌株能够耐受0.9 mol/L的Cu2+,它的基因组中含有编码与铜转运相关的P型ATP酶的基因[53]。At. caldus SM-1基因组中存在重金属离子外排泵组分CzcA、CzcD、CzcC和MFP亚基的编码基因,3个铜离子转位P型ATPase编码基因和两个重金属转运/脱毒蛋白编码基因(Atc_1888和pLAtcm_088) 。这些基因主要集中在两个基因簇中(基因簇I Atc_1883-90;基因簇II pLAtcm_082-088) [54],完成将金属离子运输出细胞外的解毒过程。此外At.caldus中含有polyP颗粒,可能与Cu2+形成金属-磷酸复合物而排出细胞外[55],还可以通过酶的抗氧化系统[包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)等]和非酶抗氧化系统(维生素C、维生素E、谷胱甘肽等)消除铜等重金属引起的活性氧类物质ROS积累造成的细胞毒性[54, 56]。
古菌的cop基因簇通常编码一套或多套与铜抗性相关的蛋白,每套包含一个与铜转运相关的CopA、CopB (P-type ATP酶)、一个金属分子伴侣(CopM),以及一个转录调控因子(CopT)。S.metallicus的基因组中含有两个同源的cop基因簇,它可以耐受高达200 mmol/L的硫酸铜[57],F. acidarmanus的基因组中含有一套copAMT基因。转录分析发现,当F. acidarmanus或S.metallicus利用氧化铜生长时,它们所含的cop基因簇中的copA与copM都是共转录的,且呈现转录水平显著上调表达[55, 58-59]。 M.sedula和M. cuprina均可以氧化含铜硫铁矿,他们的基因组中各含有一套copAMT基因[60-61]。此外,M.sedula (msed_0981)和M. cuprina (mcup_1197)均编码与S.solfataricus外源多聚磷酸酶PPX相近的蛋白[62]。研究发现,M.sedula、S.metallicus与At.caldus在生长过程中都会积累polyP颗粒。在S.metallicus中,随着polyP水平的快速下降,外源多聚磷酸酶(PPX)活性出现相应的升高,磷酸外排泵也被激发,由此推测polyP颗粒与铜抗性相关联,polyP被外源多聚磷酸酶降解为无机磷酸单体后,在细胞质内结合铜,然后由无机磷酸载体转运出细胞,从而达到降低细胞内铜浓度的目的[55]。
2.3 嗜热微生物的砷耐受机制砷在酸性条件下主要以砷酸盐或亚砷酸盐的形式存在,它们被转运进入细胞后,砷酸盐作为磷酸盐的类似物会对细胞产生毒性,亚砷酸盐则通过与巯基结合而发挥更强的毒性作用[63]。
目前测序的At. caldus菌株的基因组中均编码了arsRBC抗性系统。其中,ArsR为亚砷酸盐效应抑制因子,ArsB为位于膜上、从细胞内排出亚砷酸盐的外排泵,ArsC为砷酸盐还原酶,使砷酸盐还原并与亚砷酸盐外排泵相联系[54, 64-65]。微生物可以通过移动元件获得外界的抗性基因,在含有砷黄铁矿(FeAsS)难处理金矿的生物氧化反应池中分离得到的铁氧化细菌L.ferriphilum和硫氧化细菌At.caldus,由于通过转座子获得了额外的砷抗性基因(包括arsA编码的ATPase,可以增强外排泵ArsB的效率,以及arsD编码的砷的分子伴侣)[66],而具有比从非反应器中分离出的相应菌种更强的砷抗性。此外,在分离自砷黄铁矿冶金反应器的At.caldus SM-1的质粒pLAtc3上发现了一个可能与砷抗性有关的基因簇(pLatc3_p05-08) ,该基因簇包括一个亚砷酸盐转运蛋白编码基因(asrA,pLatc3_p05) ,一个反式阻遏蛋白编码基因(pLatc3_p06) ,一个ArsR家族的调控因子(pLatc3_p07) 和一个调控蛋白编码基因(pLatc3_p08) [54]。将砷抗性菌株At.caldus MNG与砷敏感性菌株进行比较,发现虽然两者染色体上均含有砷抗性基因簇,但砷抗性菌株还含有额外的砷抗性基因簇,序列同源性分析发现该基因簇编码的产物与Alcaligenes faecalis转座子上的相应砷酸盐抗性基因的编码产物具有很高的序列一致性(70%−95%),这表明两者的砷酸盐抗性基因可能来源于共同的祖先,而序列上的差异则显示出两者独立的进化过程[67]。此外有研究指出,将喜温嗜酸硫杆菌的砷酸盐抗性基因簇在大肠杆菌中异源表达可以有效增强大肠杆菌对砷酸盐的抗性[66];而将大肠杆菌的砷酸盐抗性基因簇导入喜温嗜酸硫杆菌中同样可以增强喜温嗜酸硫杆菌的砷酸盐抗性[68]。L.ferriphilum ML-04基因组中的两个转座子上均含有ars基因,包括arsRCDAB,还有一个编码假想蛋白的基因与arsRC和arsB分布在一起,该假想蛋白含有与重金属转运或脱毒相关的结构域[53, 69]。
F. acidarmanus含有一个由亚砷酸盐诱导的arsRB操纵子,但是缺乏ArsC的编码基因,因此它对砷酸盐的抗性机制目前尚不清楚[70]。M. sedula的基因组中含有arsB以及ArsR-like调控蛋白的基因,但是这两个基因并未编码在一起,M. cuprina基因组中也存在2个arsB及5个ArsR-like调控蛋白,但是在基因组中都独立存在,目前尚未在这两种古菌中证实ArsR-like调控蛋白能否调控砷抗性[58, 71]。S.metallicus的膜提取物可以将亚砷酸盐氧化为毒性较低的砷酸盐,冶炼厂废水中的Acidianus brierleyi也可以氧化亚砷酸盐为砷酸盐,对砷具有一定的抗性[71]。
3 嗜热微生物在高温生物冶金中的优势及应用 3.1 生物冶金工艺生物冶金工艺包括堆浸和搅拌槽浸两种。堆浸工艺中,将矿石碾碎后堆积成矿堆,然后从矿堆上喷淋稀释后的硫酸溶液(pH 2.0左右),为铁氧化和硫氧化浸矿微生物提供生长和繁殖的条件。矿石颗粒的大小、形状、筑堆方式、堆体高度、浸出液喷淋强度以及通气强度等都会影响矿堆的渗透性,影响微生物的生长和酸的产生,从而对浸出率产生影响[18]。生物冶金中广泛采用堆浸工艺来浸出铜,通过该工艺获得的铜量占全世界从原矿和碎矿石中产出的铜总量的15%[72]。搅拌槽浸工艺中,矿石粒度非常小,通常采取通气措施,更有利于微生物生长和繁殖,它的成本也往往高于堆浸工艺。所用的矿石主要是精矿,即通过浮选或重力作用去除了矿石中的非金属杂质,这样体系中矿石的体积就可以大大减小,有利于降低资本投入和操作成本。目前搅拌槽浸工艺主要应用于难处理金矿的预氧化以及次生硫化矿的浸出,由此获得的金产量占全世界金总产量的5%左右[18, 72]。
3.2 高温生物冶金的优势生物冶金过程起初主要利用中温菌(mesophiles,20−40 °C,主要是细菌),然而在矿物氧化过程中会产生大量的热量,导致浸出槽和浸堆中温度升高,为了满足中温菌的生长条件就需要对反应器进行降温处理,这大大增加了生物冶金的能耗成本。此外,中温菌浸出具有速度慢、浸出率低,而且对某些难溶矿如黄铜矿等不能持续浸出等缺点。因此,为了降低生产成本,持续浸出一些难溶矿,提高矿物浸出速度和浸出率,利用嗜热微生物在高温条件下进行的生物冶金引起了人们的注意[1]。高温生物冶金具有诸多优势,能够浸出某些难浸出的矿物(如辉钼矿)以及某些酸溶性矿物(如黄铜矿);能够解决黄铜矿等部分硫化矿因钝化而阻碍浸出反应的问题[73];浸出反应速率一般随着温度的升高 而增加,因此嗜热菌相比中温菌,能更有效地浸出金属矿物[74]。
3.3 高温生物冶金的研究目前,高温生物冶金主要用于从难处理矿中浸出铜、钼等金属,或通过生物氧化过程利用硫氧化菌提高含金硫化矿中金的提取量。
黄铜矿作为一种难以浸出的原生硫化铜矿,是世界上最大的铜资源库,占世界上铜储存总量的70%[75]。然而在室温下用酸性硫酸铁溶液浸出黄铜矿的过程中,经常遇到矿石钝化而影响浸出率的问题。发生钝化的原因可能是由于氧化过程中形成的硫层、多硫化铜和含铁化合物沉淀覆盖于矿石表面,使浸出过程减慢或者停止。近年来研究发现,中度嗜热细菌和极端嗜热古菌可以比中温菌更有效地浸出黄铜矿,其机制可能在于高温条件下冶金体系中的氧化还原电势降低,尤其是在利用极端嗜热古菌时黄铜矿是在非氧化环境下被溶解的,低氧化还原电势有利于提高嗜热微生物的活性,促进矿石的溶解[72]。
在实验室条件下研究氧化还原电势对于浸出黄铜矿精矿的影响,中度嗜热细菌在45 °C和高氧化还原电势条件下,对于铜的浸出率是64%,而人为降低氧化还原电势至420 mV时,铜的浸出率可以高达97%。使用极端嗜热古菌在70 °C和利用其固有的低氧化还原电势浸出黄铜矿时,铜的浸出率大于95%[76]。生物冶金体系中,控制氧化还原电位的因素是Fe3+/Fe2+的比例,而这一比例主要受温度和微生物种类的影响。利用中温菌浸矿,最后浸出液中的Fe2+几乎都被氧化为Fe3+;利用嗜热古菌时,最后浸出液中Fe3+/Fe2+ 的摩尔比例为0.7[72]。
3.4 高温生物冶金中嗜热微生物的协同作用微生物往往以群落的形式存在矿堆或生物冶金环境中,许多研究显示混合培养或微生物群落通过协调作用比纯培养菌株有更高的生物冶金效率。当搅拌槽浸体系pH为1.5−1.8,温度为40−45 °C时,其中的冶金微生物通常为3−6种生长迅速的中度嗜热菌,L.ferriphilum与At.caldus分别为体系中占优势地位的铁氧化和硫氧化菌,氧化Fe2+/S的兼性自养菌Sulfobacillus spp.以及氧化铁的专性异养古菌Ferroplasmaspp.或Acidiplasmaspp.则可以消耗体系中产生的有机物[5]。
在实验室条件下使用摇瓶培养,L.ferriphilum (pH 1.8,温度40 °C)与At. ferrooxidans (pH 2.0,温度30 °C)单独浸出黄铜矿时,铜的浸出率分别为23.6%与30.6%。当它们分别与At. caldus混合后(温度和pH条件分别保持不变),浸出率分别提升至80.4%和40.7%。中度嗜热细菌L. ferriphilum与At. caldus的混合培养物,与中温菌At. ferrooxidans的纯培养物或其与At.caldus混合培养物相比,能够更有效地浸出黄铜矿,主要的原因在于At.caldus可以氧化矿石表面沉积的单质硫;另外,温度较高时黄铜矿发生化学溶解的速度也较快;30 °C并不是At.caldus生长的最适温度,也是导致中温时铜浸出率低的原因之一[9, 77]。
使用可连续操控的多级反应系统在70 °C条件下,利用嗜热微生物分别浸出塞尔维亚博尔(Bor,Serbia)的铜精矿混合物和西班牙阿瓜布兰卡(Aguablanca,Spain)的镍铜矿精矿,两种精矿中所含的铜均为黄铜矿,最后铜的浸出率均高于95%。检测反应器中的嗜热微生物群落组成,其中98%−99%为Ac. brierleyi,1%−2%为M.sedula,另外还有非常少量的Sulfolobus spp.存在,说明在70 °C条件下生物浸出含黄铜矿的精矿时,高温古菌是毋庸置疑的浸矿优势微生物[78]。
当在pH 2.0、温度68 °C的生物反应器中,使用极端嗜热古菌Ac. brierleyi与S. metallicus的混合培养物处理土耳其Copler金矿(金被封闭于硫化物基质中) 240 h后,97.79%的硫化物被微生物氧化,利用氰化物处理氧化后的矿石,金的产率为94.48%,硫化物的氧化率和金的产率均高于45 °C下利用中度嗜热细菌Sulfobacillus acidophilus和Sulfobacillus thermosulfidooxidans来浸出该金矿的情况[79]。
3.5 高温生物冶金工艺的应用中高温生物冶金技术浸出硫化矿的研究早在20世纪70年代前就已开始,但真正的工业应用起始于90年代。Gencor公司最早将搅拌槽浸工艺应用于难处理金矿的生物预氧化,并在南非建立了世界上第一个用于预氧化难处理金矿的工厂,该工厂至今仍在运行,该技术之后被称为BIOX法[72]。1991年,BHP Billiton约翰内斯堡技术中心(JTC)通过引入中度嗜热微生物(如At.caldus、L.ferriphilum、Acidiplasma spp.和Ferroplasma spp.等),在搅拌反应器中从黄铁矿、磁黄铁矿及砷黄铁矿等难处理硫化矿中提取金,开拓了BIOX法在中高温难处理金矿生物氧化中的应用。1994年到1995年,该过程的反应器操作体积已达到1 000 m3,并已成功应用于新建工厂[12]。1995年,JTC同时开展了硫化铜精矿的生物浸出研究,1997−2003年之间,公司在Chuqicamata矿发展了利用嗜热菌在高于80 °C条件下操作的BioCOPTM技术,并利用该技术建立了年产20 000 t铜的硫化铜矿精矿浸出示范厂[80]。GeoBiotics有限责任公司采用GEOCOAT高温浸矿系统对纳米比亚南部Rosh Pinah矿的闪锌矿进行生物浸取,锌的回收率和纯度都得到显著提高[81];该技术被进一步应用于黄铜矿的生物浸取,铜浸取率达到97%[81],该技术中使用的中度嗜热菌及极端嗜热菌有At.caldus、Sb. thermosulfidooxidans、Ac. brierleyi、Ac. infernos、S. metallicus和Sulfolobus shibatae等;澳大利亚Bac Tech公司将开发出的采用中度嗜热菌的Bac Tech技术应用于难处理金矿生物氧化预处理过程,金提取率在氰化钠提取后超过了90%[82];另据2010年报道,加拿大马尼托巴省政府已允许Bac Tech矿业公司对归属省政府的储量为30万t的毒砂精矿进行生物浸出[83]。
在我国,近年也开展了中高温生物冶金工艺的研究与应用,Bac Tech公司、南非Mintek公司与山东莱洲合作采用Min Bac工艺生物氧化预处理山东莱州金矿[84];Billiton公司也针对我国云南兰坪铅锌矿闪锌矿浮选精矿开展高温菌生物浸出实验,目前都取得了良好的效果[18]。此外,紫金矿业集团股份有限公司2001年建成了年产1 000 t级阴极铜的中高温生物浸铜矿山工艺,2009年进一步扩大到年产万吨级示范工艺并将该工艺推广到了江西德兴铜矿、西藏玉龙铜矿、云南墨江镍钴矿和吉林白山铜镍钴矿的研究与工业实践中,不仅提高了有价金属的浸出率,而且大大降低了成本。
4 展望虽然嗜热微生物在生物冶金中的应用有诸多优势,但不可避免地存在一些应用限制。如目前发现的嗜热古菌的细胞壁不含有细菌细胞壁的肽聚糖成分,因此不如细菌细胞壁坚韧。在搅拌槽浸过程中,由于存在矿石剪切力的作用,古菌能够耐受的搅拌速度及矿浆浓度都要低于细菌,国际上已有的高温生物冶金工艺也存在浸出率低、不耐高矿浆浓度等不足[85]。此外,高温环境固然有利于加速化学反应过程,然而高温也使体系中的溶解氧浓度降
低,不利于好氧型浸矿微生物的生长,为了满足其生长需要,高温生物冶金时往往需要额外供氧,从而增加了浸矿的成本[71]。为此,筛选耐剪切、微好氧的中度和极端嗜热菌是提高生物浸矿效率、降低浸矿成本的根本;现有的生物冶金菌种耐受金属的能力差别较大,有些浸矿效率高的菌种,金属耐受程度低,因此,了解浸矿微生物的环境适应机制,尤其是金属耐受机制,通过驯化、诱变或基因工程等技术改良菌种,培育耐高矿浆浓度、耐金属毒性、耐剪切力的具有高浸出率的中高温浸矿微生物是提高菌种应用范围的策略;此外,矿石性质、浸矿过程中物理、化学等参数变化对微生物生长和微生物与矿物相互作用的影响,也是制约浸出效率的重要因素,因此摸索工艺参数,加强对浸出体系和浸出过程的优化控制是推广浸矿工艺应用的助力;而设计新型的低剪切力生物浸矿反应器或构筑合理的浸矿矿堆是提高浸矿效率的条件。
高温生物冶金技术在我国的应用尚处于初级阶段,处理量偏低,且工艺不稳定,要想解决我国目前存在的高品位矿产资源日益枯竭、低品位矿产资源得不到有效利用的难题,还需从以上几方面着手,不断挖掘高效能中高温浸矿微生物,开发具有自主知识产权的高温生物冶金技术,以满足国民经济可持续发展的需求。
| [1] | Rawlings DE, Johnson DB. The microbiology of biomining: development and optimization of mineral-oxidizing microbial consortia[J]. Microbiology, 2007, 153 (2): 315–324. |
| [2] | Chen BW, Wen JK, Liu WY. Progress in identification of bioleaching microorganisms[J]. China Mining Magazine, 2007, 16 (9): 103–106. (in chinese) 陈勃伟, 温建康, 刘文彦. 浸矿微生物鉴定研究进展[J]. 中国矿业, 2007, 16 (9):103–106. |
| [3] | Rohwerder T, Gehrke T, Kinzler K, et al. Bioleaching review part A: progress in bioleaching: fundamentals and mechanisms of bacterial metal sulfide oxidation[J]. Applied Microbiology and Biotechnology, 2003, 63 (3): 239–248. |
| [4] | Rawlings DE, Dew D, du Plessis C. Biomineralization of metal-containing ores and concentrates[J]. Trends in Biotechnology, 2003, 21 (1): 38–44. |
| [5] | Johnson DB. Biomining-biotechnologies for extracting and recovering metals from ores and waste materials[J]. Current Opinion in Biotechnology, 2014, 30 : 24–31. |
| [6] | Urbieta MS, Donati ER, Chan KG, et al. Thermophiles in the genomic era: biodiversity, science, and applications[J]. Biotechnology Advances, 2015, 33 (6): 633–647. |
| [7] | Rastogi G, Bhalla A, Adhikari A, et al. Characterization of thermostable cellulases produced by Bacillus and Geobacillus strains[J]. Bioresource Technology, 2010, 101 (22): 8798–8806. |
| [8] | Dopson M, Johnson DB. Biodiversity, metabolism and applications of acidophilic sulfur-metabolizing microorganisms[J]. Environmental Microbiology, 2012, 14 (10): 2620–2631. |
| [9] | Zhou QG, Bo F, Bo ZH, et al. Isolation of a strain of Acidithiobacillus caldus and its role in bioleaching of chalcopyrite[J]. World Journal of Microbiology and Biotechnology, 2007, 23 (9): 1217–1225. |
| [10] | Kelly DP, Wood AP. Reclassification of some species of Thiobacillus to the newly designated genera Acidithiobacillus gen. nov., Halothiobacillus gen. nov. and Thermithiobacillus gen. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50 (2): 511–516. |
| [11] | Clark DA, Norris PR. Acidimicrobium ferrooxidans gen. nov., sp. nov.: mixed-culture ferrous iron oxidation with Sulfobacillus species[J]. Microbiology, 1996, 142 (4): 785–790. |
| [12] | Coram NJ, Rawlings DE. Molecular relationship between two groups of the genus Leptospirillum and the finding that Leptospirillum ferriphilum sp. nov. dominates South African commercial biooxidation tanks that operate at 40 oC[J]. Applied and Environmental Microbiology, 2002, 68 (2): 838–845. |
| [13] | Johnson DB, Joulian C, d’Hugues P, et al. Sulfobacillus benefaciens sp. nov., an acidophilic facultative anaerobic Firmicute isolated from mineral bioleaching operations[J]. Extremophiles, 2008, 12 (6): 789–798. |
| [14] | Golyshina OV, Yakimov MM, Lünsdorf H, et al. Acidiplasma aeolicum gen. nov., sp. nov., a euryarchaeon of the family Ferroplasmaceae isolated from a hydrothermal pool, and transfer of Ferroplasma cupricumulans to Acidiplasma cupricumulans comb. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59 (11): 2815–2823. |
| [15] | Dopson M, Baker-Austin C, Hind A, et al. Characterization of Ferroplasma isolates and Ferroplasma acidarmanus sp. nov., extreme acidophiles from acid mine drainage and industrial bioleaching environments[J]. Applied and Environmental Microbiology, 2004, 70 (4): 2079–2088. |
| [16] | Norris PR, Burton NP, Foulis NAM. Acidophiles in bioreactor mineral processing[J]. Extremophiles, 2000, 4 (2): 71–76. |
| [17] | Plumb JJ, Haddad CM, Gibson JAE, et al. Acidianus sulfidivorans sp. nov., an extremely acidophilic, thermophilic archaeon isolated from a solfatara on Lihir Island, Papua New Guinea, and emendation of the genus description[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57 (7): 1418–1423. |
| [18] | Zhou HB, Mao F, Wang YG. Acidophilic microorganisms and bioleaching technology[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2015, 34 (2): 269–276. (in chinese) 周洪波, 毛峰, 王玉光. 嗜酸微生物与生物冶金技术[J]. 矿物岩石地球化学通报, 2015, 34 (2):269–276. |
| [19] | You XY, Guo X, Zheng HJ, et al. Unraveling the Acidithiobacillus caldus complete genome and its central metabolisms for carbon assimilation[J]. Journal of Genetics and Genomics, 2011, 38 (6): 243–252. |
| [20] | Hallberg KB, Lindström EB. Characterization of Thiobacillus caldus sp. nov., a moderately thermophilic acidophile[J]. Microbiology, 1994, 140 (12): 3451–3456. |
| [21] | Hawkes RB, Franzmann PD, O’hara G, et al. Ferroplasma cupricumulans sp. nov., a novel moderately thermophilic, acidophilic archaeon isolated from an industrial-scale chalcocite bioleach heap[J]. Extremophiles, 2006, 10 (6): 525–530. |
| [22] | Segerer A, Neuner A, Kristjansson JK, et al. Acidianus infernus gen. nov., sp. nov., and Acidianus brierleyi comb. nov.: facultatively aerobic, extremely acidophilic thermophilic sulfur-metabolizing archaebacteria[J]. International Journal of Systematic and Evolutionary Microbiology, 1986, 36 (4): 559–564. |
| [23] | Huber G, Stetter KO. Sulfolobus metallicus, sp. nov., a novel strictly chemolithoautotrophic thermophilic archaeal species of metal-mobilizers[J]. Systematic and Applied Microbiology, 1991, 14 (4): 372–378. |
| [24] | Peng TJ, Liu LJ, Liu C, et al. Metallosphaera tengchongensis sp. nov., an acidothermophilic archaeon isolated from a hot spring[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65 (2): 537–542. |
| [25] | Kurosawa N, Itoh YH, Iwai T, et al. Sulfurisphaera ohwakuensis gen. nov., sp. nov., a novel extremely thermophilic acidophile of the order Sulfolobales[J]. International Journal of Systematic and Evolutionary Microbiology, 1998, 48 (2): 451–456. |
| [26] | Segerer AH, Trincone A, Gahrtz M, et al. Stygiolobus azoricus gen. nov., sp. nov. represents a novel genus of anaerobic, extremely thermoacidophilic archaebacteria of the order Sulfolobales[J]. International Journal of Systematic and Evolutionary Microbiology, 1991, 41 (4): 495–501. |
| [27] | Sabath N, Ferrada E, Barve A, et al. Growth temperature and genome size in bacteria are negatively correlated, suggesting genomic streamlining during thermal adaptation[J]. Genome Biology and Evolution, 2013, 5 (5): 966–977. |
| [28] | Hickey DA, Singer GAC. Genomic and proteomic adaptations to growth at high temperature[J]. Genome Biology, 2004, 5 (10): 117. |
| [29] | Kurosawa N, Itoh YH, Itoh T. Reclassification of Sulfolobus hakonensis Takayanagi et al, 1996 as Metallosphaera hakonensis comb. nov. based on phylogenetic evidence and DNA G+C content[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53 (5): 1607–1608. |
| [30] | Deckert G, Warren PV, Gaasterland T, et al. The complete genome of the hyperthermophilic bacterium Aquifex aeolicus[J]. Nature, 1998, 392 (6674): 353–358. |
| [31] | Erauso G, Reysenbach AL, Godfroy A, et al. Pyrococcus abyssi sp. nov., a new hyperthermophilic archaeon isolated from a deep-sea hydrothermal vent[J]. Archives of Microbiology, 1993, 160 (5): 338–349. |
| [32] | Karavaiko GI, Turova TP, Kondrat'eva TF, et al. Phylogenetic heterogeneity of the species Acidithiobacillus ferrooxidans[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53 (1): 113–119. |
| [33] | Valdes J, Ossandon F, Quatrini R, et al. Draft genome sequence of the extremely acidophilic biomining bacterium Acidithiobacillus thiooxidans ATCC 19377 provides insights into the evolution of the Acidithiobacillus genus[J]. Journal of Bacteriology, 2011, 193 (24): 7003–7004. |
| [34] | Clum A, Nolan M, Lang E, et al. Complete genome sequence of Acidimicrobium ferrooxidans type strain (ICPT)[J]. Standards in Genomic Sciences, 2009, 1 (1): 38–45. |
| [35] | Trivedi S, Rao SR, Gehlot HS. Nucleic acid stability in thermophilic prokaryotes: a review[J]. Journal of Cell and Molecular Biology, 2005, 4 (2): 61–69. |
| [36] | Singer GAC, Hickey DA. Thermophilic prokaryotes have characteristic patterns of codon usage, amino acid composition and nucleotide content[J]. Gene, 2003, 317 : 39–47. |
| [37] | Lynn DJ, Singer GAC, Hickey DA. Synonymous codon usage is subject to selection in thermophilic bacteria[J]. Nucleic Acids Research, 2002, 30 (19): 4272–4277. |
| [38] | Mallick P, Boutz DR, Eisenberg D, et al. Genomic evidence that the intracellular proteins of archaeal microbes contain disulfide bonds[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99 (15): 9679–9684. |
| [39] | Farhoud MH, Wessels HJCT, Steenbakkers PJM, et al. Protein complexes in the archaeon Methanothermobacter thermautotrophicus analyzed by blue native/SDS-PAGE and mass spectrometry[J]. Molecular & Cellular Proteomics, 2005, 4 (11): 1653–1663. |
| [40] | Wang QH, Cen Z, Zhao JJ. The survival mechanisms of thermophiles at high temperatures: an angle of omics[J]. Physiology, 2015, 30 (2): 97–106. |
| [41] | Dopson M, Ossandon FJ, Lövgren L, et al. Metal resistance or tolerance? Acidophiles confront high metal loads via both abiotic and biotic mechanisms[J]. Frontiers in Microbiology, 2014, 5 : 157. |
| [42] | Slonczewski JL, Fujisawa M, Dopson M, et al. Cytoplasmic pH measurement and homeostasis in bacteria and archaea[J]. Advances in Microbial Physiology, 2009, 55 : 1–79. |
| [43] | Heijerick DG, de Schamphelaere KAC, Janssen CR. Biotic ligand model development predicting Zn toxicity to the alga Pseudokirchneriella subcapitata: possibilities and limitations[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2002, 133 (1/2): 207–218. |
| [44] | Mangold S, Potrykus J, Björn E, et al. Extreme zinc tolerance in acidophilic microorganisms from the bacterial and archaeal domains[J]. Extremophiles, 2013, 17 (1): 75–85. |
| [45] | Harrison JJ, Ceri H, Turner RJ. Multimetal resistance and tolerance in microbial biofilms[J]. Nature Reviews Microbiology, 2007, 5 (12): 928–938. |
| [46] | Orell A, Navarro CA, Rivero M, et al. Inorganic polyphosphates in extremophiles and their possible functions[J]. Extremophiles, 2012, 16 (4): 573–583. |
| [47] | Schelert J, Dixit V, Hoang V, et al. Occurrence and characterization of mercury resistance in the hyperthermophilic archaeon Sulfolobus solfataricus by use of gene disruption[J]. Journal of Bacteriology, 2004, 186 (2): 427–437. |
| [48] | Hider RC, Kong XL. Chemistry and biology of siderophores[J]. Natural Product Reports, 2010, 27 (5): 637–657. |
| [49] | Osorio H, Martínez V, Veloso FA, et al. Iron homeostasis strategies in acidophilic iron oxidizers: studies in Acidithiobacillus and Leptospirillum[J]. Hydrometallurgy, 2008, 94 (1/4): 175–179. |
| [50] | Bonnefoy V, Holmes DS. Genomic insights into microbial iron oxidation and iron uptake strategies in extremely acidic environments[J]. Environmental Microbiology, 2012, 14 (7): 1597–1611. |
| [51] | Potrykus J, Jonna VR, Dopson M. Iron homeostasis and responses to iron limitation in extreme acidophiles from the Ferroplasma genus[J]. Proteomics, 2011, 11 (1): 52–63. |
| [52] | Watkin ELJ, Keeling SE, Perrot FA, et al. Metals tolerance in moderately thermophilic isolates from a spent copper sulfide heap, closely related to Acidithiobacillus caldus, Acidimicrobium ferrooxidans and Sulfobacillus thermosulfidooxidans[J]. Journal of Industrial Microbiology & Biotechnology, 2009, 36 (3): 461–465. |
| [53] | Mi S, Song J, Lin JQ, et al. Complete genome of Leptospirillum ferriphilum ML-04 provides insight into its physiology and environmental adaptation[J]. The Journal of Microbiology, 2011, 49 (6): 890–901. |
| [54] | You XY, Ma LP, Jiang CY. Molecular mechanism of heavy metal resistance of Acidithiobacillus caldus SM-1[J]. Biotechnology, 2013, 23 (6): 72–76. (in chinese) 尤晓颜, 马丽苹, 姜成英. 喜温嗜酸硫杆菌SM-1重金属抗性分子机制研究[J]. 生物技术, 2013, 23 (6):72–76. |
| [55] | Orell A, Navarro CA, Arancibia R, et al. Life in blue: copper resistance mechanisms of bacteria and archaea used in industrial biomining of minerals[J]. Biotechnology Advances, 2010, 28 (6): 839–848. |
| [56] | You XY, Li ZZ, Zheng HJ, et al. Defense mechanisms of Acidithiobacillus caldus SM-1 responding to reactive oxygen species[J]. Microbiology China, 2014, 41 (2): 243–250. (in chinese) 尤晓颜, 李兆周, 郑华军, 等. 喜温嗜酸硫杆菌SM-1的ROS防护机制[J]. 微生物学通报, 2014, 41 (2):243–250. |
| [57] | Ettema TJG, Brinkman AB, Lamers PP, et al. Molecular characterization of a conserved archaeal copper resistance (cop) gene cluster and its copper-responsive regulator in Sulfolobus solfataricus P2[J]. Microbiology, 2006, 152 (7): 1969–1979. |
| [58] | Auernik KS, Maezato Y, Blum PH, et al. The genome sequence of the metal-mobilizing, extremely thermoacidophilic archaeon Metallosphaera sedula provides insights into bioleaching-associated metabolism[J]. Applied and Environmental Microbiology, 2008, 74 (3): 682–692. |
| [59] | Orell A, Remonsellez F, Arancibia R, et al. Molecular characterization of copper and cadmium resistance determinants in the biomining thermoacidophilic archaeon Sulfolobus metallicus[J]. Archaea, 2013, 2013 : 289236. |
| [60] | Liu LJ, You XY, Guo X, et al. Metallosphaera cuprina sp. nov., an acidothermophilic, metal-mobilizing archaeon[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61 (10): 2395–2400. |
| [61] | Huber G, Spinnler C, Gambacorta A, et al. Metallosphaera sedula gen, and sp. nov. represents a new genus of aerobic, metal-mobilizing, thermoacidophilic archaebacteria[J]. Systematic and Applied Microbiology, 1989, 12 (1): 38–47. |
| [62] | Cardona ST, Chávez FP, Jerez CA. The exopolyphosphatase gene from Sulfolobus solfataricus: characterization of the first gene found to be involved in polyphosphate metabolism in archaea[J]. Applied and Environmental Microbiology, 2002, 68 (10): 4812–4819. |
| [63] | Páez-Espino D, Tamames J, de Lorenzo V, et al. Microbial responses to environmental arsenic[J]. Biometals, 2009, 22 (1): 117–130. |
| [64] | Dopson M, Lindström BE, Hallberg KB. Chromosomally encoded arsenical resistance of the moderately thermophilic acidophile Acidithiobacillus caldus[J]. Extremophiles, 2001, 5 (4): 247–255. |
| [65] | Valdes J, Quatrini R, Hallberg K, et al. Draft genome sequence of the extremely acidophilic bacterium Acidithiobacillus caldus ATCC 51756 reveals metabolic versatility in the genus Acidithiobacillus[J]. Journal of Bacteriology, 2009, 191 (18): 5877–5878. |
| [66] | Kotze AA, Tuffin IM, Deane SM, et al. Cloning and characterization of the chromosomal arsenic resistance genes from Acidithiobacillus caldus and enhanced arsenic resistance on conjugal transfer of ars genes located on transposon TnAtcArs[J]. Microbiology, 2006, 152 (12): 3551–3560. |
| [67] | Tuffin IM, de Groot P, Deane SM, et al. An unusual Tn21-like transposon containing an ars operon is present in highly arsenic-resistant strains of the biomining bacterium Acidithiobacillus caldus[J]. Microbiology, 2005, 151 (9): 3027–3039. |
| [68] | Zhao Q, Liu XM, Zhan Y, et al. Construction of an engineered Acidithiobacillus caldus with high-efficiency arsenic resistance[J]. Acta Microbiologica Sinica, 2005, 45 (5): 675–679. (in chinese) 赵清, 刘相梅, 詹杨, 等. 一株高效抗砷喜温硫杆菌工程菌的构建[J]. 微生物学报, 2005, 45 (5):675–679. |
| [69] | Li B, Lin JQ, Mi S, et al. Arsenic resistance operon structure in Leptospirillum ferriphilum and proteomic response to arsenic stress[J]. Bioresource Technology, 2010, 101 (24): 9811–9814. |
| [70] | Baker-Austin C, Dopson M, Wexler M, et al. Extreme arsenic resistance by the acidophilic archaeon ‘Ferroplasma acidarmanus’ Fer1[J]. Extremophiles, 2007, 11 (3): 425–434. |
| [71] | Wheaton G, Counts J, Mukherjee A, et al. The confluence of heavy metal biooxidation and heavy metal resistance: implications for bioleaching by extreme thermoacidophiles[J]. Minerals, 2015, 5 (3): 397–451. |
| [72] | Brierley CL, Brierley JA. Progress in bioleaching: part B: applications of microbial processes by the minerals industries[J]. Applied Microbiology and Biotechnology, 2013, 97 (17): 7543–7552. |
| [73] | Vilcáez J, Suto K, Inoue C. Bioleaching of chalcopyrite with thermophiles: temperature-pH-ORP dependence[J]. International Journal of Mineral Processing, 2008, 88 (1/2): 37–44. |
| [74] | Olson GJ, Brierley JA, Brierley CL. Bioleaching review part B: progress in bioleaching: applications of microbial processes by the minerals industries[J]. Applied Microbiology and Biotechnology, 2003, 63 (3): 249–257. |
| [75] | Wang SJ. Copper leaching from chalcopyrite concentrates[J]. JOM, 2005, 57 (7): 48–51. |
| [76] | Gericke M, Govender Y, Pinches A. Tank bioleaching of low-grade chalcopyrite concentrates using redox control[J]. Hydrometallurgy, 2010, 104 (3/4): 414–419. |
| [77] | Fu B, Zhou HB, Zhang RB, et al. Bioleaching of chalcopyrite by pure and mixed cultures of Acidithiobacillus spp. and Leptospirillum ferriphilum[J]. International Biodeterioration & Biodegradation, 2008, 62 (2): 109–115. |
| [78] | Dinkla IJT, Gericke M, Geurkink BK, et al. Acidianus brierleyi is the dominant thermoacidophile in a bioleaching community processing chalcopyrite containing concentrates at 70 °C[J]. Advanced Materials Research, 2009, 71/73 : 67–70. |
| [79] | Ciftci H, Akcil A. Biohydrometallurgy in Turkish gold mining: first shake flask and bioreactor studies[J]. Minerals Engineering, 2013, 46/47 : 25–33. |
| [80] | Batty JD, Rorke GV. Development and commercial demonstration of the BioCOP™ thermophile process[J]. Hydrometallurgy, 2006, 83 (1/4): 83–89. |
| [81] | Harvey TJ, van der Merwe W, Afewu K. The application of the GeoBiotics GEOCOAT® biooxidation technology for the treatment of sphalerite at Kumba resources’ Rosh Pinah mine[J]. Minerals Engineering, 2002, 15 (11): 823–829. |
| [82] | Budden JR, Spencer PA. Tolerance to temperature and water quality for bacterial oxidation: the benefits of BacTech’s moderately thermophilic culture[J]. FEMS Microbiology Reviews, 1993, 11 (1/3): 191–195. |
| [83] | Chi CZ. The Manitoba government allows the BacTech mineral company to study arsenopyrite concentrate heap bioleaching[J]. Gold, 2010, 31 (8): 55. (in chinese) 迟崇哲. 马尼托巴政府允许BacTech矿业公司对毒砂精矿堆进行生物浸出试验研究[J]. 黄金, 2010, 31 (8):55. |
| [84] | Miller P, Jiao F, Wang J. The bacterial oxidation (BACOX) plant at Laizhou, Shandong Province, China-the first three years of operation[A]//Proceedings of the Bac-Min 2004 Conference[C]. Carlton: The Australian Institute of Mining and Metallurgy, 2004 |
| [85] | Bosecker K. Bioleaching: metal solubilization by microorganisms[J]. FEMS Microbiology Reviews, 1997, 20 (3/4): 591–604. |
 2016, Vol. 43
2016, Vol. 43