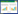扩展功能
文章信息
- 杨柳, 王青青, 吴俊贤, 周小燕, 曹焕英, 叶明
- YANG Liu, WANG Qing-Qing, WU Jun-Xian, ZHOU Xiao-Yan, CAO Huan-Ying, YE Ming
- 粒毛盘菌黄色素的稳定性研究
- Stability of yellow pigment from Lachnum sp.
- 微生物学通报, 2016, 43(5): 1042-1050
- Microbiology China, 2016, 43(5): 1042-1050
- DOI: 10.13344/j.microbiol.china.150926
-
文章历史
- 收稿日期: 2015-11-16
- 接受日期: 2016-03-01
- 优先数字出版日期(www.cnki.net): 2016-03-07
色素被广泛地应用于食品、饲料、化妆品、医药等领域。按照来源不同,色素分为天然色素和合成色素。与合成色素相比,天然色素的安全性相对较高,并具有营养和健康效应,能赋予产品许多新功能。然而天然色素却存在稳定性较差的不足,制约着它的开发应用。黄色素是一类主要的食用色素,天然黄色素主要利用抽提法从植物中获得,如栀子黄色素[1]、玉米黄色素[2]、红花黄色素[3]等。从植物中提取黄色素的生产方法受到资源紧张、成本高的限制;利用微生物生产黄色素,不受地域、季节限制,并具有周期短、易产业化、成本低的优点,日益引起人们的重视。目前,能产生黄色素的菌种资源较少,主要有红曲霉[4]、曲霉[5]、金花菌[6]、绿色木霉[7]、散囊菌[8]等。尚未见利用粒毛盘菌发酵产生黄色素的报道。
天然黄色素按结构可分为类胡萝卜素类(如栀子黄色素、玉米黄色素等)、黄酮类(如红花黄色素)、蒽醌类(Aspergillus黄色素[5])等类型。不同来源的黄色素稳定性差别很大:如绿色木霉黄色素对热稳定性好,但不耐亚硫酸钠[7];散囊菌黄色素对温度、紫外线、光、碱、过氧化氢、亚硫酸氢钠等敏感,对酸的耐受性较好[8];金花菌黄色素对热、酸和弱碱较稳定,对强碱和太阳光极不稳定[6]。天然色素的稳定性决定了其用途:如酸性色素茶黄素可用于果蔬汁饮料、配制酒等食品中[9];耐光性较差的红花黄色素用于糖果、碳酸饮料等食品中[9];还原法生产的红曲黄色素稳定性较好,能用于肉制品的着色上[10]。
粒毛盘菌(Lachnum)属于盘菌纲(Discomycetes)柔膜菌目(Helotiales)晶杯菌科(Hyaloscyphaceae),是一类腐生性真菌,一般生长在潮湿森林中腐朽的树木、叶茎或根部等处。粒毛盘菌在深层发酵条件下可以产生多糖、黑色素等活性物质[11-12]。前期研究发现粒毛盘菌在一定深层发酵条件下能产生水溶性的黄酮类胞外黄色素,发酵液的黄色素色价为30−35,该色素具有较强的抗氧化性能。本文对粒毛盘菌胞外黄色素的稳定性进行研究,以期为粒毛盘菌黄色素在农业、食品工业中规范应用提供依据。
1 材料与方法 1.1 材料粒毛盘菌DP5菌株(Lachnum DP5) ,子实体采集自中国云南省,由合肥工业大学微生物资源与应用研究室分离、保藏。
4802紫外/可见双光束分光光度计,上海尤尼柯仪器有限公司;SPX-250B-G光照培养箱、7HZ-92A振荡器、HHS-21-8水浴锅,上海博迅实业有限公司;KQ-300DE型数控超声波清洗器,昆山市超声仪器有限公司。
1.2 培养基种子培养基(g/L):蔗糖20,酵母粉5,胰蛋白胨5,pH自然。
发酵培养基(g/L):甘油20,酵母粉2,氯化镁0.5,乙酸钠2,pH自然。
1.3 培养方法将保藏菌种接种在马铃薯蔗糖平板上,30 °C培养4 d。接种直径8 mm的菌块于装有20 mL种子培养基的50 mL三角瓶中,30 °C、150 r/min培养3 d。将种子液转移至装有200 mL发酵培养基的500 mL三角瓶中,30 °C、150 r/min培养3 d后,再35 °C、120 r/min培养2 d。
1.4 黄色素的分离、纯化抽滤发酵液除菌体,滤液在60 °C进行减压浓缩至初始发酵液体积的1/2左右,按体积比浓缩发酵液:乙醇=1:4加入无水乙醇,4 °C放置过夜后,过滤除沉淀以除去蛋白质、曲酸等物质。滤液在50 °C下进行减压浓缩至初始发酵液体积的1/3左右,按体积比浓缩发酵液:乙酸乙酯=1:1加入乙酸乙酯,振荡5 min后静置,待分层后除去乙酸乙酯相以除去曲酸、糖及脂溶性杂质等物质。水相用等体积乙醚萃取3次,合并乙醚相,减压蒸发除去乙醚。样品用少量蒸馏水溶解后,利用AB-8大孔吸附树脂进行纯化,洗脱剂为80%乙醇,收集黄色素组分,浓缩、冻干后即得黄色素样品。
1.5 黄色素的定性鉴定取0.1 g色素样品,分别采用FeCl3、碘化铋钾、盐酸-镁粉、1-萘酚、氯化铁-铁氰化钾、茚三酮等溶液进行定性实验[13],判断色素的组成。
1.6 黄色素的光谱特性称取色素样品50±1 mg,用蒸馏水溶解并定容至25 mL,配成2 g/L的黄色素水溶液。以蒸馏水为对照,利用4802紫外/可见双光束分光光度计测定其在200−700 nm区间的紫外-可见吸收光谱。
1.7 黄色素的溶解实验[14]称取色素样品50±1 mg,分别置于5、10、25、50和250 mL蒸馏水、甲醇、乙醇、丙酮、乙酸乙酯、乙醚、石油醚和苯等溶剂中,振荡摇匀后,配成浓度分别为10、5、2、1和0.2 g/L的色素溶液,在40 °C超声水浴(400 W)中保温30 min,冷却至室温后,观察色素样品的溶解性。2 g/L的色素溶液在10 000 r/min下离心5 min,以相应溶剂为对照测定色素溶液的A410。
1.8 温度对黄色素水溶液稳定性的影响[6]将2 g/L的黄色素水溶液置于棕色瓶中,分别于10、30、50、70和90 °C水浴中保温6 h,每隔1 h取样,快速冷却至室温,以水为对照测定色素溶液的A410 (n=3) 。
1.9 光照强度对黄色素水溶液稳定性的影响[14-15]将2 g/L黄色素水溶液分别置于普通玻璃试剂瓶和棕色玻璃试剂瓶中。光照处理:将普通试剂瓶装的色素溶液置于25 °C光照培养箱中,调节光照强度分别为2 500 lx和5 000 lx。避光处理(0 lx):棕色试剂瓶装的色素溶液置于25 °C培养箱中(关闭光照),并用黑纸遮盖培养箱的视窗。每隔一定时间取样,以蒸馏水为对照测定色素溶液的A410 (n=3) 。
1.10 pH对黄色素水溶液稳定性的影响[16]用稀盐酸和稀氢氧化钠溶液调节蒸馏水的pH值,配制pH值分别为3.0±0.1、4.0±0.1、5.0±0.1、6.0±0.1、7.0±0.1、8.0±0.1、9.0±0.1、10.0±0.1和12.0±0.1的水溶液。用上述溶液分别配制2 g/L黄色素溶液,观察其颜色。以不同pH值的水溶液为对照测定色素溶液的A410。不同pH的2 g/L黄色素水溶液如1.9所述的方法进行室温避光保存,每隔一定时间取样,以相应的pH值的水溶液为对照测定色素溶液的A410 (n=3) 。
用pH分别为6.0±0.1、7.0±0.1和8.0±0.1的水溶液配制2 g/L黄色素溶液,以不同pH值的水溶液为对照测定色素溶液在200−500 nm区间的吸收光谱。
1.11 金属离子对黄色素水溶液稳定性的影响[8]分别用5 mmol/L的CuCl2、FeCl3、FeCl2、CaCl2、KCl、ZnCl2、MgCl2、AlCl3溶液配制2 g/L的色素溶液。室温下避光放置4 h,观察其色调,并以相应的金属盐溶液为对照测定色素溶液的A410 (n=3) 。因Fe3+、Fe2+与黄色素形成深色的络合物,将色素溶液稀释5倍后与Fe3+、Fe2+反应,其A410乘以稀释倍数(5) 后与其它进行比较。
1.12 氧化剂、还原剂对黄色素水溶液稳定性的影响[8, 17]用3、6、10、15、20、30 g/L各6个不同浓度等级的Na2SO3、NaNO2溶液配制2 g/L色素溶液;用0.1、1.0、2.0、3.0、4.0、5.0、10.0 g/L的H2O2、抗坏血酸溶液配制色素溶液;室温下避光放置2 h后,以相应的溶液为对照测定A410 (n=3) 。
1.13 食品添加剂对黄色素水溶液稳定性的影响[8, 14]分别用50、100 g/L的蔗糖、葡萄糖、氯化钠溶液配制2 g/L色素溶液;分别用5、10 g/L的山梨酸钾溶液配制色素溶液,室温下避光放置2 h后观察其色调并以相应的溶液为对照测定色素溶液的A410 (n=3) 。以色素水溶液的初始A410为100%,计算色素保存率。
2 结果与分析 2.1 粒毛盘菌黄色素的初步鉴定和光谱吸收特征由表 1知,粒毛盘菌黄色素样品的碘化铋钾试验、1-萘酚试验、Borntrager反应(碱液反应)、茚三酮试验等均为阴性,说明黄色素粗品不含生物碱、糖苷、蒽醌、氨基酸等物质;而氯化铁试验、氯化铁-铁氰化钾试验、福林-酚试验为阳性,因样品不含氨基酸说明色素含酚羟基;盐酸-镁粉实验阳性,说明色素含黄酮类物质。
| 试剂/试验 Reagent/Test | 现象 Phenomenon | 结论 Conclusion |
| 碘化铋钾实验 Bismuth potassium iodide | − | 不含生物碱 Not containing alkaloid |
| FeCl3 | 红棕色 Red brown | 含烯醇 Containing enol group |
| HCl-Mg | 粉红色 Pink | 含黄酮 Containing flavone |
| 1-naphthol | − | 不含糖 Not containing saccharide |
| 碱液反应 Borntrager reaction | − | 不含蒽醌 Not containing anthraquinone |
| FeCl3-K3[Fe(CN)6] | 蓝色 Blue | 含酚羟基 Containing phenols |
| 茚三酮 Ninhydrin | − | 不含氨基酸 Not containing amino acid |
| 福林-酚反应 Folin-Ciocalteu test | 蓝色 Blue | 含酚羟基 Containing phenols |
| 注:−:无反应. | ||
| Note: −: Negative response. | ||
粒毛盘菌黄色素的红外光谱如图 1所示,在 1 014 cm−1处为苯环上C=C伸缩,在1 540 cm−1处存在−NH弯曲振动,在1 646 cm−1处存在酮或羧酸C=O收缩振动,2 920 cm−1处噻吩C−H振动,在 3 411 cm−1处有较宽的强吸收峰,为酚羟基伸缩振动,粒毛 盘菌黄色素的红外光谱与酚类化合物的特征吸收峰比较一致。与表 1化学法鉴别结果一致,但经过熔点测定及HPLC检测,发现该色素是由多种物质组成的混合物。

|
| 图 1 粒毛盘菌黄色素的红外光谱图 Figure 1 The IR spectra of Lachnum yellow pigment |
|
|
粒毛盘菌黄色素水溶液经紫外-可见光扫描,结果如图 2所示。可知,该色素水溶液(pH 6.89) 在 300 nm和410 nm两处有吸收峰。前者吸收强度略大,峰型较锐,后者强度稍弱于前者,峰型较缓。由于410 nm处在一般有色物质溶液的吸收区间内,因此以色素在410 nm处的吸光值(A410)为指标来衡量粒毛盘菌黄色素的色度。
|
| 图 2 粒毛盘菌黄色素紫外-可见光谱图 Figure 2 Ultraviolet-visible spectrogram of Lachnum yellow pigment in aqueous solution |
|
|
粒毛盘菌代谢产生的黄色素样品为柠檬黄色粉末状,在水、甲醇、乙醇等溶剂中溶解度大于 10 g/L,在乙醚、丙酮中的溶解度为5−10 g/L,在乙酸乙酯溶解度较低,微溶于石油醚、苯等溶剂(表 2),说明该色素在极性溶剂中溶解度较好,为水溶性色素。
| 溶剂 Solvent | 溶解度 Solubility (g/L) | 2 g/L色素溶液吸光度 A410 of 2 g/L pigment solution |
| Distilled water | >10 | 0.833±0.021 |
| Methanol | >10 | 0.807±0.038 |
| Ethanol | >10 | 0.825±0.049 |
| Ethyl ether | 5−10 | 0.688±0.025 |
| Acetone | 5−10 | 0.456±0.038 |
| Ethyl acetate | 1−2 | 0.108+0.008 |
| Petroleum ether | <0.2 | 0.008±0.001 |
| Benzene | <0.2 | 0.005±0.001 |
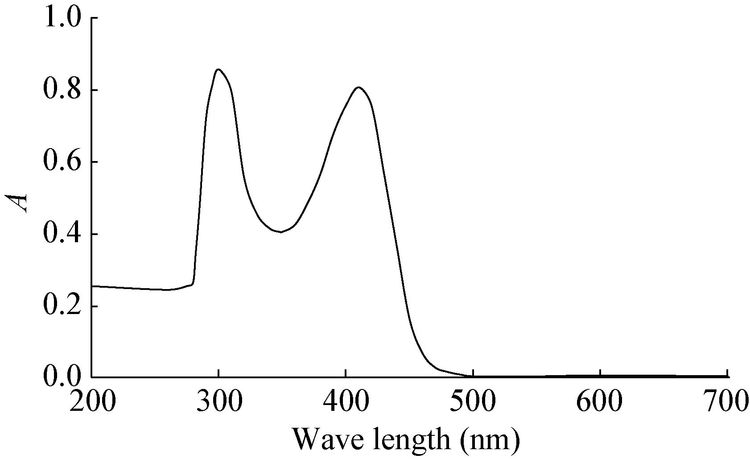
色素在分离提取及食品着色时,常需加热。将粒毛盘菌黄色素水溶液分别在10、20、30、50、70、90 °C下处理1 h,色泽无明显变化,对其吸收波长进行扫描,结果发现各温度处理的色素溶液的最大吸收波长无明显差别,均在410 nm左右,说明加热不会改变该色素的结构。粒毛盘菌黄色素水溶液在不同温度下处理6 h,A410随时间变化如图 3所示。黄色素水溶液在10−70 °C保温6 h后,色调仍保持亮黄色,色素保存率均超过85%。70 °C以上的温度对色素产生影响,表现为色素溶液的A410值有所下降,并随温度升高色素的A410值下降程度增大,其色调保持亮黄色,但略发暗。90 °C保温6 h后,其色素保存率约为75%,说明粒毛盘菌黄色素对热较稳定。粒毛盘菌黄色素对热稳定要好于海洋放线菌MA01[14]和散囊菌产生的黄色素[8]。
|
| 图 3 温度对粒毛盘菌黄色素水溶液稳定性的影响 Figure 3 Effects of temperature on the stability of Lachnum yellow pigment in aqueous solution |
|
|
日光灯的光波长范围和阳光可见光相似,且紫外线产生量少。以日光灯为光源可以模拟可见光,进行可见光光照强度对色素稳定性影响的实验。从图 4知色素溶液色泽随着照射时间和光照强度的增加而逐渐变淡。在光照条件下,色素溶液放置5 d色素颜色明显变淡,随后色素颜色变化速率减缓。放置28 d后,避光保存的色素保存率为65.54%,光照强度为5 000 lx的色素保存率仅为31.08%,光照强度为2 500 lx的色素保存率为47.47%。光照强度对粒毛盘菌黄色素的影响与对红曲色素的影响相似[15]。

|
| 图 4 光照强度对粒毛盘菌黄色素水溶液稳定性的影响 Figure 4 Effects of illumination intensity on the stability of Lachnum yellow pigment in aqueous solution |
|
|
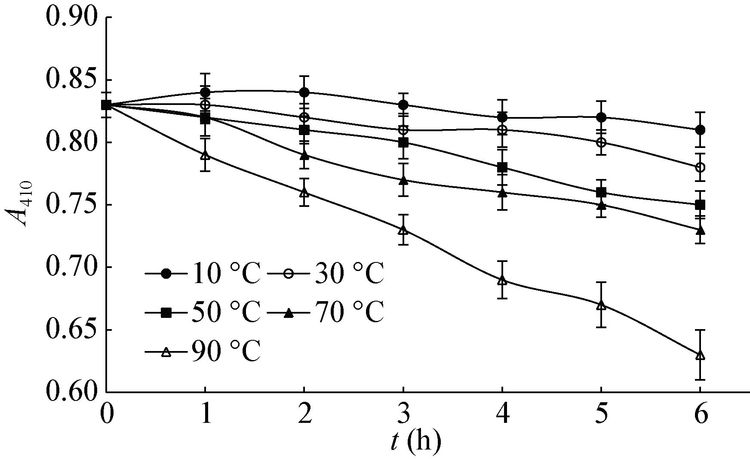
不同pH的色素水溶液颜色差别明显:在pH 3.0−10.0范围内,随着pH值的上升,颜色由浅至深,色素溶液的A410值总体呈上升趋势(图 5)。在pH 3.0−5.0范围内,溶液呈淡黄色,颜色浅,无沉淀;pH值6.0的溶液为浅黄色;pH≥7.0的溶液色泽为明亮的柠檬黄色。

|
| 图 5 pH对粒毛盘菌黄色素水溶液的A410的影响 Figure 5 Effects of pH on the A410 of Lachnum yellow pigment in aqueous solution |
|
|
在紫外-可见范围内测定不同pH的色素水溶液的吸收光谱,发现pH 3.0、4.0、5.0、6.0的色素溶液的吸收光谱图形类似,pH 8.0、9.0、10.0、11.0的色素溶液的吸收光谱图形类似,pH 6.0、7.0、8.0的色素溶液的紫外-可见光吸收如图 6所示(各pH的色素溶液在波长大于500 nm时,均无吸收峰)。可以看出,不同pH的色素溶液在300 nm处均有吸收峰,峰值相差不大,但峰宽随pH升高而增加。在可见光区域内,pH 6.0的色素溶液无吸收峰,pH 7.0、8.0的色素溶液在约410 nm处有吸收,pH 7.0的色素水溶液的最大可见吸收波长为410.5 nm,pH 8.0的吸收波长为412.0 nm,pH 10.0的溶液吸收波长为414.0 nm。随着pH的增加,色素水溶液在 410 nm处的吸收峰值和峰宽均增加。不同pH的色素溶液的吸收光谱差别较大,这是因为粒毛盘菌黄色素属芳香族化合物,体系pH不同时,芳香族结构结构形式发生改变。酸碱度对粒毛盘菌黄色素的影响与对荸荠皮色素[16]的影响较为相似。粒毛盘菌黄色素含多种酚羟基,在碱性溶液中会失去质子,易形成更大范围的电子共轭以降低体系的能力,因此在碱性溶液的吸光度增加,而在酸性条件下有相反的效果[16]。

|
| 图 6 pH对粒毛盘菌黄色素水溶液的紫外-可见光谱图的影响 Figure 6 Effects of pH on ultraviolet-visible spectrogram of Lachnum yellow pigment in aqueous solution |
|
|
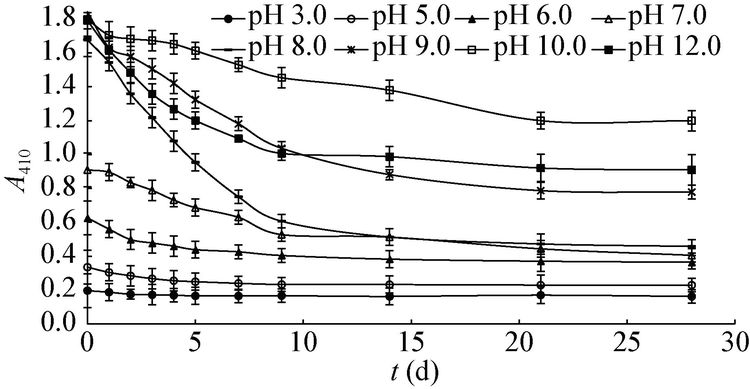
不同pH的粒毛盘菌黄色素溶液在室温下避光放置28 d,其A410值变化如图 7所示。低pH的色素水溶液颜色浅,初始A410较小,放置过程中色泽变化较小,A410变化幅度也较小。高pH的色素水溶液颜色深,放置过程中色泽变化较大,A410变化相应较大。pH 8.0的色素溶液的A410变化最大,放置5 d后的色素保存率为56.88%,9 d后色素保存率为36.14%。pH 10.0的色素溶液A410值变化较小,放置5 d后色素保存率为89.70%,9 d后色素保存率为80.85%,28 d后色素保留率为66.72%。碱性的色素溶液,其pH值在放置过程中有一定降低,如pH 8.0的色素溶液放置9 d后,其pH值由初始的8.05下降到7.85,而在pH 6.0−8.0范围内,色素溶液的A410受pH影响较大。因此,pH 8.0的色素溶液A410变化较大的原因,一方面因为色素本身的降解,另一方面是由于pH的降低引起的。pH 12.0的色素溶液不稳定的主要原因是因为碱性条件下降解速度较快。
|
| 图 7 pH 对粒毛盘菌黄色素水溶液稳定性的影响 Figure 7 Effects of pH on the stability of Lachnum yellow pigment in aqueous solution |
|
|
金属离子对色素溶液稳定性影响如图 8所示。添加Al3+的色素溶液褪色明显,室温下放置4 h的色素保存率仅28.13%。添加Zn2+、Cu2+的色素溶液有不同程度褪色,添加Ca2+、K+、Mg2+的色素溶液放置4 h后色素溶液仍呈现良好的黄色,色素保存率超过90%。含Fe2+、Fe3+离子的色素水溶液吸光度值不降反升,并非因为这些离子对色素有增色作用,而是因为Fe2+、Fe3+与色素中的酚类物质形成颜色更深的络合物,络合物呈紫色,而非黄色。
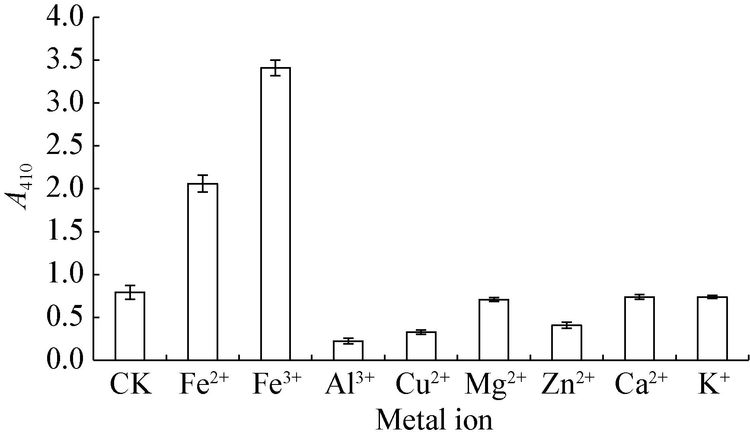
|
| 图 8 金属离子对粒毛盘菌黄色素水溶液稳定性的影响 Figure 8 Effects of different metal ions on the stability of Lachnum yellow pigment in aqueous solution |
|
|
向色素溶液添加亚硫酸钠和亚硝酸钠后,色素溶液的色调仍保持黄色,无沉淀或浑浊出现。从图 9可知,添加亚硫酸钠后,A410不仅没有减小,反而有较大幅度的增加。当亚硫酸钠浓度为15 g/L,色素溶液的A410较对照增加了3倍,说明亚硫酸钠对粒毛盘菌黄色素有增色作用。在所考察的浓度范围内,亚硝酸钠含量对粒毛盘菌黄色素无明显影响。从图 10可知,添加过氧化氢及抗坏血酸后,色素溶液的A410降低,尤其是抗坏血酸。过氧化氢浓度为5 g/L,放置2 h后色素保留率为85.90%;抗坏血酸浓度为5 g/L时,色素保留率仅30.12%。过氧化氢与抗坏血酸对黄色素水溶液的影响与其对桑果花青素的影响相似[17],说明粒毛盘菌黄色素对抗坏血酸非常敏感,使用中应注意避免和抗坏血酸直接接触。
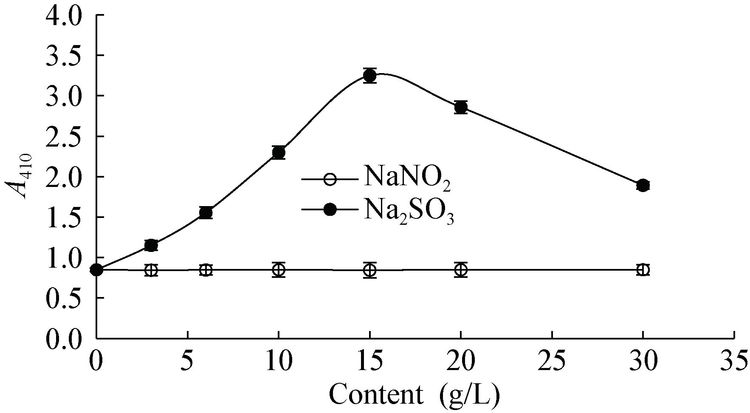
|
| 图 9 亚硫酸钠和亚硝酸钠浓度对粒毛盘菌黄色素水溶液稳定性的影响 Figure 9 Effects of Na2SO3 and NaNO2 on the stability of Lachnum yellow pigment in aqueous solution |
|
|

|
| 图 10 抗坏血酸和过氧化氢对粒毛盘菌黄色素稳定性的影响 Figure 10 Effects of ascorbic acid and H2O2 on the stability of Lachnum yellow pigment in aqueous solution |
|
|
由表 3可知,向粒毛盘菌黄色素溶液添加葡萄糖、蔗糖,放置2 h后,A410值无明显变化,色素保存率超过95%;黄色素溶液的A410随氯化钠浓度增加而减少,氯化钠浓度为100.0 g/L时,色素溶液A410减少了1/4。山梨酸钾对该色素溶液影响较小。除酱、腌制食品外,一般食品中盐含量低于10%。此色素与柠檬酸、蔗糖、可溶性淀粉、葡萄糖、食盐等添加剂同时使用。
| 食品添加剂 Food additives (g/L) | 浓度 Content (g/L) | 吸光值 A410 | 色素保存率 Preservation rate (%) | 色调 color |
| Control | 0.0 | 0.811±0.036 | 98.30 | Yellow |
| Sucrose | 50.0 | 0.802±0.105 | 97.21 | |
| 100.0 | 0.789±0.085 | 95.64 | ||
| Glucose | 50.0 | 0.805±0.076 | 97.58 | |
| 100.0 | 0.790±0.048 | 95.76 | ||
| NaCl | 50.0 | 0.731±0.062 | 88.61 | |
| 100.0 | 0.621±0.053 | 75.27 | ||
| Potassium Sorbate | 1.0 | 0.788±0.079 | 95.52 | |
| 5.0 | 0.775±0.037 | 93.94 |
色素是食品工业重要的添加剂,天然色素逐渐代替化学合成色素是食品添加剂发展的必然趋势。但目前天然色素远不能满足现代食品工业发展的需要,开发新品种的天然色素,已成为食品添加剂行业迫切需要解决的问题。
许多真菌特别是子囊菌、担子菌等,能合成并分泌种类繁多、颜色各异的色素物质。目前,担子菌在实验室条件下不易培养,不适合应用于大规模的工业生产。而许多子囊菌在优化的培养条件下能高效合成色素。如在我国、日本及东南亚地区使用历史悠久的红曲色素,现已商业应用,对红曲色素的化学组成、生物活性及安全性能等已有详尽研究[4]。
粒毛盘菌与红曲霉同属子囊菌门,粒毛盘菌在优化的发酵条件下能产生黄色素。与工业生产红曲色素相比,粒毛盘菌发酵液中的黄色素色价(30−35) 、黄色素粗品的色价(10−12) 还较低。但与红曲色素含红、黄、橙等多种色素不同,粒毛盘菌发酵液仅含黄色素,不含其它色素。
粒毛盘菌黄色素属黄酮类化合物,黄酮类化合物具有较强的抗氧化性能,能赋予产品一定的药理作用。目前,食品行业中使用的黄酮类色素比较少,主要有高粱红、可可壳色素等[9]。黄酮类色素从植物中提取得到,真菌黄酮类色素少见报道。
粒毛盘菌黄色素水溶性较好,其水溶液在可见光范围内410 nm处有最大吸收峰,这与红曲黄色素[4]、双梭孢虫草黄色素[18]的吸收光谱类似。色素的稳定性影响着其提取纯化工艺及应用范围。粒毛盘菌黄色素具有较好的热稳定性,能够满足色素生产工艺和大部分食品生产对色素耐热性的要求。亚硝酸钠、亚硫酸钠、Ca2+、K+、Mg2+等金属离子及常用的食品添加剂如蔗糖、葡萄糖、氯化钠、山梨酸钾等对粒毛盘菌黄色素溶液色泽及稳定性影响无明显影响。粒毛盘菌黄色素水溶液对光不稳定,在光照条件下发生降解反应,其降解率与光照强度、照射时间正相关。光稳定性差也是许多天然色素的不足,在生产、保存时都需注意避光。粒毛盘菌黄色素的颜色与溶液的pH值相关:pH越低,黄色越淡,pH越高,黄色越深。粒毛盘菌黄色素在不同pH条件下呈现不同的色调,这与pH会引起色素结构发生变化有关。
过氧化氢能氧化降解粒毛盘菌黄色素,从而对黄色素有一定的褪色作用。Fe3+、Fe2+、Al3+、Cu2+、Zn2+能与黄酮类物质反应,从而降低或改变黄色素溶液的色泽。
综上分析,粒毛盘菌黄色素在稳定性上呈现出一定优势,具有开发潜力,但距离工业生产应用尚有差距,还需要进一步对粒毛盘菌黄色素提取工艺、化学结构、安全性评价及着色能力方面进行深入研究。
| [1] | Chen F, Dong SX, Wang XP. Study on ultrasonic-assisted extraction of gardenia yellow pigment[J]. Journal of Ningde Normal University (Natural Science), 2015, 27 (2): 132–135. (in chinese) 陈峰, 董声雄, 王喜萍. 超声波辅助浸提栀子黄色素的工艺研究[J]. 宁德师范学院学报: 自然科学版, 2015, 27 (2):132–135. |
| [2] | Chen H, Wang XJ, Li X, et al. Microwave-assisted extraction and stabilization of yellow pigment from corn bran[J]. Food Science, 2009, 30 (14): 57–61. (in chinese) 陈红, 王秀娟, 李侠, 等. 微波辅助提取玉米皮中黄色素及其稳定性研究[J]. 食品科学, 2009, 30 (14):57–61. |
| [3] | Xiao YH, Li YY, Cui M, et al. Extraction process of hydroxy safflower yellow A in Safflower carthamus[J]. Journal of Wuhan Institute of Technology, 2015, 37 (3): 15–19. (in chinese) 肖艳华, 李艳艳, 崔猛, 等. 红花中羟基红花黄色素A的提取工艺[J]. 武汉工程大学学报, 2015, 37 (3):15–19. |
| [4] | Feng YL, Shao YC, Chen FS. Monascus pigments[J]. Applied Microbiology and Biotechnology, 2012, 96 (6): 1421–1440. |
| [5] | Shier WT, Lao YB, Steele TWJ, et al. Yellow pigments used in rapid identification of aflatoxin-producing Aspergillus strains are anthraquionnes associated with the aflatoxin biosynthetic pathway[J]. Bioorganic Chemistry, 2005, 33 (6): 426–438. |
| [6] | Li YT, Lü JL. Study on stability and antioxidant activity of the yellow pigments from Eurotium cristatum[J]. Microbiology China, 2013, 40 (11): 2030–2036. (in chinese) 李玉婷, 吕嘉枥. 金花菌黄色素的稳定性及其抗氧化活性研究[J]. 微生物学通报, 2013, 40 (11):2030–2036. |
| [7] | Wu XB, Yu X, Wu Q. Stability of yellow pigment from Trichoderma viride strain T-YY[J]. Transactions of the CSAE, 2008, 24 (1): 285–290. (in chinese) 吴晓冰, 于新, 吴青. 绿色木霉菌T-YY黄色素的稳定性研究[J]. 农业工程学报, 2008, 24 (1):285–290. |
| [8] | Wang B, Yu HS, Liu XH, et al. Research on the extraction and stability of yellow pigment produced by Eurotium cristatum[J]. Journal of Biology, 2009, 26 (3): 63–65. (in chinese) 王波, 于汉寿, 刘雪慧, 等. 散囊菌黄色素的提取及稳定性研究[J]. 生物学杂志, 2009, 26 (3):63–65. |
| [9] | Chen YZ. Natural Pigment to Produce and Apply[M]. Beijing: China Light Industry Press, 2007 . (in chinese) 陈运中. 天然色素的生产及应用[M]. 北京: 中国轻工业出版社, 2007 . |
| [10] | Rong YJ, Wu JC, Chen XT, et al. Nature of monascus yellow pigment and its application in meat products[J]. Meat Industry, 2015 (5): 43–46. (in chinese) 容艳筠, 伍剑聪, 陈锡堂, 等. 红曲黄色素的性质及其在肉制品中的应用研究[J]. 肉类工业, 2015 (5):43–46. |
| [11] | Lu Y, Ye M, Song S, et al. Isolation, purification, and anti-aging activity of melanin from Lachnum singerianum[J]. Applied Biochemistry and Biotechnology, 2014, 174 (2): 762–771. |
| [12] | Qiu T, Ma XJ, Ye M, et al. Purification, structure, lipid lowering and liver protecting effects of polysaccharide from Lachnum YM281[J]. Carbohydrate Polymers, 2013, 98 (1): 922–930. |
| [13] | Li BQ, Lian YJ. Experimental Technology of Natural Products Chemistry[M]. Beijing: Chemical Industry Press, 2012 . (in chinese) 李炳奇, 廉宜君. 天然产物化学实验技术[M]. 北京: 化学工业出版社, 2012 . |
| [14] | Li P, Yan PS. Study on stability of the yellow pigment from a new marine actinomycete and 16S rDNA analysis of the strain[J]. Science and Technology of Food Industry, 2013, 34 (22): 275–279. (in chinese) 李平, 闫培生. 一株新的海洋放线菌所产黄色素稳定性研究及其16S rDNA序列分析[J]. 食品工业科技, 2013, 34 (22):275–279. |
| [15] | Zhang QQ, Zhang D, Tang WJ, et al. Photostability of water-soluble and alcohol-soluble Monascus pigments[J]. Food Science, 2015, 36 (1): 94–98. (in chinese) 张庆庆, 张帝, 汤文晶, 等. 水溶性和醇溶性红曲色素的光稳定性[J]. 食品科学, 2015, 36 (1):94–98. |
| [16] | Li XR, Liu S, Luo YH, et al. Purification, stability and antioxidant activities of natural pigment from Chufa (Eleocharis tuberosa) peels[J]. Food and Fermentation Industries, 2014, 40 (8): 89–95. (in chinese) 李行任, 刘珊, 罗杨合, 等. 荸荠皮天然色素的纯化及其稳定性和抗氧化活性[J]. 食品与发酵工业, 2014, 40 (8):89–95. |
| [17] | Nikkhah E, Khaiamy M, Heidary R, et al. The effect of ascorbic acid and H2O2 treatment on the stability of anthocyanin pigments in berries[J]. Turkish Journal of Biology, 2010, 34 (1): 47–53. |
| [18] | Lu RL, Luo FF, Hu FL, et al. Identification and production of a novel natural pigment, cordycepoid A, from Cordyceps bifusispora[J]. Applied Microbiology and Biotechnology, 2013, 97 (14): 6241–6249. |
 2016, Vol. 43
2016, Vol. 43