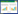扩展功能
文章信息
- 王真真, 徐婷, 袁珊珊, 廖红东, 杨远柱, 曾夏冬, 李燕, 胡小淳, 柳倩, 曾嘉锐, 朱咏华, 刘选明
- WANG Zhen-Zhen, XU Ting, YUAN Shan-Shan, LIAO Hong-Dong, YANG Yuan-Zhu, ZENG Xia-Dong, LI Yan, HU Xiao-Chun, LIU Qian, ZENG Jia-Rui, ZHU Yong-Hua, LIU Xuan-Ming
- 水稻内生放线菌OsiRt-1的分离鉴定及对稻瘟病的防治作用
- Identification of an endophytic actinomyce OsiRt-1 isolated from rice and its effect against rice blast disease
- 微生物学通报, 2016, 43(5): 1009-1018
- Microbiology China, 2016, 43(5): 1009-1018
- DOI: 10.13344/j.microbiol.china.150913
-
文章历史
- 收稿日期: 2015-11-13
- 接受日期: 2016-03-01
- 优先数字出版日期(www.cnki.net): 2016-03-04
2. 湖南亚华种业科学研究院 湖南 长沙 410119
2. Yahua Seeds Science Research Institute, Changsha, Hunan 410119, China
稻瘟病是水稻生产上威胁最大的病害之一,由真菌梨孢霉菌(Magnaporthe oryzae)感染引起,可发生在水稻整个发育时期。由于该病流行速度快,在适宜的环境条件下,短时间内即可造成大流行,给水稻生产带来巨大损失[1]。目前,农业上主要采取抗病育种和化学药剂来逐渐控制稻瘟病[2]。但由于稻瘟病菌的遗传背景复杂,易变异,抗病品种难以跟上致病菌生理小种的变异速度,常导致一个新的具有抗瘟性的水稻品种在种植几年后丧失抗性[3]。而化学防治,不仅会污染环境,降低水稻质量,破坏生态[4],还导致病菌的耐药性不断增加从而降低防效。因此,探索新的方法来控制和解决稻瘟病越来越受关注。其中,微生物农药由于其低毒性和不受病原菌抗性影响的特点[5],近年正在开发并兴起。放线菌是天然抗生素等生物活性物质的主要生产菌,很多放线菌,尤其是链霉菌,已被报道用于生物防治红辣椒根茎腐病、百合腐病、水稻白叶枯病、番茄灰霉病、马铃薯疮痂病和稻瘟病[6-10]。迄今为止,大部分的生防放线菌主要来源于根际和土壤,从植物内生环境中发掘新的生防菌资源目前逐渐受到关注。
内生菌是可以在植物的整个或部分生长周期中稳定定殖在植物内部的微生物菌群[11]。与根际和土壤微生物相比,内生菌生长在植物内部而不会与土壤菌产生生存竞争。而且,内生菌能在植物体内存活而不对寄主植物产生明显不利影响,在长期的协同进化过程中,与植物形成了互利互惠的关系。它们可以与病原菌竞争生长位置、营养物质和微量元素,一些内生菌可以通过产生抗生素或其它活性物质直接杀死病原菌或通过促进寄主植物的生长或诱发免疫反应来间接提高植物抗病性[12],如内生弗氏链霉菌CNS-42可以防治黄瓜病害[13],内生易变链霉菌CA-2和内生蓝褐链霉菌AA-2可以同时防治番茄病害和促进番茄的生 长[14],黄瓜根部的内生螺旋链霉菌可以防治黄瓜幼苗腐烂并且促进黄瓜生长[15]。但是,有关内生放线菌用于稻瘟病生物防治的报道几乎没有。
本文从湖南省浏阳市湖南亚华种业科学研究院大围山稻瘟病防治基地种植的生长11周的谷梅 4号水稻中分离出117株内生放线菌,筛选出一株对稻瘟病病原菌拮抗性最强的菌株OsiRt-1,对该菌株同时进行了体内和体外抗病试验,尤其针对其在大田复杂条件下的控病效果开展了研究。同时,对该菌株的形态特征、培养特征、生理生化特征和16S rRNA基因序列进行鉴定,并分析其与生防相关的次级代谢产物,为进一步深入了解该放线菌抗病机制及微生物新农药的开发利用提供依据。
1 材料与方法 1.1 材料1.1.1 培养基: (1) 放线菌分离培养基:HV培养基[16];MS培养基(g/L):甘露醇20,大豆粉20,琼脂20;TWYE培养基[16];WA培养基(g/L):琼脂18。(2) 放线菌保存和培养采用PDA培养 基[13]。(3) 基础发酵采用ISP2培养基[17]。(4) 平板对峙法采用PDA培养基;形态学和培养特征观察培养基:ISP2、ISP3、ISP4[17]和PDA培养基。
1.1.2 供试病原真菌: 稻瘟病菌生理小种梨孢霉菌RB3和62来自隆平高科湖南亚华种业科学研究院;Guy11来自湖南省农业科学院。
1.2 方法1.2.1 水稻内生放线菌的分离: 从湖南亚华种业科学研究院浏阳大围山稻瘟病防治基地实验大田(22.54′30′′N,103.41′44′′E)采集生长11周的谷梅 4号水稻,用清水洗净,室温放置过夜干燥后,分成根、茎、叶和鞘4个组织分别进行表面消毒[18],验证表面消毒彻底后[19],剪成1 cm左右的小段,置于4种添加有50 mg/L苯菌灵和20 mg/L萘啶酸分离培养基上,总计上样1 800个组织,分别在27 °C及37 °C的温度下培养至8周左右。将析出的放线菌转移到half-PDA培养基(g/L:PDA 19,琼脂18) 中培养,并不断划线培养得到纯培养物。
1.2.2 拮抗放线菌的筛选: 采用平板对峙法,将稻瘟病菌梨孢霉菌生理小种在PDA培养基上28 °C培养7 d后,加入200 μL的稻瘟病菌孢子液 (108 cfu/mL)于PDA培养基平板中央的牛津杯中,在距离培养皿中心30 mm处接种活化好的放线菌,每个处理重复3次,以不接待测放线菌为对照,置于28 °C培养,10 d后观察实验结果。测量真菌菌落直径并计算真菌菌丝生长抑制率。真菌菌丝生长抑制率按照下式计算:真菌菌丝生长抑制率=[1−(实验组真菌菌丝生长直径平均数/对照组真菌菌丝生长直径平均数)]×100%。
1.2.3 体外拮抗效果测定:(1) 采集对峙平板的拮抗带边缘真菌菌丝,在环境扫描电镜(SEM)下观察放线菌对稻瘟病菌菌丝的影响。(2) 用菌丝生长速率法检测无菌滤液拮抗性能:将对数生长期菌体悬浮液(108 CFU/mL)按照0.5%的接种量接种到ISP2液体培养基中,28 °C、180 r/min条件下振荡培养,分别在接种后第1、2、3、4、5、7、9、11、13、15天取出。取出的发酵液于8 000 r/min离心20 min,上清液用0.45 μm的微孔滤膜过滤后按照10% (体积比)的比例加入到已经融化的PDA培养基混合倒板,以添加等量ISP2培养基的PDA平板为对照,每个处理3个重复。加入200 μL的稻瘟病菌孢子液(108 CFU/mL)于PDA培养基平板中央的牛津杯中,28 °C培养10 d,测量菌落直径,并计算菌丝生长的相对抑制率。抑制率=(对照菌落直径−处理菌落直径)/对照菌落直径×100%。(3) 对滤液中拮抗物质蛋白酶K稳定性检测:将蛋白酶K (终浓度为0.1 g/L)加入拮抗菌培养6 d的发酵滤液,37 °C水浴处理1 h后,按照10% (体积比)的比例加入到融化的PDA培养基与之混合,制备含有蛋白酶K处理的发酵滤液平板,以添加等量发酵滤液的PDA平板和等量ISP2的PDA平板为对照,每个处理3个重复。同上用菌丝生长速率法检测其拮抗性能。(4) 挥发性拮抗物质检测:将直径 90 mm的PDA培养基平均分成4份,将对立的两个部分培养基去掉,在剩下的一部分培养基中央接种拮抗菌菌株,以不接拮抗菌株的为对照,每个处理3个重复。加入200 μL的稻瘟病菌孢子液(108 CFU/mL)于PDA培养基平板中央的牛津杯中,28 °C培养10 d,测量菌落直径。
1.2.4 拮抗菌的大田防病效果测定: 将发芽的湘矮早7号水稻种子播种于大田,并在田间周围种上已经感染稻瘟病的水稻幼苗。实验水稻幼苗分别进行两种处理:(1) 空白组:不做任何处理;(2) 处理组:在水稻生长的第10、20、50和80天向水稻叶面喷洒浓度为106−107 CFU/mL的拮抗菌孢子液;每个实验组做3块田平行。在水稻生长的第 30天,从每个实验组的每块田随机采集100个水稻叶片,观察并统计实验组苗瘟的发病情况。将取回的水稻进行表面消毒,参照1.2.1的方法,进行内生放线菌的分离和统计。在水稻生长的第110天从每个实验组的每块田随机采集100株水稻,观察并统计实验组穗瘟的发病情况。并进行内生放线菌的分离,将分离出的放线菌在不同培养基上的形态学特征与喷洒菌株比对,对不能确定是否为喷洒菌株的放线菌进一步进行16S rRNA基因序列鉴定,统计得出喷洒菌株的分离率。按照《稻瘟病检测调查规范中华人民共和国国家标准》来统计各病穗(株、叶)发病程度和病情指数。发病程度是感
染病斑的面积占整个叶片面积的百分比。病情指数=[∑(各级发病程度×各级发病程度的叶片数)/(最高发病程度×调查的总叶片数)]×100%;损失率(%)=[各级病穗(株、叶)数×各级损失率/调查总穗 数×最高级损失率]×100;防治效果(%)=[(对照的病情指数−防治的病情指数)/对照的病情指数]×100。分离率(%)=(根、地上部分)喷洒菌株析出数 量/(根、地上部分)放线菌析出数量×100。
1.2.5 拮抗菌株的鉴定: (1) 形态特征和培养特征观察:将待测放线菌划线接种于PDA培养基上,采用插片法将灭菌的盖玻片斜插入培养基内,28 °C培养10 d后,小心取出盖玻片在环境扫描电镜下观察菌丝和孢子链的形态特征。根据文献[17]的方法,将菌株分别接种在ISP2、ISP3、ISP4、PDA等培养基上,28 °C培养8−15 d,观察基内菌丝、气生菌丝的生长状况和是否产可溶性色素。(2) 生理生化特征测定:测定菌株牛奶胨化、产酪氨酸酶、黑色素、碳源利用、温度生长范围及对NaCl的耐受度等生理生化特征[17, 20]。(3) 分子生物学鉴定:基因组DNA按照上海GENEray公司细菌DNA全基因组提取试剂盒说明提取。以提取的DNA为模板,分别以引物27F (5′-AGAGTTT GATCCTGGCTCAG-3′)和765R (5′-CTGTTTGCTC CCCACGCTTTC-3′),引物704F (5′-GTAGCGGTG AAATGCCTAGA-3′)和1492R (5′-GGTTACCTTGT TACGACTT-3′)来扩增16S rRNA基因。扩增体系 (25 μL):模板(80 mg/L) 1 μL,上下游引物 (10 μmol/L)各0.5 μL,2×PCR Master Mix 12.5 μL,ddH2O 10.5 μL。扩增条件:95 °C 5 min;94 °C 1 min,54 °C 1 min,72 °C 1.5 min,30个循环;72 °C 10 min。测序由上海铂尚生物技术公司完成。所得的16S rRNA基因序列与GenBank数据库中的已知序列进行BLAST比对分析,采用 Clustalx 1.8软件和MEGA 5.1构建系统进化树。
1.2.6 拮抗菌产酶及代谢物的测定: (1) 几丁质酶活性检测参照文献[21]。(2) 纤维素酶、蛋白酶、HCN、铁载体和IAA活性检测参照文献[22]。(3) ACC脱氨酶活性检测:将20 μL菌株孢子液 (108 CFU/mL)接种于含3 mmol/L ACC的DF液体培养基[23],30 °C、150 r/min培养7 d,若此菌株能够在唯一氮源为ACC的DF培养基中连续传代3次以后还生长,则为产ACC脱氨酶阳性菌,否则为阴性菌。(4) 溶磷能力检测参照文献[24]。
1.2.7 聚酮合酶PKS 及非核糖体多肽合成酶NRPS 基因的扩增: 参照文献[25]选择引物,分别对PKSⅡ和NRPS基因进行PCR克隆,PKSⅡ引物为:5′-TSGCSTGCTTGGAYGCSATC-3′和5′-TGG AANCCGCCGAABCCGCT-3′;NRPS引物为:5′-GCSTACSYSATSTACACSTCSGG-3′和5′-SASG TCVCCSGTSCGCTAS-3′。PCR反应体系同 16S rRNA基因。扩增条件:94 °C 5 min;94 °C 30 s,57 °C 30 s,72 °C 1 min,30个循环;72 °C 10 min。
2 结果与分析 2.1 内生放线菌的分离与拮抗菌株筛选通过表面消毒结合4种分离培养基(HV、MS、TWYE、WA),从生长11周的谷梅4号水稻的1 800个组织样品中,分离出了117株水稻内生放线菌,通过对这些放线菌与稻瘟病菌RB3的平板对峙实验,筛选得到8株有拮抗特性的内生放线菌,再进一步采用3个稻瘟病菌生理小种RB3、Guy11和62进行复筛实验,最后得到一株对稻瘟病菌有较强的抑制作用的内生放线菌。这株菌分离自水稻根部,WA培养基28 °C培养,命名为OsiRt-1。OsiRt-1与RB3的平板对峙实验结果见 图 1A,它对不同稻瘟病菌的生理小种的抑菌率如图 1C所示。
|
| 图 1 OsiRt-1 对稻瘟病菌的拮抗效果 Figure 1 Antagonism of OsiRt-1 against M. oryzae A:在PDA培养基上生长的稻瘟病菌RB3和OsiRt-1处理的稻瘟菌病菌RB3,培养10 d;B:扫描电镜下稻瘟病菌RB3菌丝和OsiRt-1处理下的稻瘟病菌RB3菌丝;C:OsiRt-1对 3种稻瘟病菌RB3、Guy11、62的抑菌率. A: M. oryzae RB3 grown on PDA was not exposed or exposed to OsiRt-1; B: The corresponding hyphae structure observed by scanning electron microscopy; C: Inhibition percentage of three different physiological races of M. oryzae (RB3,Guy11 and 62) by OsiRt-1. Error bars indicate standard error. |
|
|
为了进一步验证OsiRt-1对稻瘟病菌的生长抑制能力,通过环境扫描电镜对稻瘟病菌菌丝形态结构进行了观察。如图 1B所示,对照组稻瘟病菌菌丝光滑,用OsiRt-1处理的稻瘟病菌菌丝则发生一系列的畸形变化,包括细胞壁皱缩、细胞膨胀。
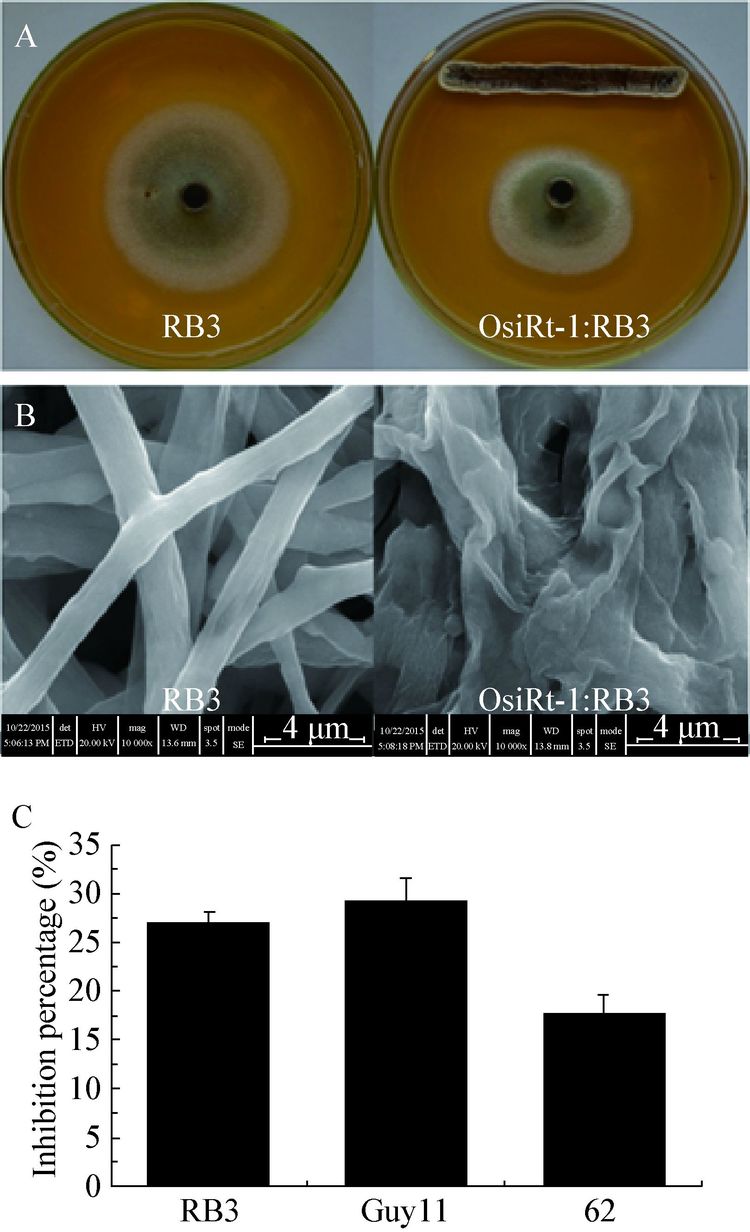
进一步分离获得OsiRt-1的发酵滤液,发现其同样可以抑制稻瘟病菌生长。如图 2所示,随着培养时间增加其抑菌效果逐渐增大,当菌株生长量最大时,其发酵滤液的抑菌率最大。另外,我们也发现添加蛋白酶K的滤液和对照在抑菌率上基本没有差别,它们的抑菌率分别为10.56%±0.48%,9.77%±0.76%,无显著性差异,表明OsiRt-1发酵滤液中的抗菌成分对蛋白酶K处理表现出稳定性。
|
| 图 2 OsiRt-1 不同培养时间下的生长和抑菌活性 Figure 2 Growth condition of OsiRt-1 at different incubation time and its antifungal activity |
|
|
挥发性拮抗物质检测实验中,OsiRt-1处理和对照菌落直径分别为27.50±1.48 cm和27.46±1.51 cm,无显著性差异,表明OsiRt-1未产生挥发性拮抗物质。
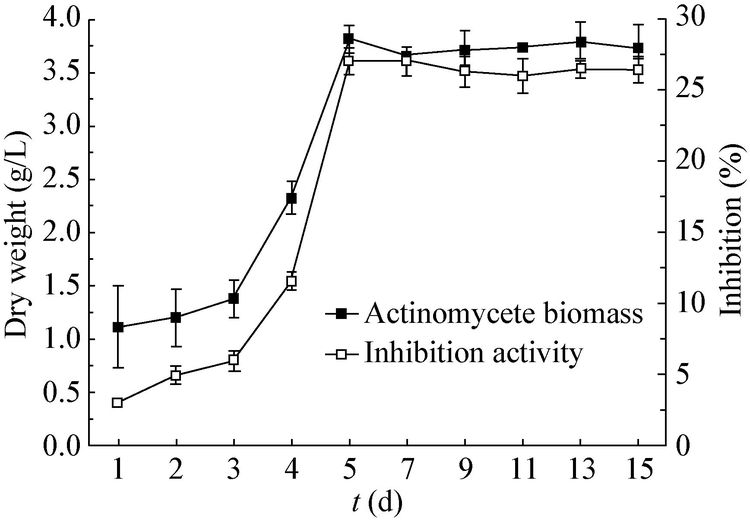
2.3 拮抗菌OsiRt-1 的大田防效在诱发稻瘟病发病的大田生长环境下,在水稻生长至第10、20天喷洒OsiRt-1孢子液,统计生长30 d的水稻发现,与空白组苗瘟病情指数(46.75%)相比,处理组苗瘟病情指数降低了7.76%。同时,处理组的水稻地上部分长度42.90 cm也高于空白组35.75 cm。同时,对水稻中的内生放线菌进行分离,发现不管是在根部、还是地上部分,处理组OsiRt-1的分离率(70.00%,81.08%)均高于空白组(44.44%,33.33%) (图 3)。
|
| 图 3 OsiRt-1 对水稻稻瘟病苗瘟的田间防治效果 Figure 3 The control efficiency of OsiRt-1 on seedling blast in field A:播种30 d,处理和未处理OsiRt-1的水稻苗瘟的病情指数;B:水稻根部和地上部分分离获得OsiRt-1菌株数占分离总放线菌的比例. Control:未处理水稻;Treatment:在水稻播种后10、20 d向水稻叶面喷洒OsiRt-1孢子液. A: Disease index of seedling blast at 30 d after sowing; B: The rate of OsiRt-1 in actinomycetes isolated from root and above-ground portion of 30 d rice. Control: Rice was not treated with OsiRt-1; Treatment: OsiRt-1 spore suspensions were sprayed on the leaf of rice at 10 and 20 d. The error bars are the standard errors. |
|
|
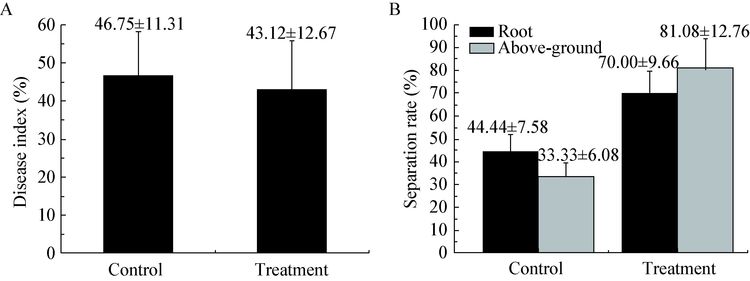
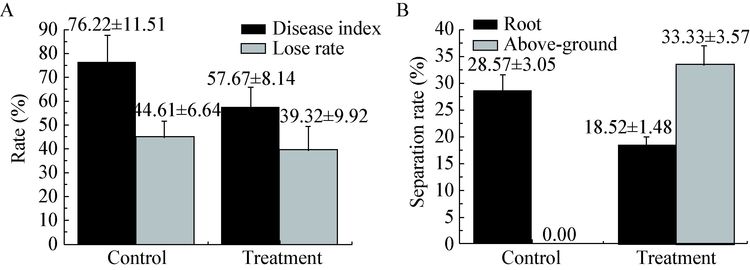
OsiRt-1菌株对水稻穗瘟的防治效果更好,统计生长110 d的水稻,结果如图 4所示,处理组的病情指数56.67%明显低于空白组76.22%,同时,与空白组种子损失率(44.61%)相比,处理组的种子损失率降低了17.46%。水稻中内生放线菌分离试验表明,虽然处理组OsiRt-1根部分离率(18.52%)略低于空白组(28.57%),但地上部分分离率33.33%明显高于空白组(0) (图 4)。
|
| 图 4 OsiRt-1 对水稻稻瘟病穗瘟的防治效果 Figure 4 The control efficiency of OsiRt-1 on panicle blast in field A:播种110 d,处理和未处理OsiRt-1水稻穗瘟的发病率和种子损失率;B:水稻根部和地上部分分离获得OsiRt-1菌株数占分离总放线菌的比例. Control:未处理水稻;Treatment:在水稻播种10、20、50和80 d向水稻叶面喷洒OsiRt-1孢子液. A: Disease index of panicle blast and lose rate at 110 d after sowing; B: The rate of OsiRt-1 in actinomycetes isolated from root and above-ground portion of 110 d rice. Control: Rice was not treated with OsiRt-1; Treatment: OsiRt-1 spore suspensions were sprayed on the leaf of rice at 10,20,50 and 80 d. The error bars are the standard errors. |
|
|
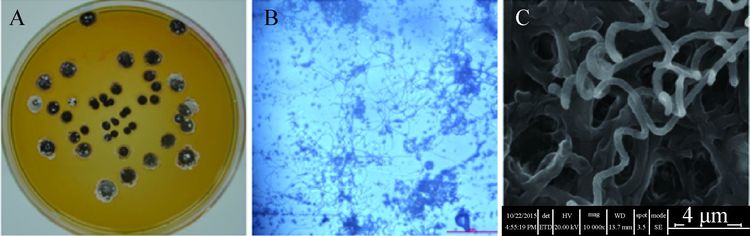
菌株OsiRt-1在PDA培养基上具有典型的链霉菌属的特征,培养14 d后,菌落呈圆形,直径 7−8 mm,无可溶性色素产生(图 5A)。气生菌丝生长丰茂,分枝较多,呈树枝状(图 5B),孢子链 2−5圈螺旋,孢子长圆形,表面光滑(图 5C)。在PDA、ISP2等部分培养基上气生菌丝生长旺盛,初期白色,后期棕黄至黑褐色(表 1)。
|
| 图 5 OsiRt-1 菌落、气生菌丝及孢子链的形态特征 Figure 5 Morphology of colony,aerial mycelium and spore chains of OsiRt-1 在PDA培养基上培养14 d的OsiRt-1. A:单菌落;B:气生菌丝;C:孢子链. OsiRt-1 grown on PDA plate for 14 days. A: Colony; B: Aerial mycelium; C: Spore chains. |
|
|
| 培养基 Culture medium | OsiRt-1 | 模式菌株 Streptomyces misionensis S1-SC15 |
| ISP2 Aerial mycelium Substrate mycelium Soluble pigment | Black brown Brownish yellow None | Grey brown Brownish yellow None |
| ISP3 Aerial mycelium Substrate mycelium Soluble pigment | Black brown Black brown None | Terra brown Olive brown None |
| ISP4 Aerial mycelium Substrate mycelium Soluble pigment | Yellow-orange Lvory white None | Red brown Grayish yellow None |
| PDA Aerial mycelium Substrate mycelium Soluble pigment | Black brown Yellow None | Grey brown Grey yellow None |
对OsiRt-1的生理生化指标检测发现,菌株OsiRt-1不能产生酪氨酸酶、黑色素,可以利用葡萄糖、阿拉伯糖、木糖、果糖、甘露醇,不利用蔗糖、肌醇、鼠李糖、棉子糖。另外,OsiRt-1在超过45 °C不能生长,最适生长温度为25−40 °C。同时,0.5%的NaCl最适于OsiRt-1的生长,而5% 以上的NaCl不利于生长(表 2)。
| 生理生化特征 Characteristic | OsiRt-1 | 模式菌株 Streptomyces misionensis S1-SC15 |
| Producion of Tyrosinase Melanin |
-
- |
-
- |
| Carbon source utilization Glucose Arabinose Xylose Fructose Mannitol |
+
+ + + + |
+
+ + + + |
| Sucrose Rhamnose Inositol Melitriose Growth at (°C) 20 25−40 45 Growth in NaCl (%,w/v) 0−10 0.5 |
-
- - - + ++ - + ++ |
-
- - - + ++ + + + |
| 注:++:较强利用;+:可利用;−:不利用. | ||
| Note: ++: strong positive utilization; +: positive utilization; −: Negative utilization. | ||
将菌株OsiRt-1克隆出的16S rRNA基因 1 493个碱基序列(登录号:KU321340) 与GenBank中相关序列BLAST比对分析显示,该放线菌与数据库中链霉菌大多数菌株序列亲缘性大于97%,与米修链霉菌(Streptomyces misionensis)序列相似性达99%。用链霉菌属中相近序列构建系统进化树见图 6。结合上述形态学、生理生化特征分析结果,可以鉴定OsiRt-1属于米修链霉菌。

|
| 图 6 构建OsiRt-1 的16S rRNA 基因系统发育树 Figure 6 Phylogenetic tree of OsiRt-1 16S rRNA gene sequences 分支点上的数字表示构建系统树时1 000 次计算时形成该节点的百分比;括号内数值为GenBank登录号;标尺或刻度0.002代表 0.2%的16S rRNA基因序列的进化差异. The bootstrap values (%) presented at the branches were calculated from 1 000 replications; Numbers in parentheses are GenBank accession numbers; The scale bar 0.002 represents 2 nucleotide substitutions per 1 000 nucleotides. |
|
|
为了了解OsiRt-1的抗病机制,对OsiRt-1的产酶及次级代谢能力进行了分析(表 3)。OsiRt-1在酪蛋白和纤维素的培养基上,菌体周围均能产生清晰的透明圈,表明OsiRt-1可以产生降解真菌细胞壁的蛋白酶和纤维素酶。OsiRt-1可使CAS培养基由蓝色变为淡橙色,表明它可以分泌铁载体。几丁质酶作为一种重要的降解真菌细胞壁的酶,HCN可诱导植物产生抗性,但在OsiRt-1的次级代谢物中并没有检测到。
| 酶和次级代谢产物 Enzymes and secondary metabolites | OsiRt-1 |
| Chitinase | − |
| Cellulase | + |
| Protease | + |
| ACC deaminase | + |
| Siderophore | + |
| IAA | + |
| HCN | − |
| Phosphate solubilization | − |
| 注:+:阳性;−:阴性. | |
| Note: +: positive; −: negative. | |
OsiRt-1菌液上清可使Salkowski’s试剂显红色,说明菌株OsiRt-1可产生植物激素IAA。OsiRt-1连续传代3次以后还能够在唯一氮源为ACC的DF培养基中生长,说明菌株OsiRt-1可以产ACC脱氨酶,后者降解乙烯合成前体物质来降低宿主植物内乙烯的含量,从而间接促进植物的生长。某些微生物还能分泌有机酸,使不溶性磷转化为可溶性磷,有利于植物生长,然而,我们并未检测到OsiRt-1的溶磷作用。
以OsiRt-1的基因组DNA为模板,用聚酮合酶基因(PKS)和非核糖体多肽合成酶基因(NRPS)特异性引物进行扩增,并进行测序,所得的序列与GenBank数据库中的已知序列进行BLAST比对分析验证,结果显示,OsiRt-1呈现PKSⅡ型和NRPS基因阳性。
3 讨论目前,稻瘟病是我国水稻产区的重要病害之一。已有研究表明内生放线菌在植物真菌病害防治中具有极大的潜力[27],但是尚未有内生放线菌防治稻瘟病的报道,提示这是一种有待开发的生防资源。为此,本研究从生长11周的水稻中分离出 117株内生放线菌,从中筛选获得一株对稻瘟病菌拮抗效果强的放线菌Streptomyces misionensis OsiRt-1。
大田环境复杂,难以取得与实验室条件下一致的抗病效果[28]。为此,我们在自然条件下,通过大田实验来检测OsiRt-1对稻瘟病的防治效果。结果发现,OsiRt-1对水稻苗瘟和穗瘟的防治上均有较好的效果,特别是穗瘟,病情指数降低了25.65%,损失率降低了17.46%。目前,有关同时在实验室和大田条件下对稻瘟病防治的研究少有报道[28],而且已有报道大多针对苗瘟,链霉菌263在温室条件下对稻瘟苗瘟有较好的控制效果[29],因此,我们的大田穗瘟实验非常难得。最近报道显示,一种抗生素灰黄霉素在温室条件下对穗瘟防效达53.79%[30]。尽管我们穗瘟防效略低于报道,但我们的实验在大田环境,且仅仅使用放线菌孢子液喷洒,若是进一步改善制剂可能会提高OsiRt-1的防治效果。此外,我们注意到OsiRt-1对穗瘟的防治效果明显优于苗瘟,这可能是由于OsiRt-1是分离于生长11周的水稻,较苗期比更能稳定生存于生殖生长期水稻,故抽穗期喷洒可能更利于OsiRt-1进入水稻发挥作用。另外,苗期和抽穗期处理水稻后,OsiRt-1地上部分分离率(81.08%,33.33%)较高,超过未处理水稻(33.33%,0.00%),表明喷洒OsiRt-1,它可能通过竞争作用,占据水稻内生态位,阻止病原菌的侵入,产生抗病效应。
我们检测到OsiRt-1可产生一系列酶、次级代谢物和植物促生长剂,推测其对抗稻瘟病存在多种机制。首先,扫描电镜结果表明,OsiRt-1可引起稻瘟病菌菌丝形态畸形(图 3)。据报道,拮抗菌可通过分泌一些降解真菌细胞壁的酶类,如几丁质酶、纤维素酶和蛋白酶导致病原菌菌丝的变形[31]。我们未检测出有几丁质酶的产生,但OsiRt-1分泌了纤维素酶和蛋白酶。虽然蛋白酶K处理发酵滤液不影响其拮抗活性,表明其拮抗成分不可能是几丁质酶等水解酶类,但某些纤维素酶类也能抵抗蛋白酶K是否是由其分泌了纤维素酶和蛋白酶导致对菌丝的抑制,还有待进一步确认。其次,OsiRt-1具有IAA和ACC脱氨酶活性,产生铁载体,有报道显示,放线菌可通过释放这些物质促进植物生长[13],我们在大田的确发现,OsiRt-1处理组水稻的长度高于空白组,证明OsiRt-1所产生的这些植物促生长剂很有可能发挥一定的作用,间接提高了植物抗病性。最后,链霉菌是主要的抗生素产生菌,可以保护植物免于病原菌侵染[32]。据报道,米修链霉菌可产生一种五烯抗真菌抗生素米修菌素[33]。PKS和NRPS基因是一类能编码聚酮合酶和多肽类生物活性物质,如抗生素类的基因[25]。OsiRt-1的PKSⅡ型和NRPS基因扩增阳性结果表明,OsiRt-1可能能分泌一些抗生素和其它次级代谢物。
OsiRt-1经过形态学,生理生化和分子生物学特性分析,鉴定为米修链霉菌Streptomyces misionensis。该种属的菌株用于生物防治上有过一定报道,但仅限于柑橘果实采后病害,百合苗枯病和百合枯萎病[7, 34]。因此,利用水稻内生米修链霉菌在水稻体内和体外抗病方面的研究属于首次报道。OsiRt-1在防治水稻稻瘟病的农业应用上,具有较好的开发潜力。
| [1] | Pooja K, Katoch A. Past, present and future of rice blast management[J]. Plant Science Today, 2014, 1 (3): 165–173. |
| [2] | Kunova A, Pizzatti C, Cortesi P. Impact of tricyclazole and azoxystrobin on growth, sporulation and secondary infection of the rice blast fungus, Magnaporthe oryzae[J]. Pest Management Science, 2013, 69 (2): 278–284. |
| [3] | Chuma I, Isobe C, Hotta Y, et al. Multiple translocation of the AVR-Pita effector gene among chromosomes of the rice blast fungus Magnaporthe oryzae and related species[J]. PLoS Pathogens, 2011, 7 (7): e1002147. |
| [4] | Miah G, Rafii MY, Ismail MR, et al. Blast resistance in rice: a review of conventional breeding to molecular approaches[J]. Molecular Biology Reports, 2013, 40 (3): 2369–2388. |
| [5] | Hyakumachi M, Takahashi H, Matsubara Y, et al. Recent studies on biological control of plant diseases in Japan[J]. Journal of General Plant Pathology, 2014, 80 (4): 287–302. |
| [6] | Boukaew S, Chuenchit S, Petcharat V. Evaluation of Streptomyces spp| for biological control of Sclerotium root and stem rot and Ralstonia wilt of chili pepper[J]. Biocontrol, 2011, 56 (3): 365–374. |
| [7] | Chung WC, Wu RS, Hsu CP, et al. Application of antagonistic rhizobacteria for control of Fusarium seedling blight and basal rot of lily[J]. Australasian Plant Pathology, 2011, 40 (3): 269–276. |
| [8] | VanHop D, PhuongHoa PT, Quang ND, et al. Biological control of Xanthomonas oryzae pv. Oryzae causing rice bacterial blight disease by Streptomyces toxytricini VN08-A-12, isolated from soil and leaf-litter samples in Vietnam[J]. Biocontrol Science, 2014, 19 (3): 103–111. |
| [9] | Kobayashi YO, Kobayashi A, Maeda M, et al. Biological control of potato scab and antibiosis by antagonistic Streptomyces sp| WoRs-501[J]. Journal of General Plant Pathology, 2015, 81 (6): 439–448. |
| [10] | Li QL, Jiang YH, Ning P, et al. Suppression of Magnaporthe oryzae by culture filtrates of Streptomyces globisporus JK-1[J]. Biological Control, 2011, 58 (2): 139–148. |
| [11] | Hardoim PR, van Overbeek LS, Berg G, et al. The hidden world within plants: ecological and evolutionary considerations for defining functioning of microbial endophytes[J]. Microbiology and Molecular Biology Reviews, 2015, 79 (3): 293–320. |
| [12] | Reinhold-Hurek B, Hurek T. Living inside plants: bacterial endophytes[J]. Current Opinion in Plant Biology, 2011, 14 (4): 435–443. |
| [13] | Li XL, Huang P, Wang Q, et al. Staurosporine from the endophytic Streptomyces sp| strain CNS-42 acts as a potential biocontrol agent and growth elicitor in cucumber[J]. Antonie van Leeuwenhoek, 2014, 106 (3): 515–525. |
| [14] | Goudjal Y, Toumatia O, Yekkour A, et al. Biocontrol of Rhizoctonia solani damping-off and promotion of tomato plant growth by endophytic actinomycetes isolated from native plants of Algerian Sahara[J]. Microbiological Research, 2014, 169 (1): 59–65. |
| [15] | El-Tarabily KA, Nassar AH, Hardy GSJ, et al. Plant growth promotion and biological control of Pythium aphanidermatum, a pathogen of cucumber, by endophytic actinomycetes[J]. Journal of Applied Microbiology, 2009, 106 (1): 13–26. |
| [16] | Coombs JT, Franco CMM. Isolation and identification of actinobacteria from surface-sterilized wheat roots[J]. Applied and Environmental Microbiology, 2003, 69 (9): 5603–5608. |
| [17] | Shirling EB, Gottlieb D. Methods for characterization of Streptomyces species[J]. International Journal of Systematic and Evolutionary Microbiology, 1966, 16 (3): 313–340. |
| [18] | Xiong XQ, Liao HD, Ma JS, et al. Isolation of a rice endophytic bacterium, Pantoea sp| Sd-1, with ligninolytic activity and characterization of its rice straw degradation ability[J]. Letters in Applied Microbiology, 2014, 58 (2): 123–129. |
| [19] | Kaewkla O, Franco CMM. Rational approaches to improving the isolation of endophytic actinobacteria from Australian native trees[J]. Microbial Ecology, 2013, 65 (2): 384–393. |
| [20] | Williams ST, Goodfellow M, Alderson G, et al. Numerical classification of Streptomyces and related genera[J]. Journal of General Microbiology, 1983, 129 (6): 1743–1813. |
| [21] | Agrawal T, Kotasthane AS. Chitinolytic assay of indigenous Trichoderma isolates collected from different geographical locations of Chhattisgarh in central India[J]. SpringerPlus, 2012, 1 (1): 73. |
| [22] | Gopalakrishnan S, Pande S, Sharma M, et al. Evaluation of actinomycete isolates obtained from herbal vermicompost for the biological control of Fusarium wilt of chickpea[J]. Crop Protection, 2011, 30 (8): 1070–1078. |
| [23] | Penrose DM, Glick BR. Methods for isolating and characterizing ACC deaminase-containing plant growth-promoting rhizobacteria[J]. Physiologia Plantarum, 2003, 118 (1): 10–15. |
| [24] | Nautiyal CS. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms[J]. FEMS Microbiology Letters, 1999, 170 (1): 265–270. |
| [25] | Ayuso-Sacido A, Genilloud O. New PCR primers for the screening of NRPS and PKS-I systems in actinomycetes: detection and distribution of these biosynthetic gene sequences in major taxonomic groups[J]. Microbial Ecology, 2005, 49 (1): 10–24. |
| [26] | Cercos AP, Eilberg BL, Goyena JG, et al. Misionina: antibiotico polienico producido por Streptomyces misionensis n. sp|[J]. Revista de Investigaciones Agricolas, 1962, 17 : 5–27. |
| [27] | Qin S, Li J, Chen HH, et al. Isolation, diversity, and antimicrobial activity of rare actinobacteria from medicinal plants of tropical rain forests in Xishuangbanna, China[J]. Applied and Environmental Microbiology, 2009, 75 (19): 6176–6186. |
| [28] | Yuan WM, Crawford DL. Characterization of streptomyces lydicus WYEC108 as a potential biocontrol agent against fungal root and seed rots[J]. Applied and Environmental Microbiology, 1995, 61 (8): 3119–3128. |
| [29] | Zarandi ME, Bonjar GS, Dehkaei FP, et al. Biological control of rice blast (Magnaporthe oryzae) by use of Streptomyces sindeneusis isolate 263 in greenhouse[J]. American Journal of Applied Sciences, 2009, 6 (1): 194–199. |
| [30] | Zhang CN, Huang MJ, Mao N. The control effect of griseofulvin on Magnaporthe grisea[J]. Chinese Agricultural Science Bulletin, 2015, 31 (4): 190–194. (in chinese) 张传能, 黄铭杰, 毛宁. 灰黄霉素对水稻稻瘟病菌的防治效果研究[J]. 中国农学通报, 2015, 31 (4):190–194. |
| [31] | Prapagdee B, Kuekulvong C, Mongkolsuk S. Antifungal potential of extracellular metabolites produced by Streptomyces hygroscopicus against phytopathogenic fungi[J]. International Journal of Biological Sciences, 2008, 4 (5): 330–337. |
| [32] | Palaniyandi SA, Yang SH, Zhang LX, et al. Effects of actinobacteria on plant disease suppression and growth promotion[J]. Applied Microbiology and Biotechnology, 2013, 97 (22): 9621–9636. |
| [33] | Shirling EB, Gottlieb D. Cooperative description of type cultures of Streptomyces. IV. Species descriptions from the second, third and fourth studies[J]. International Journal of Systematic and Evolutionary Microbiology, 1969, 19 (4): 391–512. |
| [34] | Lu LM, Du DC, Cheng BP, et al. Isolation and identification of marine actinomyces A3202 and its control efficacy against postharvest citrus diseases[J]. Acat Phytophylacica Sinica, 2014, 41 (3): 327–334. (in chinese) 鹿连明, 杜丹超, 程保平, 等. 海洋放线菌A3202的分离鉴定及其对柑橘采后病害的防效[J]. 植物保护学报, 2014, 41 (3):327–334. |
 2016, Vol. 43
2016, Vol. 43