扩展功能
文章信息
- 赵萍, 夏文旭, 郭健, 雷晨瑶, 王聪, 肖宇轩, 丁毛毛, 王雅
- ZHAO Ping, XIA Wen-Xu, GUO Jian, LEI Chen-Yao, WANG Cong, XIAO Yu-Xuan, DING Mao-Mao, WANG Ya
- 一株玉米秸秆纤维素分解菌株的分离鉴定及酶学性质
- Isolation, identification of a strain decomposing corn stalk and characterization of its cellulose
- 微生物学通报, 2016, 43(5): 991-997
- Microbiology China, 2016, 43(5): 991-997
- DOI: 10.13344/j.microbiol.china.150863
-
文章历史
- 收稿日期: 2015-11-02
- 接受日期: 2016-02-23
- 优先数字出版日期(www.cnki.net): 2016-03-11
我国作为一个农业大国,农作物秸秆的年产量高达8×108多t[1],而大部分秸秆并未得到有效利用,并造成严重的环境污染[2],解决该问题的方案之一则是将秸秆降解为可发酵性糖,并通过发酵将其转化为液体燃料及化工产品[3]。自然界中广泛存在产纤维素酶的微生物,人们利用这些微生物处理一些含纤维素的物质,如污物分解、食品发酵、饲料制作以及用于医药、能源等行业[4-5]。但是,纤维素酶的比活力一般都很低且产酶成本高,因此,筛选纤维素酶比活力高的菌株有着重要的意义。
纤维素酶是一种多组分酶,不同微生物合成的纤维素酶对纤维素的降解能力也不尽相同[6]。木霉属(Trichodermareesei)由其产生的酶系比例协调,对纤维素的降解效果最好,是目前研究应用最广的菌株。此外,许多曲霉属菌株如黑曲霉(Aspergillus niger)等能产生高活力的纤维二糖酶,与木霉菌产生的酶配合使用,具有更好的降解效果[7]。由于纤维素的结晶状和不溶性刚性结构使得酶解效率低,利用成本高,难于实现规模产业化。近年来,国内外对于产纤维素酶菌株筛选的报道虽较多,但大部分研究仍集中在对秸秆的降解上,且降解效果不佳[8]。因此,进一步提高纤维素酶活性,深入研究降解机理,提高降解率是有效利用丰富且廉价的纤维素最佳途径。
本研究通过大量采集堆积落叶枯枝且潮湿霉变腐烂处土样,从土样中分离筛选出能在玉米秸秆无机盐筛选培养基中生长的菌落,进行多次反复筛选及纯化后,最终得到具有高纤维素酶活和木质素酶活的菌株,并与从商品纤维素酶中筛选的菌株对比,研究其纤维素酶特性,以期获得比市场现有的纤维素酶菌株活性更高的菌株,为工业化生产奠定基础。
1 材料与方法 1.1 材料及培养基土样:采自于兰州理工大学甲子坪山长期堆积落叶枯枝且潮湿霉变腐烂处。
玉米秸秆:由甘肃农业大学养殖场提供。玉米秸秆粉碎,过120目筛,备用。
商品纤维素酶菌株(Penicillium spp. CICC40361) :由兰州理工大学生命科学与食品工程实验教学示范中心提供。
玉米秸秆无机盐筛选培养基(g/L)[9]:K2HPO4·3H2O 13.3,KH2PO4 4.0,MgSO4·7H2O 0.2,(NH4)2SO4 0.5,琼脂16.0,蔗糖20.0,秸秆粉4.0,pH 7.0,1×105 Pa灭菌30 min。
纤维素-刚果红培养基(g/L)[10]:羧甲基纤维素钠2.0,(NH4)2SO4 2.0,MgSO4·7H2O 0.5,K2HPO4 1.0,NaCl 0.5,刚果红0.4,琼脂20.0,pH 7.0,1×105 Pa灭菌30 min。
液体培养基(g/L):K2HPO4·3H2O 13.3,KH2PO4 4.0,MgSO4·7H2O 0.2,(NH4)2SO4 0.5,秸秆粉4.0,1×105 Pa灭菌30 min。
DNS显色剂:称取酒石酸钾钠91.00 g溶于500 mL水中,于溶液中依次加入3,5-二硝基水杨酸3.15 g,氢氧化钠20.00 g,加热溶解;再加入重蒸酚2.50 g,无水亚硫酸钠2.50 g,搅拌使之溶解,冷却后定容至1 L,贮于棕色瓶中,放置7 d后使用。
1.2 菌株的分离与纯化称量10 g用四分法处理后的土样,加入装有90 mL无菌水和适量玻璃珠的三角瓶中,室温条件下,120 r/min振荡30 min后静置,取其上清液作为菌悬液母液,梯度浓度稀释,涂布于PDA培养基[9]上,28 °C培养3−5 d,培养期间,将长出的菌丝体或菌落分别接种到玉米秸秆无机盐筛选培养基上,再次28 °C培养3−5 d,将再次长出的菌丝体或菌落转接到玉米秸秆无机盐筛选培养基上,划线分离,纯化菌株至纯种。将分离到的纯种菌株的孢子接种至纤维素-刚果红培养基上,28 °C恒温培养,选择长势最好的一株菌株,标记为:PL2#。
1.3 菌株的生理生化及分子鉴定通过镜检观察菌株PL2#的菌丝及分生孢子形态,并结合《真菌鉴定手册》[11],将PL2#的相应特征与检索表中对比,对PL2#进行形态学的初步分类。
利用ITS rRNA两端的引物NS1 (5′-GTAGTCATATGCTTGTCTC-3′)和NS8 (5′-TC CTCCGCTTATTGATATGC-3′)扩增菌株PL2#的ITS rRNA基因,并进行测序分析。筛选得到的菌株PL2#的PCR扩增及18S rRNA基因序列测序均由英茂盛业测序公司完成。
PCR扩增反应体系:基因组DNA 1.0 µL,10×Buffer (含2.5 mmol/L Mg2+) 2.5 µL,Taq聚合酶(5 U/µL) 0.5 µL,dNTPs (10 mmol/L) 1.0 µL,NS1 (10 µmol/L) 0.5 µL,NS8 (10 µmol/L) 0.5 µL,ddH2O 19 µL。PCR反应参数:95 °C 3 min;95 °C 30 s,55 °C 30 s,72 °C 120 s,35个循环;72 °C 10 min;4 °C终止反应。反应终止后取2 µL PCR产物,1%琼脂糖电泳检测扩增效果。
将测序结果与NCBI (http://blast.ncbi.nlm.nih.gov/Blast.cgi) GenBank数据库进行同源性比对,采用MEGA 6.0软件中的Neighbor-Joining法(自展值1 000) 构建系统进化树,并根据形态学与分子序列特征来确定菌株PL2#的种属。
1.4 菌株的酶活性测定1.4.1 纤维素酶活的测定: 试验采用孢子接种,用无菌水配成每毫升含108个分生孢子的悬浮液,按10% (体积比)的比例加入液体培养基中,28 °C、150 r/min恒温培养。同时做空白和平行对照。以商品纤维素酶菌株P. spp.为对照,将分离获得的菌株PL2#与之对比,进行酶学特性研究。液体培养3、5、7、9、11 d时测定纤维素酶活(CX酶活和FPA酶活),重复3次,所测纤维素酶活减去微生物培养中所得还原糖。
(1) 纤维素酶CX活力单位的测定。取4支15 mL刻度的试管,各加0.2 mL酶液;其中3支作为测定管,各管再加1.8 mL CMC (1%),另一支作空白管,同时加pH 4.8醋酸缓冲液1.8 mL。置50±0.5 °C恒温水浴60 min;然后分别加入DNS显色液2 mL;放沸水浴锅反应10 min,冷却后定容至15 mL,以空白管调零点,在550 nm吸收峰下用分光光度计测OD值。1 mL酶液于50 °C pH 4.8条件下,每分钟水解1% CMC溶液产生1 μg还原糖(以葡萄糖计)的酶量定义为1个CX酶活力单位。
(2) 纤维素酶FPA活力单位的测定。取4支15 mL刻度的试管,各加0.2 mL酶液,再加pH 4.8醋酸缓冲液1.8 mL;其中3支作为测定管,各加1 cm×6 cm滤纸条,充分浸泡置50±0.5 °C恒温水浴60 min;另一支作为空白管同时置50±0.5 °C恒温水浴60 min;然后分别加入DNS显色液2 mL,空白管同时加1 cm×6 cm滤纸条;放沸水浴锅反应10 min,冷却后定容至15 mL,以空白管调零点,在550 nm吸收峰下用分光光度计测OD值。1 mL酶液于50 °C pH 4.8条件下,每分钟水解 1 cm×6 cm的滤纸(FPA)产生1 μg还原糖(以葡萄糖计)的酶量定义为1个FPA酶活力单位。
1.4.2 木质素酶活性的测定[12]: 28 °C恒温培养3、5、7、9、11 d时测定木质素酶活。以下试验做空白对照,3次重复。
(1) Lac活力测定。室温下0.5 mmol/L的ABTS溶液2 mL,加入2 mL酶液启动反应,测定波长在420 nm处吸光值的变化。1个酶活力单位为每分钟1 μmol的ABTS被转化所需的酶量。
(2) LiP活力测定。LiP活力测定中选用的是苯胺蓝(Azure B),反应条件为0.160 mmol/L苯胺蓝500 μL,125 mmol/L pH 3.0的酒石酸钠缓冲液 1 mL,500 μL粗酶液,500 μL 2 mmol/L H2O2,测定波长在651 nm处吸光值的变化。1个酶活力单位为每分钟1 μmol的苯胺蓝(Azure B)被转化所需的酶量。
(3) MnP活力测定。室温下反应体系中 50 mmol/L、pH 4.5的乳酸钠缓冲溶液3.4 mL,1.6 mmol/L的MnSO4水溶液0.1 mL和酶液0.4 mL,加入0.1 mL 1.6 mmol/L的H2O2启动反应,测定波长在240 nm处吸光值的变化。1个酶活力单位为每分钟1 μmol Mn2+被转化所需的酶量。
1.4.3 各因素对菌株PL2# 纤维素酶活力测定的影响: 研究采用CMC为底物,DNS法测定还原糖的生成量。用优化的试验测定条件对CMC底物浓度、反应时间、反应温度、反应pH和显色剂DNS用量加以控制,以它们的影响值对纤维素酶活进行分析,得到最优测定条件[12]。
1.4.4 菌株PL2# 纤维素酶动力学常数Km值的测定: 以1 mL 1% (质量体积比) CMC-Na溶液为底物,加入0.1 mL酶液(500 mL三角瓶装150 mL培养基,按10%接种量,28 °C、150 r/min培养5 d,5 000 r/min离心20 min,弃菌体,上清液即为粗酶液),50 °C恒温60 min,然后加入2.0 mL DNS试剂,沸水浴煮10 min,冷却至室温后定容至5.0 mL,在A550测光吸收,以1 mL酶液每分钟产生1 µg葡萄糖为一个酶活单位(U)[13]。
2 结果与分析 2.1 菌株PL2# 的鉴定2.1.1 PL2#的生理生化特征鉴定结果:对照菌株P. spp. (图 1A)的菌落均呈圆形,有菌丝,中央凸起,无光泽,不透明,直径2−4 mm,菌落呈深绿色;菌株PL2#菌落(图 1B)均呈圆形,有菌丝,中央凸起,无光泽,不透明,直径3−6 mm,菌落呈绿色偏白,明显与对照菌株不同。菌株PL2#的生理生化鉴定结果见表 1。PL2#能利用的碳源为半乳糖、乳糖、果糖、木糖,能在3%−7% NaCl中生长,硝酸盐反应阳性,不能利用柠檬酸盐,不能液化明胶,不是厌氧生长,能水解淀粉。结合镜检,初步确认该株菌株为青霉。

|
| 图 1 菌株PL2#和P. spp.的显微照片(400x,棉蓝染色) Figure 1 The morphology of the strain PL2# and P. spp. (400x,cotton blue staining) A:菌株P. spp.的菌丝分生孢子梗及分生孢子显微照片;B:菌株PL2#的菌丝分生孢子梗及分生孢子显微照片. A: the strain P. spp.; B: the strain PL2#. |
|
|
| 项目 Items | 结果 Results |
| 硝酸盐还原 Nitrate reduction | + |
| 厌氧生长 Anaerobic growth | − |
| 淀粉水解 Starch hydrolysis | + |
| 明胶液化 Gelatin liquefaction | − |
| 柠檬酸盐 Citrate production | − |
| 3% NaCl生长 Growth at 3% NaCl | + |
| 5% NaCl生长 Growth at 5% NaCl | + |
| 7% NaCl生长 Growth at 7% NaCl | + |
| 半乳糖发酵 Galactose fermentation | + |
| 果糖发酵 Fructose fermentation | + |
| 乳糖发酵 Lactose fermentation | + |
| 木糖发酵 Xylose fermentation | + |
| 甘露糖发酵 Mannose fermentation | − |
| 注:+:阳性;−:阴性. | |
| Note: +: Positive reaction; −: Negative reaction. | |
2.1.2 18S rRNA基因鉴定结果: 测序结果得到一条525 bp的序列,将所得序列通过MEGA 6.0软件与GenBank中收录的同源性较高的菌株部分序列进行系统进化树的构建(图 2),最终确定该菌株为羊毛状青霉(Penicillium lanosum)。菌株PL2#的部分序列已提交至GenBank,登录号为JX536388。

|
| 图 2 菌株PL2# 的18S rRNA 基因序列系统发育分析 Figure 2 The analysis of sequence phylogenetic of 18S rRNA gene of strain PL2# Numbers in parentheses represent the sequences accession number in GenBank. Numbers at the nodes indicate the bootstrap values on Neighbor-Joining analysis of 1 000 resampled data sets. Bar (0.1) represents sequence divergence. |
|
|
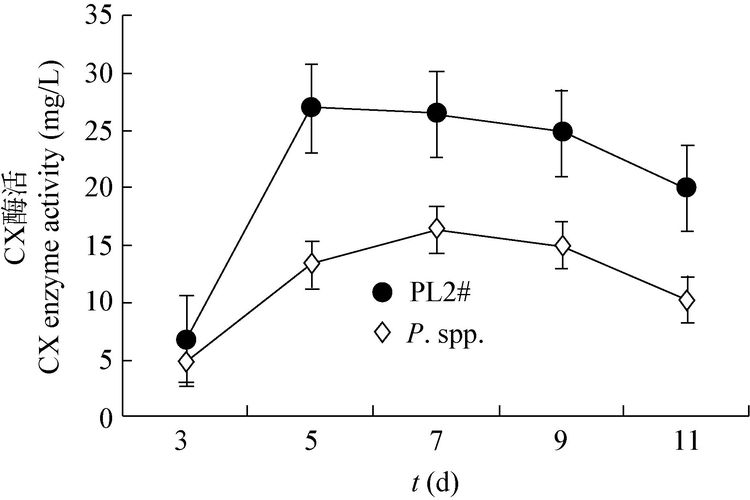
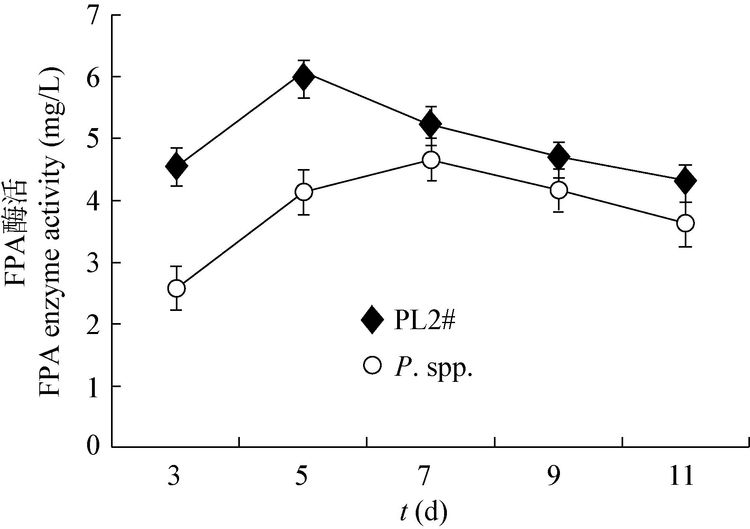
2.2.1 菌株PL2# 的纤维素酶活力: 图 3和图 4分别是菌株PL2#和P. spp.液体培养时的CX酶活力和FPA酶活力随着发酵时间的变化情况。由图 3和4可知,其中菌株PL2#在培养第5天出现最大CX酶活和FPA酶活,分别为27.01 mg/L和5.99 mg/L。对照菌株P. spp.在培养第7天出现最大CX酶活和FPA酶活,分别为16.46 mg/L和5.08 mg/L。由此可知,菌株PL2#的最高纤维素酶活比P. spp.高,分解纤维素能力比P. spp.强。
|
| 图 3 菌株PL2# 和P. spp.的CX 酶活力比较 Figure 3 Comparison of activities of CX enzyme of strain PL2# and P. spp. |
|
|
|
| 图 4 菌株PL2#和P. spp.的FPA 酶活力比较 Figure 4 Comparison of activities of FPA enzyme of strain PL2# and P. spp. |
|
|
2.2.2 菌株PL2# 的木质素酶活力: 通过对菌株PL2#和P. spp.分别进行木质素酶活的测定结果(表 2)可知,菌株PL2#和P. spp.都有木质素酶活,其中Lac酶、LiP酶活和MnP酶活最高的菌株是PL2#。由此可知,菌株PL2#和P. spp.都有木质素分解能力,其中菌株PL2#分解木质素能力相对 较高。
| Time (d) | PL2# | P. spp. | |||||
| Lac | LiP | MnP | Lac | LiP | MnP | ||
| 3 | 1.833 | 1.233 | 1.877 | 0.600 | 0.667 | 0.713 | |
| 5 | 2.433 | 2.633 | 2.100 | 0.700 | 2.533 | 1.167 | |
| 7 | 3.766 | 4.293 | 4.367 | 1.533 | 5.466 | 1.867 | |
| 9 | 2.367 | 11.500 | 3.800 | 1.356 | 10.867 | 0.533 | |
| 11 | 1.957 | 9.239 | 2.851 | 1.087 | 8.663 | 0.457 | |
2.2.3 影响菌株PL2# 纤维素酶活力因素的测定: 由表 3可知,仅改变底物CMC的浓度,在0.50%−1.25%浓度范围内,1%的CMC底物浓度对纤维素酶活的检测最为有利,原因可能是1%的CMC底物浓度恰好能和纤维素酶完全反应;仅改变反应时间,结果60 min时纤维素酶能与CMC底物完全反应,随着反应时间的增加酶活没有显著的提高;仅改变反应温度,结果温度为50 °C时对纤维素酶活的测定最好,温度太低达不到纤维素酶最大反应酶活条件,温度太高可能会使纤维素酶失活;仅改变反应pH,发现pH在4.0−5.5之间对酶活没有明显影响,因此试验采用pH为4.8的测定条件;仅改变DNS添加量时,发现当DNS添加量达到2 mL时酶活最高,随着DNS添加量增加,酶活力值减少,原因可能是2 mL的DNS用量使纤维素酶与底物CMC反应产生的葡萄糖完全显色。
| 各因素 Various factors | 酶活 Enzyme activity (mg/L) | |
| CMC concentration (%) | 1.25 | 25.54 |
| 1.00 | 26.50 | |
| 0.75 | 23.80 | |
| 0.50 | 17.82 | |
| Reaction time (min) | 30 | 20.48 |
| 60 | 26.50 | |
| 90 | 27.20 | |
| 120 | 27.32 | |
| Reaction temperature (°C) | 40 | 18.58 |
| 45 | 23.24 | |
| 50 | 26.50 | |
| 55 | 25.12 | |
| pH | 4.0 | 24.56 |
| 4.5 | 25.20 | |
| 5.0 | 25.82 | |
| 5.5 | 24.96 | |
| DNS (mL) | 1.0 | 16.28 |
| 1.5 | 24.16 | |
| 2.0 | 26.50 | |
| 2.5 | 24.48 |
2.2.4 纤维素酶动力学常数Km值的测定: 将底物(CMC-Na)终浓度分别分别调到0.75、1.00、1.25、1.75、2.25和2.5 g/L,按酶活力测定方法测定还原糖以计算酶反应的初速度。以底物浓度的倒数(1/S)为横坐标,酶反应初速度的倒数(1/V)为纵坐标,作Lineweaver-Burk双倒数图。得线性方程为:y=1.457 4x+4.197 6,可求得米氏常数Km为0.22 g/L,酶最大反应速率Vmax为0.15 mg/(min·mL)。
3 结论与讨论(1) 从土样中筛选得到多株具有纤维素分解能力的菌株,最终确定1株以玉米秸秆粉为碳源且具有较高的纤维素分解能力和一定量的木质素分解能力的菌株PL2#。经生理生化鉴定及PCR测序法测序后,确定菌株PL2#为羊毛状青霉(Penicillium lanosum)。
(2) 将菌株PL2#和对照菌株P. spp.分别接种至液体培养基中,结果发现菌株PL2#能快速生长,并在第5天纤维素酶活最大,而对照菌株P. spp.则在第7天纤维素酶活最大。其原因可能是不同纤维素分解菌对环境的适应和利用率不同,且不同菌株具有不同纤维素酶系和产酶速度。综合比较,在碳源仅为玉米秸秆时,菌株PL2#的纤维素酶和木质素酶活力均高于对照菌株P. spp.,表现出更好的生产性能和应用价值。
(3) 通过优化菌株PL2#的酶活测定条件确定最优测定条件为:1% CMC底物浓度,pH 4.8,50 °C,酶反应时间60 min以及2 mL DNS添加量。
(4) 纤维素分解菌株能将纤维素转化为还原糖,进而发酵生产乙醇等生物能源[14]。木质素分解菌株将木质素分解后是否能增加乙醇的产量,以及在半固态培养中,不同条件下所测的最高酶活是否对工业生产有应用价值,有待进一步的试验研究。
| [1] | Zhang EH, Pan XL, Wang XF, et al. Degradation of corn straw stalk fiber composite bacteria breeding and its enzyme activity[J]. Xinjiang Agricultural Sciences, 2015, 52 (4): 712–717. (in chinese) 张二红, 潘晓亮, 王新峰, 等. 降解玉米秸秆纤维素复合菌的选育及其酶活研究[J]. 新疆农业科学, 2015, 52 (4):712–717. |
| [2] | Zhao FY, Fan NJ, Zhu JC, et al. Isolation and characterization of an efficient cellulose-decomposing strain YN1[J]. Microbiology China, 2010, 37 (4): 496–502. (in chinese) 赵方圆, 范宁杰, 朱建春, 等. 纤维素高效降解菌YN1的筛选及其降解特性[J]. 微生物学通报, 2010, 37 (4):496–502. |
| [3] | Han S, Zhao Y, Song TS, et al. Isolation of cellulose-decomposing strains and analysis of enzymatic characteristics of cellulase[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2013, 22 (4): 172–177. (in chinese) 韩硕, 赵岩, 宋天顺, 等. 纤维素分解菌的筛选和酶学性质分析[J]. 西北农业学报, 2013, 22 (4):172–177. |
| [4] | Qaisar S, Zohra RR, Aman A, et al. Enhanced production of cellulose degrading CMCase by newly isolated strain of Aspergillus versicolor[J]. Carbohydrate Polymers, 2014, 104 : 199–203. |
| [5] | Raghuwanshi S, Deswal D, Karp M, et al. Bioprocessing of enhanced cellulase production from a mutant of Trichoderma asperellum RCK2011 and its application in hydrolysis of cellulose[J]. Fuel, 2014, 124 : 183–189. |
| [6] | Xiong DM, Zhou HL. Research progress in cellulose-degrading bacteria community[J]. Liquor-Making Science & Technology, 2011 (5): 94–97. (in chinese) 熊冬梅, 周红丽. 纤维素降解菌群的研究进展[J]. 酿酒科技, 2011 (5):94–97. |
| [7] | Zhang LY, Wang HH, Pan T, et al. Isolation of cellulase-producting strains and optimization of cellulase-producting conditions[J]. Journal of Cellulose Science and Technology, 2015, 23 (2): 1–7. (in chinese) 张丽影, 汪寒寒, 潘婷, 等. 产纤维素酶菌株的筛选及产酶条件优化[J]. 纤维素科学与技术, 2015, 23 (2):1–7. |
| [8] | Liu QL, Zhang JX, Ge WJ, et al. The Screening and identification of a cellulose degrading fungus and its straw degradating capability[J]. Modern Food Science and Technology, 2014, 30 (6): 82–86. (in chinese) 刘起丽, 张建新, 葛文娇, 等. 一株产纤维素酶真菌的筛选及其对秸秆的降解效果研究[J]. 现代食品科技, 2014, 30 (6):82–86. |
| [9] | Shen P, Fan XR, Li GW. Microbiology Experiment[M]. Beijing: Higher Education Press, 2004: 214 -222. (in chinese) 沈萍, 范秀容, 李广武. 微生物学实验[M]. 北京: 高等教育出版社, 2004: 214 -222. |
| [10] | Zhang YH, Wang J, Zhang W, et al. An improved differential medium for cellulose decomposing microorganisms[J]. Journal of Cellulose Science and Technology, 2004, 12 (1): 33–36. (in chinese) 张宇昊, 王颉, 张伟, 等. 一种改进的纤维素分解菌鉴别培养基[J]. 纤维素科学与技术, 2004, 12 (1):33–36. |
| [11] | Wei JC. Fungal Identification Manual[M]. Shanghai: Shanghai Science and Technology Press, 1979 . (in chinese) 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979 . |
| [12] | Guo J. The separation and purification of strains of cellulose and lignin decomposition[D]. Lanzhou: Master’s Thesis of of Lanzhou University of Technology, 2011 (in Chinese) 郭健. 纤维素和木质素分解菌株的分离筛选及纯化[D]. 兰州: 兰州理工大学硕士学位论文, 2011 |
| [13] | Qian MY, Zhang J, Liu JK, et al. New method for fermenting diluted-acid lignocellulosic hydrolysate to ethanol[J]. Acta Energiae Solaris Sinica, 2006, 27 (6): 618–622. (in chinese) 钱名宇, 张晶, 刘继开, 等. 木质纤维素稀酸水解液乙醇发酵的新方法[J]. 太阳能学报, 2006, 27 (6):618–622. |
| [14] | Fan H, Liang JF, Zhao R, et al. Effect of carbon and nitrogen sources on lignin degradation ability and enzyme activity of dual-cultured, lignin-degrading fungi[J]. Journal of Agro-Environment Science, 2010, 29 (7): 1394–1398. (in chinese) 范寰, 梁军锋, 赵润, 等. 碳氮源对复合木质素降解茵木质素降解能力及相关酶活的影响[J]. 农业环境科学学报, 2010, 29 (7):1394–1398. |
 2016, Vol. 43
2016, Vol. 43