扩展功能
文章信息
- 周叶鸣, 邹晓, 瞿娇娇, 周家喜, 李娟
- ZHOU Ye-Ming, ZOU Jiao-Jiao, QU Jiao-Jiao, ZHOU Jia-Xi, LI Juan
- 一种寄生茶小绿叶蝉蜡蚧菌的鉴定及产孢条件优化
- Identification of a parasitic Lecanicillium of tea lesser leafhopper and optimization of sporulation conditions
- 微生物学通报, 2016, 43(5): 935-941
- Microbiology China, 2016, 43(5): 935-941
- DOI: 10.13344/j.microbiol.china.150697
-
文章历史
- 收稿日期: 2015-09-15
- 接受日期: 2016-01-14
- 优先数字出版日期(www.cnki.net): 2016-01-21
有丝分裂真菌中,蜡蚧菌Lecanicillium W. Gams&Zare (又称蜡蚧轮枝菌、蜡蚧霉)是已经被商品化的虫生真菌[1]。蜡蚧菌最早被Zimmermann命名为蜡蚧头孢霉Cephalosporium lecanii Zimm.;而后Viegas将其并入轮枝孢属Verticillium Nees。形式属轮枝孢属的寄主范围很广,包括节肢动物、线虫、植物和真菌[2]。Zare和Gams[3]于2001年通过形态学和基于ITS1-5.8S-ITS2的rDNA分析重新对该形式属进行了定位,将该属中所有昆虫病原菌放在了新属蜡蚧菌属Lecanicillium W. Gams&Zare中[4]。其中包括Lecanicillium attenuatum Zare&W. Gams、L. lecanii (Zimm.) Zare&W. Gams、L. longisporum (Petch) Zare&W. Gams、L. muscarium (Petch) Zare&W. Gams、L. nodulosum (Petch) Zare&W. Gams,而这些种在之前被统一称为蜡蚧轮枝菌Verticillium lecanii Zimm.[2, 4]。对这样的分类系统而言,先前有关蜡蚧轮枝菌的研究可能会包括蜡蚧菌属的一些种,Goettel等在对相关文献研究之后发现一些学者只是单纯地用Lecanicillium取代了Verticillium,并没有提供必要的证据信息,从而增加了蜡蚧菌属的混乱程度[5-6]。
基于蜡蚧菌开发的或正在研发的商品化制剂至少有15种,有些制剂的菌种名称不够准确。但是有些制剂是基于早期的蜡蚧轮枝菌而开发,包含了蜡蚧菌属中多个种。对原始菌株的界定不清晰使得这些商品制剂的成分往往不同,甚至有些商品根本不含有注册的菌株[2]。
渐狭蜡蚧菌Lecanicillium attenuatum是蜡蚧菌属Lecanicillium W. Gams&Zare中的一个重要的种。该菌寄主广泛,已经确证的有从波兰的一种毛虫、美国的一株枯枝[2]、朝鲜的蚜虫[7]和黑龙江的大豆胞囊线虫[8]上成功分离得到,但从茶小绿叶蝉上分离得到渐狭蜡蚧菌尚未见报道。渐狭蜡蚧菌可以有效寄生线虫的卵[4]、桃蚜[9]、棉蚜[10]等农业害虫,具有重要的生防潜力。茶小绿叶蝉 Empoasca flavescens (Fab.)是危害贵州省茶叶的主要害虫之一,郑姗姗等[11]报道了蜡蚧轮枝菌对茶假眼小绿叶蝉具有一定的防治效果。本文从茶小绿叶蝉上分离得到渐狭蜡蚧菌,这对于防治茶小绿叶蝉具有潜在的应用价值。
1 材料与方法 1.1 培养基PDA培养基参照文献[12]。基础培养基(g/L):葡萄糖20.0,硝酸钠2.0,氯化钾0.5,磷酸氢二钾1.0,七水硫酸镁0.5,七水硫酸亚铁0.01,琼脂15.0,蒸馏水1 000 mL[13]。
1.2 菌株分离及培养标本来自贵州省遵义市凤冈县仙人岭茶园,为罹病茶小绿叶蝉。用火焰灭菌后的接种针小心地挑取标本表面的菌丝,接种在无菌、含有抗生素的PDA平板上,待目标真菌长出后及时转接至新的PDA平板上进行纯化培养。25 Gzuifrlun-1404,现保存于贵州大学真菌资源研究所菌种保藏中心(GZAC)。
1.3 DNA的提取及ITS序列扩增从PDA平板上挑取菌丝体,根据Tigano-Milani等的方法提取总DNA[14]。提取的DNA置于−20 保存,选用通用引物ITS5 (5′-GGTGAGAGATTTCTGTG-3′)和ITS4 (5′-TCC TCCGCTTATTGATATGC-3′)扩增ITS区的nrDNA。反应体系(25 μL):ddH2O 8.5 μL,模板(10−100 mg/L) 2 μL,引物ITS4和ITS5均为 (0.4 μmol/L) 1 μL,Master mix为12.5 μL。PCR反应条件:94 5 min;94 40 s,49 40 s,72 60 s,35个循环;72 10 min。PCR产物送上海Invitrogen公司纯化测序。
1.4 系统发育分析测序结果经手工比对校正后提交GenBank,登录号为KT345700。用NCBI的BLAST程序进行比对,下载相似度大于90%的核酸序列以及其他相关的部分真菌序列。表 1为本研究用于系统发育学分析的所有序列。用MEGA 5.2对序列进行对齐剪切后构建系统发育树,运行条件为邻接法(Neighbor-Joining),运算次数(Replications)1 000次[15]。用Rotiferophthora minutispora 作为外群[5]。
| 种类 Species | GenBank accession No. |
| Lecanicillium acerosum | EF641893 |
| L. aphanocladii | KC574075 |
| L. araneicola | JN255572 |
| L. attenuatum | AB378512 |
| L. antillanum | KP334110 |
| L. dimorphum | AJ292429 |
| L. fungicola | FJ481016 |
| L. fungicola var. fungicola | KC964107 |
| L. fusisporum | KF766521 |
| L. lecanii | FJ515771 |
| L. longisporum | KF933099 |
| L. muscarium | EF513017 |
| L. primulinum | AB712268 |
| L. psalliotae | KF358373 |
| L. saksenae | KP260559 |
| L. tenuipes | JQ764778 |
| Simplicillium aogashimaense | AB604002 |
| S. cylindrosporum | AB604006 |
| S. lamellicola | LC035065 |
| S. lanosoniveum | JN116646 |
| S. minatense | AB603992 |
| S. obclavatum | KJ173543 |
| S. subtropicum | AB603995 |
| Simplicillium sympodiophorum | AB604003 |
| Rotiferophthora minutispora | AJ292411 |
| Gzuifrlun-1404 | KT345700 |
1.5.1 单因子实验:在基础培养基的基础上,分别改变碳源、氮源、生长因子,每l 000 mL 培养基中,(1) 碳源:对照组、蔗糖、海藻糖、麦芽糖、乳糖、甘油、淀粉各30 g;(2) 氮源:对照组、蛋白胨、酵母浸出汁、尿素、硫酸铵、硝酸钾各10 g;(3) 改变添加物:对照组、马铃薯汁200 mL、土壤浸出液200 mL、蚕蛹粉浸出液 200 mL[16]。接种活化过的Lecanicillium attenuatum (菌块大小为1.5 mm×1.5 mm×0.5 mm),用食品袋封住培养皿,放入培养箱中,培养温度为25 连续观察菌落的生长情况,培养至第2天开始采用十字交叉法测量菌落生长直径,每隔2 d观测1次,直至第12天。用刀片将培养12 d的菌落移入灭菌的带有玻璃珠的20 mL吐温水中,涡旋振荡1 min,用血球计数板计数。
1.5.2 正交试验:选定最佳碳源、氮源,添加物和培养温度作为考察因素,每个因素各取3个水平,采用L9(34)正交表进行正交试验,获得最优配比及培养基条件。
1.6 数据统计与分析数据采用DPS软件和Excel软件进行统计和分析。
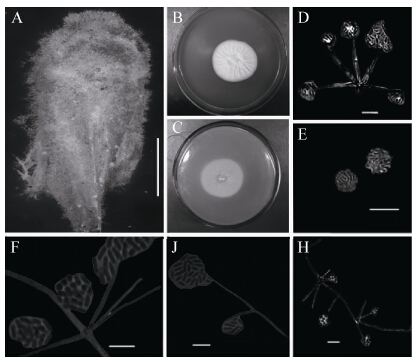
2 结果与分析 2.1 渐狭蜡蚧菌 已知种 图 1 Lecanicillium attenuatum Zare&W. Gams Figure 1寄主昆虫体长约4 mm,菌丝布满虫体表面,菌丝白色。菌落在PDA培养基中生长较快,25 −μm×(0.9−1.8) μm;气生孢子形成孢子团4.5−7.2 μm,用无菌水或棉兰染色液处理之后孢子逐渐散开成柱状,(2.7−7.2) μm×(0.9−1.8) μm。
|
| 图 1 渐狭蜡蚧菌无性阶段产孢结构和菌落特征(Gzuifrlun-1404) Figure 1 Conidiogenous structures and colonies of Lecanicillium attenuatum Gzuifrlun-1404 A:标本;B、C:在PDA上培养14 d后形成的菌落;D、E:产孢结构和分生孢子(直接用胶带粘片);F、J:产孢结构(用棉兰染色液固定);H:产孢结构(用无菌水固定). 标尺:A:1 mm;D−H:10 μm. A: The specimen; B,C: Colonies on PDA media for 14 days; D,E: The phialides structure on hyphae and the Conidia (Directly with sticky tape); F,J: The phialides structure on hyphae (In medan dye fixation); H: The phialides structure on hyphae (In medan dye fixation). A: Bar=1 mm; D−H: Bar=10 μm. |
|
|
研究标本:Gzuifrlun-1404,采集人:周叶鸣,2014年4月,罹病小绿叶蝉,标本采自贵州省遵义市凤冈县仙人岭茶庄。现保存于贵州大学真菌资源研究所。
地理分布:波兰、美国、朝鲜、中国都有分布。
从菌株Gzuifrlun-1404中扩增出来的ITS序列与GenBank中已有核酸序列BLAST结果表明,菌株Gzuifrlun-1404的rDNA-ITS序列与L. attenuatum的相应序列相似性为100%。通过系统发育树分析显示,菌株Gzuifrlun-1404与L. attenuatum属同种(图 2)。

|
| 图 2 菌株Gzuifrlun-1404及其相关种类基于ITS1-5.8S-ITS2的系统发育树 Figure 2 Phylogenetic tree based on rDNA ITS1-5.8S-ITS2 sequences of Gzuifrlun-1404 related species |
|
|
2.2.1 不同碳源筛选:由表 2可知,不同碳源对Lecanicillium attenuatum的产孢影响不一样,经DPS单因素方差检验,碳源以麦芽糖最佳,其产孢量最大为10.450×106个/mL,且麦芽糖与其他碳源的差异显著(P<0.05)。
| 编号 Number | 碳源 Carbon sources | 产孢量(×106 个/mL) Sporulation (×106 spores/mL) |
| 1 | Maltose | 10.450±0.638 a |
| 2 | Mycose | 8.167±0.586 b |
| 3 | Glycerol | 7.033±1.239 bc |
| 4 | Glucose | 8.150±0.458 b |
| 5 | Starch | 5.733±0.723 cd |
| 6 | Lactose | 3.817±0.814 d |
| 注:表中数据为均值,同一列数据中标识不同字母的数据表示与其他数据差异显著(P<0.05),下同. | ||
| Note: The data in the table is the mean and the data in the same column with different letters show significant differences with others (P<0.05),the same below. | ||
2.2.2 不同氮源筛选:由表 3可知,经DPS单因素方差检验,氮源以蛋白胨最佳,其产孢量最大为30.167×106个/mL。蛋白胨除与酵母浸出汁没有显著差异外,与其他氮源的差异显著(P<0.05)。
| 编号 Number | 氮源 Nitrogen sources | 产孢量(×106 个/mL) Sporulation(×106 spores/mL) |
| 1 | Yeast leaching juice | 24.817±5.717 a |
| 2 | Urea | 2.200±0.409 b |
| 3 | (NH4)2SO4 | 7.017±0.862 b |
| 4 | Peptone | 30.167±6.580 a |
| 5 | KNO3 | 13.317±3.126 b |
2.2.3 不同添加因子筛选:由表 4可知,经DPS单因素方差检验,添加因子以蚕蛹粉最佳,其产孢量最大为38.067×106个/mL,蚕蛹粉与其他添加因子的差异显著(P<0.05)。
| 编号 Number | 添加因子 Addition factor | 产孢量(×106 个/mL) Sporulation (×106 spores/mL) |
| 1 | Silkworm chrysalis powder | 38.067±1.848 a |
| 2 | Potato | 29.400±1.750 b |
| 3 | Soil | 12.950±1.602 c |
2.2.4 正交试验:根据单因素筛选的结果,选取影响Lecanicillium attenuatum的产孢量的各因素中有意义的水平进行正交试验,以确定最佳配比。采用L9(34)正交表,以蛋白胨(A)、麦芽糖(B)、蚕蛹粉(C)、温度(D)作为4个考察因素,选取3个水平进行实验。按表 5的正交因素水平设计L9(34)正交试验,结果见表 6。
| 水平 Level | A 蛋白胨 A Peptone(%) | B 麦芽糖 B Maltose(%) | C 蚕蛹粉 C Silkworm pupa powder (%) | D 温度 D Temperature (°C) |
| 1 | 1 | 1 | 0.5 | 15 |
| 2 | 2 | 2 | 1 | 20 |
| 3 | 3 | 3 | 1.5 | 25 |
| 编号 Number | A 蛋白胨 A Peptone(%) | B 麦芽糖 B Maltose(%) | C 蚕蛹粉 C Silkworm pupa powder (%) | D 温度 D Temperature(°C) | 产孢量(×106 个/mL) Sporulation (×106 spores/mL) | 均值 Mean value | ||
| 1 | 2 | 3 | ||||||
| 1 | 1 | 1 | 0.5 | 15 | 2.9 | 2.45 | 3.1 | 2.817 g |
| 2 | 1 | 2 | 1 | 20 | 10.9 | 8.55 | 1.085 | 6.845 efg |
| 3 | 1 | 3 | 1.5 | 25 | 16.7 | 10.9 | 13.05 | 13.550 cd |
| 4 | 2 | 1 | 1 | 25 | 35.3 | 46.9 | 41.3 | 41.167 a |
| 5 | 2 | 2 | 1.5 | 15 | 4.7 | 7.1 | 5.9 | 5.900 fg |
| 6 | 2 | 3 | 0.5 | 20 | 11.7 | 11.5 | 11.1 | 11.433 def |
| 7 | 3 | 1 | 1.5 | 20 | 22.6 | 21.3 | 23.2 | 22.367 b |
| 8 | 3 | 2 | 0.5 | 25 | 15.5 | 16 | 19.95 | 17.150 bc |
| 9 | 3 | 3 | 1 | 15 | 9.95 | 10.65 | 14.65 | 11.750 cde |
| x1 | 7.737 | 22.117 | 10.467 | 6.822 | ||||
| x2 | 19.5 | 9.965 | 19.921 | 13.548 | ||||
| x3 | 17.089 | 12.244 | 13.939 | 23.956 | ||||
| R | 11.763 | 12.152 | 9.454 | 17.133 | ||||
以每个培养皿为指标进行直观分析(表 6)和方差分析(表 7),经过方差分析结果表明4个因素都对L. attenuatum产孢有显著影响。使用DPS软件分别对4个因素进行各水平比较,并进行多重比较(LSD法),各个处理间的差异性检验结果被列在了表 5中。综合单因素筛选的结论,最佳配比为A2B1C2D3,即最适配比和培养条件为(质量体积比):蛋白胨2%,麦芽糖1%,蚕蛹粉1%,氯化钾0.05%,磷酸氢二钾0.1%,七水硫酸镁0.05%,琼脂1.5%,蒸馏水1 000 mL,25 °C。
| 方差来源 Source of variation | 离均差平方和 Sum of squares | 自由度 Degree of freedom | 均方误差 Mean square error | F 值 F | 显著性 Significance |
| A | 694.89 | 2 | 347.445 | 33.594 | ** |
| B | 750.959 | 2 | 375.48 | 36.304 | ** |
| C | 411.638 | 2 | 205.819 | 19.9 | ** |
| D | 1 341.306 | 2 | 670.653 | 64.843 | ** |
| 误差 Error | 165.483 | 16 | 10.343 |
蜡蚧菌属真菌除了被开发成生物杀虫剂用来防治昆虫危害之外,还常表现出对植物病原线虫和植物病原真菌的控制效果[10]。因此,这类真菌的开发利用将为防治农业病虫害提供了广阔的应用前景。渐狭蜡蚧菌虽已被应用到农业的害虫防治上,但未见对茶小绿叶蝉的防治有相关的报道。
寄主昆虫的种类在昆虫病原真菌种的界定上是重要的鉴别特征之一[17]。在寄主范围较广的一类真菌中,同一种真菌的不同菌株对寄主的偏好性也常表现出差异。本文从茶小绿叶蝉虫尸上成功分离得到蜡蚧菌菌株Gzuifrlun-1404,明确了该菌株的分类地位。对该菌株的产孢条件优化也为该菌株的应用提供了重要的基础。菌株Gzuifrlun-1404为小绿叶蝉的潜在生防菌株,该菌株的获得也丰富了小绿叶蝉的真菌寄主。
肉座菌科/麦角菌科共同祖先早先寄生于植物及其残体。随后的进化使得其能够寄生于特异的动物和真菌[18]。渐狭蜡蚧菌曾被报道从枯枝[2]和土壤[13]中分离得到,也被报道从线虫[8]和刺吸式口器的昆虫[7]中分离得到。从菌株Gzuifrlun-1404生长因子的筛选结果来看,该菌株的营养源偏好动物。线虫生活于土壤-植物从土壤中吸收营养-昆虫取食植物,真菌寄主是否存在这样的一个跃迁模型?这是一个有趣的生物学问题。
| [1] | Marcos R, de Faria D, Wraight SP. Mycoinsecticides and mycoacaricides: a comprehensive list with worldwide coverage and international classification of formulation types[J]. Biological Control, 2007, 43 (3): 237–256. |
| [2] | Zare R, Gams W. A revision of Verticillium section Prostrata. IV. The genera Lecanicillium and Simplicillium gen. nov[J]. Nova Hedwigia, 2001, 73 (1/2): 1–50. |
| [3] | Gams W, Zare R. A revision of Verticillium section Prostrata. III. genetic classification[J]. Nova Hedwigia,, 2001, 72 : 329–337. |
| [4] | Zare R, Gams W, Culham A. A revision of Verticillium sect. Prostrata. I. phylogenetic studies using ITS sequences[J]. Nova Hedwigia, 2000, 71 : 465–480. |
| [5] | Goettel MS, Koike M, Kim JJ, et al. Potential of Lecanicillium spp. for management of insects, nematodes and plant diseases[J]. Journal of Invertebrate Pathology, 2008, 98 (3): 256–261. |
| [6] | Sugimoto M, Koike M, Hiyama N, et al. Genetic, morphological, and virulence characterization of the entomopathogenic fungus Verticillium lecanii[J]. Journal of Invertebrate Pathology, 2003, 82 (3): 176–187. |
| [7] | Kim JJ, Goettel MS, Gillespie DR. Potential of Lecanicillium species for dual microbial control of aphids and the cucumber powdery mildew fungus, Sphaerotheca fuliginea[J]. Biological Control, 2007, 40 (3): 327–332. |
| [8] | Zhao Y, Chen DX, Wang FL, et al. Identification of fungus Lecanicillium attenuatum and cloning of its chitinase gene LACHI1[J]. Acta Agriculturae Boreali-Sinica, 2014, 29 (4): 63–70. (in chinese) 赵洋, 陈德鑫, 王凤龙, 等. 渐狭蜡蚧菌的鉴定及其几丁质酶基因LACHI1的克隆[J]. 华北农学报, 2014, 29 (4):63–70. |
| [9] | Kim HY, Lee HB, Kim YC, et al. Laboratory and field evaluations of entomopathogenic Lecanicillium attenuatum CNU-23 for control of green peach aphid (Myzus persicae)[J]. Journal of Microbiology and Biotechnology, 2008, 18 (12): 1915–1918. |
| [10] | Kim JJ, Kim KC. Selection of a highly virulent isolate of Lecanicillium attenuatum against cotton aphid[J]. Journal of Asia-Pacific Entomology, 2008, 11 (1): 1–4. |
| [11] | Zheng SS, Jiang RL, Tian L, et al. Effectiveness of Schizophragma parvulas and Lecanicillium lecanii in controlling tea leafhopper Empoasca vitis population[J]. Acta Agriculturae Universitatis Jiangxiensis, 2012, 34 (2): 282–287. (in chinese) 郑珊珊, 姜荣良, 田麟, 等. 蜡蚧轮枝菌和缨小蜂对假眼小绿叶蝉的协同控制作用[J]. 江西农业大学学报, 2012, 34 (2):282–287. |
| [12] | Shen P, Chen XD. Microbiology Experiment[M]. Beijing: Higher Education Press, 2007: 241 -243. (in chinese) 沈萍, 陈向东. 微生物学实验[M]. 北京: 高等教育出版社, 2007: 241 -243. |
| [13] | Zhang ZR, Zhang YJ, Xie M. Identification and biological characteristics of a Lecanicillium isolate originating from tropic region and its pathogenicity against Bemisia tabaci[J]. Chinese Journal of Biological Control, 2015, 31 (1): 64–70. (in chinese) 张召荣, 张艳军, 谢明. 一株来自热带地区蜡蚧菌的鉴定?生物学特性及其对烟粉虱的致病力[J]. 中国生物防治学报, 2015, 31 (1):64–70. |
| [14] | Tigano-Milani MS, Samson RA, Martins I, et al. DNA markers for differentiating isolates of Paecilomyces lilacinus[J]. Microbiology, 1995, 141 (Pt1): 239–245. |
| [15] | Kumar S, Tamura K, Nei M. MEGA3: integrated software for molecular evolutionary genetics analysis and sequence alignment[J]. Briefings in Bioinformatics, 2004, 5 (2): 150–163. |
| [16] | Qi YX, Chen FX, Li ZZ. Effects of carbon sources and nitrogen sources on the biological characteristics and antifungal activity of Beauveria bassiana[J]. Acta Laser Biology Sinica, 2011, 20 (1): 38–44. (in chinese) 齐永霞, 陈方新, 李增智. 不同碳、氮营养对球孢白僵菌生物学特性和抑菌活性的影响[J]. 激光生物学报, 2011, 20 (1):38–44. |
| [17] | Nikoh N, Fukatsu T. Interkingdom host jumping underground: phylogenetic analysis of entomoparasitic fungi of the genus Cordyceps[J]. Molecular Biology and Evolution, 2000, 17 (4): 629–638. |
| [18] | Spatafora JW, Sung GH, Sung JM, et al. Phylogenetic evidence for an animal pathogen origin of ergot and the grass endophytes[J]. Molecular Ecology, 2007, 16 (8): 1701–1711. |
 2016, Vol. 43
2016, Vol. 43