扩展功能
文章信息
- 刘亢, 张闪闪, 卢伟东, 闫艳春, 赵百锁
- LIU Kang, ZHANG Shan-Shan, LU Wei-Dong, YAN Yan-Chun, ZHAO Bai-Suo
- 一株中度嗜盐芽孢杆菌(Bacillus sp. BZ-SZ-XJ39)的微生物学特性
- Microbiological characteristics of a moderately halophilic bacterium, Bacillus sp. BZ-SZ-XJ39
- 微生物学通报, 2016, 43(5): 917-926
- Microbiology China, 2016, 43(5): 917-926
- DOI: 10.13344/j.microbiol.china.150858
-
文章历史
- 收稿日期: 2015-11-01
- 接受日期: 2015-12-16
- 优先数字出版日期(www.cnki.net): 2016-01-06
2. 青岛农业大学生命科学学院 山东 青岛 266109
2. College of Life Sciences, Qingdao Agricultural University, Qingdao, Shandong 266109, China
中度嗜盐菌是指一类能够在0.5−1.5 mol/L盐度中有最佳生长能力且能适应很宽盐度范围的极端微生物类群[1-2]。这类嗜盐菌广泛栖息于盐(碱)湖、盐碱地、海洋、盐池及盐渍食品等极端环境中。中度嗜盐菌不仅能抵抗外界高浓度的盐环境,而且能应对盐度大范围的波动。它们可以产生甘氨酸甜菜碱和四氢嘧啶等相容性溶质、合成多类型的耐盐碱酶及多聚糖等,在生物技术领域内有潜在的应用价值[3-4]。随着中度嗜盐菌不断被分离鉴定,人们对中度嗜盐菌所拥有的独特的生物学特性和广阔的应用前景产生了越来越大的兴趣。
近年来,科学家们在高盐(碱)环境中也陆续获得了一些中度嗜盐的芽孢杆菌(Bacillus)。例如Bacillus rigiliprofundi 1MBB1T[5]、Bacillus oryzaecorticis R1T[6]、Bacillus shacheensis HNA-14T[7]、Bacillus iranensis X5BT[8]、Bacillus hemicentroti JSM 076093T[9]、Bacillus aidingensis 17-5T[10]和Bacillus oshimensis K11T[11]等。这充分说明在芽孢杆菌属中存在着大量能适应高盐环境的微生物类群,因此有必要开发利用这类宝贵的微生物资源。芽孢杆菌属被发现的历史悠久,由德国植物学家Cohn在1872年依据细菌的形态特征所建立。目前为芽孢杆菌科(Bacilliceae)中最大的一个属,包含300多个种成员[12] (http://www.bacterio.net/index.html)。芽孢杆菌在自然界中分布极为广泛,属于革兰氏阳性菌,产芽孢,好氧或兼性厌氧[13]。由于其在微生物学中占据重要的地位,所以需要挖掘更多具有特殊生物学功能的芽孢杆菌菌种资源以期服务于人类。我们课题组在2013年8月从新疆乌鲁木齐附近的盐碱湖中采集了“盐碱湖淤泥”样品,通过一系列稀释,然后在高盐培养基(15% NaCl,质量体积比)平板上进行涂布、挑取单菌落、划线纯化,最终获得了一株中度嗜盐的菌株,将其命名为BZ-SZ-XJ39。本研究通过16S rRNA基因序列分析、基因组G+C mol%含量测定、细胞形态与培养条件确定、营养与生理生化特征测定以及细胞化学组成分析等,确定菌株BZ-SZ-XJ39的微生物学特性,为将来阐明该菌独特的盐适应能力和潜在的应用前景提供数据支持。
1 材料与方法 1.1 材料1.1.1 菌株及载体:菌株BZ-SZ-XJ39分离自新疆盐碱湖(43º24′35″N,88º6′39″E,海拔1 072 m),由中国农业科学院研究生院生物教研室提供,目前该菌株已保藏到中国普通微生物菌种保藏管理中心(CGMCC1.12936)和日本菌种保藏中心(JCM30194)。所用的参比模式菌株Bacillus daliensis CGMCC1.10369T (DLS13T)购自中国普通微生物菌种保藏管理中心(CGMCC);Bacillus chagannorensis DSM18086T (CG-15T)和Bacillus saliphilus DSM15402T (6AGT)购自德国微生物菌种保藏中心(DSMZ);大肠杆菌K-12 (Escherichia coli K-12)购自中国科学院微生物研究所菌种保藏中心;大肠杆菌JM109感受态细胞(E. coli JM109)购自TaKaRa公司(北京)。
1.1.2 培养基:MAB液体培养基(g/L)[14]:氯化钠80,七水硫酸镁0.12,二水硫酸钙0.061,碳酸氢钠4.2,氯化铵0.85,磷酸氢二钾0.48,七水硫酸亚铁0.021,次氮基三乙酸(Nitrilotriacetic acid) 0.015,酵母粉(Oxoid,England) 5,葡萄糖2,微量元素溶液1 mL (g/L) (MnSO4·H2O 5,C°Cl2·6H2O 1,ZnSO4·7H2O 1,CuSO4·2H2O 0.1,KAl(SO4)2·12H2O 0.1,H3BO3 0.1,Na2MoO4·2H2O 0.1,Pyridoxine HCl 0.1,Thiamine HCl·2H2O,0.05),pH 8.0。
脂肪酸分析培养基(g/L):蛋白胨5,酵母粉(Oxoid,England) 5,磷酸二氢钾1,七水硫酸镁0.2,氯化钠70,碳酸钠20,葡萄糖10,pH 9.0。
LB培养基(g/L):蛋白胨10,酵母粉(Oxoid,England) 5,氯化钠10,pH 7.0。以上培养基在 1×105 Pa灭菌30 min。本实验中的糖类化合物需要溶解于无菌水中经0.22 μm微孔滤膜过滤除菌,接种或涂布之前在超净工作台中添加。制备固体培养基时需要添加1.8%的琼脂粉。
1.1.3 主要仪器:PCR扩增仪(Bio-Rad ALS1296型),美国Bio-Rad公司;冷冻离心机(Scanspeed 1580R型),丹麦LaboGene公司;便携式分光光度计(Hach DR2700型),美国Hach公司;扫描电子显微镜(FEI Quanta200型),美国FEI公司和透射电子显微镜(JEM-1400型),日本电子株式会社。
1.1.4 主要试剂与引物:细菌基因组提取试剂盒和DNA凝胶纯化回收试剂盒购自北京New Industry公司;GoTaq GreenMaster Mix (2×) PCR反应预混液和pGEM-T Easy Vector购自北京Promega公司;T4连接酶购自北京TaKaRa公司;细菌16S rRNA基因通用引物8F和1492R由北京擎科生物技术公司合成;Biolog GN III微孔板,购自美国Biolog公司;API ZYM酶活试剂条购自法国BioMérievx公司;微生物抗生素药敏片购自杭州微生物试剂有限公司;其他试剂均为国产或进口分析纯试剂。
1.2 方法1.2.1 遗传型特征:16S rRNA基因片段扩增:用细菌基因组提取试剂盒提取待测菌株总DNA,通过1%琼脂糖凝胶电泳检测基因组DNA完整性,用紫外分光光度计测定DNA纯度和DNA浓度。以获得的总DNA为PCR模板,8F (5′-AGAGTTTGATCCT GGCTCAG-3′)和1492R (5′-CCAATGGAATGCTG AA-3′)为引物进行PCR扩增获得16S rRNA基因序列[15]。PCR反应体系如下:GoTaq GreenMaster Mix (2×)为50 µL,引物8F和1492R各10 μmol/L各 2 µL,DNA模板为1−2 µL,最后用无菌水补充至100 µL。PCR反应条件为:94 ºC 5 min;94 ºC 45 s,55 ºC 30 s,72 ºC 90 s,25个循环;72 ºC 5 min。通过1%琼脂糖凝胶电泳检测,用DNA凝胶回收试剂盒对PCR扩增的DNA目的片段进行回收纯化。
16S rRNA基因序列测定:将回收的16S rRNA基因目的片段与pGEM-T Easy Vector在4 ºC下连接过夜(T4连接酶),然后转化到E. coli JM109感受态细胞中,再均匀涂布于含X-gal、IPTG和氨苄抗性(Ampr)的固体培养基平板上,37 ºC培养约15−20 h,然后随机选挑白斑转化子用快速质粒检测法进行检测,最后将含有重组子的阳性克隆送至北京擎科生物技术公司测序。
16S rRNA基因序列分析及系统发育树的构建:将剔除pGEM-T Easy Vector序列后的16S rRNA基因序列递交至NCBI (GenBank注册号为KP456019)。应用NCBI数据库中的BLAST程序(http://blast.st-va.ncbi.nlm.nih.gov)和RDP-II数据库中的Seqmatch程序进行搜索(http://rdp.cme.msu.edu/ seqmatch/seqmatch_intro.jsp),最后获得所需的参比模式菌株及其16S rRNA基因序列。用软件ClustalX 2.0多序列比对后,最后通过软件MEGA 6.0中的邻接法(Neighbour-Joining)来构建系统发育树[16]
G+C mol%含量测定:采用热变性法(Tm)[17],以E. coli K-12为参比菌株,测定菌株的G+C mol%,由中国科学院微生物所保藏中心完成。
1.2.2 表型特征:菌落形态和细胞形态:将菌株BZ-SZ-XJ39涂布于平板固体培养基上33 ºC培养48 h后进行观察菌落形状、大小、颜色、粘稠度、透明度、边缘或隆起等现象。革兰氏染色、鞭毛染色和芽孢染色以及扫描电子显微镜和透射电子显微镜的观察按照文献[18-19]方法进行。
运动性观察:在含0.7%琼脂的半固体培养基试管中进行直针穿刺接种,若边缘清晰,表示没有运动性;若由穿刺线向四周呈云雾状扩散,表示有运动性。
1.2.3 培养特征:培养条件确定:测定生长盐度(0、0.5%、1%、2%、3%、4%、6%、8%、10%、12%、14%、16%、18%、20%、22%、25%、28%、30%和32% NaCl,质量体积比)、温度(0、4、10、15、20、25、30、33、35、37、39和41 ºC)和pH (5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5和11.5)。其中测定pH值范围时需要加入终浓度为20 mmol/L的MES (pH 5.5、6.0、6.5),HEPES (pH 7.0、7.5、8.0),TAPS (pH 8.0、8.5、9.0),CHES (pH 9.0、9.5、10.0)或者CAPS (pH 10.0、10.5、11.5)缓冲液以维持培养液pH的稳定。
微氧及无氧生长:用刃天青(0.001 g/L)作为指示剂,制备微好氧或无氧的MAB液体培养基(添加酵母粉为1.0%)于厌氧试管(Hungate)中,经高温灭菌后,接种约1.0%的待测菌液,在适宜生长条件下培养5 d后观察状况。
1.2.4 营养与生理生化特征[19]:(1) 糖利用及其产酸测定:配制含有5 mL不加碳源的MAB液体试管培养基,1×105 Pa高压灭菌30 min后加入过滤灭菌的糖源且以糖作为唯一的碳源和能源培养3 d,再连续转接3次观察生长状况。测定该菌是否产酸时,则需要添加终浓度0.003%的Bromothymol blue作为指示剂。
(2) 碳水化合物利用及其氧化检测:在Biolog GN III微孔板中用对碘硝基四唑紫作为指示剂,若底物含氮则不再加氮源(即NH4Cl),加入150 μL待测菌液培养3 d后观察颜色变化。
(3) 酶活检测及水解反应测定[19]:按照参考文献方法测定待测菌株的过氧化氢酶、氧化酶和L-苯丙氨酸脱氨酶的活性,吲哚(Indole)和硫化氢(H2S)的生成,以及酪蛋白、马尿酸盐、可溶性淀粉、酪氨酸、吐温20和吐温80的水解反应。
(4) API ZYM酶活性检测:按照试剂条的说明步骤进行操作。
(5) 某些电子受体确定(在厌氧条件下):在MAB无氧液体培养基中,以0.2%的酵母粉作为电子供体,硝酸钠(20 mmol/L),亚硝酸钠(5 mmol/L),硫代硫酸钠(20 mmol/L),二氧化锰(10 mmol/L)或延胡索酸(20 mmol/L)作为电子受体检测这些物质是否能作为电子受体。
(6) 抗生素敏感性检测:按照抗生素药敏片说明步骤进行操作。将待测菌液均匀涂布于固体培养基平板上,同时将6 mm的抗生素药敏片置于菌液表面,37 ºC培养3 d后观察生长状况。若药敏片周围有透明圈则代表敏感;反之不敏感。
1.2.5 化学指标特征:(1) 细胞脂肪酸成分分析:对菌株BZ-SZ-XJ39、B. saliphilus DSM15402T、B. daliensis CGMCC1.10369T和B. chagannorensis DSM18086T进行脂肪酸分析。将待测菌株在脂肪酸分析培养基中33 ºC培养2 d,然后4 ºC、8 000×g离心收集对数期的菌体,送至中国科学院微生物研究所分析[18]。
(2) 呼吸醌和极性脂测定:在MAB培养基中33 ºC培养2 d,然后4 ºC、8 000×g离心收集菌体,送至由德国菌种保藏中心分析(https://www.dsmz.de/ services.html)。
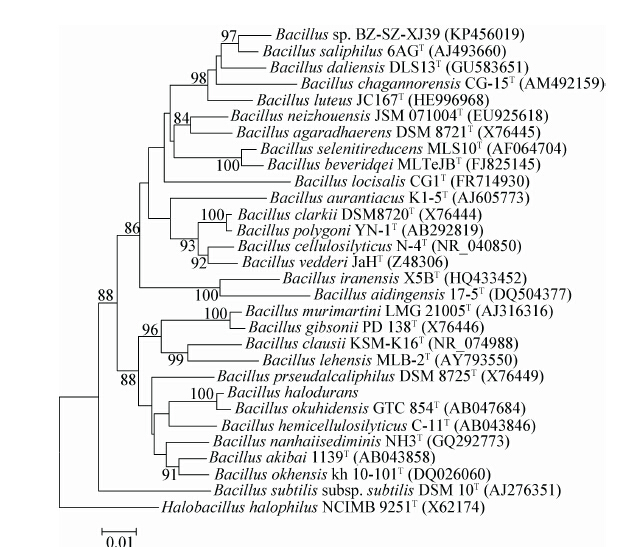
2 结果与分析 2.1 菌株的遗传型特征对菌株BZ-SZ-XJ39的16S rRNA基因序列进行测序,共获得含1 499个核苷酸的序列,将其递交到NCBI GenBank数据库,获得序列注册号为KP456019。通过NCBI BLAST和RDP-II Seqmatch进行相似性搜索,结果显示BZ-SZ-XJ39菌株 16S rRNA基因序列与Bacillus中一些模式菌株高度同源,初步推测菌株可能是Bacillus中一个成员。其中,菌株BZ-SZ-XJ39与B. saliphilus 6AGT、B. daliensis DLS13T、B. luteus JC167T、B. chagannorensis CG-15T和B. agaradhaerens DSM8721T的16S rRNA基因序列相似性依次为97.5%、96.5%、96.2%、95.5%和95.3%[20-24],与其余模式菌株的相似性则小于95.0%。为进一步确定BZ-SZ-XJ39菌株系统发育地位,选取Bacillus中与BZ-SZ-XJ39菌株16S rRNA基因同源的模式菌株共28株,以嗜盐盐芽孢杆菌(Halobacillus halophilus NCIMB 9251T)[25]作为外围支(Outgroup)构建系统发育树(图 1)。结果表明,菌株BZ-SZ-XJ39与6AGT、DLS13T、CG-15T和Bacillus locisalis CG1T[26]聚类成一个分支。BZ-SZ-XJ39与6AGT共同拥有一个节点,暗示它们的亲缘关系更为密切,并且它们以高达98%自举值进行聚类,这也充分说明该分支的拓扑结构是可信的。由此断定,菌株BZ-SZ-XJ39为Bacillus的一个成员。BZ-SZ-XJ39菌株的基因组DNA G+C含量为44.4 mol%±1.2 mol% (Tm),说明其属于低G+C菌群。由于Bacillus中成员的基因组DNA G+C含量为32 mol%-69 mol%[13],所以进一步判断菌株BZ-SZ-XJ39属于Bacillus。
|
| 图 1 菌株BZ-SZ-XJ39及其近缘模式菌株16S rRNA基因序列系统发育树 Figure 1 Phylogenetic tree based on 16S rRNA gene sequences showing the relationship between strain BZ-SZ-XJ39 and the related species from the phylum Bacillus 分支上的数字为Bootstrap值,代表分类单位被聚在一起的概率;标尺代表碱基替换. The numbers of nodes indicate bootstrap values,and represent the percentage of 1 000 bootstrap replications in which the taxa to the right are placed together. The scale bar indicates 1.0 nt substitution. |
|
|
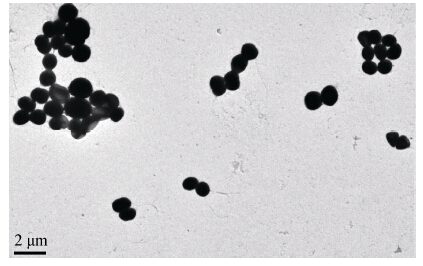
BZ-SZ-XJ39菌株为革兰氏染色阳性菌,细胞为短杆状(图 2),菌体大小为(0.7−0.9) μm×(1.0-1.2) μm。未见产生芽孢,无鞭毛,无运动性。在固体平板培养基上培养2 d,菌落大小约为1−2 mm,黄色,圆形,光滑有光泽,边缘整齐,不透明,凸起状。菌株BZ-SZ-XJ39的生长盐度范围为0.5%−28%,最适为8%;生长pH范围为5.5−9.5,最适为8.0;生长温度范围为4−41 ºC,最适为33 ºC (表 1)。此外,该菌株不能在微好氧或者无氧条件下生长(酵母粉为1.0%)。在酵母粉(0.2%)为电子供体的无氧条件下,BZ-SZ-XJ39不能利用硫代硫酸钠、硝酸钠、亚硝酸钠、二氧化锰或者延胡索酸作为电子受体进行生长。由此推断,BZ-SZ-XJ39菌株为严格好氧菌。
|
| 图 2 菌株BZ-SZ-XJ39的透射电子显微镜图像 Figure 2 Electron micrographs of strain BZ-SZ-XJ39 showing by transmission electron microscope micrograph |
|
|
| 菌株特征 Characteristic | BZ-SZ-XJ39a | B. saliphilus DSM 15402T | B. daliensis CGMCC 1.10369T | B. chagannorensis DSM 18086T |
| 样品采集地点 Sampling site | Salt lake | Algal mat | Soda lake | Soda lake |
| 细胞形态 Cell morphology | Rods | Cocci | Rods | Rods |
| 菌落颜色 Colony color | Yellow | Yellow | Yellow | Yellow-orange |
| 需氧性 O2 requirement | Strictly aerobic | Strictly aerobic | Facultively anaerobic | Facultively anaerobic |
| 芽孢形成 Endospore formation | − | − | + | + |
| 运动性 Motility | − | − | + | + |
| 生长盐度 NaCl concentration for growth (%) | ||||
| 范围 Range | 0.5−28 | 1−20 | 0−8 | 3−20 |
| 适宜条件 Optimum | 10 | 15 | 2 | 7 |
| 生长 pH Growth pH | ||||
| 范围 Range | 5.0−11.0 | 7.0−10.0 | 7.5−11.0 | 6.0−11.0 |
| 适宜条件 Optimum | 8 | 9 | 9 | 8.5 |
| 生长稳定Growth temperature (ºC) | ||||
| 范围 Range | 4−41 | 10−50 | 10−45 | 10−40 |
| 适宜条件 Optimum | 33 | 37 | 30 37 | |
| 氧化酶活性 Oxidase | − | + | + | − |
| 水解反应 Hydrolysis | ||||
| 明胶 Gelatin | + | + | − | − |
| 酪蛋白 Casein | + | − | + | − |
| 淀粉 Starch | + | − | − | − |
| 硝酸盐还原 Nitrate reduction | − | − | − | + |
| 吲哚生成 Indole production | − | + | + | − |
| 硫化氢生成 H2S production − | + | + | − | |
| 络氨酸分解 Tyrosine decomposition | − | + | ||
| 苯基丙氨酸脱氨基 Phenylalanine deamination | + | − | + | |
| Voges-Proskauer reaction | + | +a | + | −a |
| 呼吸醌成分 Quinone composition | MK-7 | MK-7,DMK-7 | MK-7 | MK-7 |
| DNA G+C content (mol%) | 44.4 | 48.8 | 43.9 | 53.8 |
| 注:a:结果来自本实验,其他则来自文献[20-21, 23]. 所有供试菌株对革兰氏染色和过氧化氢酶为阳性,对马尿酸、吐温20和吐温80的水解反应为阴性. | ||||
| Note: a: Data were obtained in this study. Except that data are from references [20-21, 23]. All strains were positive for Gram reaction and catalase,but negative for hydrolysis of hippurate,tween 20,tween 80,and methyl red test. | ||||
在5 mL试管测定实验中,BZ-SZ-XJ39菌株能利用L-阿拉伯糖、D-木糖、D-果糖、D-海藻糖、D-半乳糖、α-D-葡萄糖、L-鼠李糖、D-麦芽糖、蔗糖、D-松三糖、D-核糖或者甘露糖为唯一的碳源和能源。其中,D-木糖、D-果糖、D-海藻糖、α-D-葡萄糖、D-麦芽糖、蔗糖、D-松三糖、D-核糖或者甘露糖为底物可以产生酸类物质。Biolog GN III碳源利用及其氧化实验结果表明,菌株BZ-SZ-XJ39可以利用氧化糊精、龙胆二糖、D-松二糖、D-蜜二糖、α-D-葡萄糖、D-甘露糖、D-果糖、D-半乳糖、3-甲基葡萄糖、D-岩藻糖、L-岩藻糖、D-麦芽糖、D-海藻糖、蔗糖、D-核糖、L-鼠李糖、L-树胶醛糖、D-松三糖、D-木糖、D-葡萄糖-6-磷酸、D-果糖-6-磷酸、D-半乳糖醛酸、D-葡萄糖醛酸、葡萄糖酰胺、γ-氨基丁酸、α-酮基丁酸和果胶;但是不能利用氧化D-纤维二糖、水苏糖、α-D-乳糖、D-棉子糖、β-甲基-D-葡萄糖苷、D-水杨苷、N-乙酰-D-葡萄糖胺、N-乙酰-β-甘露糖胺、N-乙酰-D-半乳糖胺、N-乙酰-甘露糖胺丙酮酸、肌苷、D-山梨醇、D-甘露醇、D-阿拉伯醇、肌醇、甘油、D-天冬氨酸、D-丝氨酸、明胶、甘氨酰基-L-脯氨酸、L-丙氨酸、L-精氨酸、L-天冬氨酸、L-谷氨酸、L-组氨酸、L-焦谷氨酸、L-丝氨酸、L-半乳糖酸内酯、D-葡萄糖醛酸、粘液酸、D-糖酸、p-羟基苯乙酸、甲基丙酮酸盐、D-乳酸甲酯、L-乳酸、柠檬酸、α-酮-戊二酸、D-羟基丁二酸、L-羟基丁二酸、溴代琥珀酸、吐温40、α-羟基-丁酸、乙酰乙酸、丙酸、醋酸和甲酸。菌株BZ-SZ-XJ39可以水解酪蛋白和可溶性淀粉,但不能水解酪氨酸、吐温20和吐温80。氧化氢酶、苯丙氨酸脱氨酶和α-葡萄糖苷酶活性及Voges-Proskauer实验呈阳性;氧化酶、马尿酸盐水解酶和硝酸盐还原酶及甲基红实验呈阴性。不生成吲哚和硫化氢气体(表 1)。
API ZYM实验结果表明,酯酶(C4)、酯酶脂肪酶(C8)、亮氨酸芳基酰胺酶、缬氨酸芳基酰胺酶、α-胰凝乳蛋白酶、酸性磷酸酶、萘酚-AS-BI-磷酸水解酶、β-半乳糖苷酶和α-葡萄糖苷酶为阳性;但是脂肪酶(C14)、半胱氨酸芳基酰胺酶、胰蛋白酶、α-半乳糖苷酶、β-葡萄糖醛酸酶、β-葡萄糖苷酶、N-乙酰-β-氨基葡萄糖苷酶、α-甘露糖苷酶和α-岩藻糖苷酶为阴性。BZ-SZ-XJ39菌株对卡那霉素(50 µg)、链霉素(300 U)、新霉素(30 µg)、羧苄青霉素 (100 µg)、氨苄青霉素(50 µg)、利福平(30 µg)、万古霉素(20 µg)、羟氨苄青霉素(10 µg)、硫酸粘杆菌素B (300 U)、头孢西丁(20 µg)、四环素(20 µg)、氯霉素(20 µg)、青霉素(10 IU)、红霉素(15 µg)、克林霉素(2 µg)、磺胺甲恶唑、头孢噻肟(30 µg)、先锋霉素(20 µg)和克拉霉素(15 µg)敏感,但是对庆大霉素 (10 µg)和萘啶酸(30 µg)不敏感。
2.4 BZ-SZ-XJ39菌株的化学特征菌株BZ-SZ-XJ39与具有近缘关系的模式菌株的脂肪酸组成较类似(表 2),主要为饱和脂肪酸,其中有anteiso-C15:0 (50.2%),anteiso-C17:0 (16.3%),C16:0 (9.8%),iso-C16:0 (8.8%)和iso-C15:0 (7.3%),但在具体含量上,不同种类微生物略有差异;差异还表现在微量脂肪酸成分及其含量上。菌株BZ-SZ-XJ39合成极性脂为磷脂(Phospholipid,PL)、磷脂酰乙醇胺(Phosphatidylethanolamin,PE)、磷脂酰甘油(Phosphatidylglycerol,PG)、二磷脂酰甘油(Diphosphatidylglycerol,DPG)和磺酸基异鼠李糖基二脂酰基甘油(Sulfoquinovosyldiacylglycerol,SQDG),其所含的呼吸醌为甲基萘醌(Menaquinone 7,MK 7)。
| 脂肪酸相对含量 Relative amount among total fatty acids (%) | BZ-SZ-XJ39 | B. saliphilus DSM 15402T | B. daliensis CGMCC 1.10369T | B. chagannorensis DSM 18086T |
| 饱和直链脂肪酸 | ||||
| Saturated straight-chain fatty acids | ||||
| C14:0 | 0.7 | 0.8 | – | 1.4 |
| C16:0 | 9.8 | 8.8 | 9.5 | 20.7 |
| C17:0 | 0.2 | 0.3 | 0.6 | 0.8 |
| C18:0 | 0.6 | – | – | – |
| 饱和支链脂肪酸 | ||||
| Saturated branched-chain fatty acids | ||||
| iso-C14:0 | 2 | 1.5 | 2.2 | 2.4 |
| iso-C15:0 | 7.3 | 8 | 8.2 | 10.6 |
| iso-C16:0 | 8.8 | 7.4 | 5.3 | 7.8 |
| iso-C17:0 | 3.3 | 2.3 | 2.6 | 2.4 |
| anteiso-C15:0 | 50.2 | 55.7 | 51.5 | 40.6 |
| anteiso-C17:0 | 16.3 | 15.1 | 15.8 | 13.3 |
| 不饱和直链脂肪酸 | ||||
| Unsaturated straight-chain fatty acids | ||||
| C16:1ω11c | – | – | 1.4 | – |
| 不饱和支链脂肪酸 | ||||
| Unsaturated branched-chain fatty acids | ||||
| Summed features 4a | – | – | 0.7 | – |
| 注:a: Summed features表示某些不能被鉴定的混合脂肪酸. Summed feature 4包括iso-C17:1和/或anteiso-C17:1脂肪酸. | ||||
| Note: a: Summed features are groups of fatty acids which were could not be separated by GLC with the MIDI system; Summed feature 4 consists of one or more of the following fatty acids: iso-C17:1 and/or anteiso-C17:1. | ||||
在地球上分布的众多盐湖、海洋以及人工盐池等高盐环境,其中蕴藏着丰富的中度嗜盐菌资源。这类菌能够适应很宽盐浓度范围且在3%−15% NaCl (质量体积比)中有最佳生长。因此其独特的生理生化特征、代谢机理和盐适应机制及其潜在应用越来越受到重视,近几年我国科学家加快了对中度嗜盐菌菌种资源的挖掘工作[7-10, 18]。新疆拥有众多在地理位置上特殊的盐/碱湖为分离这类的微生物提供了良好的契机[27-29]。
本课题组通过系列稀释和平板分离技术获得了BZ-SZ-XJ39分离株,其来源于乌鲁木齐以东 70 km处315国道附近的一个盐碱湖(俗称新疆盐碱湖,pH测定约为8.3,Na+浓度约为1.54 mol/L,Mg2+约为0.57 mol/L)。16S rRNA基因序列相似性搜索和系统发育地位的分析结果表明,菌株BZ-SZ-XJ39与B. saliphilus 6AGT、B. daliensis DLS13T、B. chagannorensis CG-15T和B. agaradhaerens DSM8721T在分子进化上存在着近缘关系(图 1)。菌株BZ-SZ-XJ39与B. saliphilus 6AGT关系较为密切,它与芽孢杆菌属内其他物种模式株的16S rRNA基因序列相似性偏低(<97.5%),这意味着其可能为芽孢杆菌属的一个新成员。以上结果加强了人们对芽孢杆菌属微生物多样性的新认识。
虽然已发现一些属于芽孢杆菌属的耐盐/碱(或者嗜盐/碱)菌,但是最佳生长符合中度嗜盐菌范畴的成员仍然较少。本课题组分离的菌株BZ-SZ-XJ39生长最适盐度为8%且依赖于Na+ (最低盐度需>0.5% NaCl),符合中度嗜盐菌的定义[1-2]。参比菌株B. daliensis DLS13T为轻度嗜盐菌;而菌株BZ-SZ-XJ39、B. saliphilus 6AGT和B. agaradhaerens DSM8721T均为中度嗜盐菌,它们生长的最适pH都偏碱性(>8.0)且为中温菌(表 1)。虽然菌株BZ-SZ-XJ39和6AGT都属于芽孢杆菌属,然而经过长期高盐高温胁迫培养,未发现芽孢[21];文献[30]表明,少数芽孢杆菌也不产芽孢,究其原因还不清楚,可能是科研工作者目前仍未找到芽孢产生的条件或者长期进化导致芽孢产生的分子机理已经退化,因此对于确定菌株BZ-SZ-XJ39是否产芽孢这一重要特征还需进一步验证。相对于芽孢杆菌属中的其它近缘菌株,菌株BZ-SZ-XJ39在一些生理生化特性上表现有所不同(表 1)。例如菌株BZ-SZ-XJ39耐盐能力强,其可在NaCl浓度为28%的高盐培养基中生长;菌株BZ-SZ-XJ39可以水解其他3株参比菌株不能水解的可溶性淀粉;菌株BZ-SZ-XJ39不能产生吲哚(Indole)和硫化氢(H2S)等特性。此外,菌株BZ-SZ-XJ39能利用的碳源也较广泛,能合成多种类型的水解酶,对所供试的大多数抗生素敏感。
此外,菌株BZ-SZ-XJ39所含的脂肪酸组分与供试近缘菌株相似。例如菌株BZ-SZ-XJ39细胞中的饱和支链脂肪酸总含量可达到88%,占有绝对的优势(表 2)。在相对脂肪酸含量大于5%的单组分中,菌株BZ-SZ-XJ39与DLS13T、CG-15T脂肪酸含量差异小。此外,本研究还测定了菌株BZ-SZ-XJ39极性脂组成成分。
总而言之,通过中度嗜盐的Bacillus sp. BZ-SZ-XJ39菌株微生物学特性研究,阐明了其分类学地位及其生物学特性,这些特征可以为将来的应用基础研究提供必要的微生物资源及关键数据支持,将为探索生命在高盐环境中存在的本质提供新素材,也可为生物技术的潜在应用提供新抗逆原件。
| [1] | Ventosa A, Nieto JJ, Oren A. Biology of moderately halophilic aerobic bacteria[J]. Microbiology and Molecular Biology Reviews, 1998, 62 (2): 504–544. |
| [2] | Zhao BS, Yang LF, Wang L, et al. Study progress on compatible solutes in moderately halophilic bacteria[J]. Acta Microbiologica Sinica, 2007, 47 (5): 937–941. (in chinese) 赵百锁, 杨礼富, 王磊, 等. 中度嗜盐菌相容性溶质机制的研究进展[J]. 微生物学报, 2007, 47 (5):937–941. |
| [3] | Zhao BS, Yan YC, Chen SL. How could haloalkaliphilic microorganisms contribute to biotechnology?[J]. Canadian Journal of Microbiology, 2014, 60 (11): 717–727. |
| [4] | Zhao BS, Yang LF, Song L, et al. Biotechnology applications in moderately halophilic eubacteria[J]. Microbiology China, 2007, 34 (2): 359–362. (in chinese) 赵百锁, 杨礼富, 宋蕾, 等. 中度嗜盐菌在生物技术中的应用[J]. 微生物学通报, 2007, 34 (2):359–362. |
| [5] | Sylvan JB, Hoffman CL, Momper LM, et al. Bacillus rigiliprofundi sp. nov., an endospore-forming, Mn-oxidizing, moderately halophilic bacterium isolated from deep subseafloor basaltic crust[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65 (6): 1992–1998. |
| [6] | Hong SW, Kwon SW, Kim SJ, et al. Bacillus oryzaecorticis sp. nov., a moderately halophilic bacterium isolated from rice husks[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64 (8): 2786–2791. |
| [7] | Lei ZC, Qiu P, Ye RY, et al. Bacillus shacheensis sp. nov., a moderately halophilic bacterium isolated from a saline-alkali soil[J]. The Journal of General and Applied Microbiology, 2014, 60 (3): 101–105. |
| [8] | Bagheri M, Didari M, Amoozegar MA, et al. Bacillus iranensis sp. nov., a moderate halophile from a hypersaline lake[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62 (4): 811–816. |
| [9] | Chen YG, Zhang YQ, He JW, et al. Bacillus hemicentroti sp. nov., a moderate halophile isolated from a sea urchin[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61 (12): 2950–2955. |
| [10] | Xue Y, Ventosa A, Wang X, et al. Bacillus aidingensis sp. nov., a moderately halophilic bacterium isolated from Ai-Ding salt lake in China[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58 (12): 2828–2832. |
| [11] | Yumoto I, Hirota K, Goto T, et al. Bacillus oshimensis sp. nov., a moderately halophilic, non-motile alkaliphile[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55 (2): 907–911. |
| [12] | Liu GH, Liu B, Lin NQ, et al. Phyletic evolution and taxonomic characteristics of Bacillus[J]. Fujian Journal of Agricultural Sciences, 2008, 23 (4): 436–449. (in chinese) 刘国红, 刘波, 林乃铨, 等. 芽孢杆菌的系统进化及其属分类学特征[J]. 福建农业学报, 2008, 23 (4):436–449. |
| [13] | Reddy GS, Uttam A, Shivaji S. Bacillus cecembensis sp. nov., isolated from the Pindari glacier of the Indian Himalayas[J]. International Journal of Systematic and Evolutionary Microbiology, 2008, 58 (10): 2330–2335. |
| [14] | Zhao BS, Chen SL. Alkalitalea saponilacus gen. nov., sp. nov., an obligately anaerobic, alkaliphilic, xylanolytic bacterium from Soap Lake, Washington State, USA[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 32 (11): 2618–2623. |
| [15] | Zhao BS, Wang H, Li RR, et al. Thalassospira xianhensis sp. nov., a polycyclic aromatic hydrocarbon-degrading marine bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60 (5): 1125–1129. |
| [16] | Tamura K, Stecher G, Peterson D, et al. MEGA6: Molecular evolutionary genetics analysis version 6[J]. Molecular Biology and Evolution, 2013, 30 (12): 2725–2729. |
| [17] | Gerhardt P, Murray RGE, Wood WA, et al. Methods for General and Molecular Bacteriology. Methods for General and Molecular Bacteriology[M]. Washington, DC: American Society for Microbiology, 1994 . |
| [18] | Zhao BS, Wang H, Mao XW, et al. Halomonas xianhensis sp. nov., a moderately halophilic bacterium isolated from a saline soil contaminated with crude oil[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62 (1): 173–178. |
| [19] | Dong XZ, Cai MY. The Identification Manual of Systematic Bacteriology[M]. Beijing: Science Press, 2001: 62 -65. (in chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 62 -65. |
| [20] | Romano I, Lama L, Nicolaus B, et al. Bacillus saliphilus sp. nov., isolated from a mineral pool in Campania, Italy[J]. International Journal of Systematic and Evolutionary Microbiology, 2005, 55 (1): 159–163. |
| [21] | Zhai L, Liao TT, Xue YF, et al. Bacillus daliensis sp. nov., an alkaliphilic, Gram-positive bacterium isolated from a soda lake[J]. International Journal of Systematic and Evolutionary Microbiology, 2012, 62 (4): 949–953. |
| [22] | Subhash Y, Sasikala Ch, Ramana ChV. Bacillus luteus sp. nov., isolated from soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64 (5): 1580–1586. |
| [23] | Carrasco IJ, Márquez MC, Xue Y, et al. Bacillus chagannorensis sp. nov., a moderate halophile from a soda lake in Inner Mongolia, China[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57 (9): 2084–2088. |
| [24] | Nielsen P, Fritze D, Priest FG. Phenetic diversity of alkaliphilic Bacillus strains: proposal for nine new species[J]. Microbiology, 1995, 141 (7): 1745–1761. |
| [25] | Spring S, Ludwig W, Marquez MC, et al. Halobacillus gen. nov., with descriptions of Halobacillus litoralis sp. nov. and Halobacillus trueperi sp. nov., and transfer of Sporosarcina halophila to Halobacillus halophilus comb. nov[J]. International Journal of Systematic Bacteriology, 1996, 46 (2): 492–496. |
| [26] | Márquez MC, Carrasco IJ, de la Haba RR, et al. Bacillus locisalis sp. nov., a new haloalkaliphilic species from hypersaline and alkaline lakes of China, Kenya and Tanzania[J]. Systematic and Applied Microbiology, 2011, 34 (6): 424–428. |
| [27] | Ye CY, Wang ZM, Zhao SQ, et al. Sedimentary characteristics since 280 ka B. P. in Gasikule Salt Lake in western Qaidam basin[J]. Acta Sedimentologica Sinica,, 2014, 32 (1): 95–92. |
| [28] | Zhu L, Yang HM, Wang Y, et al. Archaeal diversity in sediment of Dunbasitawu salt lake, Xinjiang, China, estimated by 16S rRNA gene sequence analyses[J]. Acta Microbiologica Sinica, 2012, 52 (6): 769–775. (in chinese) 朱莉, 杨红梅, 王芸, 等. 新疆顿巴斯他乌盐湖沉积物免培养古菌多样性[J]. 微生物学报, 2012, 52 (6):769–775. |
| [29] | Wu HP, Wang ZH, Yang LF. The selective enrichment and diversity analysis of halophilic bacteria in sedimental sample from Daban salt lake in Xinjiang[J]. Microbiology China, 2010, 37 (7): 956–961. (in chinese) 吴海平, 王真辉, 杨礼富. 新疆达坂盐湖沉积土壤嗜盐细菌的定向富集与多样性分析[J]. 微生物学通报, 2010, 37 (7):956–961. |
| [30] | Logan NA, de Vos P. Family Bacillaceae[M]//De Vos P, Garrity GM, Jones D, et al., eds. Bergey’s Manual of SystematicBacteriology: Firmicutes. 2nd Edition, vol 3. New York: Springer,2009 |
 2016, Vol. 43
2016, Vol. 43