扩展功能
文章信息
- 韦善君, 张雪萌, 李婧贤, 戴景峰, 冉坤念, 刘立亚, 周宜君
- WEI Shan-Jun, ZHANG Xue-Meng, LI Jing-Xian, DAI Jing-Feng, RAN Kun-Nian, LIU Li-Ya, ZHOU Yi-Jun
- 枯草芽胞杆菌紫外线诱变实验方案的优化
- Optimized protocol for ultraviolet mutagenesis of Bacillus subtilis
- 微生物学通报, 2016, 43(3): 695-700
- Microbiology China, 2016, 43(3): 695-700
- DOI: 10.13344/j.microbiol.china.150447
-
文章历史
- 收稿日期: 2015-06-10
- 接受日期: 2015-11-12
- 优先数字出版日期(www.cnki.net): 2016-01-07
“微生物学”是生物科学类专业的一门专业基础课,也是环境科学、制药工程、食品科学与工程等多个专业的选修课。作为一门应用面广、实践性强的学科,其微生物学实验技术教学是不可或缺的重要教学环节[1]。如何提高学生的学习兴趣,培养学生综合实践能力和创新能力,是目前教学改革中的重要课题。近年来,诸多高校在微生物学实验内容中增加综合与设计性实验的比例[2, 3, 4, 5, 6],通过设置某一个主题,由学生查阅文献和设计实验,开展系列实验活动,整理和总结实验结果,并分析讨论存在的问题。这种教学过程的实施,培养了学生对微生物学实验研究的整体思维,取得了良好的效果。
遗传与育种是微生物理论和实验教学的主要内容[7, 8],紫外线诱变是微生物育种常用有效方法。在微生物学实验教学中可以将“微生物的紫外线诱变育种”设置为一个综合设计性实验[9, 10],教师提供适宜的菌种,提出育种目标,学生根据文献资料设计并开展实验。该实验的开设不仅能够考核学生对已学习的培养基配制与灭菌、微生物接种与培养、无菌操作等技能的掌握情况,还给学生进一步传授紫外线对细胞的杀伤作用以及用于微生物诱变育种的方法。枯草芽胞杆菌具有产生α-淀粉酶、蛋白酶、脂肪酶、纤维素酶等多种生理性状,这些性状的变化容易被检测到。该细菌还是一种重要的工业生产菌,在食品、酶制剂、饲料行业得到广泛的应用[11, 12]。因而将枯草芽胞杆菌用于微生物的紫外线诱变实验教学,具有可操作性和实用性。我们以“枯草芽胞杆菌的紫外诱变筛选胞外淀粉酶突变株”为题目,进行了多年的综合设计性实验教学。在教学中我们发现,学生实验普遍存在两个问题,一是涂布接种的平板菌落无法计数或计数误差大;二是辐射效应不稳定,依据辐射剂量绘制的致死效应曲线呈“波浪”状,不同小组得到的实验结果差异较大。在现有的多个教材版本中,对获得有效单菌落平板的注意事项和紫外线辐射致死效应的影响因素问题都没有特别强调或注释[8]。根据多年的教学实践,我们发现上述问题的产生的原因可能有:(1) 制备的菌悬液菌体分散不充分,梯度稀释不准确;(2) 用于涂布平板的菌悬液浓度不合适;(3) 涂布接种后培养基平板表面有液层;(4) 在辐射过程中,菌悬液用量和搅拌速度不一致,导致菌体接触紫外线的程度不一样,死亡率差异大。
为了让学生获得理想的实验结果,培养他们对实验的自信心,本文对上述问题的解决方案进行了实验探究,获得了较好的效果。现将解决方案及相关问题进行总结,以供相关教学参考。
1 材料与方法 1.1 供试菌株和培养基实验用菌株为中央民族大学生物实验中心保存的枯草芽胞杆菌(Bacillus subtilis)。细菌培养用淀粉培养基[8],固体培养基中添加琼脂粉18 g/L。培养基于(1.0−1.5)×105 Pa条件下灭菌30 min后备用。
1.2 菌悬液的制备用固体斜面或液体培养基活化菌体,在37 ℃静置或150 r/min振荡培养。用无菌生理盐水刮洗斜面菌苔,或液体培养物于5 000 r/min离心5 min收集菌体,转接入100 mL无菌三角瓶内,加入适量无菌生理盐水和1枚无菌大头针,在磁力搅拌器上搅拌至菌体充分散开,制得菌悬液。
1.3 活菌数测定采用平板菌落计数法计菌悬液中的活菌数。(1) 用无菌生理盐水对菌悬液进行适度稀释,用751型分光光度计测定其在600 nm处的吸光值OD600。(2) 对菌悬液进行10倍梯度稀释,选用估测浓度在102−103 cfu/mL之间的两个连续的梯度稀释液,取0.1 mL涂布平板。涂布接种设置3种处理:① 涂布后培养皿在超净工作台内半开盖晾干表面,盖内无水珠;② 未晾干(表面有液流),盖内无水珠;③ 表面晾干,但培养皿盖内附有较多水珠;每处理3个重复。接种后的培养皿于37 ℃生长箱中倒置培养,14−16 h后观察平板的菌落形成特征,统计有效平板中的菌落数[8],根据稀释度计算原始菌悬液浓度。
1.4 紫外线辐射及致死效应评价紫外线辐射参考实验指导书中的方法,并做适当改进[8]。超净工作台紫外灯为石英紫外线低压泵消毒灯,灯光波长253.7 nm,功率30 W。将79-1型磁力搅拌器放到超净工作台上,调节搅拌器台面与辐射光源距离为28.5 cm。辐射前先打开紫外灯15 min使光源稳定。在无菌培养皿(内径Φ=90 mm)中装适量菌悬液,放入一枚无菌大头针,置于磁力搅拌器上,先带盖辐射1 min,然后打开培养皿盖对菌悬液进行辐射,盖上培养皿盖以终止辐射。辐射菌悬液用量设计6、8和12 mL 3种体积,搅拌速度设0.5 (约300 r/min)和2档(约1 200 r/min)两种速度,辐射剂量以时间作为变量,以未辐射的菌悬液为对照。计数各辐射处理及对照中的活菌数,根据公式计算致死率[13]:
$致死率 = \frac{\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\!\! {({\rm{对照活菌数}} - {\rm{诱变后活菌数}})}}{{{\rm{ \quad \quad 对照活菌数 \quad \quad \quad \quad }}}} \times 100\% $
2 实验方案改进结果 2.1 菌悬液制备方案的改进细菌的紫外线诱变辐射对象一般是单细胞悬液。在实验教材中,菌悬液的制备方法通常采用固体斜面活化菌种,用无菌生理盐水刮洗菌苔,然后振荡10 s左右即可。枯草芽胞杆菌呈长链状排列,在固体斜面上培养16 h以上形成菌苔,用无菌生理盐水刮洗时多以大小不一的块状脱落,部分菌块搅拌30 min以上仍然不能充分散开。
改用液体振荡培养菌体8 h,经5 000 r/min离心收集、无菌生理盐水重悬的菌体,搅拌约15 min可以获得分散性良好的菌悬液。对液体培养8−40 h的菌体制备菌悬液的效果进行比较,结果表明,随着培养时间的延长,菌悬液中块状菌体增加,培养40 h菌体打散比较困难。因而,在离心设备充足的实验室,建议采用液体培养基活化菌体,制备的菌悬液量大、均一性好,操作速度快,菌体培养时间短时效果更佳。
2.2 菌悬液浓度估测方案的改进在细菌紫外线诱变实验教学中,最基本的数据是各辐射处理前后的活菌数。通常采用平板菌落计数法进行计数[8]。该计数方法需要获得单菌落数量为30−300之间的有效平板,这就需要估测菌悬液浓度,以利于选择适宜稀释度的菌悬液涂布接种。计数微生物细胞数量的快速方法之一是血球计数板计数法[8]。由于细菌个体小、菌体无色等原因,菌体不易观察,菌体重叠或过于密集时计数误差大,学生操作也比较慢。细菌悬液对波长为450−600 nm的光有吸收,在一定范围内吸光度与浓度呈正比。因此,实验中可以采用比浊法代替血球计数板法估算浓度。本研究测定了枯草芽胞杆菌不同菌悬液在600 nm处的吸光度值,通过平板菌落计数法测得活菌数,然后以活菌数浓度的对数为纵坐标(y),吸光度值为横坐标(x),制得菌悬液浓度-吸光度值之间的标准曲线,其回归方程为:y=1.140x+7.554 (R2=0.996) (图 1)。本研究中多次使用该回归方程估测浓度以指导菌悬液稀释,都获得了有效的计数平板。
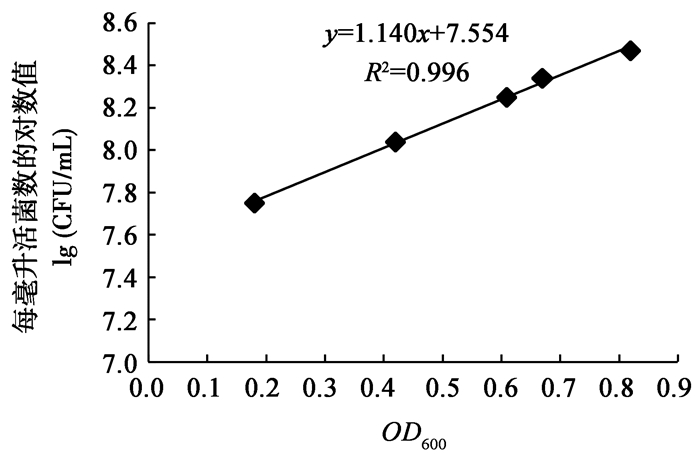 |
| 图 1 菌悬液浓度与吸光度值OD600的关系曲线 Figure 1 The relationship between concentration and OD600 of B. subtilis suspension |
| |
在有效估测菌悬液浓度的基础上,涂布接种后培养产生单菌落是成功计数又一关键环节。若把握不好,经常出现平板菌落数过多,或菌落扩散连成一体等现象,影响活菌的准确计数。观察发现,学生在实验过程一般是平板现制现用,而且通常在培养基较热时即倒平板,水蒸汽使培养皿内盖上附着大量水珠,涂布平板未等表面晾干即放到培养箱中 培养,培养后易出现菌苔,无法计单克隆。本研究结果表明,对于估测浓度为1.77×108 CFU/mL的菌悬液,用10−5稀释液0.1 mL涂布接种,晾干平板表面后转到培养箱中培养,单菌落生长良好,平均数量为289个/皿(图 2A)。若接种时快速涂布,平板未晾干,倾斜时看到表面有明显的液流,培养后菌落偏大,有的连成片状的菌苔(图 2B)。当培养基平板盖内表面附着较多水珠时,接种后即使晾干了表面,倒置培养后,也有局部菌落连成一体,影响计数(图 2C)。以上结果表明,菌悬液浓度、接种后平板表面湿度、培养皿盖内表面湿度都会影响单菌落的形成。
 |
| 图 2 细菌在平板上的生长 Figure 2 Growing of bacteria inoculated on plates |
| |
由于枯草芽胞杆菌有鞭毛[14],当平板表面有液层时菌体扩散快,所以培养后易出现菌落扩展相连的现象,严重时形成菌苔。当培养皿内盖上有较多水分时,在倒置培养过程中水分会蒸发到平板表面也会形成薄的液层,因而也出现菌落扩展相连的结果。因而,实验用培养皿建议采用干热法灭菌,或湿热灭菌后放到烘箱中烘干以后使用。培养基冷却至55−60 ℃ (手背感觉不烫)时倒平板,可以有效减少培养皿盖上的水分。涂布接种后,培养皿应半开盖放置于超净工作台中,使表面充分晾干(通常3 min左右),然后置37 ℃培养箱中培养12−16 h,可获得单菌落分布良好的平板。
2.4 紫外线辐射方案的改进对单细胞悬液进行紫外线辐射诱发突变是微生物育种的常用方法。辐射剂量的选择对诱变效果至关重要,太小起不到诱变的作用,太大则杀死菌体。“微生物的紫外线诱变育种”实验的另一个教学目的是让学生认识紫外线辐射致菌体死亡的剂量效应,掌握获得预定致死率的辐射剂量的确定方法。辐射剂量的控制方法包括光源的功率(光强)、辐射距离和辐射时间。在实践中,一般是通过控制时间来调节剂量(即以时间作为变量)。由于紫外线穿透力弱[14],只能对菌悬液表层的细胞起作用,为使菌悬液中细胞受到均匀辐射,辐射的同时进行搅拌[8]。本研究结果表明,在相同辐射剂量下,菌悬液量多、搅拌速度慢时菌体死亡率低(表 1)。实验中观察到,内径Φ=90 mm的培养皿中,8 mL的菌悬液刚好没过大头针,搅拌效果良好;6 mL的菌悬液可以布满培养皿底部,但由于培养皿底部中央略凸起,所以中央菌悬液过薄,未没过大头针,搅拌过程中未能充分带动培养皿边缘的菌悬液;12 mL菌悬液在培养皿中的液层较厚,在搅拌过程中菌体暴露于表面的机率降低。搅拌速度慢时,菌体被暴露到液层表面接触辐射的频次也下降,所以致死率也下降。在恒定的8 mL菌悬液用量和2档搅拌速度下,在辐射时间为15−300 s范围内,辐射剂量与致死效应呈现非常好的线性关系(图 3)。以上结果说明,培养皿中菌悬液用量以8 mL左右为宜,在辐射过程中用固定的搅拌速度,可以获得稳定的实验结果。
| 菌悬液体积 Volume of suspension (mL) | 搅拌速度 Stirring speed (grade) | 对照组活菌浓度 Colony forming units in the control (CFU/mL) | 辐射组活菌浓度 Colony forming units in the radiation group (CFU/mL) | 致死率 Fatality rate (%) |
| 6 | 2 | 2.52×107 | 87.65 | |
| 8 | 2 | 2.04×108 | 1.70×107 | 91.67 |
| 12 | 2 | 2.32×107 | 88.63 | |
| 8 | 0.5 | 2.95×107 | 85.54 |
 |
| 图 3 辐射剂量与致死效应的关系曲线 Figure 3 Relationship between ultraviolet radiation dose and lethal effects |
| |
综上所述,本研究得出的细菌紫外线诱变实验方案为:(1) 采用液体法活化菌体制备菌悬液,用比浊法估测菌悬液浓度;(2) 在内径Φ=90 mm的培养皿中加8 mL菌悬液,辐射时以恒定速度搅拌;(3) 根据估测的菌悬液初始浓度和预计辐射致死率将菌悬稀释至浓度为102−103 cfu/mL;(4) 取0.1 mL稀释液涂布接种,待培养基平板表面晾干后转培养箱中倒置培养;(6) 计菌落数,计算存活率。对该方案的验证实验结果见表 2。制备的菌悬液OD600值为0.80,根据OD600值与浓度关系方程 和辐射剂量与致死效应方程,估测菌悬液初始和辐射5 s后的活菌数分别为2.92×108 cfu/mL和4.39×107 cfu/mL。对照和辐射处理菌悬液分别稀释到5×10−6和5×10−5。各取0.1 mL涂布平板,测得的实际活菌数分别为3.29×108 CFU/mL和4.31×107 CFU/mL,5 s的辐射致死率为86.90%,均接近方案的估算值。
| 菌悬液OD600 of suspension | 处理 Treatment | 估测浓度 Estimated concentration (CFU/mL) | 稀释度 Degree of dilution | 实测浓度 Actual concentration (CFU/mL) | 存活率 Living rate (%) |
| 0.80 | CK | 2.92×108 | 5×10−6 | 3.29×108 | 100 |
| UV 5 s | 4.39×107 | 5×10−5 | 4.31×107 | 13.10 |
值得注意的是,对于不同的微生物,菌悬液浓度与OD600的关系曲线、紫外辐射剂量与致死效应曲线有差异,不同的辐射参数,包括紫外灯功率、辐射距离、搅拌速度、辐射菌悬液体积,对辐射致死效果也有影响。在紫外线诱变育种中多数采用致死率为85%−90%的辐射剂量[15, 16, 17],一些文献提出该致死率的辐射剂量为60−100 s[18, 19],甚至有些长达4−9 min[20, 21, 22, 23]。本实验中该致死率的辐射剂量为5−18 s,比文献报道的低很多,可能的原因之一是辐射参数差异,一般辐射用的紫外灯功率为15 W,我们辐射用的紫外灯功率为30 W,辐射用的菌悬液体积和搅拌速度与文献报道的也不同。另一种原因可能是我们所用的菌株对紫外线比较敏感。因而,在实验教学中,需要先通过预实验确定这两个曲线,以获得理想的实验结果。当获得一定紫外辐射诱变菌体后,则可以进行下一步的胞外酶活性的检测等实验。
| [1] | Zhou YJ, Liu Y, Dai JF, et al. Exploration and practice on the reformation for the microbiology experiment teaching methods[J]. Microbiology China, 2009, 36(10): 1609-1613 (in Chinese)周宜君, 刘越, 戴景峰, 等. 微生物学实验教学改革探索与实践[J]. 微生物学通报, 2009, 36(10): 1609-1613 |
| [2] | Hong L. The exploration of modular teaching pattern for Microbiology Experiment in Peking University[J]. Microbiology China, 2014, 41(4): 744-747 (in Chinese)洪龙. 北京大学微生物学实验课模块化教学的探索[J]. 微生物学通报, 2014, 41(4): 744-747 |
| [3] | Xiao XZ, Peng F, Che J, et al. Exploration on innovative experimental item construction for isolation of microorganisms in soil[J]. Microbiology China, 2014, 41(12): 2525-2529 (in Chinese)夏曦中, 彭方, 车婧, 等. 创新型实验教学项目建设的探索——土壤微生物分离实验[J]. 微生物学通报, 2014, 41(12): 2525-2529 |
| [4] | Lü LZ, Lin H, Chen XZ, et al. Reform and practice of environmental engineering microbiology experiment teaching[J]. Microbiology China, 2014, 41(10): 2149-2153 (in Chinese)吕绿洲, 林海, 陈秀枝, 等. 环境工程微生物学实验教学改革与实践[J]. 微生物学通报, 2014, 41(10): 2149-2153 |
| [5] | Yuan LH, Zhou H, Wei P, et al. Probing and practising of improving the microbiology experiment teaching[J]. Microbiology China, 2008, 35(4): 614-618 (in Chinese)袁丽红, 周华, 韦萍, 等. 提高微生物学实验课教学效果的探索与尝试[J]. 微生物学通报, 2008, 35(4): 614-618 |
| [6] | Liu ZW, Qu NR, Gao DW. Opening experiment of microbiology[J]. Microbiology China, 2011, 38(1): 118-122 (in Chinese)刘志伟, 屈年瑞, 高大威. 微生物学开放性实验的探索与研究[J]. 微生物学通报, 2011, 38(1): 118-122 |
| [7] | Zhou DQ. Microbiology Course[M]. 3rd Edition. Beijing: Higer Education Press, 2011: 198-216 (in Chinese)周德庆. 微生物学教程[M]. 第3版. 北京: 高等教育出版社, 2011: 198-216 |
| [8] | Sheng P, Chen XD. Experiment of Microbiology[M]. 4th Edition. Beijing: Higher Education Press, 2007: 32-34,51-54,126-131,208 (in Chinese)沈萍, 陈向东. 微生物学实验[M]. 第4版. 北京: 高等教育出版社, 2007: 32-34,51-54,126-131,208 |
| [9] | Mao N. Arabidopsis genome sequencing and plant functional genomics[J]. Microbiology China, 2001, 28(3): 96-98 (in Chinese)毛宁. 生物工程专业微生物学实验课的改革探索[J]. 微生物学通报, 2001, 28(3): 96-98 |
| [10] | Zhang XH, Hu QP, Zhang LH, et al. Design and practice of experimental teaching of microbiology relevant course[J]. Experiment Science and Technology, 2009, 7(4): 113-115 (in Chinese)张秀红, 胡青平, 张丽红, 等. 微生物学相关课程实验教学的设置与实践[J]. 实验科学与技术, 2009, 7(4): 113-115 |
| [11] | Schallmey M, Singh A, Ward OP. Developments in the use of Bacillus species for industrial production[J]. Canadian Journal of Microbiology, 2004, 50(1): 1-17 |
| [12] | Hu DP, Tang JY, Cao Y, et al. Isolation, identification and enzyme system distribution of bacterium Bacillus subtilis[J]. Fisheries Science, 2008, 27(2): 86-88 (in Chinese)胡德朋, 唐家毅, 曹昱, 等. 枯草芽孢杆菌的分离鉴定及酶系分布的研究[J]. 水产科学, 2008, 27(2): 86-88 |
| [13] | Peng WH, Li LP, Liu SQ, et al. Research on effective time of ultraviolet germicidal irradiation for air disinfection in a low temperature environment[J]. Chinese Journal of Modern Nursing, 2011, 17(22): 2637-2639 (in Chinese)彭卫红, 李丽萍, 刘素球, 等. 低温条件下紫外线照射进行空气消毒有效时间的研究[J]. 中华现代护理杂志, 2011, 17(22): 2637-2639 |
| [14] | Zhou J, Huang XH, Xiao BM, et al. Identification of a multi-functional Bacillus strain[J]. Chinese Journal of Microecology, 2013, 25(9): 997-1000 (in Chinese)周静, 黄晓辉, 肖冰梅, 等. 一株多功能芽孢杆菌的鉴定[J]. 中国微生态学杂志, 2013, 25(9): 997-1000 |
| [15] | Dai SY, He YJ, Shen WS, et al. Mutagenesis of a phosphate dissolving bacterial strain by UV and its application to rice cultivation in red soil[J]. Ecology and Environmental Sciences, 2010, 19(7): 1646-1652 (in Chinese)戴沈艳, 贺云举, 申卫收, 等. 一株高效解磷细菌的紫外诱变选育及其在红壤稻田施用效果[J]. 生态环境学报, 2010, 19(7): 1646-1652 |
| [16] | Zhang T, Liang HQ, Yang H, et al. The breeding of high-producing polysaccharide 202 strain by UV induced mutagenesis[J]. Guangxi Journal of Light Industry, 2005(3): 16-18 (in Chinese)张颋, 梁海秋, 杨辉, 等. 紫外诱变筛选高产可溶性葡聚糖PS202菌株的研究[J]. 广西轻工业, 2005(3): 16-18 |
| [17] | Liang JZ, Li YH, Fan HC. Screening of γ-Polyglutamic acid high productive strain using crop materials and optimization of fermentation condition[J]. China Biotechnology, 2007, 27(12): 46-51 (in Chinese)梁金钟, 李艳华, 范洪臣. 玉米原料高产γ-聚谷氨酸优良菌株的选育及发酵条件优化[J]. 中国生物工程杂志, 2007, 27(12): 46-51 |
| [18] | Jia J, Guo XH, Hui M, et al. Breeding of an anti-microbial Bacillus strain and study on the anti-microbial protein from the strain[J]. Science and Technology of Food Industry, 2005, 26(11): 53-56 (in Chinese)贾洁, 郭小华, 惠明, 等. 枯草芽孢杆菌R21-4的诱变育种及其抗菌蛋白性质的研究[J]. 食品工业科技, 2005, 26(11): 53-56 |
| [19] | Yin MH, Xu H, Cheng DL, et al. Selection of high acetoin-producing strain of Bacillus subtilis by UV mutation[J]. China Brewing, 2010(4): 76-79 (in Chinese)尹明浩, 徐慧, 程殿林, 等. 紫外诱变选育高产3-羟基丁酮枯草芽孢杆菌[J]. 中国酿造, 2010(4): 76-79 |
| [20] | Chen FL. Selection of stains for xylanase synthesis[J]. Bulletin of Fermentation Science and Technology, 2012, 41(2): 21-24 (in Chinese)陈凤莲. 木聚糖酶合成菌株的诱变选育[J]. 发酵科技通讯, 2012, 41(2): 21-24 |
| [21] | Xie FX, Zhao YJ, Zhou K, et al. The isolation, screening and ultraviolet mutation breeding of Bacillus subtilis strains producing extracellular amylase[J]. ACTA Agriculturae Boreali-Sinica, 2009, 24(3): 78-82 (in Chinese)谢凤行, 赵玉洁, 周可, 等. 产胞外淀粉酶枯草芽孢杆菌的分离筛选及其紫外诱变育种[J]. 华北农学报, 2009, 24(3): 78-82 |
| [22] | Yang S, Wang JS, Yang XJ, et al. Review on Bacillus subtilis mutagenesis high yield strain[J]. Academic Periodical of Farm Products Processing, 2014(3): 76-78 (in Chinese)杨森, 王金水, 杨小佳, 等. 枯草芽孢杆菌诱变育种研究进展[J]. 农产品加工(学刊), 2014(3): 76-78 |
| [23] | Bian CY, Huang ST, Pan DR, et al. Breeding of UV and EMS-induced mutant strains of Bacillus subtilis with enhanced thrombolytic enzyme production[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2014, 43(3): 312-315 (in Chinese)卞承荫, 黄舒婷, 潘大仁, 等. 利用紫外线和EMS诱变选育高产枯草芽孢杆菌[J]. 福建农林大学学报: 自然科学版, 2014, 43(3): 312-315 |
 2016, Vol. 43
2016, Vol. 43