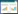扩展功能
文章信息
- 时玉菲, 章先, 谢珲, 王歆, 方维焕
- SHI Yu-fei, ZHANG Xian, XIE Hui, WANG Xin, FANG Wei-huan
- 金黄色葡萄球菌A型肠毒素双抗体夹心ELISA检测方法的建立及应用
- Development and application of DAS-ELISA for detection of staphylococcal enterotoxin A
- 微生物学通报, 2016, 43(3): 687-694
- Microbiology China, 2016, 43(3): 687-694
- 10.13344/j.microbiol.china.150416
-
文章历史
- 收稿日期: 2015-05-25
- 接受日期: 2015-06-09
- 优先数字出版日期(www.cnki.net): 2015-07-20
金黄色葡萄球菌(Staphylococcus aureus,SA)是一种广泛分布的重要人兽共患病病原,其致病力强弱主要取决于其产生的毒素以及侵袭性酶[1],包括肠毒素(Staphylococcal enterotoxins,SEs)、溶血素、杀白细胞素、血浆凝固酶等。该菌不仅能够引起人和动物的化脓性感染及脓毒败血症,是造成奶牛乳腺炎的最主要病原[2],其肠毒素还可通过污染食物而引起食源性疾病的暴发[3]。
SEs是由耐热核酸酶或血浆凝固酶阳性菌株产生的一类对热稳定的低分子量可溶性胞外蛋白质,除了5种传统肠毒素SEA、SEB、SEC、SED、SEE外,SEG、SEH、SEI、SEJ、SEK、SEL、SEM、SEN、SEO、SEIP、SEIQ、SEIR、SEIU和SEIV等肠毒素也随着研究不断被发现[4],已成为第二大类细菌毒素[5]。
近年来,由SEs引起的食物中毒已成为世界性的公共卫生问题之一[6],其中以A型肠毒素(Staphylococcal enterotoxin A,SEA)引起的食物中毒发生率最高、毒性最大、危害最为严重。在美国,SEA引起的食物中毒占肠毒素引起的中毒事件的77.8%,其次是SED和SEB,分别占37.5%和10%;在日本、法国、英国的SEs食物中毒事件中,SEA的地位居高不下[7];我国也以A型最为常见[8, 9, 10],被分泌SEA的金黄色葡萄球菌污染的食品原料是造成食物中毒的重要原因。因此,建立快速、灵敏、特异的检测方法以实现对食品及其原料中微量SEA的检出是预防SEA食物中毒的必要条件,具有重要的公共卫生意义。本研究以筛选特异性强、亲和力高的单克隆抗体为基础,建立了DAS-ELISA检测方法,可实现对SEA样品的定性及定量检测。
1 材料与方法 1.1 材料 1.1.1 实验动物及菌株:6周龄Balb/c雌性小鼠和2-3 kg清洁级新西兰大白兔雌兔均购自浙江省中医学院实验动物中心;金黄色葡萄球菌水产品分离株46株由浙江省舟山市出入境检验检疫局惠赠;金黄色葡萄球菌奶牛乳房炎分离株164株由浙江大学奶业科学研究所惠赠;pMD-18T克隆载体购自TaKaRa宝生物(大连)公司;产A型肠毒素的金黄色葡萄球菌(SA120926),DH5α和Rosetta大肠杆菌感受态细胞及原核表达载体pET-28a质粒,骨髓瘤细胞SP2/0等为本实验室保存。 1.1.2 主要试剂:SEA、SEB和SED标准品购自北京军事医学科学院;His-SEC2重组蛋白由本实验室制备冻存;PrimerSTAR高保真酶、Nde I、Xho I和DNA连接试剂盒均购自TaKaRa宝生物(大连)公司;弗氏完全佐剂(FCA)和不完全佐剂(FIA)购自美国Sigma公司;RPMI 1640培养基及次黄嘌呤、氨基喋呤、胸腺嘧啶脱氧核苷(HAT)和次黄嘌呤胸腺嘧啶脱氧核苷(HT)均购自GIBCO公司;ProteinA/G抗体纯化柱购自上海悦克生物科技有限公司;辣根过氧化物酶(HRP)标记的羊抗鼠和羊抗兔IgG均购自天津三箭生物技术有限公司;TMB显色液购自北京泰天河生物技术有限公司;肠毒素产毒培养基购自青岛海博生物技术有限公司。 1.1.3 主要器材:SpectraMax M5酶标仪购自美国Molecular Divice公司;96孔ELISA酶标板、细胞培养板和细胞培养皿购自美国Corning公司。 1.2 重组SEA免疫抗原制备 1.2.1 sea基因的扩增和克隆:根据GenBank公布的sea基因序列(GenBank:M18970.1)设计特异性引物(S. aureus-sea-F-Nde I: 5′-GAATTCCATATGAGCGAGAAAAGCGAAG-3′,S. aureus-sea-R-XhoI: 5′-CCGCTCGAGTTAACTTGTATATAAATATATATCAATATGC-3′),并在引物的5′端分别引入Nde I和基因组抽提试剂盒提取产SEA毒素金黄色葡萄球菌菌株(SA120926)基因组后,用设计的引物进行PCR扩增。反应体系为:DNA模板(118 mg/L) 1 μl,上下游引物(10 μmol/L)各0.5 μl,PrimerSTAR 0.3 μl,dNTPs mixture (2.5 mmol/L) 2.4 μl,2×PrimerSTAR® GC buffer 15 μl,ddH2O 10.3 μl。反应条件为:98℃ 3 min;98℃ 10 s,57℃ 5 s,72℃ 1 min,30个循环;72℃ 10 min。产物纯化后连接到pMD-18T载体中,转化重组质粒pMD-18T-sea至大肠杆菌DH5α感受态细胞中。挑取单菌落,PCR鉴定为阳性之后,提取质粒。 1.2.2 重组质粒pET-28a-sea构建:用限制性内切酶Nde I和Xho I分别对阳性质粒pMD-18T-sea和表达载体pET-28a进行双酶切,经琼脂糖凝胶电泳回收后连接,将连接产物转化入表达感受态细胞Rosetta中,提取质粒,经酶切鉴定后,将含有阳性重组质粒的菌命名为Rosetta-pET-28a-sea,将菌液送北京华大基因科技股份有限公司测序。 1.2.3 可溶性SEA的低温诱导表达及纯化:将测序正确的阳性菌接入含有卡那霉素的LB液体培养基(g/L,胰蛋白胨10,酵母提取物5,氯化钠10),37℃、200 r/min培养至OD600为0.6时,加入IPTG (终浓度1 mmol/L) 16℃诱导表达5 h,设置梯度摸索最佳诱导时间。将最佳诱导条件下表达的菌液经超声波裂解,分离上清与沉淀并进行SDS-PAGE分析。经镍螯合层析柱纯化获得目的蛋白,SDS-PAGE电泳分析其纯度,利用BCA法测定浓度后加甘油分装,-20℃备用。 1.3 抗SEA单克隆抗体的制备及纯化根据免疫程序[11],利用纯化后的重组His-SEA免疫6周龄Balb/c小鼠4次后,取血清抗体效价最高小鼠的脾细胞与杂交瘤细胞进行融合,先后用含HAT和HT的细胞培养基对融合后的细胞进行筛选。间接ELISA检测细胞上清筛选阳性杂交瘤细胞,以His-SEA作为抗原,以杂交瘤细胞上清作为一抗,以羊抗鼠IgG-HRP作为二抗,同时设立His-SEC为阴性对照排除与His标签反应的假阳性孔,选出特异性高、敏感性好、细胞生长旺盛的阳性孔有限稀释。3-5次亚克隆后,将阳性单克隆细胞株扩大培养注入石蜡提前致敏的小鼠腹腔,制备腹水,Protein A/G抗体纯化柱纯化,SDS-PAGE对纯化效果进行分析。
1.4 抗SEA多克隆抗体的制备将SEA与等量弗氏完全佐剂混合,乳化后对新西兰大白兔进行背部皮下多点注射免疫,500 mg/只。之后改用弗氏不完全佐剂乳化,隔两周免疫一次,四免后两周心脏采血获得血清,离心初纯后-20℃备用。
1.5 单克隆抗体的鉴定 1.5.1 单克隆抗体亲和力常数的测定:参考文献[12]所述方法对单克隆抗体进行亲和力常数测定,用2.5 mg/L和1.25 mg/L的SEA进行包被,倍比稀释已知浓度的单克隆抗体进行间接ELISA,酶标仪读波长为450 nm处的OD值,将平台期(抗体过量、抗原饱和,该区间内OD450值波动极小)的OD450值记为100%,并根据公式计算单克隆抗体亲和力常数:Ka=(n-1)/2(n×Ab1-Ab2),n=Ag2/Ag1
式中:Ag1、Ag2为两个不同的抗原包被质量浓度(mg/L);Ab1、Ab2为相应抗原包被浓度下OD450值为平台期一半时的对应的抗体摩尔浓度(mmol/L)。
1.5.2 单克隆抗体特异性的测定:用Western blot对单克隆抗体的特异性进行鉴定,将His-SEA、SEA、SEB、His-SEC2、SED以及产SEA菌株(SA120926)上清蛋白浓缩样SDS-PAGE,转膜后分别与腹水抗体作用来鉴定单克隆抗体与SEA的反应特异性。 1.6 DAS-ELISA检测方法的建立 1.6.1 方阵试验确定最佳抗体工作浓度:采用亲和力最高的单克隆抗体及兔多抗血清分别作为捕获抗体及检测抗体,方阵法确定最佳抗体浓度。捕获抗体包被浓度为1:250、1:500、1:1 000、1:2 000倍稀释,检测抗体工作浓度为1:1 000、1:2 000、1:4 000、1:8 000倍稀释,固定夹心抗原SEA浓度同时设立阴性对照,然后用DAS-ELISA一般方法进行试验,选择检测下限最低且对应夹心抗原浓度下P/N值最大的组合确定为最佳抗体工作浓度。 1.6.2 DAS-ELISA试验条件优化:根据1.6.1确定的抗体最佳工作浓度,分别试验在不同反应条件下,不同包被时间(37℃ 2 h,4℃ 12 h);封闭液(5%脱脂奶粉,10%脱脂奶粉,5% BSA,1% BSA),封闭时间(37℃ 1 h,37℃ 2 h,4℃ 12 h);多抗血清作用时间(37℃ 0.5 h,37℃ 1 h,37℃ 1.5 h,37℃ 2 h);酶标二抗(1:2 000-1:10 000),二抗作用时间(37℃ 0.5 h,37℃ 1 h,37℃ 1.5 h,37℃ 2 h),采用方阵法进行ELISA试验。检测同一阳性样品和阴性样品,选择P/N值最大时为最佳反应条件。 1.6.3 临界值的确定:选取40株经PCR鉴定为SEA阴性的金黄色葡萄球菌菌株,经肠毒素产毒培养基培养24 h后滤除菌体取上清作为SEA阴性样品,按照上述建立的DAS-ELISA方法进行测定。每份样品重复2孔,测定OD450值,进行统计学分析,计算40份培养上清OD450值的平均值($\bar x$)和标准方差(s),根据统计学原理,大于等于$\bar x$+3s为阳性,小于等于$\bar x$+2s为阴性,小于$\bar x$+3s且大于$\bar x$+2s为可疑样品。 1.6.4 标准曲线的绘制:根据1.6.1和1.6.2确定最佳反应条件,在该条件下建立DAS-ELISA曲线,夹心抗原的浓度区间为0.5-512 μg/L。以SEA的浓度对数为横坐标、OD450为纵坐标构建DAS-ELISA标准曲线,并求得曲线方程和相关系数。 1.7 DAS-ELISA检测的特异性、灵敏性及重复性评价用建立的DAS-ELISA方法检测1 mg/L的SEB、His-SEC2、SED等毒素样品,SEA标准品为阳性对照,同时设立空白对照,根据结果判定其特异性。根据1.6.3计算$\bar x$+2s在曲线中对应的质量浓度,计算该试验方法的检测下限[13]。在线性范围内选择3个质量浓度点,在一次试验中每个质量浓度测8个重复,连续测4个批次,计算批内及批间变异系数。
1.8 初步应用 1.8.1 鲜奶加标回收检测:应用DAS-ELISA对光明、伊利、蒙牛等品牌的15种产品(涵盖奶粉,鲜奶,酸奶,纯奶等)进行检测,选择不含肠毒素的产品进行加标回收试验。将已知浓度的SEA添加到不含肠毒素的鲜奶中,制备不同污染程度的样品。采用DAS-ELISA对污染后的样品进行检测,每个质量浓度测5个重复,计算OD450平均值在DAS-ELISA标准曲线中对应的质量浓度为实测浓度,根据实测浓度/添加浓度×100%计算回收率。 1.8.2 金黄色葡萄球菌分离株中SEA阳性株检测:应用DAS-ELISA对2012年舟山进出口检疫局自水产品中分离的46株金黄色葡萄球菌以及2005-2015年期间浙江大学奶业科学研究所从浙江、上海、新疆、山东、内蒙、河北、兰州、重庆、广东、陕西等地奶牛乳腺炎中分离到的164株金黄色葡萄球菌进行检测。金黄色葡萄球菌分离株接种LB复苏后转接入5 mL肠毒素产毒培养基,37℃产毒培养24 h后DAS-ELISA检测培养上清筛选阳性菌株。 2 结果与分析 2.1 重组质粒pET28a-sea的鉴定琼脂糖凝胶电泳可见,双酶切后得到约750 bp和5 000 bp的片段,与预期条带大小相符。测序结果与GenBank中M18970.1相比,核苷酸的相似性为100%。
2.2 重组蛋白的可溶性表达及纯化Rosetta-pET28a-sea经IPTG (终浓度1 mmol/L) 16℃低温诱导表达5 h后表达量理想,收集菌体超声破碎后进行SDS-PAGE发现,SEA重组蛋白总表达量的90%以上位于上清中。SEA重组蛋白大小在30 kD左右,与预期相符。收集Rosetta-pET28a-sea经IPTG 16℃诱导5 h后的菌体裂解上清,通过镍柱纯化获得高纯度的重组SEA蛋白(图 1)。
 |
|
图 1 SEA重组蛋白的可溶性表达及纯化
Figure 1 The soluble detection and purification of recombinant SEA protein
注:M:蛋白Marker;1:未诱导的Rosetta-pET28a-sea全菌蛋白;2-4:诱导1、3、5 h的全菌蛋白;5:诱导5 h后的菌裂解沉淀;6:诱导5 h后的菌裂解上清;7:纯化后的重组SEA.
Note: M: Protein molecular marker; 1: Non-induced Rosetta-pET28a-sea; 2-4: Whole bacteria with IPTG induction for 1,3 and 5 hours; 5: Precipitate after ultrasonication; 6: Supernatant after ultrasonication; 7: Purified recombinant SEA protein. |
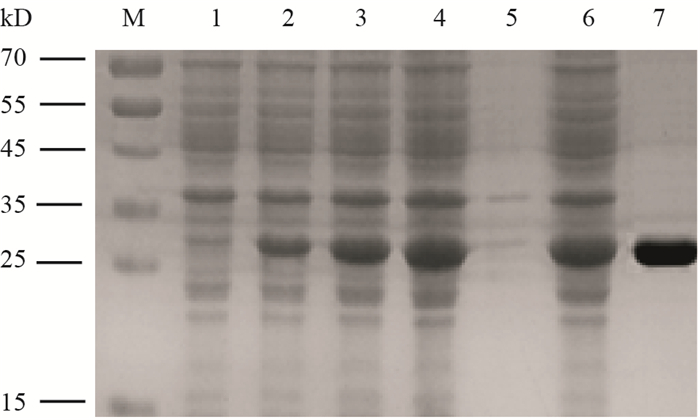
获得6株单克隆细胞株,分别命名为3D12、2C10、1G6、1F8、2A12和4C9,腹水效价均高于20万。Protein A/G纯化柱纯化后SDS-PAGE,在泳道中仅出现两条带,分子量大约在50 kD和25 kD左右(图 2),与抗体的重、轻链分子质量大小一致,纯化效果较好。
 |
|
图 2 纯化的腹水抗体SDS-PAGE电泳图谱
Figure 2 SDS-PAGE analysis of purified ascetic mAb
注:M:蛋白Marker;1:未纯化的腹水;2:纯化后的腹水.
Note: M: Protein molecular marker; 1: Non-Purified ascetic mAb; 2: Ascitic mAb purified by protein A/G plus beads. |
 |
|
图 3 腹水抗体3D12的Western-blot分析
Figure 3 Western-blot of anti-SEA ascetic mAb 3D12
注:M:蛋白Marker;1:His-SEA;2:SEA;3:SEB;4:His-SEC2;5:SED;6:产毒SEA菌株SA12096三氯醋酸法提取上清蛋白.
Note: M: Protein molecular marker; 1: His-SEA; 2: SEA; 3: SEB; 4: His-SEC2; 5: SED; 6: SEA natural toxin deposited by trichloroacetic acid form SA12096. |
| 项目 Items | 单抗包被 mAb 3D12 | 封闭条件 Blocking conditions | 样品 Sample | 多抗检测 Rabbit Ab | HRP标记二抗 IgG-HRP |
| Optimized dilutions | 1:500 | 5% Skim milk powder | 1:2 000 | 1:2 000 | |
| Reaction conditions | 4 °C, 12 h | 37 °C, 2 h | 37 °C, 1 h | 37 °C, 1 h | 37 °C, 1 h |
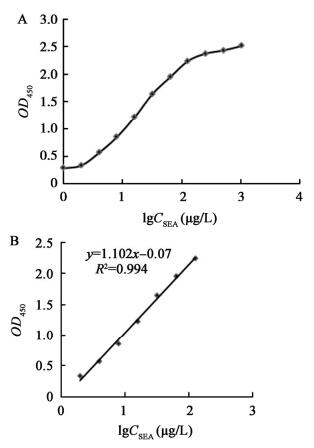 |
| 图 4 SEA的DAS-ELISA检测曲线(A)和线性回归分析(B) Figure 4 Detection of SEA by DAS-ELISA (A) and linear analysis (B) |
DAS-ELISA方法检测His-SEA和SEA呈阳性,SEB、His-SEC2和SED,OD450值均小于0.2呈阴性,说明建立的DAS-ELISA方法特异性良好。DAS-ELISA的有效检测范围为2-128 μg/L,$\bar x$+2s为0.233,计算OD450值0.233在标准曲线(y=1.102x-0.07)中对应的质量浓度,该试验方法检测下限为1.89 μg/L。重复试验中,批内和批间变异系数均小于10% (表 2),说明该方法重复性好。
| SEA (µg/L) | 批内变异系数 Intra batch (n=8) | 批间变异系数 Inter batch (n=4) | ||
| 平均数 $\bar x$±s | 变异系数 Cv (%) | 平均数 $\bar x$±s | 变异系数 cv (%) | |
|
8 32 64 |
0.85±0.061 1.66±0.076 1.95±0.055 |
7.17 4.59 2.82 |
0.85±0.073 1.67±0.101 2.04±0.185 |
8.61 6.04 9.06 |
| SEA (µg/L) | 批内变异系数 Intra batch (n=5) | 批间变异系数 Inter batch (n=4) | ||
| 平均数 $\bar x$±s | 变异系数 cv (%) | 平均数 $\bar x$±s | 变异系数 cv (%) | |
|
5 10 20 50 100 |
94.9±6.09 99.1±3.94 103.9±5.08 102.9±4.12 114.0±2.91 |
6.41 3.97 4.89 4.00 2.55 |
97.8±9.82 98.0±6.62 100.2±9.37 107.9±10.56 111.4±6.59 |
9.12 6.75 9.71 9.79 5.92 |
SEs基因往往以基因簇(cgc)[15]的形式存在,导致同一株金黄色葡萄球菌能够同时产生多种分子量相近、理化性质相似的肠毒素,用一般方法无法从金黄色葡萄球菌培养上清中完成SEs的分离和纯化,严重限制了SEA的纯化及检测方法的发展。本实验通过原核表达,利用PCR技术从产SEA的金黄色葡萄球菌菌株中扩增了sea序列,将该片段克隆至pET-28a载体中,在16℃低温条件下对重组菌Rosetta进行诱导表达,表达产物主要以可溶状态存在。原核表达的可溶性重组SEA与野生SEA在结构和活性上都基本一致[16]。
抗SEA单克隆抗体筛选过程中,以重组的His-SEC2作为阴性对照,排除了His标签以及其他相似结构的影响,确保了筛选出的单克隆抗体是针对SEA抗原的,具有良好的特异性。同时,通过比较6株单克隆抗体的亲和性,最终选择了高亲和力单克隆抗体杂交瘤细胞株3D12作为检测抗体并以此为基础建立了DAS-ELISA检测方法。该方法与SEB、His-SEC2、SED均无交叉反应,检测下限为1.89 μg/L,精密度和回收率均良好,可以实现对SEA样品的定量检测。采用DAS-ELISA检测方法对不同来源的金黄色葡萄球菌分离株进行产毒检测,均检测到SEA阳性菌株的存在。近年来的研究表明,奶牛乳腺炎已经成为发生最普遍、防治最难的奶牛疾病之一,在国内奶牛场的检出率可达54.3%[17],而金黄色葡萄球菌作为其最主要的病原菌,在奶牛乳腺炎特别是隐性乳腺炎中的带菌率高达85.4%[18]。本研究对2005-2015年从浙江、上海、新疆、山东、内蒙、河北、兰州、重庆、广东和陕西等地奶牛乳腺炎中分离到的164株金黄色葡萄球菌分离株进行产毒检测,SEA产毒菌株阳性率高达50.6%,表明具有SEA毒素分泌能力的金黄色葡萄球菌产毒菌株在国内的奶牛场广泛存在,揭示乳及乳制品从来源到成品都存在很大的安全风险。
目前常用的SEA检测方法均有其局限性。PCR方法仅能检测出肠毒素基因而不能直接检测肠毒素,而一般烹饪方法可以杀灭食物中的金黄色葡萄球菌却无法杀灭食物中的肠毒素,因此PCR方法很容易造成漏检[19, 20]。SN/T2416-2010规定了Western blot法检测进出口食品中的SEA,但该方法中易产生假阳性,检测下限也较高,为50 μg/L。在目前的生产及实验中,ELISA方法仍是应用最广泛、可信度较高的方法,但普遍采用多克隆抗体[21, 22],无法排除非特异性结合。刘鹏翀等[23]虽然利用单克隆抗体建立了SEs检测体系,但筛选的单克隆抗体可以与多种肠毒素反应,检测下限高达307 μg/L,无法满足高精度的检测要求。目前,SEA检测试剂盒主要由美国Biocontrol公司和德国拜发公司生产,前者只能进行定性检测,后者的检测下限为2 μg/L。进口试剂盒价格高昂,无法广泛应用于生产。本研究建立的DAS-ELISA检测方法特异性强、灵敏度高,能够与进口试剂盒相媲美,可用于SEA的初步定量及大批量样品检测,为相关食品中SEA污染的检测及SEA阳性菌株的筛选提供了有效手段。
| [1] | Yang B, Zhang XM, Luo SP, et al. Investigation on virulence determinants and genetic typing of Staphylococcus aureus isolated from mastitis milk[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2009, 18(5): 1-6(in Chinese)杨波, 张雪梅, 罗淑萍, 等. 奶牛乳房炎金黄色葡萄球菌毒力因子检测与基因分型[J]. 西北农业学报, 2009, 18(5): 1-6 |
| [2] | Memon J, Yang YC, Kashif J, et al. Genotypes, virulence factors and antimicrobial resistance genes of Staphylococcus aureus isolated in bovine subclinical mastitis from Eastern China[J]. Pakistan Veterinary Journal, 2013, 33(4): 486-491 |
| [3] | Liu W, Wang JG, Sun XH, et al. Analysis of enterotoxin of Staphylococcus aureus isolated from food and food poisoning samples[J]. chinese preventive medicine, 2013, 14(8): 608-611(in Chinese)刘伟, 王菊光, 孙晓华, 等. 日常食品及食物中毒样本中金黄色葡萄球菌肠毒素的分型检测分析[J]. 中国预防医学杂志, 2013, 14(8): 608-611 |
| [4] | Balaban N, Rasooly A. Staphylococcal enterotoxins[J]. International journal of food microbiology, 2000, 61(1): 1-10 |
| [5] | Li JP, Zhou HJ, Yuan L, et al. Genotyping of Staphylococcus aureus isolated from bovine mastitis using pulsed-field gel electrophoresis[J]. Chinese Journal of Preventive Veterinary Medicine, 2009, 31(9): 684-687(in Chinese)李建平, 周海健, 袁林, 等. 奶牛乳房炎金黄色葡萄球菌脉冲场凝胶电泳分型研究[J]. 中国预防兽医学报, 2009, 31(9): 684-687 |
| [6] | Kadariya J, Smith TC, Thapaliya D. Staphylococcus aureus and staphylococcal food-borne disease: an ongoing challenge in public health[J]. BioMed research international, 2014, 2014: Article ID 827965 |
| [7] | Argudín MÁ, Mendoza MC, Rodicio MR. Food poisoning and Staphylococcus aureus enterotoxins[J]. Toxins, 2010, 2(7): 1751-1773 |
| [8] | Shen XY, Song QF, Xu JY, et al. Study on the distribution of enterotoxin genotypes in foodborne Staphylococcus aureus[J]. Chinese Journal of Food Hygiene, 2012, 24(5): 427-429(in Chinese)沈玄艺, 宋启发, 徐景野, 等. 食源性金黄色葡萄球菌肠毒素基因型分布研究[J]. 中国食品卫生杂志, 2012, 24(5): 427-429 |
| [9] | Wang T, Lin L, Yan WL, et al. Effects of storage temperature and inoculum amount on the growth of Staphylococcus aureus and production of enterotoxin in whipping cream[J]. Food Science, 2014, 35(23): 210-214(in Chinese)王彤, 林露, 严维凌, 等. 温度和接种量对搅打奶油中金黄色葡萄球菌生长及产肠毒素的影响[J]. 食品科学, 2014, 35(23): 210-214 |
| [10] | Cui Y, Zhang D, Zhang XL. Laboratory analysis of a food poisoning case caused by Staphylococcus aureus and its enterotoxin[J]. Chinese Journal of Health Laboratory Technology, 2014, 24(8): 1162-1164(in Chinese)崔莹, 张丁, 张秀丽. 一起由金黄色葡萄球菌及其肠毒素引起的食物中毒实验室分析[J]. 中国卫生检验杂志, 2014, 24(8): 1162-1164 |
| [11] | Tong TG, Bai Y, Liu GL, et al. Expression, purification and monoclonal antibodies preparation of recombinant equine mature interleukin-18[J]. Veterinary Immunology and Immunopathology, 2010, 136(3/4): 194-200 |
| [12] | Wan wH. Monoclonal antibody affinity constant determination[J]. Journal of Monoclonal Antibody, 1993, 9(2): 72-75(in Chinese)万文徽. 单克隆抗体亲和常数的测定[J]. 单克隆抗体通讯, 1993, 9(2): 72-75 |
| [13] | Sun JZ, Wang XT, Liu XH, et al. Development and preliminary application of double antibody sandwich ELISA for detection of Clostridium perfringens alpha toxin[J]. chinese Journal of veterinary science, 2014, 34(6): 930-935,941(in Chinese)孙佳芝, 王新桐, 刘雪慧, 等. 产气荚膜梭菌α毒素双抗体夹心ELISA检测方法的建立及初步应用[J]. 中国兽医学报, 2014, 34(6): 930-935,941 |
| [14] | Sun YN, Teng M, Hu XF, et al. Preparation and immunological characterization of monoclonal antibody against ochratoxin A[J]. Food Science, 2011, 32(9): 236-240(in Chinese)孙亚宁, 滕蔓, 胡骁飞, 等. 抗赭曲霉毒素A单克隆抗体的制备及免疫学鉴定[J]. 食品科学, 2011, 32(9): 236-240 |
| [15] | Beatty JD, Beatty BG, Vlahos WG. Measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay[J]. Journal of Immunological Methods, 1987, 100(1/2): 173-179 |
| [16] | Xu QB, Liu CX, Ma QJ. Gene cloning, soluble expression and activity analysis of rSEA[J]. Chinese Journal of Biotechnology, 2003, 19(4): 402-406(in Chinese)胥全彬, 刘传暄, 马清钧. 金黄色葡萄球菌肠毒素A的基因克隆、表达及活性试验[J]. 生物工程学报, 2003, 19(4): 402-406 |
| [17] | Li JP, Zhou HJ, Yuan L, et al. Prevalence, genetic diversity, and antimicrobial susceptibility profiles of Staphylococcus aureus isolated from bovine mastitis in Zhejiang Province, China[J]. Journal of Zhejiang University Science B, 2009, 10(10): 753-760 |
| [18] | Ren M. Establishment of multiple PCR detection method for staphylococcus aureus virulence gene and the investigation of Staphylococcus aureus contamination in the raw milk at Yangling[D]. yangling: Master's thesis of Northwest A&F University, 2014(in Chinese)任敏. 金黄色葡萄球菌毒力基因多重PCR方法的建立及杨凌市售生鲜牛乳中该菌污染状况调查[D]. 杨凌: 西北农林科技大学硕士学位论文, 2014 |
| [19] | Li ZR. Enterotoxin gene profiles and genotypes of food-borne Staphylococcus aureus isolates from Shanghai[D]. Shanghai: Master's thesis of Shanghai Jiaotong University, 2012(in Chinese)李自然. 上海市食源性金黄色葡萄球菌肠毒素基因多样性及分型研究[D]. 上海: 上海交通大学硕士学位论文, 2012 |
| [20] | Peng GH, Hu ZH, Xue L, et al. Detection of Staphylococcus aureus and enterotoxin in food poisoning samples[J]. Modern Preventive Medicine, 2008, 35(20): 3943-3945(in Chinese)彭国华, 胡主花, 薛琳, 等. 食物中毒样品中金黄色葡萄球菌及肠毒素检测[J]. 现代预防医学, 2008, 35(20): 3943-3945 |
| [21] | Xu DD, Huang JH, Liu Y, et al. An indirect competitive ELISA method for quantitative analysis of staphylococcal enterotoxin A[J]. Science and Technology of Food Industry, 2010(10): 380-382,385(in Chinese)徐丹丹, 黄金海, 刘莹, 等. 葡萄球菌A型肠毒素检测竞争ELISA方法的建立[J]. 食品工业科技, 2010(10): 380-382,385 |
| [22] | Poli MA, Rivera VR, Neal D. Sensitive and specific colorimetric ELISAs for Staphylococcus aureus enterotoxins A and B in urine and buffer[J]. Toxicon, 2002, 40(12): 1723-1726 |
| [23] | Liu PC, Huang JH, Liu L, et al. Development and application of DAS-ELISA for detection of staphylococcal enterotoxin[J]. Food Science, 2012, 33(8): 195-198(in Chinese)刘鹏翀, 黄金海, 刘莉, 等. 葡萄球菌肠毒素DAS-ELISA检测方法的建立及应用[J]. 食品科学, 2012, 33(8): 195-198 |
 2016, Vol. 43
2016, Vol. 43