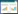扩展功能
文章信息
- 李迷, 王素英, 董世瑞
- LI Mi, WANG Su-Ying, DONG Shi-Rui
- 螺旋藻的超低温保存法
- Cryopreservation of Spirulina
- 微生物学通报, 2016, 43(3): 679-686
- Microbiology China, 2016, 43(3): 679-686
- 10.13344/j.microbiol.china.150418
-
文章历史
- 收稿日期: 2015-05-26
- 接受日期: 2015-10-21
- 优先数字出版日期(www.cnki.net): 2015-12-10
在螺旋藻研究领域和养殖行业,常用的藻种保藏措施为液体继代培养,该方法存在保藏周期短、易污染、人工传代培养次数多易造成藻种退化等缺陷,因此急需寻找一种可延长保藏时间、提高存活率的螺旋藻保藏技术[1]。超低温冷冻保存是一种以液氮为冷源,使细胞处于-196℃低温的保藏方法。生物材料在如此低温下,调节和控制细胞生长代谢的各种酶的作用受到极大抑制,活细胞内的新陈代谢和生理活动几乎完全停止,但细胞仍处于可逆的成活状态,避免了细胞遗传性状的改变和遗传漂变[2]。因此,近年来超低温保种技术在微藻藻种保藏方面的研究日益增多,并且发现除大多数鞭毛藻类、隐藻类外,许多淡水和海洋微藻成功利用超低温保藏法进行了藻种保藏,且硅藻、绿藻、黄绿藻、蓝藻的冷冻复苏率要好于其它种类的微藻[3, 4, 5]。Day[6]曾运用两步冷冻法将绿藻类中的原始小球藻(Chlorella protothecoides)保存了22年,是藻类超低温保藏时间最长的记录,遗传性状不但没有发生改变,还保持了很高的存活率(84.2%)。英国的Morris[7]研究了小球藻(Chlorella vulgaris)的冷冻保存技术,保存一年后存活率为100%。Hwang等[8]将7属9种微藻的22个品系,在-196℃的低温下保藏了5-8年的时间。
本文拟对螺旋藻的超低温保藏方法进行研究,探究超低温保存法对螺旋藻的适用性,为螺旋藻藻种的保藏提供一种安全、有效、长期保存的方法。
1 材料与方法 1.1 材料 1.1.1 藻种:FACHB-793、FACHB-810、FACHB-351、FACHB-1070、FACHB-794、FACHB-902、FACHB-971、FACHB-350,购自中国科学院水生生物研究所淡水藻种库。其中FACHB-351为盐泽螺旋藻(Spirulina subsalsa),FACHB-810、FACHB-1070、FACHB-971为螺旋藻(Spirulina sp.),FACHB-793、FACHB-794、FACHB-902、FACHB-350为钝顶螺旋藻(Spirulina platensis)。 1.1.2 主要试剂:甘油、甲醇、聚乙烯吡咯烷酮购自天津市风船化学试剂科技有限公司;二甲基亚砜、海藻糖、蔗糖购自天津市科密欧化学试剂有限公司。 1.1.3 主要仪器:Neofuge 18R台式高速冷冻离心机,香港力康发展有限公司;单列六孔电热恒温水浴锅,天津市中环实验电炉有限公司;U-5100分光光度计,日本Hitachi公司;家用电冰箱,博西华家用电器有限公司;超低温冰箱,美国Thermo Fisher Scientific;液氮罐,四川亚西橡塑机器有限公司。 1.2 实验方法 1.2.1 实验藻种耐低温性检测:将处于对数末期的8株螺旋藻的藻悬液在4℃、3 000 lx的条件下处理6 h,之后用碘量法[9]测定其光合放氧活性,比较8株螺旋藻的耐低温性,选取耐低温性最好的藻种进行超低温保存条件优化实验。 1.2.2 螺旋藻超低温保存条件优化实验:以筛选出的耐低温性最好的藻种为实验材料,将对数末期藻悬液(藻丝体密度为1×106 cfu/mL)在4℃黑暗条件下驯化12 h,再将藻液和保护剂分别在0℃预冷30 min,之后取1 mL藻液于2 mL冻存管中,并加入1 mL保护剂(保护剂配成使用体积分数的2倍),混匀后按照0℃ 1 h→-20℃ 1 h→-80℃ 1 h的程序将藻种预冻后投入液氮中保存24 h,之后于37℃水浴中快速回温复苏,然后用TTC-脱氢酶还原法测定螺旋藻细胞存活率。(1) 超低温保存条件优化单因素实验: 保持其它因子不变,变化单一因子,研究保护剂种类及浓度(二甲基亚砜、甘油、甲醇、聚乙烯吡咯烷酮、海藻糖、蔗糖,浓度都设5%、10%、15% 3个梯度)、藻丝体密度(1.0、2.5、5.0、7.5、10、12.5、15×106 cfu/mL)、驯化时间(0、12、24、36、48、60、72 h)、0℃停留时间(0、1、2、3、4、5 h)、-20℃停留时间(0、1、2、3、4、5 h)和-80℃停留时间(0、1、2、3、4、5 h)对螺旋藻细胞冷冻存活率的影响。
(2) 冷冻程序优化正交试验: 在单因素实验确定的最优藻丝体密度及最佳保护剂的基础上,为了确定最优降温程序,对低温驯化时间、0℃停留时间、-20℃停留时间、-80℃停留时间进行正交优化试验,以单因素实验确定的各因素适宜范围作为依据,每个因素各取3个水平,以冷冻24 h后螺旋藻细胞存活率作为筛选指标,按L9(34)正交试验表进行实验设计,每个处理重复3次。
(3) 细胞存活率的测定: 参考文献[10, 11]的方法,将解冻后藻液用蒸馏水离心(10 000 r/min,20 min)洗涤2次去除保护剂,在藻泥中加入5 mL 0.1% TTC溶液,35℃恒温水浴中暗处发色培养5 h之后离心(10 000 r/min,20 min),用蒸馏水清洗2次后于沉淀中加入5 mL体积分数为60%的乙醇溶液(含0.01 mol/L NaOH),在室温下放置30 min,然后加入3 mL正己烷振 荡2-3 min,稳定约15 min后测定正己烷萃取液在485 nm处的吸光度值,试验重复3次,试验数据取其平均值。按公式(1)计算细胞存活率。
| ${\rm{细胞存活率}} = \frac{{{\rm{冷冻处理藻}}TTC{\rm{值}}}}{{{\rm{未处理藻}}TTC值}} \times 100{\rm{\% }}$ | (1) |
在低温环境中参与光合作用的酶的活性减弱,光合作用随之降低,且氧气的释放量也随之减少,因此可通过水中氧含量的高低来反映藻株在低温条件下的生理状态,即水中氧含量越低说明藻株在低温环境中活性越低,越不耐受低温环境。室温下,用碘量法对经过低温处理的8株螺旋藻藻液的溶解氧(DO)含量进行了测定,结果见图 1。由图 1可见,实验藻株的耐低温性由高到低依次为FACHB-351> FACHB-810>FACHB-793>FACHB-794>FACHB-971> FACHB-1070>FACHB-902>FACHB-350,因此螺旋藻超低温保存条件的优化实验选取耐低温性最好的藻株FACHB-351。
 |
| 图 1 实验藻种耐低温性检测结果 Figure 1 Low temperature resistance test for the experimental algals Note: F is shorthand for FACHB. |
使用抗冻保护剂,且细胞类型不同对保护剂的种类及浓度要求也不同[12],因此首先探讨了保护剂的种类及浓度对FACHB-351藻株超低温保存的影响,结果见图 2。
 |
|
图 2 不同冷冻保护剂对螺旋藻存活率的影响
Figure 2 Effect of different protective agents on viability of theSpirulina
注:X:未加保护剂;A:二甲基亚砜;B:甘油;C:甲醇;D:聚乙烯吡咯烷酮;E:海藻糖;F:蔗糖.
Note: X: Without protective agent; A: Dimethyl sulfoxide; B: Glycerol; C: Methanol; D: Polyvinyl pyrrolidone; E: Trehalose; F: Sucrose. |
由图 2可知,添加保护剂的螺旋藻经过冷冻处理后均比X组未加保护剂直接冷冻处理的螺旋藻存活率(4.32%)要高,说明A-F这6种保护剂均对螺旋藻的超低温保存具有保护作用。但不同种类、不同浓度保护剂的保护效果不同,其中10%蔗糖溶液对F-351的保护效果最好,存活率为51.43%,15%聚乙烯吡咯烷酮解冻存活率最低,为7.64%。蔗糖是非渗透型保护剂,可使细胞外保存液中电解质的浓度降低,进入细胞内的阳离子数量减少,从而减缓细胞所受的冷冻损害,对细胞膜的完整性起到了一定的保护作用;在溶液中蔗糖与水分子还可通过水合作用使游离水含量降低,减缓冰晶的生成;并且糖分子的多个羟基可与微生物表面自由基结合,形成保护层,避免菌体直接暴露在介质中[13, 14]。
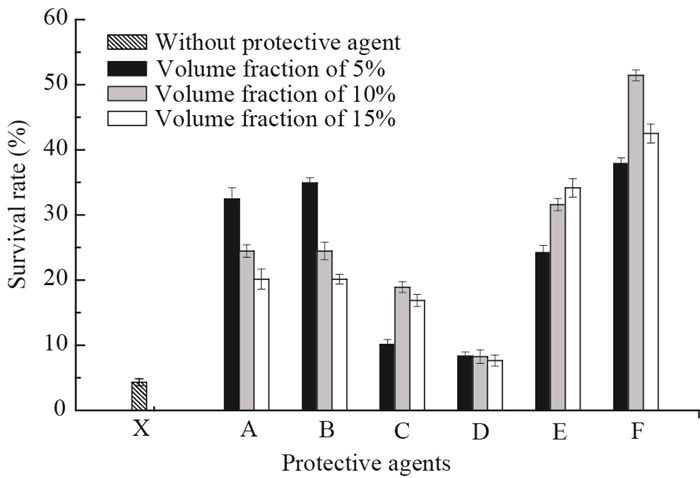
2.2.2 藻丝体密度对螺旋藻超低温保存效果的影响:藻丝体密度是影响藻类超低温保藏效果的重要因素之一,但关于其影响目前研究较少。Piasecki等[15]研究了细胞密度对衣藻(Chlamydomonas reinhardtii)冷冻存活率的影响,发现衣藻在高细胞密度下的冻融存活率很低。但是造成衣藻死亡的直接原因并不是因为高细胞密度,而是衣藻在冷冻和解冻时细胞壁在酶的作用下会释放一种或多种有害物质,这些物质在正常培养条件下对细胞无毒害作用,而在低温条件下可降低细胞的活性。由图 3可知,螺旋藻冷冻后细胞存活率随着藻丝体密度的增大而升高。藻丝体密度为1.0×106 cfu/mL时,存活率为48.04%,藻丝体密度增加至1.0×107 cfu/mL时,存活率为61.47%,之后随着藻丝体密度的升高,藻细胞存活率与细胞密度为1.0×107 cfu/mL时藻细胞存活率持平。螺旋藻高藻丝体密度对细胞的保护作用,可能是由于螺旋藻与衣藻不同,在冷冻过程中其细胞壁不会释放有害物质;同时,高细胞浓度可形成菌胶团,相 对减少了藻细胞暴露在冷冻介质中的面积;而且较大密度的藻悬液,还可保证藻种在长期保存后有足够量的活细胞。
 |
| 图 3 藻丝体密度对螺旋藻存活率的影响 Figure 3 Effect of different algal filament density on viability of the Spirulina |
 |
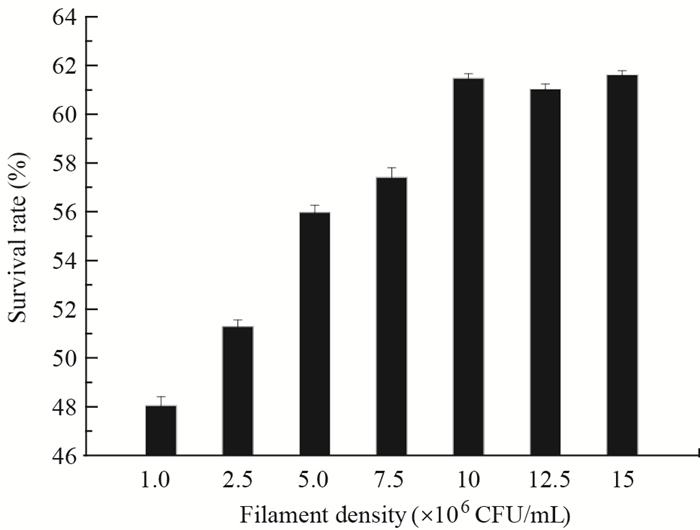
| 图 4 低温驯化时间对螺旋藻存活率的影响 Figure 4 Effect of different cold acclimation time on viability of the Spirulina |
从图 4可知,没有经过低温驯化的藻细胞抗冻能力较差,冷冻后存活率较低,将藻株在4℃低温下驯化,随着驯化时间的延长,螺旋藻冷冻保存后存活率也逐渐增大,驯化时间为60 h时存活率最高为54.97%,随后细胞存活率降低。所以螺旋藻在超低温保藏时应将藻细胞在4℃低温下驯化60 h,可提高藻种冷冻保藏后存活率。
2.2.4 0、-20、-80℃停留时间对冷冻存活率的影响:生物细胞在低温保藏时,降温速率影响细胞冷冻后的存活率。降温速度慢时,细胞脱水时间充分,不容易形成胞内冰;降温速度较快时,细胞内的水分还没能形成冰晶,便降到了-196℃的安全温度,形成对细胞结构没有伤害的玻璃化状;但是当降温速度在中间范围(200-5 000℃/min)时,脱水会导致细胞萎缩、产生胞内冰,从而对生物细胞产生不可逆的伤害[17]。由于不同类型细胞对冷冻伤害的敏感性不同,因此在超低温保存时需要采用不同的降温方法。由图 5可看出:降温过程中在0℃停留2 h时,冷冻后藻细胞的存活率最高为53.02%;在-20℃的停留时间为0 h时存活率最高为48.31%,停留1 h时存活率比0 h时存活率明显降低,但随着停留时间的延长,存活率与停留1 h时存活率基本持平,因此超低温保藏时-20℃停留时间应选择0 h;冷冻过程中在-80℃停留时间为0 h时存活率最高为53.42%,随着在-80℃停留时间的延长,存活率逐渐降低,因此超低温保藏时-80℃停留时间选择0 h。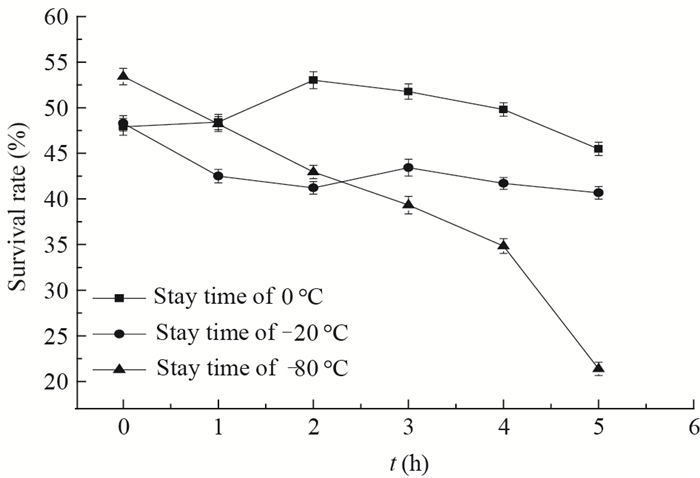 |
| 图 5 不同温度停留时间对冷冻存活率的影响 Figure 5 Effect of stay time of different temperature on viability of the Spirulina |
由单因素实验可知螺旋藻超低温保存最适藻丝体密度为1.0×107 cfu/mL,最佳保护剂为10%蔗糖溶液,本实验在固定螺旋藻藻丝体密度及保护剂的前提下,根据单因素实验结果对螺旋藻超低温保存冷冻过程的4个因素(4℃驯化时间、0℃停留时间、-20℃停留时间、-80℃停留时间)通过正交实验进行3水平优化,以获得螺旋藻超低温保存的最佳冷冻程序,因素水平见表 1,实验方案及结果见表 2。
| 水平 Level | A 驯化时间 Acclimation time (h) | B 0 °C停留时间 Stay time of 0 °C (h) | C −20 °C停留时间 Stay time of −20 °C (h) | D −80 °C停留时间 Stay time of −80 °C (h) |
| 1 | 48 | 1 | 0 | 0 |
| 2 | 60 | 2 | 0.5 | 0.5 |
| 3 | 72 | 3 | 1 | 1 |
由表 2极差分析可知,各因素水平的变化对螺旋藻超低温保存存活率影响的主次顺序为:-80℃停留时间;驯化时间;0℃停留时间;-20℃停留时间。通过方差分析(表 3)可知,-20℃停留时间、驯化时间、0℃停留时间对冷冻后螺旋藻的存活率有极显著影响(P<0.01)。对这3个因素进行多重比较,并结合直观分析可知,4℃驯化时间为72 h的存活率显著高于驯化时间为60 h和48 h的存活率(P<0.01),因此驯化时间最优水平为72 h;0℃停留时间的3个水平间也存在显著差异(P<0.01),所以0℃停留时间选择3 h。-80℃停留时间以0 h存活率明显高于0.5 h和1 h的存活率(P<0.01),因此-80℃停留时间选择0 h。由于-20℃停留时间对螺旋藻细胞存活率无显著影响,为了使螺旋藻超低温保存法更简便省时,-20℃停留时间选择0 h。因此螺旋藻超低温保存的最优条件组合为:藻丝体密度1.0×107 cfu/mL,10%蔗糖溶液做保护剂,4℃驯化72 h,0℃停留3 h,-20℃停留0 h,-80℃停留0 h。
| 处理号Treatment | 驯化时间 Acclimation time (h) | 0 °C 停留时间 Stay time of 0 °C (h) | −20 °C 停留时间 Stay time of −20 °C (h) | −80 °C 停留时间 Stay time of −80 °C (h) | 存活率 Survival rate (%) |
| 1 | 1 | 1 | 1 | 1 | 66.13 |
| 2 | 1 | 2 | 2 | 2 | 46.83 |
| 3 | 1 | 3 | 3 | 3 | 53.02 |
| 4 | 2 | 1 | 2 | 3 | 51.03 |
| 5 | 2 | 2 | 3 | 1 | 69.70 |
| 6 | 2 | 3 | 1 | 2 | 51.54 |
| 7 | 3 | 1 | 3 | 2 | 52.03 |
| 8 | 3 | 2 | 1 | 3 | 55.75 |
| 9 | 3 | 3 | 2 | 1 | 76.11 |
| k1 | 55.33 | 56.40 | 58.67 | 70.65 | |
| k2 | 57.42 | 58.28 | 57.99 | 50.13 | |
| k3 | 62.15 | 60.23 | 58.25 | 54.13 | |
| R | 6.82 | 3.83 | 0.68 | 20.52 |
| 变异来源 Variation | 平方和 Sum of squares | 自由度 Degree of freedom | 均方和 Mean square | F值 F value | 显著性 Significance |
| 驯化时间 Acclimation time | 220.033 | 2 | 110.017 | 65.249** | P<0.01 |
| 0 °C停留时间 Stay time of 0 °C | 65.976 | 2 | 32.988 | 19.565** | P<0.01 |
| −20 °C停留时间 Stay time of −20 °C | 2.079 | 2 | 1.039 | 0.616 | P>0.05 |
| −80 °C停留时间 Stay time of −80 °C | 2 129.292 | 2 | 1 064.646 | 631.420** | P<0.01 |
| 误差 Deviation | 30.350 | 18 | 1.686 | ||
| Note: F0.95(2,18)=3.55,F0.99(2,18)=6.01; **: There are significant differences. | |||||
以优化后的螺旋藻超低温保种方法对8株实验藻种进行液氮超低温保藏,每隔一定时间取出测藻种存活率(表 4),发现所有实验藻株在液氮中保存24 h后均能恢复生长繁殖,保存1个月后所有藻种的存活率均显著降低,但之后随着保存时间的延长,实验藻株的存活率变化不大,只是耐低温性最差的FACHB-350藻种在保存3个月时失去活性,而FACHB-1070、FACHB-902在保存4个月时失去活性。其它5株藻在液氮中保存6个月后,均能恢复正常的生长繁殖,其中FACHB-351的存活率最高,为39.33%,FACHB-971存活率最低为21.13%。对存活的螺旋藻进行镜检,发现虽然冷存6个月后5株藻的藻丝体均发生断裂,但藻丝段呈新生态。将其进行再培养,5株藻在经过10 d左右的延缓期后均能进入对数生长期,并保持较高的相对生长速率。
| 藻种 Algae species | 时间 Time | ||||||
| 24 h | 1 Month | 2 Month | 3 Month | 4 Month | 5 Month | 6 Month | |
| F-810 | 69.92 | 42.27 | 41.66 | 41.31 | 40.52 | 40.03 | 38.41 |
| F-793 | 65.18 | 45.38 | 43.49 | 40.76 | 38.72 | 36.09 | 35.11 |
| F-351 | 75.79 | 50.91 | 46.30 | 42.68 | 41.43 | 40.20 | 39.33 |
| F-1070 | 40.84 | 10.47 | 8.93 | 6.77 | 0 | 0 | 0 |
| F-794 | 68.77 | 42.11 | 40.54 | 39.08 | 35.21 | 32.14 | 31.32 |
| F-902 | 37.24 | 9.15 | 7.11 | 5.43 | 0 | 0 | 0 |
| F-971 | 59.04 | 30.05 | 28.39 | 27.13 | 24.39 | 22.54 | 21.13 |
| F-350 | 43.65 | 7.81 | 4.40 | 0 | 0 | 0 | 0 |
目前,针对螺旋藻超低温保存法的研究很少,闫立强等[18]曾研究了钝顶螺旋藻超低温保存抗冻保护剂,发现非渗透性保护剂(蔗糖)比渗透性保护剂(二甲基亚砜)效果要好,本实验结果与其研究结果一致;马志珍等[19]用超低温的方法对螺旋藻进行了保藏试验,但其结果仅说明螺旋藻经过冷冻处理后可以复活,并未说明螺旋藻用超低温保藏法可保藏多长时间。本实验以优化后的超低温冷冻工艺对8 株不同种类的螺旋藻进行了保种实验。保藏6个月后除耐低温性较差的FACHB-350、FACHB-902、
FACHB-1070三株藻不能恢复生长繁殖,其余5株耐低温性较好的藻种均能恢复生长繁殖,且5株藻的存活率虽然在保存1个月后有显著降低,但在之后的保藏中存活率变化不大,说明本实验建立的一步冷冻液氮超低温保藏法可适用于耐低温较好的螺旋藻藻种的长期保藏。
本实验选用耐低温性较好的FACHB-351作为螺旋藻超低温保存条件优化研究的藻株。以冷冻保藏后藻的存活率为筛选指标,通过单因素实验和正交实验确定了螺旋藻超低温保存方案:以10%蔗糖溶液做冷冻保护剂,将藻丝体密度为1.0×107 cfu/mL的藻悬液于4℃冰箱驯化72 h,再将藻液和保护剂分别在0℃预冷30 min后混匀,之后在0℃停留3 h再投入液氮保存;耐低温藻种在此条件下可保藏6个月以上,在螺旋藻的养殖中可保证藻种在冬季时安全越冬,并能保持藻种优良遗传性状的稳定;且本法比闫立强的两步冷冻法、马志珍的逐级慢冻法操作简便,不需要价格昂贵的程序降温仪,在普通实验室即可实现对耐低温藻株的长期保藏。
本实验选用耐低温性较好的藻种对螺旋藻的超低温保存技术进行了初步研究,最终确定的超低温保种方法仅适用于耐低温藻株的长期保藏,对不耐低温藻种的保藏效果较差,今后还应加大对耐低温性差的藻株的研究,以获得能广泛适用于各种螺旋藻藻种保藏的方法。
| [1] | Cai ZP, Li YX, Duan SS, et al. Collection and conservation of microalgal germplasm resources[J]. Ecological Science, 2014, 33(2): 396-400(in Chinese)蔡卓平, 李燕璇, 段舜山, 等. 微藻种质资源的采集及保存现状[J]. 生态科学, 2014, 33(2): 396-400 |
| [2] | Kulus D, Zalewska M. Cryopreservation as a tool used in long-term storage of ornamental species-A review[J]. Scientia Horticulturae, 2014, 168: 88-107 |
| [3] | Tsutsaeva AA, Anan'ina AE, Balyberdina LM, et al. Long-term storage of industrial microbial strains[J]. Microbiology, 2008, 77(5): 621-624 |
| [4] | Harding K, Benson EE, Müller J. Cryopreservation of storage recalcitrant algae through fundamental studies of thermal behaviour and oxidative stress pHysiology[J]. Cryobiology, 2006, 53(3): 399-400 |
| [5] | Halmagyi A, Fischer-Klüver G, Mix-Wagner G, et al. Cryopreservation of Chrysanthemum morifolium(Dendranthema grandiflora Ramat. ) using different approaches[J]. Plant Cell Reports, 2004, 22(6): 371-375 |
| [6] | Day JG. Cryo-conservation of microalgae and cyanobacteria[J]. Cryo-Letters, 1988(Suppl 1): 7-14 |
| [7] | Morris GJ. The cryopreservation of Chlorella. 2. effect of growth temperature on freezing tolerance[J]. Archives of Microbiology, 1976, 107(3): 309-312 |
| [8] | Hwang SW, Hudock GA. Stability of Chlamydomonas reinhardii in liquid nitrogen storage[J]. Journal of Phycology, 1971, 7(4): 300-303 |
| [9] | Tang YT, Kan JL. Improvement of Determination Method of Dissolving Oxygen in Water Sample by Iodometry[J]. Sea-lake Salt and Chemical Industry, 2001, 30(6): 30-31(in Chinese)汤宜听, 阚家玲. 碘量法测定水样中溶解氧方法的改进[J]. 海湖盐与化工, 2001, 30(6): 30-31 |
| [10] | Liang WY, Wang K, Ruan QY, et al. Viability determination of Microcystis aeruginosa by TTC-dehydrogenase assay[J]. Acta Scientiae Circumstantiae, 2008, 28(9): 1745-1750(in Chinese)梁文艳, 王珂, 阮清鸳, 等. TTC-脱氢酶还原法测定铜绿微囊藻活性[J]. 环境科学学报, 2008, 28(9): 1745-1750 |
| [11] | Liang WY, Wang K, Wang JL, et al. Optimization and evaluation of TTC-dehydrogenase assay on algal viability determination[J]. Environmental Science and Management, 2009, 34(5): 10-13(in Chinese)梁文艳, 王珂, 王金丽, 等. TTC-脱氢酶还原法测定藻细胞活性的优化与评价[J]. 环境科学与管理, 2009, 34(5): 10-13 |
| [12] | Liu H, Liu W, Gong Q, et al. Protoplasts of the algae Porphyra yezoenisis by vitrification[J]. Plant Science, 2004, 166: 97-102 |
| [13] | Ohki S, Morita M, Boroda AV, Aizdaicher NA, Odintsova NA. The influence of cryopreservation on marine microalgal cells[J]. Cryobiology, 2013, 67(3): 423 |
| [14] | Boroda AV, Aizdaicher NA, Odintsova NA. The influence of cryopreservation on marine microalgal cells[J]. Cryobiology, 2013, 67(3): 423 |
| [15] | Piasecki BP, Diller KR, Brand JJ. Cryopreservation of Chlamydomonas reinhardtii: a cause of low viability at high cell density[J]. Cryobiology, 2009, 58(1): 103-109 |
| [16] | Brand JJ, Diller KR. Application and theory of algal cryopreservation[J]. Nova Hedwigia, 2004, 79(1/2): 175-189 |
| [17] | Day JG, Fleck RA. Cryo-injury in algae and the implications this has to the conservation of micro-algae[J]. Microalgae Biotechnology, 2015, 1(1): 1-11 |
| [18] | Yan LQ, Zhao SR, Cheng AH, et al. A study of anti-freeze protective material of cyanophyta[J]. Journal of Liaoning Normal University (Natural Science Edition), 1993, 16(2): 153-155(in Chinese)闫立强, 赵树仁, 程爱华, 等. 两种蓝藻超低温保存抗冻保护剂的研究[J]. 辽宁师范大学学报: 自然科学版, 1993, 16(2): 153-155 |
| [19] | Ma ZZ, Zhang JH. Studies on ultralow temperature maintenance species technique of microalgae for mariculture[J]. Journal of Fishery Sciences of China, 1997, 4(4): 13-17(in Chinese)马志珍, 张继红. 海产饵料微藻超低温保种技术的研究[J]. 中国水产科学, 1997, 4(4): 13-17 |
 2016, Vol. 43
2016, Vol. 43