扩展功能
文章信息
- 黄俊, 张祥, 尤玉如, 刘士旺, 肖功年, 龚金炎, 方文姬
- HUANG Jun, ZHANG Xiang, YOU Yu-Ru, LIU Shi-Wang, XIAO Gong-Nian, GONG Jin-Yan, FANG Wen-Ji
- 酸奶后酸化控制措施的研究进展
- Advances in controlling postacidification in yogurt
- 微生物学通报, 2016, 43(3): 663-670
- Microbiology China, 2016, 43(3): 663-670
- 10.13344/j.microbiol.china.150466
-
文章历史
- 收稿日期: 2015-06-16
- 接受日期: 2015-09-22
- 优先数字出版日期(www.cnki.net): 2015-11-10
2. 贝因美婴童食品股份有限公司 浙江 杭州 310007
2. Beingmate Baby & Child Food Co., Ltd., Hangzhou, Zhejiang 310007, China
酸奶具有特殊的风味、丰富的营养和良好的生理功能,因而倍受广大消费者的喜爱,已成为我国第一大发酵乳制品。酸奶发酵结束后,需要在2-6℃冷藏12-24 h,冷藏可促进香味物质的产生,改善酸奶硬度,并且乳酸菌会继续分解残存的乳糖产生乳酸,此过程称为酸奶后熟期或后酸化。但是,酸奶在产品运输、销售过程中乳酸菌仍在缓慢生长繁殖,酸度还会继续增加,乳酸的过量积累会严重刺激味觉,使酸奶感官质量下降,此过程的后酸化严重影响了酸奶的品质,缩短了酸奶的保质期,进而影响酸奶的跨地域销售[1]。如何通过简单有效、低成本的方法控制酸奶在产品运输、销售过程中的后酸化已经成为目前酸奶制品研究的热点。
研究者采用了许多方法控制酸奶的后酸化,包括发酵后快速冷却、高压处理等物理方法,添加防腐剂、细菌素等化学方法以及诱变育种等生物方法。其中物理和化学方法由于增加产品成本、产品营养价值降低、推迟后酸化时间短、产品不稳定等弊端已经不能满足市场的需求。通过获得酸敏感的突变株,能够很好地解决酸奶过度发酵的问题,从而提高经济效益。本文综述了酸奶后酸化机理和革兰氏阳性菌乳酸菌的耐酸机制,从物理、化学、生物方法三个方面对目前酸奶后酸化防治措施进行了阐述与展望,期望为解决酸奶后酸化的问题提供参考。
1 物理方法 1.1 发酵后快速冷却酸奶的后酸化可分为3个阶段:(1) 冷却过程中的产酸;(2) 冷却后的产酸;(3) 冷藏阶段的产酸。不同的冷却阶段主要是让菌种能够产生应激蛋白,使其在低温环境下仍能存活。酸奶终止发酵时的pH以及酶对pH的敏感性等因素都能影响其发酵产酸,通过发酵后快速冷却可以缩短冷却时间,减少菌体在冷却过程中的产酸量,从而在一定程度上控制后酸化,延长酸奶的保质期。发酵后快速冷却还能够使乳酸菌的活菌数达到规定的106 CFU/mL以上。
1.2 巴氏杀菌和高压处理巴氏杀菌方法是奶制品中广泛使用的杀菌方法,将混合原料加热至68-70℃,并保持此温度30 min,然后急速冷却到4-5℃。由于一般细菌的致死点均为温度68℃与时间30 min,所以将混合原料经此法处理后,可杀灭其中的致病性细菌和绝大多数非致病性细菌;混合原料加热后突然冷却,急剧的热与冷变化也可以促使细菌的死亡。利用此方法可以很好地防止酸奶的后酸化,但是经过杀菌后的酸奶只含有很少量的活菌,不符合《中华人民共和国食品安全国家标准 发酵乳》(GB 19302-2010)中关于酸奶的规定,该规定指出酸奶中乳酸菌的活菌数需达到106 CFU/mL以上。因此,巴氏杀菌法在酸奶的应用中受到一定的限制。相比之下,高压处理方法能够保存几乎酸奶全部的营养价值,还可改变蛋白质、糖类分子构象,从而抑制乳酸菌发酵乳糖产酸及分解蛋白质的反应,能够很好地解决后酸化的问题。但是,高压处理过程中要注意压力的大小与处理的时间,使酸奶保存一定数量的活菌数与菌种活力。
2 化学方法 2.1 添加化学防腐剂食品防腐剂是通过影响微生物的细胞亚结构而实现抑菌作用。防腐剂的防腐原理一般分为3种:(1) 通过抑制酶的活性,干扰微生物新陈代谢的正常进行;(2) 通过使蛋白质变性,影响微生物的生长繁殖;(3) 通过改变细胞膜的通透性,阻碍胞内代谢产物的释放,最终破坏菌体的生长。添加防腐剂可以抑制保加利亚乳杆菌的生长,从而延缓酸奶的后酸化。虽然山梨酸钾被认为是安全的化学防腐剂,但在食品添加剂使用标准(GB 2760-2014)中明确规定其不可用于酸奶。
2.2 添加天然防腐剂 2.2.1 添加细菌素:细菌素是由细菌分泌的一种多肽抗生素,对大部分革兰氏阳性菌有强烈的抑制作用。目前乳酸链球菌素(Nisin)已被很多国家应用于乳制品等食品的防腐保鲜,被认为是一种安全无毒的天然生物防腐剂。对于Nisin的抑菌机制存在两种不同的观点:一种观点认为Nisin的抑菌机制是由于脱氢丙氨酸和脱氢丁氨酸能与革兰氏阳性敏感菌细胞膜中某些酶的巯基发生作用,使细胞破裂,释放细胞质;另一种观点认为Nisin主要是消耗细胞的质子驱动力,抑制细胞壁中肽聚糖的合成,使细胞膜和磷脂化合物的合成受阻,最终导致细胞内含物外泄甚至引起细胞裂解[2]。Nisin是多肽物质,在消化道很快被蛋白水解酶消化成氨基酸,因此不会影响肠道内的正常菌群存活[3]。随着人们对化学防腐剂认识的深入,细菌素作为天然生物防腐剂在食品保存上的需求必然会不断增加[4]。虽然部分细菌素被认为是安全的天然防腐剂,但是如果大量或长期摄取仍然可能对人体有害,因此确定适量的添加范围是十分重要的,在食品添加剂使用标准(GB 2760-2014)中规定,Nisin在乳及乳制品中最大使用量为0.5 g/kg。
2.2.2 添加壳寡糖:壳寡糖是由壳聚糖解聚制成,具有良好的生物降解性和溶解性,能够改变微生物细胞膜的通透性,与细胞内带有负电荷的细胞质结合,干扰细胞正常的生理活动,从而抑制菌株的生长繁殖,在一定程度上控制酸奶的后酸化。曹维强等[5]研究表明,当壳寡糖浓度为0.25%时能明显抑制酸奶的后酸化,而空白组的酸度比添加壳寡糖酸奶的酸度高出24.99°T。刘芳等[6]研究发现壳寡糖对酸乳中微生物的增殖具有明显的抑制作用,而且随着浓度的增大其抑制作用逐渐增强,对原料乳中细菌的最好抑菌效果为50 g/L。 2.2.3 添加葡萄糖氧化酶:葡萄糖氧化酶(Glucose oxidase,GOD)是通过黑曲霉、点青霉等发酵制得的一种需氧脱氢酶,作为天然食品防腐剂,对人体无毒,可以除去食品中的氧,从而有效防止食物的腐败。其作用机理为:葡萄糖氧化酶在分子氧存在下能氧化葡萄糖生成D-葡萄糖酸内酯,同时消耗氧生成过氧化氢,而过氧化氢是一种强氧化剂,本身也具有杀菌效果。Cruz等[7]研究发现,酸奶储存时采用氧渗透率低的材料包装会产生更多的有机酸,加剧后酸化程度,通过加入葡萄糖氧化酶并结合包装系统的改进可以为解决后酸化问题提供一个可行的方案。 2.3 添加细胞膜通透剂酸奶发酵的主要产酸菌是保加利亚乳杆菌,由于H+-ATPase的作用,在菌种发酵产酸时通过分解ATP不断将胞内H+运输到胞外,增强了乳杆菌的耐酸性,是酸奶后酸化的主要原因。在正常生长条件下,菌体内pH与胞外环境pH不同,菌体有保持其细胞内pH在中性附近的能力,这样有利于菌体进行正常的新陈代谢和各种酶反应,保持良好的活力[8]。在酸奶发酵过程中由于胞外环境的pH不断下降,保加利亚乳杆菌和嗜热链球菌的细胞膜受到酸胁迫,胞外大分子物质不能直接通过细胞膜,因此通过改变菌体的细胞膜通透性,使细胞外的乳酸能够进入胞内,细胞内的pH就会很快下降,导致H+-ATPase酶活性降低,菌体生长和产酸停止,后酸化程度减弱,保质期延长。
在低乳糖乳的生产过程中,已应用化学诱变剂来改变乳酸菌细胞膜的通透性,从而增加β-半乳糖苷酶的活力,进而提高了乳糖的水解度。如果能够找到一种安全的通透剂,可以提高乳酸菌细胞膜的通透性,就能很好地控制后酸化。据报道,添加牛胆盐可以增加乳酸菌细胞的通透性,使乳酸菌丧失调节pH的能力,发酵乳糖产酸能力降低,菌体细胞生长处于停滞状态[9]。
此外,Kurdi等[10]对片球乳酸菌研究发现,酸敏感型突变株的细胞膜成分与亲本相比,细胞膜中不饱和脂肪酸与饱和脂肪酸的比率明显低于亲本株。这表明细胞膜中脂肪酸组成比例的不同可能导致菌株对酸敏感程度的不同。因此,通过改变细胞膜中脂肪酸的比例来改变菌株细胞膜的通透性,可能是一种潜在的解决酸奶过度酸化问题的方法。
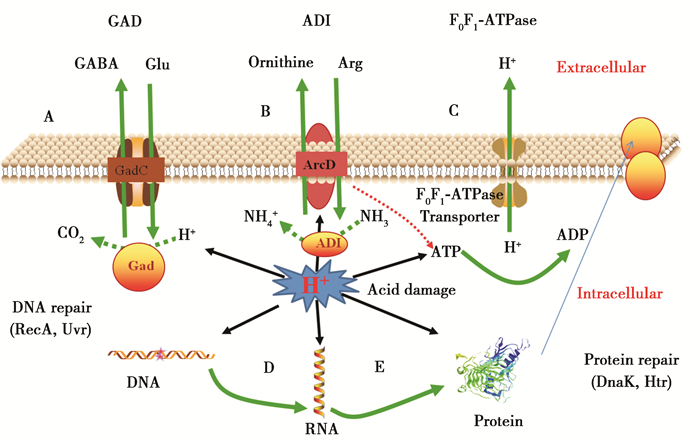
3 生物方法 3.1 乳酸菌耐酸机制酸奶发酵常用的发酵剂是保加利亚乳杆菌和嗜热链球菌,乳酸菌是一类革兰氏阳性菌,Cotter等[11]认为乳酸菌的耐酸机制主要通过以下几种方式应对酸胁迫环境,以提高自身对酸的耐受性,如图 1所示。
 |
|
图 1 革兰氏阳性菌的抗酸胁迫机制图解
Figure 1 Graphical presentation of the mechanisms of acid resistance in gram-positive bacteria
注:A:通过GAD途径提高胞内pH;B:通过ADI途径产生碱性物质;C:F1F0-ATPase排出氢离子;D:DNA的修复机制;E:分子伴侣蛋白、蛋白酶和热应激蛋白等的保护和修复作用.
Note: A: The GAD system bring about an increase in internal pH; B: the production of alkali by the ADI; C: proton pumps such as the F1F0-ATPase; D: DNA damage can be repaired through the excision of errors or the restarting of stalled replication forks; E: chaperones,proteases,and heat shock proteins results in the protection of proteins or their degradation if damaged. |
(1) 利用H+-ATPase排出胞内H+,维持细胞内pH的相对稳定。细胞膜上H+-ATPase既可以利用跨膜质子电化学梯度合成ATP,也可以利用ATP水解产生的能量将胞内H+排出。当外界pH下降时,H+会通过细胞膜进入胞内,对乳酸菌细胞形成酸胁迫,诱导细胞膜上H+-ATPase水解ATP释放自由能,推动细胞内质子泵出胞外,从而使胞内pH维持在中性附近[12, 13, 14, 15],直至环境pH降至3.5时才失去活性。一些乳酸菌编码的H+-ATPase操纵子已被鉴定,这些乳酸菌的H+-ATPase基因簇结构相似,包括编码膜质子通道F0的3个亚单位(a、b、c)以及编码复合体F1的5个亚单位(α、β、γ、δ、ε)。利用蛋白质双向电泳研究这些乳酸菌酸应激过程中的差异蛋白表达,结果发现F1复合体的全部或部分亚单位表达均上调[16, 17]。由此说明,H+-ATPase对胞内pH的调控普遍存在,并且发挥着重要作用。
(2) 通过谷氨酸脱羧酶(Glutamate decarboxylase,GAD)途径消耗胞内H+。GAD催化谷氨酸发生脱羧反应生成γ-氨基丁酸(γ-Aminobutyrate,GABA)的同时会消耗H+,产生的偏碱性代谢产物GABA通过Glu2-/GABA-载体逆向转运到细胞外,导致细胞质的H+浓度降低和胞内pH的增加,从而起到耐酸的作用[18]。大量研究表明[19, 20, 21, 22, 23, 24],GAD和位于细胞膜上的Glu2-/GABA-反向转运蛋白的协同作用与乳酸菌的耐酸机制有关,细胞外的低pH环境可以促进细胞内GAD基因的表达。例如,短乳杆菌GAD系统上主要含有两个谷氨酸脱羧酶(GadA、GadB)和一个反向转运蛋白(GadC),本课题组用荧光定量PCR技术对短乳杆菌在酸胁迫下gadA、gadB、gadC表达水平及其在基因组中位置关系进行研究,发现gadB和gadC组成操纵子,在菌体生长进入对数后期以后,低pH环境能极大地促进gadC和gadB的表达,且在菌体生长进入稳定期时达到最大值[19]。
(3) 通过精氨酸脱亚氨酶(Arginine deiminase,ADI)途径生成的NH3和H+反应,以碱化胞内环境。ADI途径利用精氨酸脱亚氨酶、鸟氨酸氨甲酰转移酶和氨甲酸酯激酶,将精氨酸转变为鸟氨酸、NH3和CO2,同时生成ATP。其中NH3可以和H+反应,进一步使胞内pH保持在中性附近。此过程已经在链球菌[25]、乳酸菌[26]以及植物乳杆菌[27]中报道。ADI途径存在于一些乳酸菌中,但其对于乳酸菌酸耐受的作用及pH调控的重要性在不同菌种间表现不同。
(4) 诱导产生具有保护或修复作用的应激蛋白。乳酸菌在酸环境适应过程中会产生诱导蛋白,其中的部分蛋白参与DNA和蛋白的保护或修复。除了上述4种机制外,细胞自身的缓冲作用、细胞膜结构的适应性、细胞密度和能量代谢也与乳酸菌酸耐受密切相关。例如,Zuljan等[28]研究发现乳酸菌在酸胁迫条件下能够通过双乙酰途径对胞内丙酮酸进行脱羧反应,防止胞内丙酮酸积累,从而维持胞内pH的稳定。综上所述,基于乳酸菌的耐酸机制,研究者可以通过筛选得到酸敏感性的菌株来解决酸奶发酵的后酸化问题,如采用诱变育种、基因工程技术以及原生质体融合等方法,得到与耐酸机制相关的关键酶活性弱化的乳酸菌突变株。随着蛋白组学和分子生物学技术的发展与结合,关于乳酸菌耐酸机制的研究正逐步深入[29],目前对控制酸奶后酸化的研究已深入到分子生物学的水平,通过对乳酸菌的产酸机制进行分子水平的研究得到弱酸化的发酵剂已成为热点。
3.2 诱变育种诱变育种是利用诱变剂处理均匀分散的微生物细胞群,促使其突变率大幅度提高,然后从中筛选出符合要求的突变株。汉森公司已研制出温敏型的乳酸菌株,在冷藏条件下发酵乳糖产酸能力明显减弱,而在43℃时产酸能力没有影响[30]。徐成勇等[31]在此基础上对汉森公司研制的后酸化弱化菌株进行研究,发现用该菌株作为发酵剂生产的酸奶在6℃条件下储存30 d酸度仅上升14.5°T,酸奶的感官品质仍然良好。
Ongol等[32]通过以硫酸新霉素作为筛选工具获得酸敏感的保加利亚乳杆菌,并进行发酵实验,结果发现酸奶后酸化得到很好的控制。王雪妮等[33]研究表明,用硫酸新霉素对保加利亚乳杆菌进行诱变,筛选出H+-ATPase弱化菌株,在MRS培养基中37℃培养18 h,发现H+-ATPase活力比出发菌株下降35%,并且代谢乳糖、乳酸、半乳糖能力也明显低于出发菌株。Wang等[34]成功筛选出两株H+-ATPase缺陷的德氏保加利亚乳杆菌突变株,发现突变株的H+-ATPase活性分别比亲本下降51.3%和34.3%,并且突变株的生长和产酸能力明显低于亲本菌株。Jia等[35]成功筛选出一株H+-ATPase上β亚基发生突变的植物乳杆菌,并应用于泡菜发酵中,发现其H+-ATPase活力比亲本下降43.44%,而且在MRS培养基产酸量仅为亲本的50%,可以有效地防止泡菜发酵的后酸化。笔者认为今后酸奶发酵剂诱变育种的发展趋势是筛选酸敏性的H+-ATPase弱化菌株,在正常的酸度下H+-ATPase正常行使其功能,保持乳酸菌的耐酸性,但酸度超过阈值时H+-ATPase酶活性显著弱化,乳酸菌产酸能力显著下降,在菌株的耐酸性和抑制后酸化之间达到平衡。
3.3 基因工程技术的应用诱变育种虽然能得到突变菌株,但工作量大、突变频率低,且得到的突变株的稳定性不易控制。相比之下,利用基因工程手段对乳酸菌进行基因改良和分子修饰,过程简单易操作,且得到的突变株能稳定遗传。
孙懿琳等[30]研究发现β-半乳糖苷酶是保加利亚乳杆菌产酸的关键酶,乳糖通过透性酶作用进入细胞内,经β-半乳糖苷酶的作用分解为葡萄糖和半乳糖,其中葡萄糖被嗜热链球菌和保加利亚乳杆菌代谢成乳酸,而半乳糖则被排出胞外。通过基因突变的方法使β-半乳糖苷酶的基因缺失、无义突变、扰乱乳糖操纵子编码序列等,能筛选出后酸化减弱的菌株。例如,Santiago等[36]通过基因敲除得到了H+-ATPase活性和耐酸性均降低的链球菌突变株,Mollet等[37]通过基因删除得到了β-半乳糖苷酶活性减弱的保加利亚乳杆菌。Druesne等[38]通过用丙氨酸代替乳糖通透酶的552位点上的组氨酸密码子,发现酶的活性减弱,后酸化程度得到明显改善。
3.4 改变发酵剂的比例和组成目前市场上常用的酸奶发酵剂是由两种表现为共生关系的德氏乳杆菌保加利亚亚种和嗜热链球菌混合而成,两种菌混合发酵时杆菌会为球菌提供一些氨基酸,而球菌反过来产生甲酸等物质促进杆菌产酸。酸奶发酵时,首先是球菌快速增殖,当pH降至5.5时,杆菌才加快生长并且开始产酸,当发酵pH降至3.5,此时杆菌的细胞膜或细胞壁丧失了调节作用,细胞内外pH趋于一致[39]。由于酸奶发酵产酸菌主要是杆菌,所以增加发酵剂中球菌的比例有助于控制酸奶的后酸化。郭清泉[40]研究发现,球菌和杆菌的比例与酸奶的最终酸度之间存在线性关系,通过线性回归分析,得出德氏乳杆菌保加利亚亚种比例为35%时可以在一定程度上推迟后酸化。Torriani等[41]研究表明,球菌与杆菌比例为1.5:1时最佳,这样有助于两菌更好的发酵,缩短发酵时间,减轻后酸化程度。由于部分地区酸奶从出厂到消费者饮用之前,冷链可能被打断,基于这种实际情况,酸奶发酵剂中嗜热链球菌和保加利亚乳杆菌之间的比例还可以进一步加大[42]。
通过改变发酵剂的组成,利用其产生的代谢产物(如细菌素)对乳酸菌的抑制作用来控制乳酸菌产酸,从而控制后酸化也是目前研究的一个方向。尚楠等[43]选择产细菌素双歧杆菌与保加利亚乳杆菌和嗜热链球菌混合发酵剂配伍共同发酵生产酸奶,发现双歧杆菌的加入能有效抑制酸奶的后酸化,以添加水平(2-5)×106 CFU/mL为最佳。Yamauchi等[44]研究表明,将产Nisin的乳酸链球菌与其它乳酸菌混合接种于酸奶中,发酵过程中产生的Nisin可以抑制产酸菌株的生长,从而减少储存和运输过程中酸度的增加,而且能够提高产品稳定性。Poonam等[45]研究发现丙酸杆菌能够产生细菌素和B族维生素等功能分子,因此将其混合发酵,也可能控制酸奶的后酸化程度。因此,通过改变发酵剂的组成,用新的安全菌株来混合发酵不仅可能控制后酸化,还可能产生更富营养的功能酸奶。但是,混合发酵要注意发酵菌种的安全性和组成比例。
4 展望目前国内外关于控制酸奶后酸化的研究有很多,其中一些方法也已应用到酸奶的后酸化防治中。物理、化学方法以及两种方法的结合使用虽然已经在一定程度上延缓了酸奶的后酸化,但是还不能从源头上解决酸奶的后酸化问题。对菌种在分子水平进行改造已经成为当前研究的焦点,比物理和化学方法更加经济有效,也能从源头解决酸奶的后酸化问题。在酸奶发酵菌株的研究中,筛选得到的一些弱后酸化菌株,部分已应用到工业生产中,而诱变育种得到的弱后酸化菌株代谢机理的研究鲜有报道,因此通过对弱化菌株代谢机理的研究,并结合基因工程的方法可能得到更加优良的发酵菌株。
在诱变育种的基础上对突变株进行反复筛选,若能筛选出两种或多种酶同时弱化的突变株,就具有更好地控制后酸化的潜力。目前对于菌种的改良其实主要还是通过控制乳酸菌的产酸来控制后酸化过程,但是仍存在问题需要进一步研究。一是通常认为,益生菌的数量级一般要达到106 CFU/mL以上才能起到益生作用,对于诱变育种得到的酸敏感性菌株,其耐酸机制减弱,将导致在人肠道增殖能力降低,可能就无法达到应有的益生菌作用。如何在菌株的耐酸性和减弱后酸化之间寻找一个平衡点至关重要。因此,研究者希望能筛选到酸敏性菌株,在正常的酸度下发酵乳糖产酸能力没有影响,当酸度超过阈值,产酸能力明显减弱,不需冷链保藏控制酸度。二是诱变育种虽然可能在根本上解决酸奶后酸化的问题,但是传统诱变育种工作量大、耗时长;基因工程技术的应用虽然克服了这个难题,却带来了新的食品安全问题,如何证明新的菌株的安全性仍亟待解决。因此,酸奶后酸化防治中发酵剂的研制至关重要,方法和问题同时存在,需要不断去探索解决。
| [1] | You YR. Dairy and Beverage Technology[M]. Beijing: China Light Industry Press, 2014(in Chinese)尤玉如. 乳品与饮料工艺学[M]. 北京: 中国轻工业出版社, 2014 |
| [2] | Bayoumi S. Nisin and yogurt manufacture[J]. Chemistry and Microbiology of Technology Lebensmittel, 1991, 13(3/4): 65-69 |
| [3] | Liu QL. Research on improvement of antibacterial stability of Nisin and its application[D]. Guangzhou: Master's Thesis of South China University of Technology, 2012(in Chinese)刘启莲. Nisin抑菌稳定性改善研究及其应用[D]. 广州: 华南理工大学硕士学位论文, 2012 |
| [4] | Bali V, Panesar PS, Bera MB, et al. Bacteriocins: recent trends and potential applications[J]. Critical Reviews in Food Science and Nutrition, 2014. DOI: 10.1080/10408398.2012.729231 |
| [5] | Cao WQ, Wang J, Zhang YC, et al. The effect of chitooligosaccharides on the postacidification of yogurt[J]. Food and Fermentation Industries, 2005, 31(8): 115-118(in Chinese)曹维强, 王静, 张英春, 等. 壳寡糖对酸乳后酸化抑制效果的研究[J]. 食品与发酵工业, 2005, 31(8): 115-118 |
| [6] | Liu F, Du P, Huo GC. Study on inhibitant activities of chitosan oligosaccharide against microbes from milk[J]. China Dairy Industry, 2005, 33(6): 28-30(in Chinese)刘芳, 杜鹏, 霍贵成. 壳寡糖对原料乳中微生物抑制作用的研究[J]. 中国乳品工业, 2005, 33(6): 28-30 |
| [7] | Cruz AG, Castro WF, Faria JAF, et al. Stability of probiotic yogurt added with glucose oxidase in plastic materials with different permeability oxygen rates during the refrigerated storage[J]. Food Research International, 2013, 51(2): 723-728 |
| [8] | Nyanga-Koumou AP, Ouoba LII, Kobawila SC, et al. Response mechanisms of lactic acid bacteria to alkaline environments: a review[J]. Critical Reviews in Microbiology, 2012, 38(3): 185-190 |
| [9] | Yoast S, Adams RM, Mainzer SE, et al. Generation and characterization of environmentally sensitive variants of the β-galactosidase from Lactobacillus delbrueckii subsp. bulgaricus[J]. Applied and Environment Microbiology, 1994, 60(4): 1221-1226 |
| [10] | Kurdi P, Smitinont T, Valyasevi R. Isolation and characterization of acid-sensitive mutants of Pediococcus acidilactici[J]. Food Microbiology, 2009, 26(1): 82-87 |
| [11] | Cotter PD, Hill C. Surviving the acid test: responses of gram-positive bacteria to low pH[J]. Microbiology and Molecular Biology Reviews, 2003, 67(3): 429-453 |
| [12] | Kobayashi H, Suzuki T, Unemoto T. Streptococcal cytoplasmic pH is regulated by changes in amount and activity of a proton-translocating ATPase[J]. The Journal of Biological Chemistry, 1986, 261(2): 627-630 |
| [13] | Yokota A, Amachi S, Ishii S. Acid sensitivity of a mutant of Lactococcus lactis subsp. lactis C2 with reduced membrane-bound ATPase activity[J]. Bioscience, Biotechnology, and Biochemistry, 1995, 59(10): 2004-2007 |
| [14] | Yamamoto N, Masujima Y, Takano T. Reduction of membrane-bound ATPase activity in a Lactobacillus helveticus strain with slower growth at low pH[J]. FEMS Microbiology Letters, 1996, 138(2/3): 179-184 |
| [15] | Senouci-Rezkallah K, Jobin MP, Schmitt P. Adaptive responses of Bacillus cereus ATCC14579 cells upon exposure to acid conditions involve ATPase activity to maintain their internal pH[J]. Microbiology Open, 2015, 4(2): 313-322 |
| [16] | Koponen J, Laakso K, Koskenniemi K, et al. Effect of acid stress on protein expression and phosphorylation in Lactobacillus rhamnosus GG[J]. Journal of Proteomics, 2012, 75(4): 1357-1374 |
| [17] | Lee K, Lee HG, Pi K, et al. The effect of low pH on protein expression by the probiotic bacterium Lactobacillus reuteri[J]. Proteomics, 2008, 8(8): 1624-1630 |
| [18] | Jaichumjai P, Valyasevi R, Assavanig A, et al. Isolation and characterization of acid sensitive Lactobacillus plantarum with application as starter culture for Nham production[J]. Food Microbiology, 2010, 27(6): 741-748 |
| [19] | Peng CL, Huang J, Zhao WR, et al. Effects of acid stress on the expression of key genes of glutamate decarboxylase system and enzyme activity in Lactobacillus brevis[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(2): 359-365(in Chinese)彭春龙, 黄俊, 赵伟睿, 等. 酸胁迫下短乳杆菌谷氨酸脱羧酶系统关键基因的表达及酶活性响应[J]. 高校化学工程学报, 2015, 29(2): 359-365 |
| [20] | Yu K, Lin L, Hu S, et al. C-terminal truncation of glutamate decarboxylase from Lactobacillus brevis CGMCC 1306 extends its activity toward near-neutral pH[J]. Enzyme and Microbial Technology, 2012, 50(4/5): 263-269 |
| [21] | Sanders JW, Leenhouts K, Burghoorn J, et al. A chloride-inducible acid resistance mechanism in Lactococcus lactis and its regulation[J]. Molecular Microbiology, 1998, 27(2): 299-310 |
| [22] | Higuchi T, Hayashi H, Abe K. Exchange of glutamate and gamma-aminobutyrate in a Lactobacillus strain[J]. Journal of Bacteriology, 1997, 179(10): 3362-3364 |
| [23] | Peng CL, Huang J, Hu S, et al. A two-stage pH and temperature control with substrate feeding strategy for production of gamma-aminobutyric acid by Lactobacillus brevis CGMCC 1306[J]. Chinese Journal of Chemical Engineering, 2013, 21(10): 1190-1194 |
| [24] | Huang J. Process study on the preparation of γ-aminobutyric acid by Lactobacillus brevis[D]. Hangzhou: Doctoral Dissertation of Zhejiang University, 2007(in Chinese)黄俊. 利用短乳杆菌制备γ-氨基丁酸相关过程研究[D]. 杭州: 浙江大学博士学位论文, 2007 |
| [25] | Marquis RE, Bender GR, Murray DR, et al. Arginine deiminase system and bacterial adaptation to acid environments[J]. Applied and Environment Microbiology, 1987, 53(1): 198-200 |
| [26] | Vrancken G, Rimaux T, Weckx S, et al. Environmental pH determines citrulline and ornithine release through the arginine deiminase pathway in Lactobacillus fermentum IMDO 130101[J]. International Journal of Food Microbiology, 2009, 135(3): 216-222 |
| [27] | Arena ME, Saguir FM, Nadra MCMD. Arginine dihydrolase pathway in Lactobacillus plantarum from orange[J]. International Journal of Food Microbiology, 1999, 47(3): 203-209 |
| [28] | Zuljan FA, Repizo GD, Alarcon SH, et al. α-Acetolactate synthase of Lactococcus lactis contributes to pH homeostasis in acid stress conditions[J]. International Journal of Food Microbiology, 2014, 188: 99-107 |
| [29] | Wu CD, Zhang J, Chen W, et al. A combined physiological and proteomic approach to reveal lactic-acid-induced alterations in Lactobacillus casei Zhang and its mutant with enhanced lactic acid tolerance[J]. Applied Microbiology and Biotechnology, 2012, 93(2): 707-722 |
| [30] | Sun YL, Fang W, Tian H, et al. Study on key enzymes involved in producing lactic acid of Lactobacillus delbrueckii subsp.bulgaricus[J]. Science and Technology of Food Industry, 2013, 34(10): 187-191(in Chinese)孙懿琳, 方伟, 田辉, 等. 保加利亚乳杆菌产酸关键酶的研究[J]. 食品工业科技, 2013, 34(10): 187-191 |
| [31] | Xu CY, Wu H, Zheng SC, et al. Screening of the starter cultures of weak postacidification in yoghourt[J]. China Dairy Industry, 2007, 35(3): 12-13,16(in Chinese)徐成勇, 吴昊, 郑思聪, 等. 弱后酸化酸奶发酵剂的筛选[J]. 中国乳品工业, 2007, 35(3): 12-13,16 |
| [32] | Ongol MP, Sawatari Y, Ebina Y, et al. Yoghurt fermented by Lactobacillus delbrueckii subsp. bulgaricus H+-ATPase defective mutants exhibits enhanced viability of Bifidobacterium breve during storage[J]. International Journal of Food Microbiology, 2007, 116(3): 358-366 |
| [33] | Wang XN, Chen M, Sun CL. Mutation breeding of H+-ATPase deficient mutant of Lactobacillus delbrueckii subsp.bulgaricus[J]. China Dairy Industry, 2013, 41(8): 8-11,28(in Chinese)王雪妮, 陈明, 孙春玲. 保加利亚乳杆菌H+-ATPase弱化菌株的诱变选育[J]. 中国乳品工业, 2013, 41(8): 8-11,28 |
| [34] | Wang XH, Ren HY, Liu DY, et al. H+-ATPase defective variants of Lactobacillus delbrueckii subsp. bulgaricus contribute to inhibition of postacidification of yogurt during chilled storage[J]. Journal of Food Science, 2013, 78(2): M297-M302 |
| [35] | Jia BH, Zhong XT, Yuan CH, et al. Screening of Lactobacillus plantarum LPM21 with F1F0-ATPase β-subunit mutation used as probiotics adjunct in Sichuan pickle[J]. Food Science and Technology Research, 2013, 19(6): 1045-1050 |
| [36] | Santiago B, MacGilvray M, Faustoferri RC, et al. The branched-chain amino acid aminotransferase encoded by ilvE is involved in acid tolerance in Streptococcus mutants[J]. Journal of Bacteriology, 2012, 194(8): 2010-2019 |
| [37] | Mollet B, Delley M. A β-galactosidase deletion mutant of Lactobacillus bulgaricus reverts to an active enzyme by internal DNA sequence duplication[J]. Molecular Genetics and Genomics, 1991, 227(1): 17-21 |
| [38] |
Druesne A, Garult P, Faurie J, et al. Mutant strains of lactic acid bacteria having a non-phosphorylable lactose permease: US, 8198065[P]. 2012-09-24. http://www.freepatentsonline.com/ 8198065.html |
| [39] | Hutkins RW, Nannen NL. pH homeostasis in lactic acid bacteria[J]. Journal of Dairy Science, 1993, 76(8): 2354-2365 |
| [40] | Guo QQ. Study on the mechanism of postacidification of the plain yogurt during storage and the methods to control it[D]. Haerbin: Master's Thesis of Northeast Agricultural University, 2001(in Chinese)郭清泉. 酸奶制品在贮存过程发生后酸化的机理及控制措施的研究[D]. 哈尔滨: 东北农业大学硕士学位论文, 2001 |
| [41] | Torriani S, Gardini F, Guerzoni ME, et al. Use of response surface methodology to evaluate some variables affecting the growth and acidification characteristics of yoghurt cultures[J]. International Dairy Journal, 1996, 6(6): 625-636 |
| [42] | Xu CY, Guo BH, Wu H, et al. Advance in both starter cultures in yoghurt and breeding of lactic acid bacteria by biotechnology[J]. China Biotechnology, 2004, 24(7): 55-59(in Chinese)徐成勇, 郭本恒, 吴昊, 等. 酸奶发酵剂和乳酸菌生物技术育种[J]. 中国生物工程杂志, 2004, 24(7): 55-59 |
| [43] | Shang N, Liu LS, Ren FZ, et al. Effect of a bacteriocin-producing strain of Bifidobacterium L-SN on the postacidification and quality of yogurt[J]. Journal of China Agricultural University, 2013, 18(4): 178-182(in Chinese)尚楠, 刘丽莎, 任发政, 等. 产细菌素双歧杆菌L-SN对酸奶后酸化及品质的影响[J]. 中国农业大学学报, 2013, 18(4): 178-182 |
| [44] | Yamauchi Y, Ishii S, Toyoda S, et al. Process for the manufacture of fermented milk: US, 5527505[P]. 1996-06-18. http://www.freepatentsonline.com/5527505.html |
| [45] | Poonam, Pophaly SD, Tomar SK, et al. Multifaceted attributes of dairy Propionibacteria: a review[J]. World Journal of Microbiology and Biotechnology, 2012, 28(11): 3081-3095 |
 2016, Vol. 43
2016, Vol. 43