扩展功能
文章信息
- 黄睿, 马艳庆, 赵晋, 宋雷
- HUANG Rui, MA Yan-Qing, ZHAO Jin, SONG Lei
- 假结核耶尔森氏菌与宿主之间相互作用的分子机制研究进展
- Advance in molecular mechanism of host-microbe: invasion and survival of Yersinia pseudotuberculosis in host cells
- 微生物学通报, 2016, 43(3): 640-647
- Microbiology China, 2016, 43(3): 640-647
- 10.13344/j.microbiol.china.150442
-
文章历史
- 收稿日期: 2015-06-08
- 接受日期: 2015-09-01
- 优先数字出版日期(www.cnki.net): 2015-11-06
假结核耶尔森氏菌(Yersinia pseudotuberculosis)是耶尔森氏菌属中一种人类的肠道致病性细菌,为革兰氏阴性菌,呈杆状,有鞭毛系统并具有运动功能。该菌宿主范围广泛,是重要的人畜共患病原菌。感染假结核耶尔森氏菌的动物表现出类似结核的症状,造成淋巴结等局部组织坏死;人感染后的症状表现为发烧、头痛、腹痛和呕吐等。同时引起肠系膜淋巴结炎,与阑尾炎有相似的症状[1, 2]。欧洲食品安全局早在2010年就把耶尔森氏菌定为第三大人畜共患传染病病原体,其中最易感染的是小肠结肠炎耶尔森氏菌[3]。在芬兰和日本,曾经有多次假结核耶尔森氏菌感染的大暴发[4, 5, 6, 7]。过去十年内,在芬兰由假结核耶尔森氏菌感染的病例占耶尔森氏菌属感染病例的16%,从1995至2006十年间,假结核耶尔森氏菌的感染发病率从0.000 6%增加到0.004 8%[8]。
研究发现,假结核耶尔森氏菌的主要感染部位是小肠黏膜滤泡相关的上皮组织(Follicle associated epithelium,FAE),FAE上分布着小肠派氏淋巴结(Peyer’s patches),假结核耶尔森氏菌能通过小肠派氏淋巴结上的一种特殊的抗原摄取细胞(被称为M细胞,Microfold cell)进行跨细胞转运[9, 10, 11, 12]。这个转运过程涉及到多种蛋白分子表达、精细的组装和大量基因多层水平的调控。我们对参与该过程的分子及其机制的研究进行了综述,同时探讨了电子显微镜和高压冷冻技术在研究超分子复合物及组装的动态变化方面的应用及优势。
1 侵袭素、黏附素和整合素1985年,Isberg等构建了一个假结核耶尔森氏菌的克斯质粒库,该库包含假结核耶尔森氏菌的随机基因组序列,随后他们将这些质粒转入大肠杆菌Escherichia coli K12,将转化后的大肠杆菌感染单层培养的人喉癌上皮细胞(HEp2细胞),感染一段时间后利用抗生素杀死黏附在细胞表面的细菌,分离出侵入HEp2细胞内的细菌,从而确定了假结核耶尔森氏菌的某个基因的表达赋予了无侵入能力的大肠杆菌K12侵入HEp2细胞的能力[13]。随后,1987年Isberg等鉴定出假结核耶尔森氏菌的inv基因能使大肠杆菌K12菌株具有侵入哺乳动物细胞的能力。inv基因编码一种称为Invasin的103 kD的细菌外表面蛋白质,这种蛋白能使细菌侵入培养的HEp-2细胞[14]。inv基因的表达受多种环境因素的调控,如温度、生长周期、营养条件、渗透压和pH值等,这种调控作用需要转录激活因子RovA的参与。为了研究温度对inv基因的调控作用,Nagel等用一个含有inv基因和inv-phoA融合基因的部分二倍体菌株YP1 (inv+,inv-phoA),以及一个采用转座子插入突变使inv失活,但在inv基因座上含有inv-phoA融合基因的菌株YP2 (inv-,inv-phoA)。他们发现,当YP1在25 °C并处于稳定生长期时,inv基因的表达水平最高;而当YP1处于37 °C时,inv-phoA相比指数生长期的细胞被诱导表达量增加了10倍。这种温度依赖的假结核耶尔森氏菌YPⅢ的inv-phoA表达在大肠杆菌K12中,无论是处于25 °C还是37 °C时均不表达。由此可见,大肠杆菌中的inv基因并不受温度的调控,为了鉴定inv基因的温度调控基因,Nagel等把假结核耶尔森氏菌的基因组引入含有inv-phoA融合质粒pAK002的大肠杆菌CC118λpir中,筛选得到受温度诱导表达的inv-phoA阳性菌株,从而确定了RovA基因调控inv基因对温度的响应作用,他们对inv启动子进行删减分析,确定了inv基因转录起点上游的207 bp存在RovA蛋白的结合位点[15]。有研究发现,RovA在37 °C时能够被蛋白酶水解[16]。可见,inv基因主要在感染的起始阶段发挥功能。
Isberg等猜测分布在细菌表面的Invasin可能是作为配体使微生物与宿主细胞膜上的受体结合。1990年,他们鉴定出动物细胞表面的Integrin蛋白是Invasin的受体,Integrin蛋白的β1链能以非常高的亲和力结合配体,促进假结核耶尔森氏菌侵入动物细胞[17]。同年,他们发现Invasin蛋白C端的192个氨基酸含有Integrin的结合结构域,该结构域负责与宿主细胞识别[18]。Hynes和Isberg等随即发现Integrins是一大类异二聚体跨膜蛋白,能够通过黏附底物向细胞骨架传递信号。已经发现5种Integrins能与Invasin结合,分别是(α3β1、α4β1、α5β1、α6β1和αvβ1),Integrins作为细胞外基质蛋白的受体,它们还参与细胞和细胞之间相互作用[17, 19]。其中最具有特点的是α5β1,也是纤连蛋白Fibronectin (Fn)的受体。Invasin与β1受体的结合激活宿主细胞骨架的识别,形成伪足结构吞噬细菌[20]。研究表明Integrins主要分布在上皮细胞的基底面,无法接触小肠内腔的细菌,但在M细胞中至少存在两对Integrin和Invasin均匀地分布在细胞表面[21],这也就解释了为什么肠道致病耶尔森氏菌仅分布在小肠上皮层的这些细胞内。1999年Hamburger等解析了Invasin蛋白的晶体结构,发现Invasin的细胞外区含有5个结构域,与纤连蛋白III的结构相似[22]。
RGD结构域(Arg-Gly-Asp)起初是在纤连蛋白中发现的、能够介导细胞黏附的三肽序列,在Integrin蛋白中也发现存在该结构域。而Invasin本身没有RGD结构域,但是两种蛋白和Integrin相互作用是通过相似的结构域。研究发现Invasin和Integrin以很高的亲和力结合并且寡聚化,Integrin富集并有效地激活下游信号。β1的胞质尾区通常能和细胞骨架相互作用,这对于细菌的入侵具有决定性作用,而这个区域的改变能削弱与细胞骨架之间的相互作用,但是能增加细菌的内化[23, 24]。
在假结核耶尔森氏菌中发现的另一个介导细菌侵袭宿主细胞的黏附素是来自毒性质粒的蛋白YadA[25]。YadA最初是在1982年被发现的,Bölin等发现含毒性质粒的假结核耶尔森氏菌YPⅢ(P+)生长在26 °C的环境中时,细菌以非常高的结合率与Hela细胞结合,当把细菌移到37 °C时,这种结合程度降低。为了研究该功能的机制,Bölin等构建了无毒性质粒的突变菌株YPⅢ(P-),他们发现把YPⅢ(P-)分别置于26 °C和37 °C环境中时,其黏附Hela细胞的能力无差别。并且他们在26 °C环境中,用假结核耶尔森氏菌YPⅢ感染瑞士白化小鼠(Swiss albino mice)时发现,YPⅢ(P+)的平均致死量是109细菌/小鼠,而YPⅢ(P-)的浓度达到1010时仍未引起小鼠死亡,当细菌处于37 °C环境中时,其感染能力却降低了。他们把假结核耶尔森氏菌从26 °C环境中转移到37 °C环境中时,发现在2 min内诱导合成一种分子量为41-44 kD质粒外膜蛋白,他们把这种蛋白称为蛋白1,也就是YadA,YadA在外膜可以形成三聚体,该蛋白的表达受到培养基中钙离子浓度影响[26, 27]。YadA也是假结核耶尔森氏菌的毒力因子,但是假结核耶尔森氏菌的毒性并不依赖钙离子,YadA也并非主要的毒力因子[28]。
有多篇文献报道了Invasin与YadA的关系,例如Yang等在1993年发现,Invasin蛋白插入突变的细菌YPⅢ(P+)中Invasin仍表现出依赖于毒性质粒的细菌内化,而破坏了YadA开放阅读框的Invasin蛋白突变体YPⅢ(P-)中Invasin影响细菌的内化,Yang等为了证实YadA介导细菌内化的作用,他们把YadA的基因片段插入载体pACYC184构成pAY04质粒,导入内化缺陷菌株YP332(P-,inv),发现含有pAY04质粒的YP332(P-,inv)内化缺陷菌株的细胞侵入能力增加了100倍[29]。Marra等1997年利用inv基因的点突变体P-invD911E和P-invD911A,该点负责Invasin与Integrin的结合,该点的天冬氨酸突变为丙氨酸,失去结合受体的能力;当突变为谷氨酸时不影响与受体的结合。结果发现,这种不完全的缺陷突变体黏附和侵入细胞的能力介于P-野生型菌株和P-inv完全突变体之间。当细菌感染小肠45 min内,所有野生型细菌到达小肠的派氏淋巴结,这种缺陷的突变体不能促进细菌的有效转移,停留在小肠表皮的细胞内腔表面,即使是P-invD911E具有结合受体的能力,转移仍然受到抑制;而当P-invD911A的菌株同时插入突变使YadA失去功能时,菌株表现出不依赖于Invasin的细胞摄取,这些结果发现YadA的另一个重要功能:Invasin缺陷的点突变体细菌在小肠细胞表面的集聚依赖于YadA的存在[10],而YadA和inv插入突变体却很少能观察到这种现象。这些结果结合inv突变体低效率的跨细胞转运可以推测出YadA并不直接促进小肠细胞对细菌的摄取[30]。
研究发现假结核耶尔森氏菌毒力因子YadA蛋白的N端33个氨基酸通过结合纤连蛋白和Integrin受体α5β1,启动该细菌侵袭细胞的过程[31]。在小肠结肠炎耶尔森氏菌和鼠疫耶尔森氏菌中还发现另一种重要的侵袭素是Ail (Attachment invasion locus)[32, 33]。Ail是一种由细菌染色体基因编码的17 kD的外膜蛋白,在37 °C时表达[2]。有多篇文献报道了小肠结肠炎耶尔森氏菌Ail的功能,包括赋予血清抗性(补体抗性)、黏附和侵入宿主细胞的功能[34, 35, 36, 37]。也有文献报道假结核耶尔森氏菌的Ail也能够赋予血清抗性,并且这种功能和小肠结肠炎耶尔森氏菌一样,Ail能够与补体的经典途径和凝集素途径的抑制因子C4b-结合蛋白(C4BP)等结合介导这种补体抗性作用,这种结合作用与细菌的血清型没有关系。有趣的是,有报道称在大肠杆菌中表达的假结核耶尔森氏菌Ail蛋白并没有黏附和侵入细胞的能力[38, 39, 40]。为了研究其机理,Tsang等在2013年发表的关于Ail的文章中对于已经测序的假结核耶尔森氏菌YPⅢ、IP2666、PB1/+、IP31758、IP32953以及鼠疫杆菌KIM5、CO92进行了氨基酸序列比对指出,与鼠疫杆菌氨基酸序列不同的是,假结核耶尔森氏菌YPⅢ和IP2666的43位天冬氨酸代替了谷氨酸,126位缬氨酸代替了苯丙氨酸,IP31758和IP32953只有126位的氨基酸存在差异,而对于PB1/+的氨基酸序列与鼠疫杆菌的氨基酸序列完全一致;并且他们发现在大肠杆菌中表达YPⅢ和鼠疫杆菌的Ail蛋白时,前者黏附和侵入细胞的能力是后者的50%,而在大肠杆菌中表达鼠疫杆菌突变蛋白Ail-E43D或Ail-F126V时,黏附和侵入细胞的能力大大降低,在鼠疫杆菌中表达该突变蛋白时,其黏附和侵入细胞的能力降低了30%-50%,而假结核耶尔森氏菌YPⅢ却检测不到黏附和侵入细胞的能力,他们指出这和细菌细胞的环境有关[41]。也有文章报道假结核耶尔森氏菌YPⅢ的Ail的第7位异亮氨酸代替了苏氨酸[38],这和Tsang等的结果不一致,我们推测这可能是由于测序错误造成的。
2 细菌与宿主细胞之间的相互作用方式 2.1 “拉链”式机制Cossart等把细菌侵入细胞的主要方式分为两种,一种称为“拉链”式,另一种称为“触发”式,并指出李斯特菌和耶尔森氏菌是“拉链”式机制[42]。“拉链”式机制是当细菌表面蛋白与宿主细胞受体结合后传递信号,膜结构发生重排,细菌侵入;而在“触发”机制中,如沙门氏菌(Salmonella)和志贺氏菌(Shigella flexneri),细菌利用一个“注射器式的Ⅲ型分泌系统(Syringe-like type 3 secretion system,T3SS)”把自己的效应蛋白通过宿主膜注入[42, 43]。
Y. pseudotuberculosis侵入哺乳细胞时利用跨膜细胞黏附蛋白作为受体,其过程可被分成3个连续的步骤:(1) 接触和黏附。这一步不依附细胞骨架,仅涉及细菌配体和它的受体,受体在这一步富集。(2) Phagocytic cup的形成。这一步配体-受体复合物形成,迅速触发肌动蛋白聚合和膜扩张等信号,侵入的微生物繁殖。(3) Phagocytic cup关闭并且缩回肌动蛋白解聚[23]。
2.2 Ⅲ型分泌系统和效应分子Ⅲ型分泌系统是一个由多种蛋白组成的转运效应蛋白的通道,Salmond和Reeves提出Ⅲ型分泌系统是多种细菌采用的分泌装置[44]。耶尔森氏菌利用其毒性质粒编码Ⅲ型分泌系统和效应蛋白:感染宿主细胞时,Ⅲ型分泌系统组装,注入一系列被称为Yops (Yersinia outer proteins)的效应蛋白而破坏宿主的初级免疫应答;Yops侵入宿主细胞后,干扰多条信号通路,破坏宿主细胞肌动蛋白骨架、抑制促炎信号、诱导宿主细胞凋亡,从而使耶尔森氏菌在宿主的细胞外大量繁殖。
研究表明3种耶尔森氏菌均拥有一个70 kb的质粒pYV,也被称作毒性质粒,这个质粒是耶尔森氏菌致病装置的核心,能够抗争宿主免疫系统细胞[45]。这个毒性质粒编码效应分子Yops和一些帮助注入它们的蛋白T3SS的成分[46, 47]。共发现6种Yops:YopH、YopE、YpkA/YopO、YopJ/YopP、YopT和YopM。YopT只在小肠结肠炎耶尔森氏菌中被发现,而其它Yops在3种耶尔森氏菌中都存在。到目前为止,除了YopM,其它Yops均被报道有催化功能,YopM的功能只在少数几篇文献中报道过[48, 49]。YopH是一种酪氨酸磷酸酶;YopE是一种GTPase激活蛋白;YopM是一种支架蛋白;YopT是一种半胱氨酸蛋白酶;YpkA是一种多功能蛋白,N-端同源真核生物丝氨酸/苏氨酸蛋白激酶结构域,紧接着有一个Rho-GTPase结合结构域和一个C-端肌动蛋白结合结构域;YopJ是一个丝氨酸/苏氨酸乙酰转移酶[50]。Shao在2008年发表了关于耶尔森氏菌Ⅲ型效应分子的生物化学功能的综述[51]。这6种效应蛋白在宿主细胞内的靶分子、生物学功能和致病效应见表 1。但是这些仅仅都是分子生物学水平方面的研究,对于整个过程的分子动态变化仅仅只是人们的推测,Shao[51]也指出比如YopE、YopT和YpkA这3种效应蛋白在以前的文献报道中都能结合Rho GTP酶,在吞噬作用中改变细胞骨架的重排,他也提出这种单一的作用很可能是由于目前研究方法限制了对这些蛋白功能的解析,并且这些效应蛋白的功能还有待于在动物体内生理水平上进一步研究。有文献报道指出鼠疫杆菌、假结核耶尔森氏菌和小肠结肠炎耶尔森氏菌的1B菌株存在由染色体基因编码的III型分泌装置[49]。小肠结肠炎耶尔森氏菌的1B菌株,其染色体编码Ysa TTSS能使细菌在胃肠组织有效地聚集,并且人们通过蛋白质组学的方法也鉴定出了一些能够通过该分泌装置的效应分子。比如YopE效应分子[52],但对这种分泌系统的功能和结构研究得不是很清楚。近几年,电子断层扫描技术(electron tomography)能够获取同一区域多个角度的投影图来反向重构所研究对象的三维结构,即在纳米级尺度上研究不具有结构均一性的蛋白、细菌和病毒、细胞器以及它们之间组成的复合体的三维结构,尤其是结合现在的各种标记技术,对揭示重要分子之间组装的动态过程发挥着重要作用[53]。因此我们也利用电子断层成像技术的多种优势,在生理水平研究假结核耶尔森氏菌与宿主细胞之间相互作用时的分子组装及动态变化,如He等曾发表电子断层成像技术结合各种标记技术的应用[54, 55, 56]。
| 耶尔森氏菌Ⅲ型效应分子 Yersinia type III effectors | 宿主靶分子 Host targets | 生物学功能 Biochemical function | 致病效应 Pathogenic effects |
| YopH | 黏着斑复合体(p130cas、FAK、Paxillin蛋白、Fyb、SKAP-HOM);LAT、SLP-76、Lck | 去磷酸化;减弱黏着斑的组装 | 抑制吞噬作用和细胞因子的产生 |
| YpkA | Gαq (激酶结构域);RhoA/Rac (Rho GDI结构域);Actin | 磷酸化,抑制核苷酸交换 | 破坏细胞骨架,抑制吞噬作用 |
| YopE | RhoA/Rac/Cdc42 | 加速GTP水解,失活 | 抑制吞噬作用和成孔作用;抑制IL-1β产生 |
| YopT | RhoA/Rac/Cdc42 | 通过蛋白水解去除脂类的修饰,膜的分解 | 抑制吞噬作用和成孔作用 |
| YopJ | MAPK信号通路的MKKs;NF-ΚB通路的IKKs | 乙酰化作用,阻止磷酸化作用的激活 | 抑制细胞因子的产生,诱导巨噬细胞凋亡 |
| YopM | RSK1和PRK2 | 抑制IL-15(R),消耗NK细胞 |
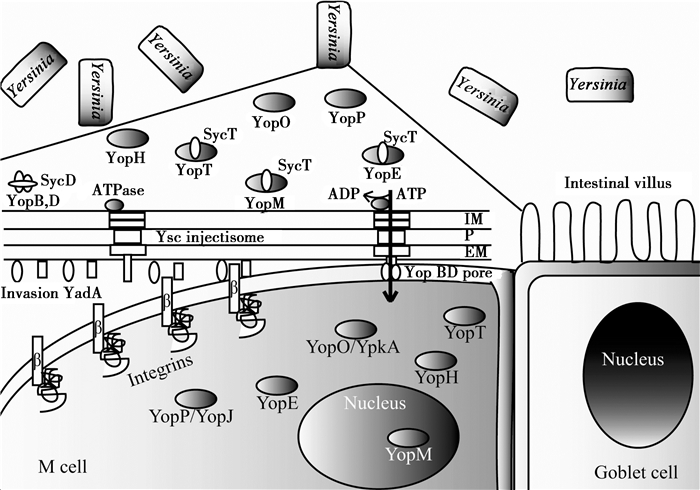
耶尔森氏菌的Ⅲ型分泌系统蛋白在37 °C环境中表达上调,通过细胞之间连接使Yops跨过宿主细胞膜转移[57]。有研究表明,当假结核耶尔森氏菌与宿主细胞之间紧密接触后,Yop效应分子分泌,YopB和YopD这两个T3SS分泌的底物,含有疏水结构域,能插入红细胞或者有核细胞的细胞膜上,此处的细胞膜上能形成孔结构并通过Ysc/Yop T3SS组装的连续通道进行转移(图 1),侵袭素Invasin、Ail和YadA能够增强Yops向宿主细胞转移,并且在血清的抗性方面起到非常重要的作用[58]。有研究表明这种从细菌细胞液到宿主细胞的细胞质之间进行的极性转移是一步进行的[46, 59]。然而Akopyan等利用免疫电镜等技术发现通过Ⅲ型分泌系统进行的蛋白转移经历了一个细胞外中间步骤,这个步骤可以在体外环境中重构出来[60]。Ⅲ型分泌系统的详细结构在Chatterjee等2013年的综述中有所描述[61];然而也有研究认为假结核耶尔森氏菌通过Ⅲ型分泌系统注入效应蛋白的装置存在诸多矛盾[62]。因此Ⅲ型分泌系统转运分子的具体分子机制还有待于进一步研究。
|
|
图 1 小肠表面Yops经Ysc的分泌以及跨M细胞转运
Figure 1 Secretion of Yops by the Ysc injectisome and translocation across the M cell membrane
注:当假结核耶尔森氏菌选择性的移向M细胞时,M细胞膜上,Ysc (Yop secretion)注入体组装,一系列的Yop蛋白被合成. 当细菌处于内化阶段,一些Yops被它特异的Syc伴侣加上帽子结构. 一旦细菌与M细胞接触,其黏附素YadA或者侵袭素特异性的与M细胞表面Integrins受体相互作用,停靠在细胞表面,然后分泌通道打开,Yops被分泌出去,同时YopB和YopD在细胞膜上形成一个孔的结构,效应分子跨过膜转运到宿主细胞质中,YopM移向细胞核. EM:外膜;P:肽聚糖;IM:质膜. Note: When Y.pseudotuberculosis moved M cell,the Ysc injectisome is installed and a stock of Yop proteins are synthesized. During their intrabacterial stage,some Yops are capped with their specific syc chaperone. Upon contact with the M cell,the adhesins YadA or invasin interact with integrins and the bacterium docks at the cell’surface. Then,the secretion channel opened and Yops are exported. YopB and YopD formed a pore in M cell membrane and Yops are translocated across this pore into M cell cytosol. YopM migrated to the nucleus. EM: extra membrane; P: peptigoglycen; IM: plasma membrane. |
假结核耶尔森氏菌也有其它的分泌装置,例如Zhang等在2011报道了假结核耶尔森氏菌的Ⅵ型分泌系统T6SS受温度的调控[63],并且他们发现OmpR能够直接结合在T6SS4操纵子的启动子上调控其表达,并且这种调控也受低pH诱导[64]。
3 展望对于假结核耶尔森氏菌的研究主要是在过去三四十年内,尤其是对其感染的分子机制的研究取得了重大的进展。然而到目前为止,假结核耶尔森氏菌与宿主细胞的识别、结合,Ⅲ型分泌系统注入效应分子的过程,以及注入后引起的一系列分子组装动态仍然存在争议,因此对于这一过程的分子组装还有待于进一步的研究,我们借助电子显微镜技术和分子标记技术结合的优势对这一相互作用进行进一步的解析,He等[65]介绍了细胞电子断层成像技术,能够在组织和细胞的生理状态下瞬时冷冻固定样品,再经过去水、切片等过程能够使这一分子组装动态过程“可视化”。另外,耶尔森氏菌的生长温度和宿主细胞的环境温度不一致,因此耶尔森氏菌感染宿主后,在宿主细胞环境中受温度调控产生毒性因子的过程是一个复杂的过程。目前这种复杂的调控过程已经被许多研究人员重视。温度的调控涉及到DNA、RNA和蛋白质等多层水平,这方面的研究报道也越来越多[66]。另外,文章前面也提到了假结核耶尔森氏菌的某些基因也受到pH变化的影响,这种调控的精确机制也是目前研究的热点。近几年关于这个系统转录水平调控的研究较多,也有很多研究是关于转录后水平和翻译后水平调控的研究[67]。
致谢:感谢北京生命科学研究所(NIBS)为本工作提供的平台,感谢何万中老师对本工作的指导和建议。| [1] | Paff JR,Triplett DA,Saari TN.Clinical and laboratory aspects of Yersinia pseudotuberculosis infections,with a report of two cases[J].American Journal of Clinical Pathology,1976,66(1): 101-110 |
| [2] | Leo JC,Skurnik M.Adhesins of human pathogens from the genus Yersinia[A]//Bacterial Adhesion[M].Netherlands: Springer,2011: 1-15 |
| [3] | Eurosurveillance editorial team.The European Union summary report on trends and sources of zoonoses,zoonotic agents and food-borne outbreaks in 2010[J].European Communicable Disease Bulletin,2012,17(10): 20113 |
| [4] | Jalava K,Hakkinen M,Valkonen M,et al.An outbreak of gastrointestinal illness and erythema nodosum from grated carrots contaminated with Yersinia pseudotuberculosis[J].The Journal of Infectious Diseases,2006,194(9): 1209-1216 |
| [5] | Jalava K,Hallanvuo S,Nakari UM,et al.Multiple outbreaks of Yersinia pseudotuberculosis infections in Finland[J].Journal of Clinical Microbiology,2004,42(6): 2789-2791 |
| [6] | Kangas S,Takkinen J,Hakkinen M,et al.Yersinia pseudotuberculosis O: 1 traced to raw carrots,Finland[J].Emerging Infectious Diseases,2008,14(12): 1959-1961 |
| [7] | Rimhanen-Finne R,Niskanen T,Hallanvuo S,et al.Yersinia pseudotuberculosis causing a large outbreak associated with carrots in Finland,2006[J].Epidemiology & Infection,2009,137(3): 342-347 |
| [8] | Palonen E.Sequence variability of virulence genes and stress responses in Yersinia pseudotuberculosis[D].Finland: Doctoral Dissertation of University of Helsinki,2015 |
| [9] | Clark MA,Jepson MA.Intestinal M cells and their role in bacterial infection[J].International journal of medical microbiology,2003,293(1): 17-39 |
| [10] | Marra A,Isberg RR.Invasin-dependent and invasin-independent pathways for translocation of Yersinia pseudotuberculosis across the Peyer’s patch intestinal epithelium[J].Infection and Immunity,1997,65(8): 3412-3421 |
| [11] | Deshmukh GR,Kumar KH,Reddy PVS,et al.M-cells and their role in mucosal immunity and disease causation[J].Journal of Pharmacy Research,2012,5(4): 1921-1923 |
| [12] | Miller H,Zhang J,KuoLee R,et al.Intestinal M cells: the fallible sentinels?[J].World Journal of Gastroenterology,2007,13(10): 1477-1486 |
| [13] | Isberg RR,Falkow S.A single genetic locus encoded by Yersinia pseudotuberculosis permits invasion of cultured animal cells by Escherichia coli K-12[J].Nature,1985,317(6034): 262-264 |
| [14] | Isberg RR,Voorhis DL,Falkow S.Identification of invasin: a protein that allows enteric bacteria to penetrate cultured mammalian cells[J].Cell,1987,50(5): 769-778 |
| [15] | Nagel G,Lahrz A,Dersch P.Environmental control of invasin expression in Yersinia pseudotuberculosis is mediated by regulation of RovA,a transcriptional activator of the SlyA/Hor family[J].Molecular Microbiology,2001,41(6): 1249-1269 |
| [16] | Quade N,Mendonca C,Herbst K,et al.Structural basis for intrinsic thermosensing by the master virulence regulator RovA of Yersinia[J].Journal of Biological Chemistry,2012,287(43): 35796-35803 |
| [17] | Isberg RR,Leong JM.Multiple β-1-chain integrins are receptors for invasin,a protein that promotes bacterial penetration into mammalian cells[J].Cell,1990,60(5): 861-871 |
| [18] | Leong JM,Fournier RS,Isberg RR.Identification of the integrin binding domain of the Yersinia pseudotuberculosis invasin protein[J].The EMBO Journal,1990,9(6): 1979-1989 |
| [19] | Hynes RO.Integrins: versatility,modulation,and signaling in cell adhesion[J].Cell,1992,69(1): 11-25 |
| [20] | van Nhieu GT,Krukonis ES,Reszka AA,et al.Mutations in the cytoplasmic domain of the integrin β1 chain indicate a role for endocytosis factors in bacterial internalization[J].Journal of Biological Chemistry,1996,271(13): 7665-7672 |
| [21] | Clark MA,Hirst BH,Jepson MA.M-cell surface β1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse peyer’s patch M cells[J].Infection and Immunity,1998,66(3): 1237-1243 |
| [22] | Hamburger ZA,Brown MS,Isberg RR,et al.Crystal structure of invasin: a bacterial integrin-binding protein[J].Science,1999,286(5438): 291-295 |
| [23] | Cossart P,Sansonetti PJ.Bacterial invasion: the paradigms of enteroinvasive pathogens[J].Science,2004,304(5668): 242-248 |
| [24] | D'Souza SE,Ginsberg MH,Plow EF.Arginyl-glycyl-aspartic acid(RGD): a cell adhesion motif[J].Trends in Biochemical Sciences,1991,16: 246-250 |
| [25] | Bliska JB,Copass MC,Falkow S.The Yersinia pseudotuberculosis adhesin YadA mediates intimate bacterial attachment to and entry into HEp-2 cells[J].Infection and Immunity,1993,61(9): 3914-3921 |
| [26] | Bölin I,Norlander L,Wolf-Watz H.Temperature-inducible outer membrane protein of Yersinia pseudotuberculosis and Yersinia enterocolitica is associated with the virulence plasmid[J].Infection and Immunity,1982,37(2): 506-512 |
| [27] | Trček J,Oellerich MF,Niedung K,et al.Gut proteases target Yersinia invasin in vivo[J].BMC Research Notes,2011,4(1): 129 |
| [28] | Bölin I,Wolf-Watz H.Molecular cloning of the temperature-inducible outer membrane protein 1 of Yersinia pseudotuberculosis[J].Infection and Immunity,1984,43(1): 72-78 |
| [29] | Yang Y,Isberg RR.Cellular internalization in the absence of invasin expression is promoted by the Yersinia pseudotuberculosis yadA product[J].Infection and Immunity,1993,61(9): 3907-3913 |
| [30] | Huang Y,Jing HQ.Advances in research of Yersinia pseudotuberculosis invasion[J].Chinese Journal of Zoonoses,2009,25(7): 669-672(in Chinese)黄瑛,景怀琦.耶尔森菌侵袭性研究进展[J].中国人兽共患病学报,2009,25(7): 669-672 |
| [31] | Heise T,Dersch P.Identification of a domain in Yersinia virulence factor YadA that is crucial for extracellular matrix-specific cell adhesion and uptake[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(9): 3375-3380 |
| [32] | Mikula KM,Kolodziejczyk R,Goldman A.Yersinia infection tools—characterization of structure and function of adhesins[J].Frontiers in Cellular and Infection Microbiology,2012,2: 169 |
| [33] | Bari ML,Hossain MA,Isshiki K,et al.Behavior of Yersinia enterocolitica in foods[J].Journal of Pathogens,2011,2011: 420732 |
| [34] | Bliska JB,Falkow S.Bacterial resistance to complement killing mediated by the Ail protein of Yersinia enterocolitica[J].Proceedings of the National Academy of Sciences of the United States of America,1992,89(8): 3561-3565 |
| [35] | Miller VL,Falkow S.Evidence for two genetic loci in Yersinia enterocolitica that can promote invasion of epithelial cells[J].Infection and Immunity,1988,56(5): 1242-1248 |
| [36] | Kirjavainen V,Jarva H,Biedzka-Sarek M,et al.Yersinia enterocolitica serum resistance proteins YadA and ail bind the complement regulator C4b-binding protein[J].PLoS Pathogens,2008,4(8): e1000140 |
| [37] | Biedzka-Sarek M,Salmenlinna S,Gruber M,et al.Functional mapping of YadA- and Ail-mediated binding of human factor H to Yersinia enterocolitica serotype O: 3[J].Infection and Immunity,2008,76(11): 5016-5027 |
| [38] | Yang Y,Merriam JJ,Mueller JP,et al.The psa locus is responsible for thermoinducible binding of Yersinia pseudotuberculosis to cultured cells[J].Infection and Immunity,1996,64(7): 2483-2489 |
| [39] | Ho DK,Riva R,Skurnik M,et al.The Yersinia pseudotuberculosis outer membrane protein Ail recruits the human complement regulatory protein factor H[J].The Journal of Immunology,2012,189(7): 3593-3599 |
| [40] | Ho DK,Riva R,Kirjavainen V,et al.Functional recruitment of the human complement inhibitor C4BP to Yersinia pseudotuberculosis outer membrane protein Ail[J].The Journal of Immunology,2012,188(9): 4450-4459 |
| [41] | Tsang TM,Wiese JS,Felek S,et al.Ail proteins of Yersinia pestis and Y.pseudotuberculosis have different cell bingding and invasion activities[J].PLoS One,2013,8: e83621 |
| [42] | Bonazzi M,Cossart P.Bacterial entry into cells: a role for the endocytic machinery[J].FEBS Letters,2006,580(12): 2962-2967 |
| [43] | Haglund CM,Welch MD.Pathogens and polymers: microbe-host interactions illuminate the cytoskeleton[J].The Journal of Cell Biology,2011,195(1): 7-17 |
| [44] | Salmond GPC,Reeves PJ.Membrance traffic wardens and protein secretion in Gram-negative bacteria[J].Trends in Biochemical Sciences,1993,18(1): 7-12 |
| [45] | Wang X,Jing HQ.Advances in Yersinia pseudotuberculosis[J].Chinese Journal of Zoonoses,2007,23(10): 1041-1046(in Chinese)王鑫,景怀琦.假结核耶尔森菌研究进展[J].中国人兽共患病学报,2007,23(10): 1041-1046 |
| [46] | Cornelis GR.Yersinia type Ⅲ secretion: send in the effectors[J].The Journal of Cell Biology,2002,158(3): 401-408 |
| [47] | Ghosh P.Process of protein transport by the type Ⅲ secretion system[J].Microbiology and Molecular Biology Reviews,2004,68(4): 771-795 |
| [48] | Mccoy MW,MarréML,Lesser CF,et al.The C-terminal tail of Yersinia pseudotuberculosis YopM is critical for interacting with RSK1 and for virulence[J].Infection & Immunity,2010,78(6): 2584-2598 |
| [49] | Viboud GI,Bliska JB.Yersinia outer proteins: role in modulation of host cell signaling responses and pathogenesis[J].Annual Review of Microbiology,2005,59: 69-89 |
| [50] | Trosky JE,Liverman ADB,Orth K.Yersinia outer proteins: Yops[J].Cellular Microbiology,2008,10(3): 557-565 |
| [51] | Shao F.Biochemical functions of Yersinia type Ⅲ effectors[J].Current Opinion in Microbiology,2008,11(1): 21-29 |
| [52] | Matsumoto H,Young GM.Proteomic and functional analysis of the suite of Ysp proteins exported by the Ysa type Ⅲ secretion system of Yersinia enterocolitica Biovar 1B[J].Molecular Microbiology,2006,59(2): 689-706 |
| [53] | Huang XX,Song XW,Zhu P.Cryo electron tomography and its application to biological research[J].Acta Biophysica Sinica,2010,26(8): 570-578(in Chinese)黄晓星, 宋晓伟,朱平.冷冻电子断层成像技术及其在生物研究领域的应用[J].生物物理学报,2010,26(8): 570-578 |
| [54] | He WZ,Kivork C,Machinani S,et al.A freeze substitution fixation-based gold enlarging technique for EM studies of endocytosed nanogold-labeled molecules[J].Journal of Structural Biology,2007,160(1): 103-113 |
| [55] | Morphew M,He WZ,Bjorkman PJ,et al.Silver enhancement of Nanogold particles during freeze substitution for electron microscopy[J].Journal of Microscopy,2008,230(Pt 2): 263-267 |
| [56] | He WZ,Ladinsky MS,Huey-Tubman KE,et al.FcRn-mediated antibody transport across epithelial cells revealed by electron tomography[J].Nature,2008,455(7212): 542-546 |
| [57] | Schmid A,Neumayer W,Trülzsch K,et al.Cross-talk between type three secretion system and metabolism in Yersinia[J].Journal of Biological Chemistry,2009,284(18): 12165-12177 |
| [58] | Maldonado-Arocho FJ,Green C,Fisher ML,et al.Adhesins and host serum factors drive Yop translocation by Yersinia into professional phagocytes during animal infection[J].PLoS Pathognes,2013,9(6): e1003415 |
| [59] | Cornelis GR,van Gijsegem F.Assembly and function of type Ⅲ secretory systems[J].Annual Review of Microbiology,2000,54: 735-774 |
| [60] | Akopyan K,Edgren T,Wang-Edgren H,et al.Translocation of surface-localized effectors in type Ⅲ secretion[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(4): 1639-1644 |
| [61] | Chatterjee S,Chaudhury S,McShan AC,et al.Structure and biophysics of type Ⅲ secretion in bacteria[J].Biochemistry,2013,52(15): 2508-2517 |
| [62] | Edgren T,Forsberg Å,Rosqvist R,et al.Type Ⅲ secretion in Yersinia: injectisome or not?[J].PLoS Pathogens,2012,8(5): e1002669 |
| [63] | Zhang WP,Xu SJ,Li J,et al.Modulation of a thermoregulated type VI secretion system by AHL-dependent quorum sensing in Yersinia pseudotuberculosis[J].Archives of Microbiology,2011,193(5): 351-363 |
| [64] | Gueguen E,Durand E,Zhang XY,et al.Expression of a Yersinia pseudotuberculosis type VI secretion system is responsive to envelope stresses through the OmpR transcriptional activator[J].PLoS One,2013,8(6): e66615 |
| [65] | He WZ,Fernández JJ.Electron tomography[A]//eLS[M].Chichester: John Wiley & Sons,Ltd.,2010 |
| [66] | Lam O,Wheeler J,Tang CM.Thermal control of virulence factors in bacteria: A hot topic[J].Virulence,2014,5(8): 852-862 |
| [67] | Schiano CA,Lathem WW.Post-transcriptional regulation of gene expression in Yersinia species[J].Frontiers in Cellular and Infection Microbiology,2012,2: 129 |
 2016, Vol. 43
2016, Vol. 43