扩展功能
文章信息
- 李文艳, 董明倩, 王亚光, 邵巧巧, 管越强
- LI Wen-Yan, DONG Ming-Qian, WANG Ya-Guang, SHAO Qiao-Qiao, GUAN Yue-Qiang
- 单增李斯特菌感染过程中炎性体激活的研究进展
- Activation of inflammasome during Listeria monocytogenes infection―a review
- 微生物学通报, 2016, 43(3): 634-639
- Microbiology China, 2016, 43(3): 634-639
- 10.13344/j.microbiol.china.150487
-
文章历史
- 收稿日期: 2015-06-25
- 接受日期: 2015-09-02
- 优先数字出版日期(www.cnki.net): 2015-12-04
2. 河北大学生命科学学院 河北 保定 071002
2. College of Life Science, Hebei University, Baoding, Hebei 071002, China
单核细胞增生性李斯特菌(Listeria monocytogenes,LM)简称单增李斯特菌,是人兽共患的食源性革兰氏阳性菌,可导致人和动物胃肠炎、脑膜炎、败血症等疾病的发生,甚至危及生命[1]。LM一旦感染机体,机体需要马上启动先天免疫系统和适应性免疫系统进行复杂的免疫反应,来识别和清除病原菌,保护机体免受病原的侵害。其中,先天免疫系统通过调节促炎性细胞因子的产生在启动和组织宿主防御反应中起着关键的作用[2]。因此,关于LM感染过程中炎性体激活的研究成为当前动物学、微生物学和医学界研究的热点之一。
1 单增李斯特菌的感染和传播LM既能感染吞噬细胞,也能感染非吞噬细胞,如巨噬细胞、肝细胞、上皮细胞及成纤维细胞等,其感染过程可以分为4个阶段:入侵、逃逸吞噬泡、增殖以及在细胞与细胞之间传播[3, 4]。在入侵过程中,菌体的表面蛋白与细胞膜的表面蛋白受体结合使LM逐渐被膜包裹并陷入到胞内,从而形成囊状吞噬泡[3];吞噬泡很快与溶酶体结合,溶酶体内的酸性环境可迅速酸化吞噬泡降解菌体,但LM在被吞噬形成吞噬泡后,会通过李斯特菌溶血素O (listeriolysin O,LLO)的成孔毒性和磷脂酶C (phospholipase C,PLC)的裂解作用溶解吞噬体膜,阻止或延长吞噬泡酸化的时间,并使细菌尽快逃离吞噬体,进入宿主细胞质基质[3, 4, 5];在胞质中菌体快速增殖,同时表达肌动蛋白聚合蛋白推动细菌向细胞膜移动[4];当LM移动到细胞膜时,在膜上形成“伪足”状突起,突起被与之相邻的细胞内吞,形成双层膜结构的二级吞噬体,在LLO和PLC的作用下,包裹有菌体的二级吞噬泡被破坏,LM继续逃离再进入邻近细胞[3],传播过程中宿主细胞没有发生裂解,从而避免菌体暴露在含有多种细胞因子和抗体的胞外环境中被杀伤。
2 炎性体的组成炎性体是细胞内NOD样受体(nucleotide-binding oligomerization domain like receptor,NLR)和DNA/RNA感受器感受病原体及危险信号后组装形成的多蛋白复合体,它可激活半胱氨酸的天冬氨酸蛋白水解酶1 (Cysteinyl aspartate specific proteinase,Caspase1),进而使IL-1β前体和IL-18前体转变为成熟的IL-1β和IL-18发挥生物学效应,参与机体的先天性免疫反应[6, 7, 8],导致caspase1介导的细胞程序性的快速死亡[7]。
炎性体的组成可以简单概括为感受器通过凋亡相关点样蛋白(apoptosis-associated speck-like protein,ASC)连接到caspase1。ASC是所有炎性体的衔接蛋白,包含两个死亡褶皱域:一个热蛋白结构域(Pyrin domain,PYD)和一个Caspase1的激活和招募域(Caspase-recruitment domain,CARD),PYD可与上游的感受器互作引发ASC组装成一个大的含有ASC二聚体的多聚体蛋白复合体[9],CARD可与下游的Caspase1前体互作,使Caspase1前体聚合、裂解形成有活性的Caspase1 (图 1)[10]。
目前报道较多的可引发炎性体形成的感受器是NLR,如含有PYD-1的NLR (NLR containing PYD-1,NLRP1)、NLRP3、NLRP6、NLRP7、NLRP12或含有CARD-4结构域的NLR (NLR containing CARD-4,NLRC4)。除了NLRP1,其它的NLR蛋白质都由3个结构域组成,包含一个氨基末端死亡褶皱域(NLRPs含有PYD,而NLRC4含有CARD),一个中央NACHT (神经元凋亡抑制蛋白NALP、MHCⅡ类分子反式激活因子CⅡTA、柄孢霉不亲和位点蛋白HET-E和端粒酶相关蛋白TPl的第一、二个字母或首字母的缩写)核苷结合域和一个羧基末端富含亮氨酸的重复域(leucine-rich repeats,LRR)[6]。其中NACHT域有ATP酶活性,具有蛋白质寡聚化的作用;LRR有监管职能,还可能参与了与配体的相互作用;NLR蛋白质的死亡褶皱域如果是PYD,则通过衔接蛋白ASC连接到caspase1前体,如果死亡褶皱域为CARD,则直接与Caspase1前体相互作用[6],但也有可能是NLR首先与ASC通过CARD-CARD相互作用,再通过与另一个ASC的PYD-PYD相互作用[11]。
最近发现,细胞质DNA感受器黑色素瘤缺乏因子2 (Absent in melanoma 2,AIM2)和干扰素γ诱导蛋白16 (IFNγ-inducible protein 16,IFI16)也属于炎性体成员[11],AIM2含有一个招募ASC的PYD和一个结合DNA的HIN-200域(图 1),而IFI16含有一个PYD和两个结合DNA的HIN-200域[11, 12]。另外,视黄酸诱导基因I (Retinoic acid-inducible gene-I,RIG-I)蛋白也被认为是炎性体,因为它可通过CARD与ASC相互作用后激活Caspase1,促进IL-1β的成熟和释放(图 1)[13]。
3 LM对不同炎性体的激活当单增李斯特菌感染宿主细胞进入细胞质后,细菌的病原相关分子模式(Pathogen associated molecular pattern,PAMP)、菌体蛋白、毒力因子和核酸等可被宿主细胞质中的不同炎性体识别并激活,进而活化Casepase1,促进IL-1β和IL-18的成熟和分泌,以及Casepase1依赖的细胞死亡[15, 16]。
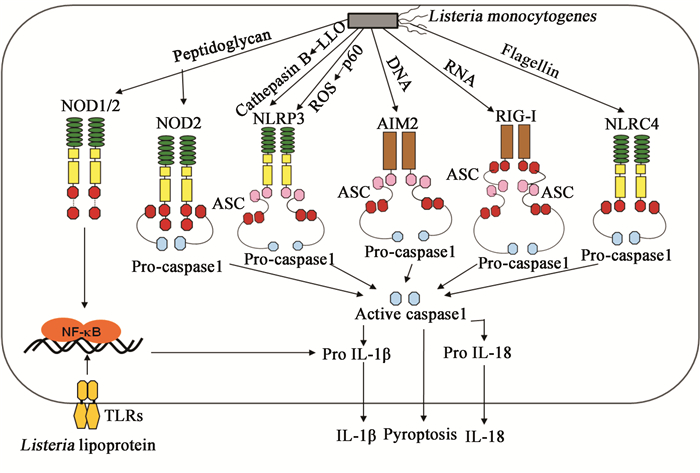
3.1 LM对NLRP3炎性体的激活NLRP3是第一个被鉴别出的LM激活的炎性体[17],LM激活NLRP3的机制可归纳为3个方面:(1) LM被细胞吞噬裹入吞噬体后,LLO介导的吞噬体膜破坏导致吞噬体中组织蛋白酶B释放到细胞质,进而激活NLRP3炎性体[17];(2) LM感染后,LLO的成孔特性使K+通过细胞膜外流,从而诱导NLRP3的激活,尤其是细胞外的LLO诱导NLRP3的激活不依赖于组织蛋白酶B的释放,只与K+外流有关[18];(3) LM分泌的P60蛋白诱导宿主细胞产生大量活性氧(Reactive oxygen species,ROS),从而激活了NLRP3炎性体(图 2)[19]。
|
| 图 2 单增李斯特菌对炎性体的激活 Figure 2 The activiation of inflammasome by Listeria monocytogenes |
LM激活NLRP3的过程主要依赖于髓样分化因子(Myeloid differentiation factor 88,MyD88)——白介素-1受体相关激酶4 (Inerleukin-1 receptor associated kinase 4,IRAK4)—白介素-1受体相关激酶1 (Inerleukin-1 receptor associated kinase 1,IRAK1)路径。实验证实,LM感染NLRP3重建的N1-8巨噬细胞,在没有Toll样受体(Toll like receptor,TLR)刺激物预刺激的前提下,Caspase1也能被快速激活,但在MyD88-KO、IRAK4-KO和IRAK-1-KO细胞中,LM对NLRP3炎性体的激活明显受阻,说明LLO的释放激活了炎性体组装的第2个阶段,而在早期阶段,LM的PAMP激活了膜上的TLR,进而通过MyD88-IRAK4-IRAK1路径快速激活NLRP3。同时,绿色荧光蛋白标记NLRP3的激光共聚焦成像观察也得到了类似的结果[20]。
3.2 LM对AIM2炎性体的激活在LM感染过程中,宿主细胞中炎性体AIM2通过识别胞质中的菌体DNA被激活,从而促进IL-1β的释放和细胞的快速死亡(图 2)[21, 22, 23, 24, 25]。AIM2缺陷的巨噬细胞在LM感染后,Casepase1活化和IL-1β的分泌部分被抑制[22, 23, 24],NLRP3缺陷的巨噬细胞经AIM2的siRNA处理,在LM感染后,Casepase1的活化完全被抑制;LM感染的巨噬细胞经氨苄青霉素处理释放出细菌DNA,导致AIM2依赖性的细胞死亡和IL-1β的产生明显增强[25]。由于AIM2是IFN刺激的基因,所以LM激活AIM2时需要启动I型IFN信号的反应[25]。
3.3 LM对NLRC4炎性体的激活不同细菌表达的鞭毛蛋白可通过激活NLRC4炎性体激活巨噬细胞的Casepase1,促进IL-1β的分泌(图 2)[21, 26, 27]。研究显示,LM感染后NLRC4缺陷细胞Casepase1的激活和IL-1β的产生部分受损[21, 27],因此认为LM对NLRC4炎性体具有激活作用,但也有实验结果得到了不同的结论,认为NLRC4在LM介导的Casepase1激活中并未发挥关键性作用[18, 22]。这可能是由于LM菌株在37 °C时鞭毛蛋白的表达受到强抑制,以及不同菌株鞭毛蛋白表达的差异性造成的。
3.4 LM对RIG-I炎性体的激活新近研究发现,RIG-I作为炎性体也参与了抗LM感染的先天免疫(图 2)。免疫组织化学结果显示,感染LM的小鼠肝Kupffer细胞和脾网状细胞中RIG-I表达上调,体外培养的RAW264.7小鼠巨噬细胞样细胞无论是被热杀死的LM还是活的LM感染后,RIG-I的表达都上调[28]。进一步研究发现,胞质中的RIG-I识别LM释放的RNA/DNA后被激活,引起RIG-I依赖的IL-1β产生,并且在此过程中,信号分子CARD9促成IL-1β的产生[29];另外,RIG-I对菌体RNA的识别是非免疫细胞中一个必要的基质免疫识别,它不依赖功能性的干扰素刺激因子(Stimulator of interferon genes,STING)信号路径[30]。
3.5 LM对其它炎性体的激活炎性体NOD2 (NLRC2)主要是被LM细胞壁肽聚糖的降解产物MDP所感受和激活(图 2)[31]。在细胞质中,LM的肽聚糖碎片被NOD1和NOD2感知导致促炎症因子和抗菌肽的表达[31, 32]。这种NOD1/2激活的基因表达依赖受体互作蛋白-2 (Receptor-interacting protein-2,Rip-2)、核转录因子-κB和p38有丝分裂激活蛋白激酶[32],因此,缺乏NOD1或者Rip-2的老鼠对LM的易感性增加。
NLRC5作为NLR家族中最大的成员,近来引起人们更多的兴趣。然而,NLRC5在宿主防御和调节免疫信号路径中的作用还不清楚,在LM感染CD8+T细胞过程中,NLRC5参与MHCI抗原呈递作用,而且NLRC5缺陷的小鼠NLRP3介导的炎性体激活部分受损[33],因此推测NLRC5可能与LM激活的NLRP3炎性体有关。
3.6 LM对多种炎性体激活的比较在LM感染过程中,宿主细胞胞质中多种炎性体被激活,在这些炎性体中,NLRP3可能首先被激活,随后NLRC4和AIM2被激活,因为在LM感染过程中,细菌破坏吞噬泡要早于鞭毛蛋白单体和细菌DNA释放到细胞质基质[26]。
在LM激活炎性体诱导IL-1β产生的过程中,哪一种炎性体发挥最主要的作用,目前还没有定论,但讨论的焦点主要集中在NLRP3和AIM2炎性体之间。Meixenberger等[18]通过外周血单个核细胞的RNA干扰实验和骨髓来源的巨噬细胞的NLRP3和Rip2敲除实验都证实LM诱导的IL-1β释放依赖于NLRP3炎性体,而其它炎性体如NOD2、Rip2、NLRP1、NLRP6、NLRP12、NLRC4和AIM2则是非必要的,并且进一步证实LM促进IL-1β的产生与AIM2无关;但是Wu等用无鞭毛蛋白的LM感染巨噬细胞,发现菌体只能被AIM2炎性体识别,而不能被NLRP3炎性体识别,说明LM诱导IL-1β产生和Caspase1依赖的细胞死亡依赖AIM2炎性体,而不是NLRP3炎性体[21];还有部分
实验结果则证实在LM诱导IL-1β和IL-18产生的过程中,LM不但激活了NLRP3炎性体,也激活了AIM2炎性体,但AIM2炎性体占优势,因为与野生型巨噬细胞相比,NLRP3和NLRC4敲除的巨噬细胞在LM感染后,IL-1β和IL-18的分泌量只是轻微的减少,而AIM2敲除的巨噬细胞IL-1β和IL-18的分泌量则明显降低[22, 23]。在上述几种观点中,大家比较认可的是LM既激活了NLRP3炎性体,也激活了AIM2炎性体,但AIM2炎性体的激活明显占优势。得到上述不同见解的原因可能是由于使用的LM菌株和细胞系的不同导致炎性体激动剂表达和释放的不同造成的;此外,有的实验使用脂多糖(Lipopolysaccharid,LPS)预刺激促进细胞使IL-1β前体和NLRP3的表达,而有的实验没有经过LPS预刺激,这可能也是造成上述不同结果的原因之一。
4 结语炎性体在机体抵御病原微生物感染过程中发挥着先天免疫的作用,在LM感染宿主细胞的过程中,宿主细胞中不同的炎性体分别识别细菌不同的PAMPs和毒力因子被直接或间接激活,介导炎性因子IL-1β和IL-18的产生,改变免疫系统,遏制细菌感染。
虽然已经发现LM可通过不同途径激活宿主细胞的多种炎性体,但是尚有一些问题有待解决:(1) 这些炎性体的感受器是否能够直接与LM的不同成分结合,即炎性体的感受器是否是真正的受体分子,是否在识别LM的过程中需要宿主细胞中蛋白分子的辅助。(2) 炎性体感受LM后,这些感受器是否进行翻译后修饰,如磷酸化、泛素化和酶解等,如果发生修饰,那么细胞中的相关酶会发挥重要的作用,这也可以作为李斯特病治疗的靶点。(3) LM对不同炎性体激活并不是彼此孤立的,它们之间存在着一定的“对话”机制,但不同炎性体之间是如何进行“对话”还不清楚。(4) 目前关于LM激活炎性体的研究主要集中于体外实验,但这不能完全代表体内水平,只有了解LM如何在体内激活炎性体才能真正预防和治疗LM相关的疾病。这些问题虽然具有挑战性,但也是科研工作者和医学工作者今后努力的方向。
| [1] | Cheers C,McKenzie IF.Resistance and susceptibility of mice to bacterial infection: genetics of listeriosis[J].Infection and Immunity,1978,19(3): 755-762 |
| [2] | Geyer MB,Radhakrishnan K,van de Ven C,et al.Enhanced survival during experimental Listeria monocytogenes sepsis in neonatal mice prophylactically treated with Th1 and macrophage immunoregulatory cytokines and mediators[J].Pediatric Infectious Disease Journal,2014,33(12): e330-e337 |
| [3] | Portnoy DA,Auerbuch V,Glomski J.The cell biology of Listeria monocytogenes infection the intersection of bacterial pathogenesis and cell-mediated immunity[J].Journal of Cell Biology,2002,158(3): 409-414 |
| [4] | Li WY,Zhang YH,Lin HY,et al.Secretory expression of recombinant Listeria monocytogenes listeriolysin O in E.coli and analysis of its biological activity[J].Chinese Journal of Veterinary Science,2014,34(8): 1278-1283(in Chinese)李文艳,张永红,林洪羽,等.重组单增李斯特菌溶血素O在大肠杆菌中的分泌表达及活性分析[J].中国兽医学报,2014,34(8): 1278-1283 |
| [5] | Lam GY,Fattouh R,Muise AM,et al.Listeriolysin O suppresses phospholipase C-mediated activation of the microbicidal NADPH oxidase to promote Listeria monocytogenes infection[J].Cell Host & Microbe,2011,10(6): 627-634 |
| [6] | Vanaja SK,Rathinam VAK,Fitzgerald KA.Mechanisms of inflammasome activation: recent advances and novel insights[J].Trends in Cell Biology,2015,25(5): 308-315 |
| [7] | Jorgensen I,Miao EA.Pyroptotic cell death defends against intracellular pathogens[J].Immunological Reviews,2015,265(1): 130-142 |
| [8] | Li WY,Han DM,Liang S,et al.Molecular mechanism for the effects of E.coli heat-labile enterotoxin on mouse embryo survival[J].Reproductive Toxicology,2014,45: 31-38 |
| [9] | Vajjhala PR,Mirams RE,Hill JM.Multiple binding sites on the pyrin domain of ASC protein allow self-association and interaction with NLRP3 protein[J].Journal of Biological Chemistry,2012,287(50): 41732-41743 |
| [10] | Proell M,Gerlic M,Mace PD,et al.The CARD plays a critical role in ASC foci formation and inflammasome signalling[J].Biochemical Journal,2013,449(3): 613-621 |
| [11] | Latz E,Xiao TS,Stutz A.Activation and regulation of the inflammasomes[J].Nature Reviews Immunology,2013,13(6): 397-411 |
| [12] | Unterholzner L,Keating SE,Baran M,et al.IFI16 is an innate immune sensor for intracellular DNA[J].Nature Immunology,2010,11(11): 997-1004 |
| [13] | Kell AM,Gale M Jr.RIG-I in RNA virus recognition[J].Virology,2015,479/480: 110-121 |
| [14] | Eitel J,Suttorp N,Opitz B.Innate immune recognition and inflammasome activation in Listeria monocytogenes infection[J].Frontiers in Microbiology,2011,1: 149 |
| [15] | Tsuji NM,Tsutsui H,Seki E,et al.Roles of caspase-1 in Listeria infection in mice[J].International Immunology,2004,16(2): 335-343 |
| [16] | Cervantes J,Nagata T,Uchijima M,et al.Intracytosolic Listeria monocytogenes induces cell death through caspase-1 activation in murine macrophages[J].Cellular Microbiology,2008,10(1): 41-52 |
| [17] | Mariathasan S,Weiss DS,Newton K,et al.Cryopyrin activates the inflammasome in response to toxins and ATP[J].Nature,2006,440(7081): 228-232 |
| [18] | Meixenberger K,Pache F,Eitel J,et al.Listeria monocytogenes-infected human peripheral blood mononuclear cells produce IL-1β,depending on listeriolysin O and NLRP3[J].The Journal of Immunology,2010,184(2): 922-930 |
| [19] | Schmidt RL,Lenz LL.Distinct licensing of IL-18 and IL-1β secretion in response to NLRP3 inflammasome activation[J].PLoS One,2012,7(9): e45186 |
| [20] | Fernandes-Alnemri T,Kang S,Anderson C,et al.Cutting edge: TLR signaling licenses IRAK1 for rapid activation of the NLRP3 inflammasome[J].The Journal of Immunology,2013,191(8): 3995-3999 |
| [21] | Wu JH,Fernandes-Alnemri T,Alnemri ES.Involvement of the AIM2,NLRC4,and NLRP3 inflammasomes in caspase-1 activation by Listeria monocytogenes[J].Journal of Clinical Immunology,2010,30(5): 693-702 |
| [22] | Tsuchiya K,Hara H,Kawamura I,et al.Involvement of absent in melanoma 2 in inflammasome activation in macrophages infected with Listeria monocytogenes[J].The Journal of Immunology,2010,185(2): 1186-1195 |
| [23] | Kim S,Bauernfeind F,Ablasser A,et al.Listeria monocytogenes is sensed by the NLRP3 and AIM2 inflammasome[J].European Journal of Immunology,2010,40(6): 1545-1551 |
| [24] | Witte CE,Archer KA,Rae CS,et al.Innate immune pathways triggered by Listeria monocytogenes and their role in the induction of cell-mediated immunity[J].Advances in Immunology,2012,113: 135-156 |
| [25] | Sauer JD,Witte CE,Zemansky J,et al.Listeria monocytogenes triggers AIM2-mediated pyroptosis upon infrequent bacteriolysis in the macrophage cytosol[J].Cell Host & Microbe,2010,7(5): 412-419 |
| [26] | Zhao Y,Shao F.The NAIP-NLRC4 inflammasome in innate immune detection of bacterial flagellin and type Ⅲ secretion apparatus[J].Immunological Reviews,2015,265(1): 85-102 |
| [27] | Warren SE,Mao DP,Rodriguez AE,et al.Multiple Nod-like receptors activate caspase 1 during Listeria monocytogenes infection[J].The Journal of Immunology,2008,180(11): 7558-7564 |
| [28] | Imaizumi T,Sashinami H,Mori F,et al.Listeria monocytogenes induces the expression of retinoic acid-inducible gene-I[J].Microbiology and Immunology,2006,50(10): 811-815 |
| [29] | Abdullah Z,Schlee M,Roth S,et al.RIG-I detects infection with live Listeria by sensing secreted bacterial nucleic acids[J].The EMBO Journal,2012,31(21): 4153-4164 |
| [30] | Hagmann CA,Herzner AM,Abdullah Z,et al.RIG-I detects triphosphorylated RNA of Listeria monocytogenes during infection in non-immune cells[J].PLoS One,2013,8(4): e62872 |
| [31] | Park JH,Kim YG,McDonald C,et al.RICK/RIP2 mediates innate immune responses induced through Nod1 and Nod2 but not TLRs[J].The Journal of Immunology,2007,178(4): 2380-2386 |
| [32] | Mosa A,Trumstedt C,Eriksson E,et al.Nonhematopoietic cells control the outcome of infection with Listeria monocytogenes in a nucleotide oligomerization domain 1-dependent manner[J].Infection and Immunity,2009,77(7): 2908-2918 |
| [33] | Yao YK,Wang YL,Chen FX,et al.NLRC5 regulates MHC class I antigen presentation in host defense against intracellular pathogens[J].Cell Research,2012,22(5): 836-847 |
 2016, Vol. 43
2016, Vol. 43