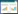扩展功能
文章信息
- 郭永华, 陈济琛, 贾宪波, 林新坚
- GUO Yong-Hua, CHEN Ji-Chen, JIA Xian-Bo, LIN Xin-Jian
- 分子伴侣共表达对嗜热环糊精葡萄糖基转移酶异源可溶性表达的影响
- Effects of chaperone co-expression on heterologous solubility expression of thermophilic cyclodextrin glucosetransferase
- 微生物学通报, 2016, 43(3): 518-526
- Microbiology China, 2016, 43(3): 518-526
- 10.13344/j.microbiol.china.150453
-
文章历史
- 收稿日期: 2015-06-11
- 接受日期: 2015-09-18
- 优先数字出版日期(www.cnki.net): 2015-09-28
2. 福建省农业科学院土壤肥料研究所 福建 福州 350003
2. Soil and Fertilizer Institute, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China
环糊精(CDs)被广泛应用于环保、医药、化学、食品等领域[1, 2],具有重要的工业应用价值。它有3种主要的类型,分别由6、7、8个葡萄糖通过α-1,4糖苷键连接而成的α-CD、β-CD、γ-CD组成,内疏水外亲水的筒形结构,主要由环糊精葡萄糖基转移酶(EC2.4.1.19;Cyclodextrin glucosetransferase,CGTase)通过催化分子内的转糖基反应将淀粉和相关基质转化成而来[3]。CGTase是微生物产生的一种多功能胞外酶、糖基水解酶α-淀粉酶家族(家族13)的重要成员,其特别功能是催化分子内的转糖基反应生成相应的产物。近年来,由于环糊精葡萄糖基转移酶具有较大的应用前景,引起了广泛而深入的研究,主要通过原核表达系统生产得到具有商业应用价值的酶制品[4]。然而,运用这一原核表达系统时发现一些问题,如在大肠杆菌中表达的大部分异源蛋白经常不能正确折叠形成天然构型,易聚集形成没有活性的包涵体,为后续研究和生产应用带来诸多不便[5, 6]。大量的研究试图减少重组大肠杆菌中包涵体的形成,结果发现分子伴侣和折叠酶作为共表达的折叠辅助蛋白,可以在一定程度上增加异源蛋白的可溶性表达[7]。
研究表明CGTase在重组大肠杆菌中的表达也主要以包涵体形式存在[8],复性费时费力,不适合工业化的生产应用。Jin等[9]通过优化pH和添加剂在一定程度上提高了CGTase的可溶性表达。Wu等[10]构建了来源于Paenibacillus macerans JFB05-01的α-CGTase基因的分泌型表达载体pET-20b(+)/cgt,发酵90 h后胞外酶活可达22.5 U/ml;张海军等[11]在原核表达体系中加入HG-PGR07分子伴侣质粒与重组质粒pET-32-pfu共表达,使HG-PGR07表达的分子伴侣蛋白能够有效促进Pfu酶的可溶性表达和酶活性提高。万娟等[12]的研究表明,pET-28a-med-ORF8与分子伴侣质粒pTf16共表达后,有效减少了包涵体的形成,提高了可溶性表达量。然而,与分子伴侣共表达提高嗜热CGTase可溶性表达的研究在国内还罕见报道。
本文利用原核表达载体pET-28a(+)-ompA进行嗜热脂肪芽孢杆菌CHB1嗜热CGTase在Escherichia coli BL21(DE3)中的异源表达,并进行了CGTase和分子伴侣蛋白(DnaK-DnaJ-GrpE、GroEL-GroES、tig)共表达的研究,通过筛选最佳分子伴侣蛋白促进酶可溶性表达,以及优化最适分子伴侣蛋白共表达条件,为下一步的工业化生产应用奠定基础。
1 材料与方法 1.1 材料菌株与质粒:嗜热脂肪芽孢杆菌CHB1、E. coli BL21(DE3)、表达载体pET-28a(+)-ompA本实验室保存。
主要试剂和仪器:标准分子量蛋白质、分子伴侣质粒,TaKaRa公司;IPTG、质粒提取试剂盒,天根生化科技有限公司;L-阿拉伯糖,Sigma公司;卡那霉素(Kan)、氯霉素(Cm)、四环素,上海生工生物工程有限公司;其余常用试剂均为分析纯。
1.2 基因克隆、pET-28a(+)-ompA-cgt载体构建及鉴定以嗜热脂肪芽孢杆菌CHB1的基因组DNA为模板,根据已知的环糊精葡萄糖基转移酶基因序列,设计引物序列:cgt-F:5′-CGCGGATCCAATAAG GTAAATTTTACATCG-3′,含BamH I酶切位点;cgt-R:5′-CCGCTCGAGGTTTTGCCAATTCACTATA AT-3′,含Xho I酶切位点。PCR扩增产物纯化回收后和载体pET-28a(+)-ompA分别进行BamH I和Xho I双酶切,回收纯化后,按载体与目的基因比1:3混合,加入T4 DNA连接酶,16 ℃连接过夜。连接产物转化E. coliBL21(DE3),卡那霉素抗性平板筛选阳性克隆。挑取单个阳性克隆子培养过夜,提取质粒,进行BamH I和Xho I双酶切验证,并且将阳性克隆子送上海生工生物工程有限公司测序。
1.3 目的蛋白的表达与表达条件优化1.3.1 目的蛋白的表达:挑取单菌落接种于50 ml含100 mg/l卡那霉素的LB培养基(g/L,胰蛋白胨10.0,酵母粉5.0,NaCl 10.0,pH 7.2-7.4),37 ℃、180 r/min振荡培养至OD600=0.6,加入终浓度为0.6 mmol/L的IPTG,诱导表达72 h。10 000 r/min离心5 min收集菌体,上清用于胞外酶活检测。菌体重悬于50 mmol/L PBS缓冲液中,冰浴中超声破碎,分离上清和沉淀,SDS-PAGE分析表达产物。
1.3.2 诱导温度的筛选:E. coli BL21/pET-28a(+)-ompA-cgt表达菌分别在20、25、30和37 ℃诱导表达72 h。发酵液10 000 r/min离心5 min,上清用于胞外酶活的检测。沉淀重悬于缓冲液中,冰浴中超声破碎,分离上清和沉淀,SDS-PAGE分析表达产物。
1.4 分子伴侣共表达系统的构建和可溶性表达条件优化 1.4.1 重组质粒pET-28a(+)-ompA-cgt与分子伴侣共表达体系的构建:将E. coliBL21/ pET-28a(+)-ompA-cgt重组菌接种于含100 mg/l卡那霉素的液体LB培养基中于37 ℃、180 r/min振荡培养,待细菌生长到OD600约为0.4-0.6时,用常规CaCl2方法制备感受态细胞。把pKJE8、pKJE7、pGro7、pTf16、pG-Tf2五种分子伴侣质粒(表 1)分别转化新制备的感受态细胞,用20 mg/L氯霉素和100 mg/L卡那霉素的平板筛选阳性克隆,获得同时含pET-28a(+)-ompA-cgt和分子伴侣质粒的基因工程菌。将含重组质粒pET-28a(+)-ompA-cgt的表达菌株作为阴性对照。| 质粒 Plasmid | 分子伴侣组合 Molecular chaperone | 启动子 Promoter | 诱导物 Inducer | 抗性标记 Resistant |
| pET-28a(+)-ompA | - | T7 | IPTG | 卡那霉素 |
| pKJE8 | dnaK-dnaJ-grpE groES-groEL-tig | araB | L-阿拉伯糖 四环素 | 氯霉素 |
| pKJE7 | dnaK-dnaJ-grpE | araB | L-阿拉伯糖 | 氯霉素 |
| pGro7 | groES-groEL | araB | L-阿拉伯糖 | 氯霉素 |
| pTf16 | tig | araB | L-阿拉伯糖 | 氯霉素 |
| pG-Tf2 | groES-groEL-tig | Pzt1 | 四环素 | 氯霉素 |
重点考虑环糊精葡萄糖基转移酶α-环化活力,参照Lejeune等[13]方法,以3% (质量体积比)可溶性淀粉为底物进行环糊精葡萄糖基转移酶α-环化活力测定。一个酶活力单位定义为在最适反应条件下每分钟生成1 μmol α-环糊精所需的酶量。
参照Bradford[14]方法进行蛋白浓度测定。
应用软件Bandscan 5.0分析SDS-PAGE电泳图谱中蛋白条带进行灰度扫描,测定各泳道中目的蛋白表达比率和灰度值,计算可溶性蛋白占总蛋白的比例。
2 结果与分析 2.1 重组质粒pET-28a(+)-ompA-cgt的构建及鉴定PCR扩增CGTase基因片段,分子量在2 000 bp左右,与预期基因长度大小一致,PCR产物与pET-28a(+)表达质粒经双酶切,纯化酶切产物经T4连接酶连接后转入E. coli BL21中,经菌液PCR验证,条带在2 000 bp左右;重组质粒双酶切验证,出现两个片段,分别与目的基因和载体的大小一致(图 1);另外,测序结果经比对显示序列正确,证明重组质粒pET-28a(+)-ompA-cgt构建成功,抗性平板上长出来的菌落即为阳性克隆。
 |
|
图 1 CGTase基因PCR产物和重组表达质粒pET-28a(+)-ompA-cgt的酶切验证
Figure 1 PCR product of cgt gene and the restriction analysis of recombinant plasmid pET28a(+)-OmpA-cgt
注:M1:DL2000 DNA标准分子量;1:cgt基因;M2:λ/Hind III DNA标准分子量;2:重组质粒pET-28a(+)-ompA-cgt经BamH I和Xho I双酶切验证. Note: M1: DL2000 DNA marker; 1: cgt gene; M2: λ/Hind III DNA marker; 2: pET-28a(+)-ompA-cgt digestion by BamH I and Xho I. |
| |
重组菌株pET-28a(+)-ompA-cgt/BL21(DE3)经诱导剂诱导表达72 h后,离心发酵液,收集菌体,细胞破碎后离心分离上清和沉淀,SDS-PAGE电泳分析(图 2),结合图 2的结果表明重组CGTase的相对分子质量在75 kD左右,符合预期目的蛋白大小。CGTase得到了大量表达,但是可溶性的蛋白含量很少,大部分是以不溶性的包涵体形式存在于沉淀中。以3% (质量体积比)可溶性淀粉为底物测细胞胞外上清酶活,结果显示酶活只有6.69 U/ml (表 2)。
 |
|
图 2 纯化CGTase的SDS-PAGE检测
Figure 2 SDS-PAGE analysis of the purified CGTase
注:M:标准量分子蛋白;1:未纯化的CGT酶;2:纯化的CGT酶. Note: M: Protein marker; 1: Crude enzyme; 2: Purified CGTase. |
| |
| 分子伴侣质粒 Molecular chaperone plasmid | 可溶性蛋白占总蛋白比例 Soluble protein of total protein (%) | 胞外上清酶活 Extracellular enzyme activity (U/mL) |
| pET-28a(+)-ompA- cgt | 5.8 | 6.65 |
| pKJE8/pET-28a(+)-ompA- cgt | 7.0 | 9.94 |
| pKJE7/pET-28a(+)-ompA- cgt | 9.1 | 7.10 |
| pGro7/pET-28a(+)-ompA- cgt | 7.4 | 9.90 |
| pG-Tf2/pET-28a(+)-ompA- cgt | 6.4 | 7.23 |
| pTf16/pET-28a(+)-ompA- cgt | 6.9 | 8.20 |
重组菌经诱导表达后,收集菌体,低温超声波破碎,离心后取上清,过Ni-IDA柱,收集洗脱液,SDS-PAGE (图 2)分析显示经镍柱纯化后的蛋白纯度达到95%以上。
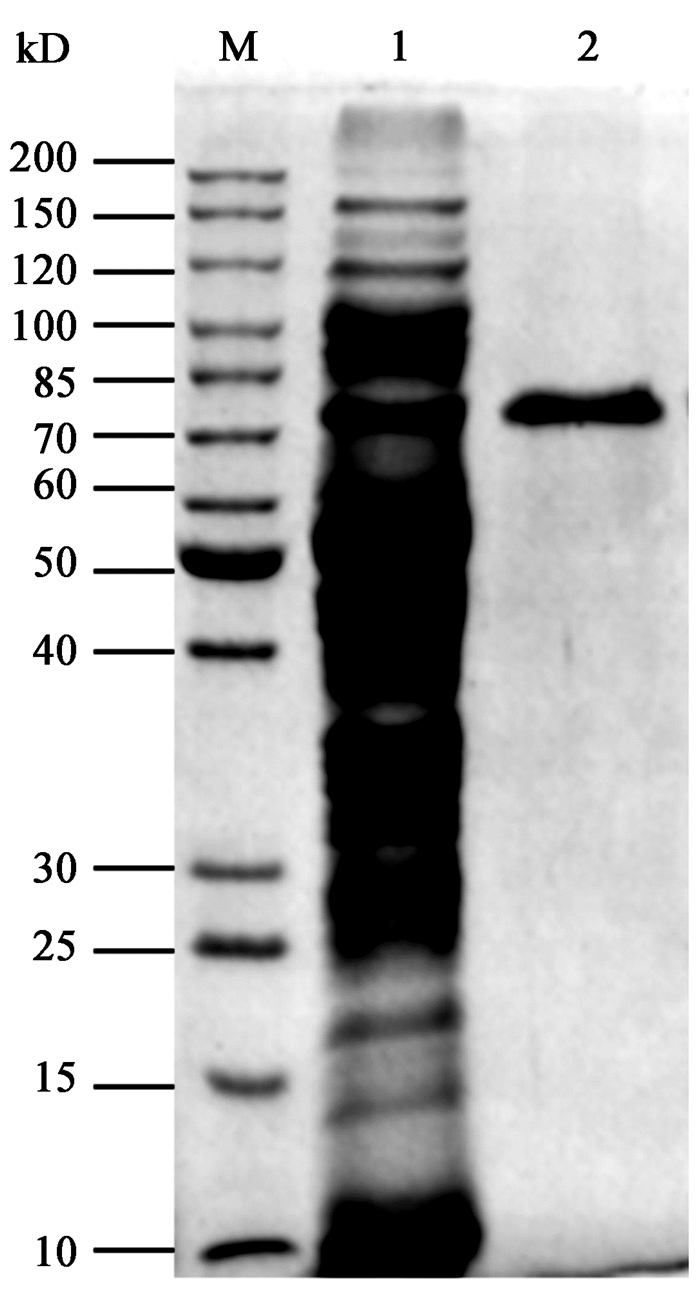
2.4 诱导温度的筛选将E. coliBL21/pET-28a(+)-ompA-cgt分别于20、25、30和37 ℃诱导表达72 h,表达产物经酶活测定和SDS-PAGE分析。如图 3所示,胞外酶活和目的蛋白的可溶性表达量在诱导温度为25 ℃时达到最大;诱导温度低于或高于25 ℃都不利于重组CGTase的胞外表达,可溶性目的蛋白占总蛋白比例减少,胞外酶活性降低,因此选择25 ℃为最适诱导温度。
 |
| 图 3 不同诱导温度下目的蛋白CGTase可溶性表达和胞外酶活的检测 Figure 3 Effects of different induction temperature on soluble expression and extracellular enzyme activity of recombinant CGTase |
| |
转入了重组质粒和分子伴侣质粒的E. coli BL21(DE3)经双抗性培养基筛选,并提取质粒进行验证和蛋白表达鉴定,表明5种分子伴侣分别与重组质粒共存于同一个表达菌株中。如图 4所示,pET-28a(+)-ompA-cgt与5种分子伴侣质粒共表达时,目的蛋白的可溶性表达量出现不同的情况。经软件Bandscan 5.0灰度扫描(表 2),E. coli BL21/pET-28a(+)-ompA-cgt单独表达时,目的蛋白在上清中的含量为5.8%,与pKJE8、pKJE7、pGro7、pTf16、pG-Tf2分子伴侣质粒分别共表达后,可溶性蛋白的量各为7.0%、9.1%、7.4%、6.4%和6.9%。其中与pKJE7分子伴侣质粒共表达后目的蛋白的可溶性表达量提高最为明显,提高了56.9%。
 |
|
图 4 5种分子伴侣共表达系统中目的蛋白CGTase表达水平的检测
Figure 4 SDS-PAGE analysis of expression products in five co-expression systems
注:M:标准量分子蛋白;S:可溶性部分;I:不可溶性部分. Note: M: Protein maker; S: Soluble fraction; I: Insoluble fraction. |
| |
通过测定其胞外酶活,结果发现重组质粒与分子伴侣共表达后,胞外酶活出现不同程度的提高,其中pKJE8和pGro7质粒对提高酶活性的程度比较大,分别提高了48.6%和48.0%。而分子伴侣质粒pKJE7对提高CGTase胞外活性影响最少,酶活仅提高了6.1%。
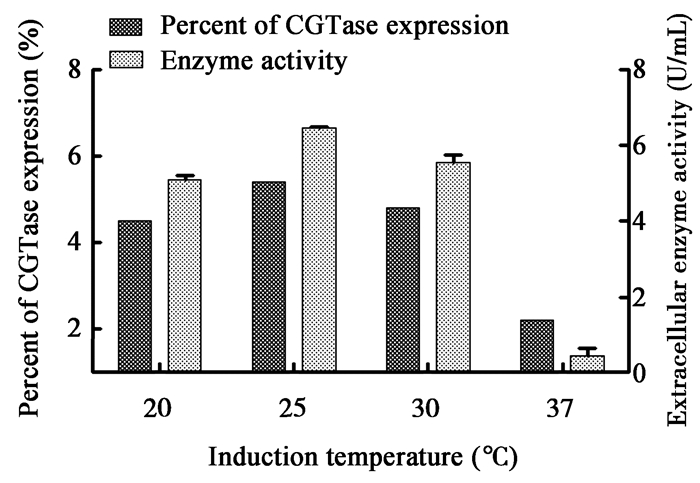
2.6 诱导共表达条件优化 2.6.1 温度对共表达的影响:如图 5所示,在不同温度下对双质粒重组菌株进行发酵培养,在培养至72 h后,CGTase与分子伴侣质粒pKJE8的共表达,胞外酶活最高达9.94 U/mL,说明25 ℃是最适共表达温度;发酵温度为20 ℃和37 ℃时,胞外酶活明显降低,胞外酶活只有4.68 U/mL和1.29 U/mL。结果表明,当温度较高时,虽然适合菌株的生长,但CGTase的表达受到明显抑制;当温度太低时,菌体生长速率较慢,导致重组CGTase合成速率较低,不利于酶的表达和分泌。原因可能是:(1) 高温条件下,质粒的丢失率上升,影响重组酶的生产;(2) 较高的发酵温度使得重组酶的合成速率太快,不利于酶的正确折叠,而较低的温度,酶的合成速率也低。  |
| 图 5 不同温度对5种分子伴侣共表达系统的胞外酶活检测 Figure 5 Different temperature for five molecular chaperone co-expression system in terms of extracellular enzyme activity |
| |
 |
| 图 6 不同浓度L-阿拉伯糖对5种分子伴侣共表达系统的胞外酶活检测 Figure 6 Different concentration of L-Arabinose for five molecular chaperone co-expression system in terms of extracellular enzyme activity |
| |
采用大肠杆菌表达系统对本实验室筛选到的一株嗜热芽孢杆菌CHB1环糊精葡萄糖基转移酶进行表达,研究发现25 ℃诱导能够改善目的蛋白的可溶性表达。究其原因,可能由于较低的生长温度降低了无活性聚集体形成的速率和疏水相互作用,从而减少了包涵体的形成。优化诱导温度在一定程度上可以提高CGTase的可溶性表达,但重组CGTase仍大多以包涵体形式存在,可溶性部分极少,可见提高蛋白的可溶性表达是大肠杆菌系统实用性的关键问题。为此,通常采用的措施:(1) 选择适合的表达宿主[15];(2) 优化表达条件,如降低培养温度;(3) 分子伴侣、融合蛋白、折叠酶的共表达[16];(4) 化学物质的添加,如培养基中加入山梨醇提高渗透压蛋白产物的可溶性[9]。
分子伴侣是一类能够协助其它蛋白质进行正确折叠、组装、转运、降解的重要因子,它们在细胞内帮助其它蛋白质的结构完成正确构象的形成,而且在行使功能后与之分离,不构成这些蛋白质执行功能的组分[17]。目前,大肠杆菌中存在3种主要的分子伴侣体系:DnaK-DnaJ-GrpE、GroEL-GroES和TF,它们在蛋白折叠过程中起着相互独立又相辅相成的作用[18],实验过程中可以通过不同分子伴侣的组合以获得最佳效果。本研究引入了分子伴侣共表达系统,采用了5种分子伴侣质粒(pKJE8、pGro7、pKJE7、pG-Tf2和pTf16)分别与pET-28a(+)- ompA-cgt进行共表达。SDS-PAGE分析结果显示,共表达不同分子伴侣的情况下,目的蛋白的可溶性表达量获得了不同程度的提高,并且胞外酶活也有了不同程度的提高。说明了不同的分子伴侣可能对提高目的蛋白质可溶性表达的程度有所不同[19, 20]。其中,pKJE8分子伴侣质粒共表达后,CGTase的可溶性表达量和胞外酶活性提高最为明显。由此可见,就CGTase而言,pKJE8质粒含有最佳的分子伴侣组合,减少了CGTase包涵体的形成,显著促进了CGTase的可溶性表达。pKJE8分子伴侣质粒携带3种分子伴侣基因,同时表达3种分子伴侣蛋白(DnaK-DnaJ-GrpE、GroEL-GroES和TF)有关,这3种蛋白相互协作促进目的蛋白的正确折叠、组装、转运,而其它分子伴侣质粒可能只表达一种或两种分子伴侣蛋白,这可能就是pKJE8分子伴侣质粒能较好地提高目的蛋白可溶性表达效果的原因。然而,分子伴侣蛋白共表达系统对提高胞外酶活性有限,大肠杆菌异源表达CGTase普遍存在形成大量包涵体的问题[9, 10],有待筛选合适的表达宿主如通过穿梭质粒在嗜热芽孢杆菌CHB1中进行表达,或者通过蛋白质工程方法改变酶的空间结构减少包涵体形成等方法进一步提高胞外酶活性。
综上所述,本研究对嗜热芽孢杆菌CHB1的CGTase进行了原核表达,发现CGTase在25 ℃低温诱导时可溶性表达量最高;当发酵温度为25 ℃和L-阿拉伯糖浓度为0.5 g/L时,与分子伴侣质粒pKJE8共表达能够显著提高CGTase的可溶性表达量和胞外酶活。本研究为获得大量可溶性CGTase、开展CGTase的工业化生产应用研究奠定了良好基础。
| [1] | Szente L, Szejtli J. Cyclodextrins as food ingredients[J]. Trends in Food Science & Technology, 2004, 15(3/4): 137-142 |
| [2] | Davis ME, Brewster ME. Cyclodextrin-based pharmaceutics: past, present and future[J]. Nature Reviews Drug Discovery, 2004, 3(12): 1023-1035 |
| [3] | Uitdehaag JCM, van der Veen BA, Dijkhuizen L, et al. Catalytic mechanism and product specificity of cyclodextrin glycosyltransferase, a prototypical transglycosylase from the α-amylase family[J]. Enzyme and Microbial Technology, 2002, 30(3): 295-304 |
| [4] | Mergulhao FJM, Monteiro GA, Cabral JMS, et al. Design of bacterial vector systems for the production of recombinant proteins in Escherichia coli[J]. Journal of Microbiology and Biotechnology, 2004, 14(1): 1-14 |
| [5] | Kane JF, Hartley DL. Formation of recombinant protein inclusion bodies in Escherichia coli[J]. Trends in Biotechnology, 1988, 6(5): 95-101 |
| [6] | Mitraki A, Fane B, Haase-Pettingell C, et al. Global suppression of protein folding defects and inclusion body formation[J]. Science, 1991, 253(5015): 54-58 |
| [7] | Nishihara K, Kanemori M, Kitagawa M, et al. Chaperone coexpression plasmids: differential and synergistic roles of DnaK-DnaJ-GrpE and GroEL-GroES in assisting folding of an allergen of Japanese cedar pollen, Cryj2, in Escherichia coli[J]. Applied and Environmental Microbiology, 1998, 64(5): 1694-1699 |
| [8] | Han RZ, Li JH, Shin H, et al. Recent advances in discovery, heterologous expression, and molecular engineering of cyclodextrin glycosyltransferase for versatile applications[J]. Biotechnology Advances, 2014, 32(2): 415-428 |
| [9] | Jin HH, Han NS, Kweon DH, et al. Effects of environmental factors on in vivo folding of Bacillus macerans cyclodextrin glycosyltransferase in recombinant Escherichia coli[J]. Journal of Microbiology and Biotechnology, 2001, 11(1): 92-96 |
| [10] | Wu J, Li ZF, Li B, et al. A new strategy for efficient secretory expression of extracellular proteins into culture medium of E. coli[J]. Journal of Biotechnology, 2008, 136(S): S719-S720 |
| [11] | Zhang HJ, Yang J, Liu XG, et al. Expression and enzyme activity assay of pfu with molecular chaperone[J]. Acta Botanica Yunnanica, 2009, 31(6): 499-503 (in Chinese) 张海军, 杨君, 刘晓光, 等. 应用分子伴侣共表达系统表达pfu基因及酶活性测定[J]. 云南植物研究, 2009, 31(6): 499-503 |
| [12] | Wan J, Deng HQ, Zhang BQ, et al. Prokaryotic expression of a glycosyltransferase Med-ORF8 involved in an antitumor antibiotic medermycin biosynthesis aided by the molecular chaperone[J]. Microbiology China, 2011, 38(2): 221-227 (in Chinese) 万娟, 邓会群, 张碧乾, 等. 分子伴侣协助下抗肿瘤抗生素美达霉素生物合成中的糖基转移酶Med-ORF8的原核表达[J]. 微生物学通报, 2011, 38(2): 221-227 |
| [13] | Lejeune A, Sakaguchi K, Imanaka T. A spectrophotometric assay for the cyclization activity of cyclomaltohexaose (α-cyclodextrin) glucanotransferase[J]. Analytical Biochemistry, 1989, 181(1): 6-11 |
| [14] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254 |
| [15] | Seddi R, Chaix JC, Puigserver A, et al. Expression of a soluble and activatable form of bovine procarboxypeptidase A in Escherichia coli[J]. Protein Expression and Purification, 2003, 27(2): 220-228 |
| [16] | Huang HR, Dong X, Zhang ZD, et al. Co-expression of protein of M. tuberculosis with molecular chaperone[J]. Chinese Journal of Antituberculosis, 2009, 31(2): 76-79 (in Chinese) 黄海荣, 董旭, 张宗德, 等. 应用分子伴侣共表达系统表达结核分枝杆菌编码蛋白[J]. 中国防痨杂志, 2009, 31(2): 76-79 |
| [17] | Ellis RJ. The molecular chaperone concept[J]. Seminars in Cell Biology, 1990, 1(1): 1-9 |
| [18] | Hartl FU, Hayer-Hartl M. Molecular chaperones in the cytosol: from nascent chain to folded protein[J]. Science, 2002, 295(5561): 1852-1858 |
| [19] | Huang P, Fan SL, Ling M, et al. Recombination and expression of hepatocellular carcinoma associated antigen SMP30 and exploration of co-expressed system with molecular chaperones[J]. Biotechnology Bulletin, 2012(4): 170-175 (in Chinese) 黄朋, 范升龙, 凌敏, 等. 肝癌相关抗原SMP30重组基因的构建、表达及分子伴侣共表达系统的探索[J]. 生物技术通报, 2012(4): 170-175 |
| [20] | Choi MS, Saxena A, Chilukuri N. A strategy for the production of soluble human senescence marker protein-30 in Escherichia coli[J]. Biochemical and Biophysical Research Communications, 2010, 393(3): 509-513 |
 2016, Vol. 43
2016, Vol. 43