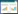扩展功能
文章信息
- 冯玮, 张蕾, 宣慧娟, 万平, 李艳红, 杨志伟
- FENG Wei, ZHANG Lei, XUAN Hui-Juan, WAN Ping, LI Yan-Hong, YANG Zhi-Wei
- 西藏土壤中耐辐射阿氏芽胞杆菌T61的分离和鉴定
- Isolation and identification of radiation resistant Bacillus aryabhattai T61 from Tibetan soil
- 微生物学通报, 2016, 43(3): 488-494
- Microbiology China, 2016, 43(3): 488-494
- 10.13344/j.microbiol.china.150334
-
文章历史
- 收稿日期: 2015-04-20
- 接受日期: 2015-05-18
- 优先数字出版日期(www.cnki.net): 2015-06-02
耐辐射微生物是一类十分重要的极端环境微生物资源,对于电离辐射、UV射线、化学诱变剂、强氧化剂和干燥剂具有很强的抗性,目前在细菌、古菌和真核生物中都有报道[1, 2, 3, 4, 5]。大多数耐辐射细菌是革兰氏阳性菌,包括Deinococcus、Rubrobacter、Kocuria、Lactobacillus、Enterococcus、Kineococcu和Serratia等属的菌株[3, 4, 6]。只有少数耐辐射细菌是革兰氏阴性菌,例如Methylobacterium[7]和Chroococcidiopsis[8]等属的菌株。在所有耐辐射微生物中,耐辐射奇异球菌(D. radiodurans)是迄今发现的辐射抗性最强的菌株[1, 3],与它同属的细菌也大多具有较强的辐射抗性。在芽胞杆菌辐射抗性研究方面,目前大多数研究集中在芽胞抗性方面,对生长期细胞辐射抗性的研究不是十分深入。目前已报道从含盐土壤或热泉中分离得到γ-射线耐受菌株Bacillus sp. HKG112[9]和巨大芽胞杆菌WHO[10, 11]。Shivaji等报道阿氏芽胞杆菌B8W22生长期细胞具有较强的UV抗性[12]。陈晓明等观察了枯草芽孢杆菌黑色变种营养体细胞对中子、脉冲X光和紫外线的耐受性[13]。研究耐辐射芽胞杆菌的辐射抗性,不仅可以促进人们对生物体辐射抗性机理的了解,还有助于揭示辐射相关的抗氧化保护机制。
西藏自治区位于青藏高原的西南部,平均海拔在4 000 m以上,高寒、缺氧、降水少、日照长、辐射强。其独特的自然地理环境,使之蕴含着丰富的生物资源宝藏。在2010-2011年间,本课题组先后两次赴西藏采集了大量土壤样品,并已报道一株耐辐射革兰氏阴性菌株Belnapia sp. F-4的分离和鉴定[14]。本研究对另一个耐辐射菌株Bacillus aryabhattai T61进行了分离鉴定和UV辐射抗性分析。
1 材料与方法 1.1 菌株和培养条件菌株T61分离于西藏冈巴拉山土样,由本实验室分离保存。对照菌株耐辐射奇异球菌(Deinococcus radiodurans,CGMCC1.633)和枯草芽胞杆菌(Bacillus subtilis,CGMCC1.1391)购自中国科学院微生物研究所菌种保藏中心。大肠杆菌(Escherichia coli K12)由中国农业科学院张维研究员馈赠。巨大芽胞杆菌(Bacillus megaterium,ACCC10245)由中国农业微生物菌种保藏管理中心张晓霞副研究员馈赠。Bacillus aryabhattai DSM21047购自德国微生物菌种保藏中心DSMZ。T61、Bacillus aryabhattai DSM21047、Bacillus megaterium和Deinococcus radiodurans用TGY培养基(g/L,胰蛋白胨5、酵母提取物3、葡萄糖1,pH 7.0) 30 ℃培养。Escherichia coli用LB (Luria- Bertani)培养基(g/L,蛋白胨10、酵母粉5、NaCl 10,pH 7.0) 37 ℃培养。Bacillus subtilis用BPY (Beef-Protein-Yeast)培养基(g/L,牛肉膏5、蛋白胨10、酵母粉5、葡萄糖5、NaCl 5,pH 7.0) 37 ℃培养。
1.2 菌株的分离和纯化取1 g土样加入5 mL 0.1 mol/L磷酸钾缓冲液(pH 7.0)中,充分振荡30 min,混匀静置20 min后,取100 μL上清液涂布于TGY固体培养基,30 ℃培养。挑取单菌落在TGY培养基上划线纯化,获得纯培养菌株。
将菌株培养至对数早期(OD600=0.3-0.4),分别吸取20 mL菌液,5 000 r/min离心5 min,收集菌体沉淀。用0.1 mol/L磷酸钾缓冲液洗涤两次并等体积悬浮。之后分别吸取1.5 mL悬液加入直径30 mm的无菌培养皿中,放入灭菌磁针,开盖置于电动旋转平台上(转速20-30 r/min),进行紫外线辐照,辐照剂量为400 J/m2。UV处理后,将菌液用0.1 mol/L磷酸钾缓冲液适当稀释,取100 μL稀释液涂布TGY固体培养基。每个处理重复3次。以对数早期D. radiodurans和E. coli K12为对照,计算辐射存活率,选取辐射生存率较高的菌株进行下一步实验。
1.3 形态学观察和生理生化鉴定采用Leica-DMRE显微镜(德国莱卡公司)和Hitachi SU8010冷场发射扫描电子显微镜(日本日立公司)观察菌株形态特征。革兰氏染色采用标准的革兰氏染色方法[15]。采用API 20E、API ZYM和API 50CHB/E试剂条(BioMérieux inc.)测定菌株的生理生化特点,按照厂家说明书进行操作。生长温度测定:采用TGY固体培养基在4、20、30、37和50 ℃培养5 d,观察生长情况。生长pH测定:采用TGY液体培养基在pH 5.0-10.0范围内(间隔1.0) 30 ℃、200 r/min培养24 h,观察生长情况。抗生素抗性分析:采用药敏纸片(杭州微生物试剂有限公司),终浓度为(mg/L):氨苄青霉素(Amp) 10、氯霉素(Cm) 30、卡那霉素(Km) 30、四环素(Tc) 30、链霉素(Sm) 10、红霉素(Erm) 15、壮观霉素(Spc) 100、利福平(Rif) 5。具体方法是:挑取T61单菌落于5 mL TGY液体培养基中,30 ℃、200 r/min培养2-8 h。用灭菌棉拭子蘸取菌液,涂布整个TGY培养基表面。待平板上的水分被琼脂完全吸收后贴药敏纸片。经30 ℃温箱培养18-24 h后,观察菌落生长情况。
1.4 总DNA提取和16S rRNA基因序列分析菌株基因组DNA提取采用CTAB法[16]。以菌株基因组DNA为模板,以细菌16S rRNA基因通用引物27F (5′-AGAGTTTGATCCTGGCTCA-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。反应体系(50 μL):ddH2O 37.75 μL,27F和1492R (10 μmol/L)各1 μL,10×缓冲液(40 mmol/L Tris-HCl,50 mmol/L KCl,1.5 mmol/L MgCl2,pH 8.3) 5 μL,dNTPs 2 mmol/L 4 μL,模板1 g/L 1 μL,Taq酶5 U/μL 0.25 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,52 ℃ 90 s,72 ℃ 90 s,30个循环;72 ℃ 10 min。LYPCR产物克隆到pEASY-T3 (TransGen Biotech)载体上,转化Trans1-T1感受态细胞(TransGen Biotech)中,筛选正确的阳性克隆在生工生物工程(上海)有限公司进行测序。测序结果在EzTaxon网站与细菌模式菌株的16S rRNA基因序列进行比对。用MEGA 5.0对16S rRNA基因相似度高的菌株进行系统发育分析。
1.5 G+C含量测定与脂肪酸含量测定由中国科学院微生物研究所对菌株进行脂肪酸成分分析,所用仪器是美国MIDI (Microbial Identification)公司Sherlock全自动细菌鉴定系统。深圳华大基因科技有限公司利用Illumina Hiseq 2000对菌株T61进行了全基因组测序,并根据基因组DNA的G、C碱基数目的比例,确定G+C含量[9]。
1.6 DNA-DNA杂交DNA-DNA杂交由中国工业微生物菌种保藏管理中心进行鉴定。所用仪器为Beckman Coulter DU800 UV/VIS Spectrophotometer (德国贝克曼公司)。将实验菌株T61分别与巨大芽胞杆菌(Bacillus megaterium DSM32)和阿氏芽胞杆菌(Bacillus aryabhattai DSM21047)进行DNA杂交。
1.7 UV辐射抗性实验为避免芽胞对UV辐射抗性测定的影响,将芽胞杆菌T61新鲜液体培养过夜物按1:3 000的比例接入TGY液体培养基,30 ℃、200 r/min培养至对数早期(OD600约为0.3-0.4),另外两种对照菌B. megaterium和B. subtilis也按以上方法处理,在Leica-DMRE显微镜下镜检,没有观察到芽胞。之后按照1.2的方法,5 000 r/min离心5 min收集菌体,用0.1 mol/L的磷酸钾缓冲液(pH 7.0)洗涤并悬浮。取l.5 mL细胞悬液加入直径30 mm无菌培养皿中,置于电动旋转平台上进行UV辐照,辐射波长254 nm,辐照剂量为0、200和400 J/m2。UV处理后,用0.1 mol/L磷酸钾缓冲液适当稀释菌液,取100 μL稀释液涂布于TGY固体培养基上,每个处理重复3次。以对数早期D. radiodurans、E. coli K12、B. megaterium和B. subtilis为对照,计算辐射存活率并绘制生存曲线。
2 结果与分析 2.1 菌株T61的分离和生理生化特征从400 J/m2 UV辐射后的西藏土壤样品中得到一株具有较强辐射抗性的菌株T61。在TGY固体培养基30 ℃培养14 h后,菌落为圆形,微黄色,表面平坦湿润,菌落内部呈黏液状,直径大约2-5 mm。菌株T61革兰氏反应阳性,能运动,可以产生内生孢子。在扫描电子显微镜下,T61菌株的细胞形态为杆状,长度约为2 μm,直径约为1 μm (图 1)。生理生化实验显示,T61与阿氏芽胞杆菌模式株DSM21047一致,氧化酶、磷酸酶、酯酶、半乳糖苷酶等阳性,胰蛋白酶、芳胺酶等阴性;可以利用甘油、L-阿拉伯糖、核糖、D-木糖、半乳糖、葡萄糖、果糖、麦芽糖、海藻糖等产酸;可以利用丙酮酸、葡萄糖、甘露醇、蔗糖、蜜二糖等碳源,但不能利用山梨醇、鼠李糖等。T61菌株在10-37 ℃、pH 6.0-10.0条件下可以生长,最适温度30 ℃,最适pH 7.0。抗生素试验显示,T61对氨苄青霉素、氯霉素、卡那霉素、四环素、链霉素、红霉素、壮观霉素、利福平敏感,不具抗性,有利于细菌的遗传操作。
 |
| 图 1 菌株T61的扫描电子显微镜图片(液体TGY饱和培养物) Figure 1 The scanning electron microscopic photographs T61 cells grown to saturation in TGY medium |
| |
将T61的16S rRNA基因序列与EzTaxon细菌模式菌株的16S rRNA基因序列进行比较,结果表明,T61与阿氏芽胞杆菌B8W22T (Bacillus aryabhattai B8W22T=DSM21047)相似度最高,达到99.93%,与巨大芽胞杆菌IAM13418T (Bacillus megaterium IAM13418T=DSM32)相似度为99.53%。基于16S rRNA基因序列构建了T61与亲缘关系相近种的系统发育树(图 2)。系统发育树表明菌株T61与阿氏芽胞杆菌和巨大芽胞杆菌的进化距离非常近,是Bacillus属的一个菌株,暂定名为Bacillus sp. T61。
 |
|
图 2 根据16S rRNA基因序列构建的T61与亲缘关系相近菌种的系统发育树
Figure 2 Phylogenetic dendrogram obtained by distance-matrix analysis of 16S rRNA gene sequences indicating the position of strain T61 among its phylogenetic neighbors
注: 括号里的数字为GenBank登录号;节点上的数字为Bootstrap值(1 000次重复抽样的百分比);比例尺代表每100个核苷酸中有0.5个核苷酸发生替代. Note: Numbers in parentheses are GenBank accession numbers; Bootstrap values (expressed as percentages of 1 000 replications) are given at nodes; The scale bar represents 0.5 substitutions per 100 nucleotide positions. |
| |
脂肪酸组成测定表明T61含有C14:0 iso、C14:0、C15:0 iso、C15:0 anteiso、C16:0 iso、C16:1 w11c、C16:0和C17:0-anteiso (表 1)。与阿氏芽胞杆菌和巨大芽胞杆菌模式株相比,菌株T61的脂肪酸组成更接近于阿氏芽胞杆菌B8W22T。
| 脂肪酸 Fatty acid | 阿氏芽胞杆菌T61 Bacillus aryabhattai T61 | 阿氏芽胞杆菌 Bacillus aryabhattai B8W22 T (DSM21047) | 巨大芽胞杆菌 Bacillus megaterium IAM13418 T (DSM32) |
| C14:0 iso | 10.81 | 8.13 | 6.80 |
| C14:0 | 2.05 | 2.25 | 1.62 |
| C15:0 iso | 32.13 | 28.87 | 24.98 |
| C15:0 anteiso | 44.77 | 45.68 | 49.95 |
| C16:0 iso | 1.69 | 2.27 | 2.46 |
| C16:1 w11c | 1.24 | 1.90 | 1.91 |
| C16:0 | 3.10 | 5.43 | 4.72 |
| C17:0 iso | - | 1.35 | 1.85 |
| C17:0 anteiso | 1.76 | 3.25 | 4.87 |
T61基因组DNA的G+C含量为38.02%,与阿氏芽胞杆菌模式菌株B8W22T一致[12]。DNA-DNA杂交结果显示,在全基因组水平上,T61与阿氏芽胞杆菌B8W22T的相似度为81.4%,而与巨大芽胞杆菌IAM13418T的相似度只有50.3%。根据以上结果,确定T61为阿氏芽胞杆菌的一个菌株,命名为Bacillus aryabhattai T61。
2.4 阿氏芽胞杆菌T61在不同UV辐射剂量下的存活曲线将菌株T61和对照株分别培养到对数生长早期(OD600约为0.3-0.4),取细胞悬液接受不同剂量的UV 辐射,绘制生存曲线,结果见图 3。可以看出,B. aryabhattai T61菌株的辐射抗性显著高于辐射敏感的E. coli K12 、B. megaterium和B. subtilis,而与耐辐射菌株D. radiodurans相接近。在辐照剂量达100 J/m2时,E. coli K12 的存活率已降至0.001%以下,而B. aryabhattai T61的存活率仅下降1个数量级(D10=100 J/m2)。随着辐射剂量的增加,T61依然保持较高的存活率,而对照菌株B. megaterium和B. subtilis在辐照剂量超过200 J/m2时,存活率都下降至0.01%以下。
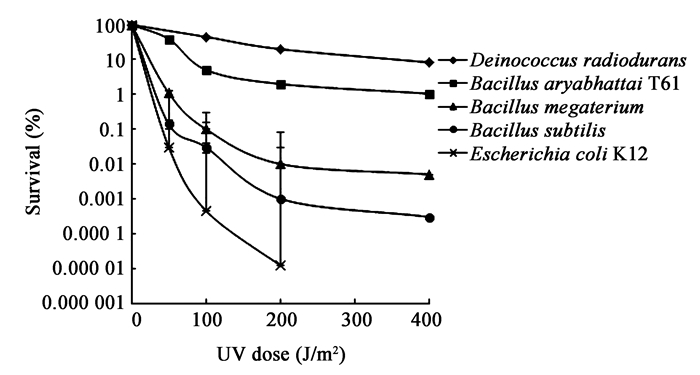 |
| 图 3 菌株T61 UV辐射生存曲线 Figure 3 Survival curves of T61 after exposure to UV radiation |
| |
本研究从来自西藏冈巴拉山的土样中分离了一株耐辐射芽胞杆菌T61。系统进化树分析表明,T61与阿氏芽胞杆菌B8W22T和巨大芽胞杆菌IAM13418T的相似度最高,16S rRNA基因的相似度分别达到99.93%和99.53%。但DNA-DNA杂交分析表明,在全基因组范围内,T61与阿氏芽胞杆菌B8W22T的相似度为81.4%,而与巨大芽胞杆菌IAM13418T的相似度只有50.3%。结合形态和生理生化分析,确定T61为阿氏芽胞杆菌的一个菌株,命名为Bacillus aryabhattai T61。T61对UVC辐射具有较强抗性,对数期细胞D10为100 J/m2。
目前在芽胞杆菌辐射抗性研究方面,大多数研究集中在芽胞的辐射抗性方面,常用的实验系统有枯草芽胞杆菌和短小芽胞杆菌等[17, 18, 19]。近年来,一些研究报道芽胞杆菌生长期细胞具有较强的辐射抗性。Gupta等从含盐土壤中分离得到Bacillus sp. HKG112,在γ-射线辐射下,该菌株的对数期细胞(OD660=0.3) D10达到12.5 kGy[9]。Yazdani等报道Bacillus megaterium WHO的对数期细胞也表现出较强的γ-射线辐射抗性,D10约为10 kGy[10, 11]。Shivaji等对阿氏芽胞杆菌B8W22对数生长后期细胞(OD660=1.0)进行UV抗性测定,在UV剂量为0.1 J/cm2时的存活率为20%[12]。陈晓明等将枯草芽孢杆菌黑
色变种37 ℃、200 r/min培养12 h获得营养体细胞,并测定了细胞对中子、X光和紫外线的辐射抗性,其中对UVC的D10达到16.68 J/cm2[13]。本研究以辐射敏感和抗性菌株为对照,表明阿氏芽胞杆菌T61对数期细胞(OD660约为0.3-0.4)对UVC具有较强的辐射抗性,并且前期工作证实该菌株对γ射线也具有较强的抗性,D10值为4 kGy[20]。需指出的是,由于各研究组所用辐射设备和辐射条件不同,受试菌株的生长期不一致,因此难以对各菌株的辐射抗性强弱进行比较。
目前对芽胞杆菌的辐射抗性及其调控机理还所知甚少。在未来的工作中,将以阿氏芽胞杆菌T61为实验系统,进一步克隆和分析辐射抗性相关基因,研究辐射抗性的转录调控机制,以期拓宽对细菌辐射抗性机理的认识。同时,利用耐辐射芽胞杆菌抗逆性很强的特点构建的工程菌,将在污染环境的生物修复、饲料、肥料加工业等方面具有广阔的应用前景。
致谢:感谢北京理工大学生命学院张建丽教授对T61菌株分离鉴定的指导和帮助。| [1] | Cox MM, Battista JR. Deinococcus radiodurans-the consummate survivor[J]. Nature Reviews Microbiology, 2005, 3(11): 882-892 |
| [2] | Confalonieri F, Sommer S. Bacterial and archaeal resistance to ionizing radiation[J]. Journal of Physics: Conference Series, 2011, 261(1): 012005 |
| [3] | Slade D, Radman M. Oxidative stress resistance in Deinococcus radiodurans[J]. Microbiology and Molecular Biology Reviews, 2011, 75(1): 133-191 |
| [4] | Sun JH, Shen PH, Wu B. A new ionizing-radiation resistant strain WGR702 isolated, identified, and radioresistant character[J]. Microbiology China, 2008, 35(8): 1214-1218 (in Chinese) 孙继华, 申佩弘, 武波. 一株新的耐辐射菌WGR702的分离鉴定及耐辐射特性[J]. 微生物学通报, 2008, 35(8): 1214-1218 |
| [5] | Wang W, Zhu J, Zhang ZD, et al. Research progress and application prospect of radiation-resistant prokaryotic microbe[J]. Journal of Nuclear Agricultural Sciences, 2013, 27(2): 177-182 (in Chinese) 王玮, 朱静, 张志东, 等. 原核耐辐射微生物资源研究及其应用前景[J]. 核农学报, 2013, 27(2): 177-182 |
| [6] | Yuan ML, Zhang WP, Dai SM, et al. Deinococcus gobiensis sp. nov., an extremely radiation-resistant bacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(Pt 6): 1513-1517 |
| [7] | Nogueira F, Luisa Botelho M, Tenreiro R. Radioresistance studies in Methylobacterium spp.[J]. Radiation Physics and Chemistry, 1998, 52(1/6): 15-19 |
| [8] | Baqué M, Viaggiu E, Scalzi G, et al. Endurance of the endolithic desert cyanobacterium Chroococcidiopsis under UVC radiation[J]. Extremophiles, 2013, 17(1): 161-169 |
| [9] | Gupta AK, Pathak R, Singh B, et al. Proteomic analysis of global changes in protein expression during exposure of gamma radiation in Bacillus sp. HKG 112 isolated from saline soil[J]. Journal of Microbiology and Biotechnology, 2011, 21(6): 574-581 |
| [10] | Yazdani M, Naderi-Manesh H, Khajeh K, et al. Isolation and characterization of a novel γ-radiation-resistant bacterium from hot spring in Iran[J]. Journal of Basic Microbiology, 2009, 49(1): 119-127 |
| [11] | Yazdani M, Naderi-Manesh H. Comparative proteomics analysis of a novel g-radiation-resistant bacterium wild-type Bacillus megaterium strain WHO DQ973298 recovering from 5 kGy g-irradiation[J]. Iranian Journal of Biotechnology, 2012, 10(2): 96-105 |
| [12] | Shivaji S, Chaturvedi P, Begum Z, et al. Janibacter hoylei sp. nov., Bacillus isronensis sp. nov. and Bacillus aryabhattai sp. nov., isolated from cryotubes used for collecting air from the upper atmosphere[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(12): 2977-2986 |
| [13] | Chen XM, Cao YC, Xiao ZX. Radio resistance ability of a Bacillus subtilis radioresistant strain[J]. Environmental Science & Technology, 2011, 34(9): 1-4 (in Chinese) 陈晓明, 曹以诚, 萧主先. 一株耐辐射枯草芽孢杆菌的辐照抗性研究[J]. 环境科学与技术, 2011, 34(9): 1-4 |
| [14] | Bai MY, Xuan HJ, Li L, et al. Identification of a radiation resistant Belnapia strain and proteomic analysis after exposure to gamma radiation[J]. Journal of Nuclear Agricultural Sciences, 2014, 28(2): 169-176 (in Chinese) 白明艳, 宣慧娟, 李利, 等. 耐辐射Belnapia菌株的分离和辐射后蛋白质组学分析[J]. 核农学报, 2014, 28(2): 169-176 |
| [15] | Dong XZ, Cai MY. Identification Manual of Common Bacteria System[M]. Beijing: Science Press, 2001 (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001 |
| [16] | Wilson K. Preparation of genomic DNA from bacteria[J]. Current Protocols in Molecular Biology, 2001, 2: 2.4.1-2.4.5 |
| [17] | Moeller R, Stackebrandt E, Reitz G, et al. Role of DNA repair by nonhomologous-end joining in Bacillus subtilis spore resistance to extreme dryness, mono- and polychromatic UV, and ionizing radiation[J]. Journal of Bacteriology, 2007, 189(8): 3306-3311 |
| [18] | Granger AC, Gaidamakova EK, Matrosova VY, et al. Effects of Mn and Fe levels on Bacillus subtilis spore resistance and effects of Mn2+, other divalent cations, orthophosphate, and dipicolinic acid on protein resistance to ionizing radiation[J]. Applied and Environmental Microbiology, 2011, 77(1): 32-40 |
| [19] | Vaishampayan PA, Rabbow E, Horneck G, et al. Survival of Bacillus pumilus spores for a prolonged period of time in real space conditions[J]. Astrobiology, 2012, 12(5): 487-497 |
| [20] | Xuan HJ, Li L, Bai MY, et al. Radiation resistance of Bacillus sp. T61 and analysis of cellular protein changes after gamma-ray irradiation[J]. Journal of Radiation Research and Radiation Processing, 2014, 32(3): 030204 (in Chinese) 宣慧娟, 李利, 白明艳, 等. 芽胞杆菌T61的辐射抗性和伽玛射线辐照后蛋白质组的变化分析[J]. 辐射研究与辐射工艺学报, 2014, 32(3): 030204 |
 2016, Vol. 43
2016, Vol. 43