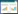扩展功能
文章信息
- 李迅, 邓若冰, 段成元, 王亮亮, 王飞
- LI Xun, DENG Ruo-Bing, DUAN Cheng-Yuan, WANG Liang-Liang, WANG Fei
- 复合脂肪酶协同催化制备生物柴油的研究
- High efficient biodiesel production by synergistic catalysis with combined lipases
- 微生物学通报, 2016, 43(3): 471-478
- Microbiology China, 2016, 43(3): 471-478
- 10.13344/j.microbiol.china.150422
-
文章历史
- 收稿日期: 2015-05-27
- 接受日期: 2015-10-20
- 优先数字出版日期(www.cnki.net): 2015-11-10
2. 江苏省生物质绿色燃料与化学品重点实验室 江苏 南京 210037
2. Jiangsu Key Laboratory of Biomass-Based Green Fuels and Chemicals, Nanjing, Jiangsu 210037, China
生物柴油无毒且可生物降解,这种液体燃料可以减少二氧化碳、颗粒物和硫的排放,是环境友好的可再生能源[1, 2, 3]。碱法催化油脂转酯化制备生物柴油应用最广泛、转化率高,但其缺点也显而易见,比如能耗高、对环境污染严重、对原料要求高及易皂化等[4, 5]。酶法催化反应因具有条件温和、对原料要求低和产物易分离等特点,使其成为最具发展前景的制备生物柴油方法之一[6]。目前多种来源的脂肪酶已经被有效应用于生物柴油的转酯化反应,如荧光假单胞菌脂肪酶(Pseudomonas fluorescens lipase,PFL)、南极假丝酵母脂肪酶(Candida antarctica lipase B,CALB)、疏棉状嗜热丝袍菌脂肪酶(Thermomyces lanuginose lipase,TLL)、嗜热链状杆菌脂肪酶(Bacillus thermocatenulatus lipase,BTL)和米根霉脂肪酶(Rhizopus oryzae lipase,ROL)[7, 8, 9, 10, 11]。其中具有广谱底物接受性的CALB和具有较高水含量耐受性的ROL在制备生物柴油中的应用较为广泛,但这两种酶各自的催化特性限制了其在生物柴油生产中的应用。
为了降低生物柴油生产成本,近年来开发出用复合脂肪酶生产生物柴油的新工艺[12, 13, 14, 15],有的选择共溶剂系统,有的选择超临界流体系统,虽然复合脂肪酶能有效地克服单一脂肪酶的底物专一性,提高复合脂肪酶的甲醇耐受力,缩短反应时间,降低酶的使用成本,但都使用有机溶剂或特殊溶剂,这些因素决定这些体系都无法最终解决生物柴油酶法制备成本过高的瓶颈问题。广谱底物接受性的CALB在含水量较高的体系中酶活较低,在有机相体系中酶活较高[16];而ROL具有较高的水含量耐受性,但由于Sn-2酰基转移过程慢而使反应时间过长[17]。有关CALB和ROL协同作用的研究尚未见报道,构建重组CALB和ROL的协同催化体系,研究在含水量较高的体系中复合酶催化油脂制备生物柴油的影响因素,为解决生物柴油酶法制备成本过高、酶对甲醇的耐受力差及反应时间较长等瓶颈问题提供理论依据。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒:南极假丝酵母(C. antarctica,NRRL No. Y-7954)来源于美国农业研究菌种保藏中心。大肠杆菌(Escherichia coli) DH5α、毕赤酵母(Pichia pastoris) KM71H和质粒pPICZαA购自Invitrogen (Carlsbad,California,USA)公司。pPICZαA-CALB及pPICZαA-ROL为实验室构建[18, 19]。引物由上海生工生物工程有限公司合成。 1.1.2 试剂:胰蛋白胨、酵母提取物购于Oxoid (Hampshire,England)公司;棕榈酸甲酯(Methyl palmitate)、硬脂酸甲酯(Methyl stearate)、油酸甲酯(Methyl oleate)、亚油酸甲酯(Methyl linoleate)、亚麻酸甲酯(Methyl linolenate)、三辛酸甘油酯、对硝基苯酚辛酸酯(pNPO,4-Nitrophenyl octanoate)、RNase A、Tris-HCl和氨苄青霉素(Amp)等购自Sigma公司;ExTaq聚合酶和限制性内切酶等购自TaKaRa公司;PCR纯化、低分子量标准蛋白质和Gel/PCR Extraction Kit、质粒小量提取试剂,购自Biomiga公司;引物由上海生工生物工程有限公司合成;测序由上海捷瑞生物工程有限公司完成。其余生化试剂和药品均为分析纯。 1.1.3 培养基:用于细菌常规培养的LB (Luria-Bertani)培养基(g/L):蛋白胨10,酵母粉5,氯化钠10,调pH至7.0。用于重组载体转化的YPD培养基(g/L):酵母提取物10,蛋白胨20,D-葡萄糖20。用于重组菌筛选的YPDS培养基(g/L):在YPD培养基的基础上添加Sorbital 182.2和100 g/LZeocin 1 mL。脂肪酶的诱导表达使用BMGY培养基(g/L):酵母提取物10,蛋白胨20,YNB 134 (含硫酸铵不含氨基酸的酵母氮基),生物素0.2和甘油100,加0.1 mol/L pH 6.0的磷酸钾缓冲液至1 L。培养基配方参照Invitrogen公司的毕赤酵母表达手册。三辛酸甘油酯聚乙烯醇乳化液:以三辛酸甘油酯:2%聚乙烯醇溶液体积比为1:3配制,在9 500 r/min高速匀浆7 min,若不均匀或分层,可稍微加热或增加搅拌次数和时间。 1.2 实验方法 1.2.1 脂肪酶工程菌的筛选:重组质粒pPICZαA- CALB及pPICZαA-ROL分别以限制性酶Sac I进行线性化,电击转入毕赤酵母KM71H感受态细胞中,立即加入预冷的1 mol/L山梨醇,于30 ℃ 水浴静置培养1-2 h,取出菌液涂布于含适宜浓度Zeocin的YPDS平板上,30 ℃培养3-5 d,分别获得分泌表达重组ROL和CALB的基因工程菌。具体步骤参考Invitrogen公司的毕赤酵母表达手册。三辛酸甘油酯平板筛选法:挑取产CALB和ROL的重组酵母单菌落,接种于含5%三辛酸甘油酯的YNB基础培养基的平板上,培养3-5 d,每隔24 h补充100 μL甲醇至平板盖上,观察并选取水解圈较大的表达ROL和CALB的基因工程菌,将菌体于含有15%甘油的YPD管中-80 ℃保存。 1.2.2 酶活测定方法:以对硝基苯酚辛酸酯(pNPO)为底物测定脂肪酶酶活[20]。13.5 mmol/L pNPO 50 μL和0.05 mol/L pH 7.5 Tris-HCl 850 μL缓冲液混合均匀,在40 ℃预热,加入100 μL适宜浓度的酶液反应5 min,在410 nm处测吸光值。空白样则用缓冲代替酶液。一个酶活单位(U)定义为在pH 7.5、40 ℃条件下,每分钟释放1 μmol对硝基苯酚(pNP)所需要的酶量。蛋白浓度的测定方法采用Bradford法[21]。 1.2.3 重组酶CALB和ROL的制备:将脂肪酶基因工程菌挑取单菌落接种于BMGY培养基中30 ℃、200 r/min培养,再转接BMGY培养基中获得种子液。将种子液接种于生物反应器(BioFlo/CelliGen 115,Eppendorf,USA)中,工作体积为7 L,培养温度为28 ℃,控制溶氧值DO为35%,自动流加25%氨水维持pH值为6.0,发酵24 h至基础培养基碳源耗尽,以40%的流速恒速补加甘油,至OD600达到200,停止补加甘油。2 h后进入甲醇诱导阶段,为了减少高密度发酵中的重组脂肪酶被蛋白酶降解,采用优化的诱导条件培养至72-84 h[22]。分别收集2种重组菌的发酵上清液,分别进行酶活测定及保存。 1.2.4 复合酶催化大豆油甲酯化方法:5 g大豆油中,加入20-100 U的复合酶(CALB与ROL的酶活配比为1:9-9:1),含水量为5%-110% (相对于大豆油重量),分批加入一定量的甲醇,醇油比为3:1-5:1,在50 ml具塞三角瓶中混合,在40 ℃、200 r/min条件下进行转酯化反应。反应结束后12 000 r/min离心5 min,取上层油状液体进行气相色谱分析。 1.2.5 复合酶催化大豆油甲酯化产物分析:将上层油状液体用正己烷稀释成一定浓度,加入等体积的1 g/L内标(十七烷酸甲酯,正己烷配制),混匀后进行色谱分析。采用Agilent-7890A气相色谱仪,分析条件为:HP-5毛细管柱,FID检测器,进样量2 μL,初始温度170 ℃ ,以3 ℃/min升温至200 ℃保温10 min,以20 ℃/min升温至260 ℃,进样口温度250 ℃,检测器温度260 ℃,以内标法计算甲酯得率[23]。以碱法催化大豆油甲酯化(1% NaOH为催化剂,醇油摩尔比为7:1,40 ℃反应70 min)获得的脂肪酸甲酯量为油脂完全甲酯化后脂肪酸甲酯的质量。每组实验重复3次,数据为3次的平均值,误差线显示标准差值。
| $\eqalign{ & 甲酯得率(\% ) = \cr & \frac{{复合酶催化获得甲酯化产物中脂肪酸甲酯的质量分数}}{{油脂完全甲酯化后脂肪酸甲酯的质量分数}} \cr & \times 100{\text{ }} \cr} $ |
对甲酯化反应后所得脂肪酸甲酯产品进行气相质谱GS-MS分析,以确定产物组成。采用Agilent GC-MS Trace DCQ气质联用仪,分析条件为:HP-5M (0.25 mm×30 m×0.25 μm)毛细管柱,离子源温度230 ℃,MS四极杆温度150 ℃,载气高纯He,载气流速1 mL/min,分流比50:1,进样量为1 μL。汽化室温度250 ℃。程序升温:初始柱温150 ℃保温0 min后,以5 ℃/min升至190 ℃,再以1 ℃/min升至205 ℃,然后以10 ℃/min升至260 ℃并保温5 min。
2 结果与分析 2.1 CALB和ROL的制备三辛酸甘油酯平板的筛选结果如图 1所示,阴性对照的原始菌在三辛酸甘油酯平板上无透明圈,重组菌在三辛酸甘油酯平板上的透明圈大小不一,显示重组菌分泌表达的CALB和ROL降解三辛酸甘油的能力不一,挑选透明圈直径与菌落直径之比较大的菌落供后续研究。30 ℃、200 r/min培养重组菌,经诱导,CALB重组酶酶活达42.9 U/mL,蛋白浓度为0.5 g/L,ROL重组酶脂肪酶酶活最高为137.2 U/mL,蛋白浓度为0.3 g/L。如图 2所示,CALB和ROL以胞外酶的形式分泌表达于发酵液中,胞外酶以重组蛋白为主,重组酶无需纯化即可使用。筛选到的CALB和ROL的重组酵母菌株分别进行高密度发酵,蛋白浓度和单位体积酶活都获得有效提高,发酵液中CALB重组酶酶活可达179.2 U/mL,蛋白浓度为1.4 g/L,发酵液中ROL重组酶酶活可达171.4 U/mL,蛋白浓度为1.0 g/L。分别保存重组CALB和ROL酶液,供后续大豆油甲酯化制备生物柴油的生物催化剂。
 |
|
图 1 三辛酸甘油酯筛选平板
Figure 1 Tricaprylin screening plate of recombinant P. pastoris with high lipase activity
注:黑线标注为阴性对照. A:pPICZαA-CALB+KM71H重组菌;B:pPICZαA-ROL+KM71H重组菌. Note: the strains with black line marked are negative control. A: pPICZαA-CALB+KM71H recombinant strain; B: pPICZαA-ROL+KM71H recombinant strain. |
| |
 |
|
图 2 重组菌发酵液上清SDS-PAGE分析
Figure 2 SDS-PAGE analysis of supernatants of recombinant P. pastoris
注:M:蛋白质标准分子量. A:pPICZαA-CALB+KM71H重组菌发酵液上清SDS-PAGE分析;1:pPICZαA-CALB+KM71H重组菌发酵液上清. B:pPICZαA-ROL+KM71H重组菌发酵液上清SDS-PAGE分析;1:pPICZαA-ROL+KM71H重组菌发酵液上清. Note: M: Protein marker. A: SDS-PAGE analysis of supernatants of pPICZαA-CALB+KM71H; 1: Supernatants of pPICZαA- CALB+KM71H. B: SDS-PAGE analysis of supernatants of pPICZαA-ROL+KM71H; 1: Supernatants of pPICZαA- ROL+KM71H. |
| |
利用重组CALB及ROL酶液构建复合酶催化体系,酶用量为16 U CLAB-ROL/g 油,醇油比为4:1,其他条件同1.2.4,尝试了不同的CALB与ROL的酶活配比,复合酶以CALB:ROL为7:3配比时转酯化效率最高,甲酯得率达到87.4%。当CALB:ROL为7:3、6:4、5:5的复合配比时甲酯得率均较高(85.8%-87.4%),而当CALB:ROL为3:7时,甲酯得率下降至78.1%,由此可以推断复合酶催化体系中需要较多的CALB和较少的ROL可达到较好的催化效果。
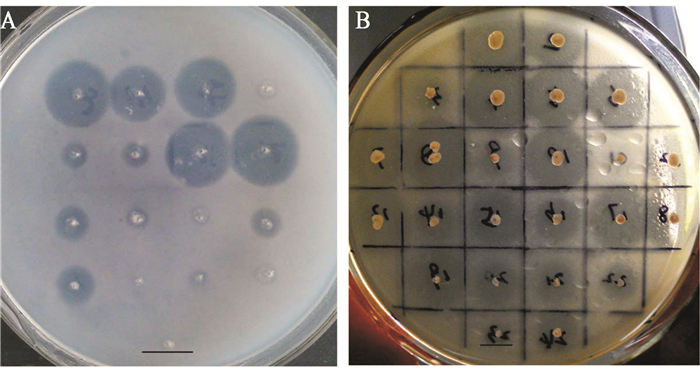
在确认CALB:ROL为7:3是最佳复合酶配比的基础上,选取CALB:ROL为10:0、7:3、5:5、3:7、0:10的具有代表性的复合酶配比,探讨复合酶用量对催化效果的影响。结果如图 3所示,当复合酶用量仅为ROL单一酶用量的50%时,即复合酶用量约为60 U (16 U/g油)时即可达到ROL用量为120 U (32 U/g油)的催化效果。复合酶的最佳酶活用量为80 U (18 U/g油),且复合酶配比CALB:ROL为7:3效果最好,甲酯得率为88.6%。该实验结果显示,复合酶的催化效率明显优于单一的脂肪酶,不仅有效减少了酶的使用量,且最终的甲酯得率获得提高。
 |
| 图 3 CALB和ROL的酶量对转酯化效果的影响 Figure 3 Effect of different amount of lipases on transesterification Note: ◆: C3R7; □: C5R5; ▲: C3R7; ※: ROL; ■: CALB. |
| |
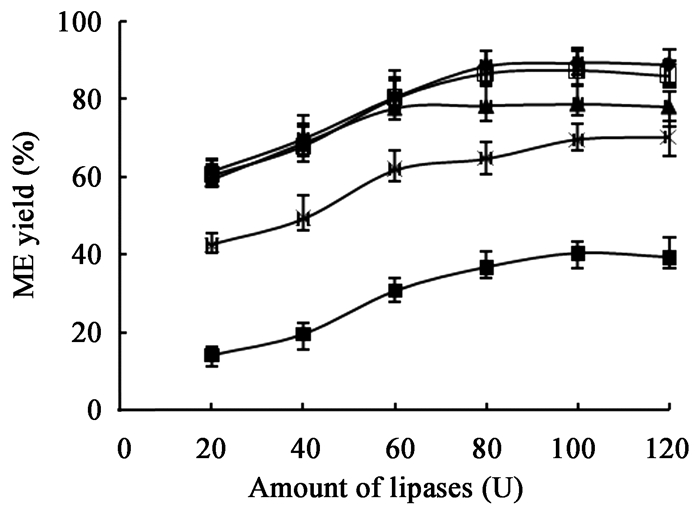
探讨含水量对催化效率的影响,酶用量为18 U CLAB-ROL/g油,复合酶配比CALB:ROL为7:3,其他反应条件同2.2,结果如图 4所示,当含水量为50%时催化效果最好,甲酯得率达91.8%。这个结果验证了ROL具有较高的水含量耐受性,且当含水量为6%-90%之间时复合酶催化甲酯化得率都为75%以上。
 |
| 图 4 含水量对转酯化效果的影响 Figure 4 Effect of water content on transesterification |
| |
已验证甲醇与大豆油的摩尔比为4:1时甲酯得率最高(数据未显示),因此固定醇油摩尔比为4:1。为了获得该复合酶体系最佳的甲醇流加方式,比较在0 h加入醇油摩尔比1:1-4:1的甲醇添加方式(表 1),其他反应条件同2.3,结果如图 5所示,发现反应时间与甲醇的流加方式直接相关。起始醇油比为2:1时,甲酯得率较原有方法有很大提高,且有效缩短了反应时间;而起始醇油比高于2:1时,甲酯得率较原有方法下降较多,分析为过多甲醇对脂肪酶产生了毒害作用。方法1和方法2的差别是在12 h时加入的甲醇量不同,结果显示12 h加入过多甲醇(方法1和方法3),使得甲酯得率有明显下降,分析原因为在12 h不能添加过多甲醇,否则会导致甲醇积累而对脂肪酶产生毒性。综合以上实验结果,显示复合酶对甲醇的耐受性有明显提高,特别是在起始阶段,所以可选择0 h时,使醇油比为2:1加入甲醇;12 h和24 h时,为了防止过多的甲醇累积,适当减少甲醇的加入量,使醇油比为1:1加入甲醇,甲酯得率快速上升,反应时间为36 h时,甲酯得率已达92.6% (图 5)。
| 方法 Method | 0 h醇油摩尔比 The molar ratio of methanol and oil on 0 h | 12 h醇油摩尔比 The molar ratio of methanol and oil on 12 h | 24 h醇油摩尔比 The molar ratio of methanol and oil on 24 h | 36 h醇油摩尔比 The molar ratio of methanol and oil on 36 h |
| 方法1 Method 1 | 2:1 | 2:1 | - | - |
| 方法2 Method 2 | 2:1 | 1:1 | 1:1 | - |
| 方法3 Method 3 | 1:1 | 2:1 | 1:1 | - |
| 方法4 Method 4 | 1:1 | 1:1 | 1:1 | 1:1 |
| 方法5 Method 5 | 3:1 | 1:1 | - | - |
| 方法6 Method 6 | 4:1 | - | - | - |
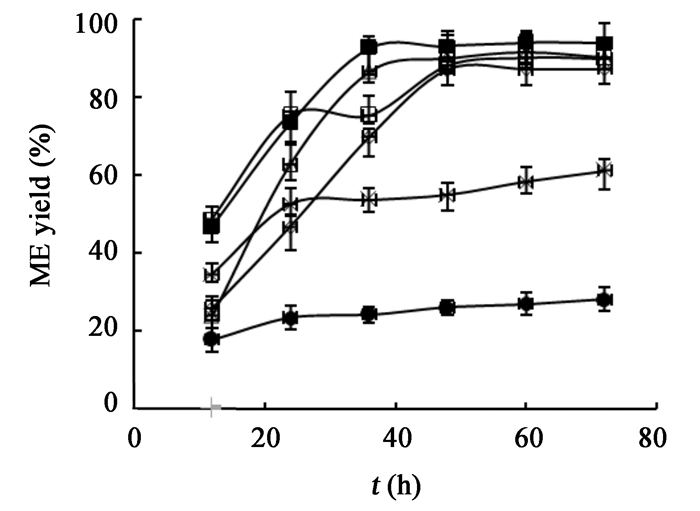 |
| 图 5 甲醇流加方式对转酯化效果的影响 Figure 5 Effect of methanol addition method on transesterification Note: □: Method 1; ■: Method 2; △: Method 3; ◇: Method 4; ※: Method 5; ●: Method 6. |
| |
由以上结果得出,该复合酶协同催化体系制备生物柴油的反应优化条件为:40 ℃、200 r/min,CALB:ROL最佳复合酶配比为7:3;加入的复合酶的总酶活为18 U/g大豆油;甲醇与大豆油摩尔比为4:1;并按0 h加入2:1,12 h加入1:1,24 h加入1:1的醇油摩尔比分批加入甲醇;含水量为50%。在最佳条件下进行甲酯化反应,绘制时间曲线,结果如图 6所示,反应了29 h,甲酯得率即达90.2%,之后甲酯得率维持在93%左右。与已报道的其他复合酶体系所取得的效果相比,本复合酶体系效果相当[24, 25]。
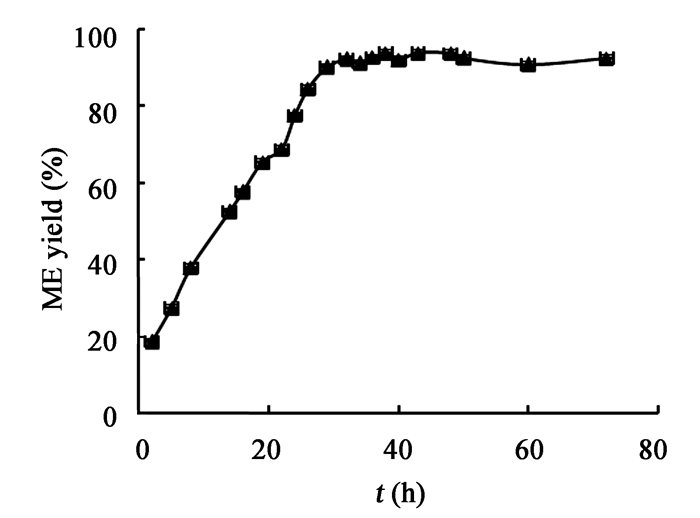 |
| 图 6 最佳条件下转酯化反应的时间曲线 Figure 6 Typical time-course profiles of the ME yield in transesterification reaction with optimal conditions |
| |
获得重组脂肪酶CALB及ROL,在高水含量体系中复合酶催化油脂制备生物柴油。ROL为1、3位特异性的脂肪酶,催化甲酯化反应到后期,2位酯键的酰基迁移过程会使得反应时间加长,且其最终转酯得率要低一些[26]。然而CALB无位置特异性,1、2、3位酯键均直接被CALB有效水解,提高了最终的甲酯得率,但在含水体系中CALB的酶活要低于ROL。酶量对转酯化效果影响的实验结果验证了以上分析,复合酶体系在催化过程中产生了协同效应,不仅有效减少了酶的使用量,且最终的甲酯得率获得提高。
选择合适的含水量对于构建复合酶制备生物柴油的体系十分重要。甲酯化反应为可逆反应,因而过量的水存在时可能导致平衡向逆反应方向移动,从而导致甲酯得率下降。水量过少,酶的活动空间受限,也会使脂肪酶因失水而失活[27]。重组米根霉脂肪酶在催化制备生物柴油时,最佳的含水量为80%[19],而南极假丝酵母脂肪酶B在非水相环境中有较好的稳定性[28],协同催化体系显示当含水量为50%时催化效果最好,与文献[19]对比,协同催化体系需水量与所含ROL酶量呈正比关系,实验结果验证了ROL具有较高的水含量耐受性,而CALB的需水量极小。
甲酯化反应中理论醇油摩尔比为3:1,甲酯化反应为可逆反应,甲醇需过量才可使反应正向进行,但甲醇量过大会对脂肪酶有抑制作用,影响其催化活性及效率。为了使加入的甲醇既与大豆油充分反应,又能减少对脂肪酶的毒性作用,前期实验还尝试了以少量多次的方式加入甲醇,实验结果并未达到预期的目的,甲酯得率较原有方法均有较多下降,且甲酯得率的提升速度也更为缓慢。同时发现在转酯化反应的最初12 h,ROL的反应速度比CALB快,ROL与混合酶的反应初速度接近(数据未显示),且在催化反应的最初12 h混合酶的反应速度是最快的。之后尝试在0 h加入多量甲醇,满足复合酶较高的反应初速度所需要的甲醇,快速生成大量的脂肪酸甲酯,甲醇的快速消耗降低了甲醇对酶催化剂的毒害作用。同时CALB又确保1、2、3位酯键均直接被脂肪酶催化水解,提高了最终的甲酯得率。复合酶体系的甲醇流加方式实验验证了反应时间与甲醇的流加方式直接相关,通过优化,使反应时间减少了50%以上,即该复合酶协同催化体系的工艺有效缩短了甲酯化反应的时间,反应29 h即可获得了90%以上的甲酯得率。
总之,本复合酶协同催化体系无需加入任何有机溶剂,对环境友好,并能适应高水含量的体系;克服单一脂肪酶的底物专一性,提高了对甲醇的耐受力;与常规酶法制备生物柴油工艺相比,酶的使用量和催化时间都减少50%以上,有效提高了酶法催化制备生物柴油的效率,并降低了催化剂使用成本;甲酯得率大于93%,产品易于分离,因此该复合酶体系较单酶体系具有更多工业化应用的优势。
| [1] | Meher LC, Sagar DV, Naik SN. Technical aspects of biodiesel production by transesterification—a review[J]. Renewable and Sustainable Energy Reviews, 2006, 10(3): 248-268 |
| [2] | van Gerpen JH. Biodiesel processing and production[J]. Fuel Processing Technology, 2005, 86(10): 1097-1107 |
| [3] | Marchetti JM, Miguel VU, Errazu AF. Possible methods for biodiesel production[J]. Renewable and Sustainable Energy Reviews, 2007, 11(6): 1300-1311 |
| [4] | Haas MJ, Mcaloon AJ, Yee WC, et al. A process model to estimate biodiesel production costs[J]. Bioresource Technology, 2006, 97(4): 671-678 |
| [5] | Suehara K, Kawamoto Y, Fujii E, et al. Biological treatment of wastewater discharged from biodiesel fuel production plant with alkali-catalyzed transesterification[J]. Journal of Bioscience and Bioengineering, 2005, 100(4): 437-442 |
| [6] | Fjerbaek L, Christensen KV, Norddahl B. A review of the current state of biodiesel production using enzymatic transesterification[J]. Biotechnology and Bioengineering, 2009, 102(5): 1298-1315 |
| [7] | Kaieda M, Samukawa T, Kondo A, et al. Effect of methanol and water contents on production of biodiesel fuel from plant oil catalyzed by various lipases in a solvent-free system[J]. Journal of Bioscience and Bioengineering, 2001, 91(1): 12-15 |
| [8] | Ban K, Hama S, Nishizuka K, et al. Repeated use of whole-cell biocatalysts immobilized within biomass support particles for biodiesel fuel production[J]. Journal of Molecular Catalysis B: Enzymatic, 2002, 17(3/5): 157-165 |
| [9] | Wang G, Luo Y, Jiang ZB, et al. Production of biodiesel catalyzed by a novel lipase LipB52 from Pseudomonas fluorescens[J]. Journal of East China University of Science and Technology (Natural Science Edition), 2008, 34(2): 197-201 (in Chinese) 王刚, 罗宇, 江正兵, 等. 新型脂肪酶LipB52催化生物柴油[J]. 华东理工大学学报: 自然科学版, 2008, 34(2): 197-201 |
| [10] | Mao YJ, Ou XJ, Du W, et al. High-level expression of lipase from Bacillus thermocatenulatus BTL2 in E. coli and its application in biodiesel production[J]. CIESC Journal, 2012, 63(7): 2100-2105 (in Chinese) 茅羽佳, 欧先金, 杜伟, 等. 大肠杆菌高水平表达脂肪酶BTL2及其催化油脂制备生物柴油[J]. 化工学报, 2012, 63(7): 2100-2105 |
| [11] | Li X, He XY, Li ZL, et al. Enzymatic production of biodiesel from Pistacia chinensis bge seed oil using immobilized lipase[J]. Fuel, 2012, 92(1): 89-93 |
| [12] | Lee JH, Kim SB, Kang SW, et al. Biodiesel production by a mixture of Candida rugosa and Rhizopus oryzae lipases using a supercritical carbon dioxide process[J]. Bioresource Technology, 2011, 102(2): 2105-2108 |
| [13] | Li Q, Zheng JJ, Yan YJ. Biodiesel preparation catalyzed by compound-lipase in co-solvent[J]. Fuel Process Technology, 2010, 91(10): 1229-1234 |
| [14] | Huang Y, Gao H, Zheng H, et al. Immobilized lipases cooperates to catalyze transesterification reaction of lard[J]. China Biotechnology, 2008, 28(1): 30-35 (in Chinese) 黄瑛, 高欢, 郑海, 等. 脂肪酶协同催化猪油合成生物柴油工艺研究[J]. 中国生物工程杂志, 2008, 28(1): 30-35 |
| [15] | Royon D, Daz M, Ellenrieder G, et al. Enzymatic production of biodiesel from cotton seed oil using t-butanol as solvent[J]. Bioresource Technology, 2007, 98(3): 648-653 |
| [16] | Lutz S. Engineering lipase B from Candida antarctica[J]. Tetrahedron: Asymmetry, 2004, 15(18): 2743-2748 |
| [17] | Kaieda M, Samukawa T, Matsumoto T, et al. Biodiesel fuel production from plant oil catalyzed by Rhizopus oryzae lipase in a water-containing system without an organic solvent[J]. Journal of Bioscience and Bioengineering, 1999, 88(6): 627-631 |
| [18] | Li X, Deng RB, Wang F. Expression of Candida antarctica lipase B in Pichia pastoris and studying of enzyme properties[J]. Journal of Sichuan Normal University (Natural Science), 2014, 37(6): 911-916 (in Chinese) 李迅, 邓若冰, 王飞. 南极假丝酵母脂肪酶B在毕赤酵母中的分泌型表达及酶学性质初探[J]. 四川师范大学学报: 自然科学版, 2014, 37(6): 911-916 |
| [19] | Li ZL, Li X, Wang Y, et al. Expression and characterization of recombinant Rhizopus oryzae lipase for enzymatic biodiesel production[J]. Bioresource Technology, 2011, 102(20): 9810-9813 |
| [20] | Zhang J, Liu JF, Zhou J, et al. Thermostable esterase from Thermoanaerobacter tengcongensis: high-level expression, purification and characterization[J]. Biotechnology Letters, 2003, 25(17): 1463-1467 |
| [21] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254 |
| [22] | Li X, He XY, Li ZL, et al. Combined strategies for improving the production of recombinant Rhizopus oryzae lipase in Pichia pastoris[J]. BioResources, 2013, 8(2): 2867-2880 |
| [23] | Wang YD, Shen XY, Li ZL, et al. Immobilized recombinant Rhizopus oryzae lipase for the production of biodiesel in solvent free system[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 67(1/2): 45-51 |
| [24] | Yan YJ, Xu L, Dai M. A synergetic whole-cell biocatalyst for biodiesel production[J]. RSC Advances, 2012, 2(15): 6170-6173 |
| [25] | Lee JH, Lee DH, Lim JS, et al. Optimization of the process for biodiesel production using a mixture of immobilized Rhizopus oryzae and Candida rugosa lipases[J]. Journal of Microbiology & Biotechnology, 2008, 18(12): 1927-1931 |
| [26] | Li W, Li RW, Li Q, et al. Acyl migration and kinetics study of 1(3)-position specific lipase of Rhizopus oryzae-catalyzed methanolysis of triglyceride for biodiesel production[J]. Process Biochemistry, 2010, 45(12): 1888-1893 |
| [27] | Oda M, Kaieda M, Hama S, et al. Facilitatory effect of immobilized lipase-producing Rhizopus oryzae cells on acyl migration in biodiesel-fuel production[J]. Biochemical Engineering Journal, 2005, 23(1): 45-51 |
| [28] | Watanabe Y, Pinsirodom P, Nagao T, et al. Production of FAME from acid oil model using immobilized Candida antarctica lipase[J]. Journal of the American Oil Chemists’ Society, 2005, 82(11): 825-831 |
 2016, Vol. 43
2016, Vol. 43