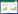扩展功能
文章信息
- 颜正飞, 郭健, 杨杨, 刘乃旭, 田风华, 李长田, 李玉
- YAN Zheng-Fei, GUO Jian, YANG Yang, LIU Nai-Xu, TIAN Feng-Hua, LI Chang-Tian, LI Yu
- 分离自茯砖茶的真菌菌株MJAU EC021 的鉴定及培养过程中生理特性
- Identification and physiological characteristics in cultivation of fungal strain MJAU EC021 isolated from brick tea
- 微生物学通报, 2016, 43(2): 310-321
- Microbiology China, 2016, 43(2): 310-321
- 10.13344/j.microbiol.china.150310
-
文章历史
- 收稿日期: 2015-04-12
- 接受日期: 2015-07-16
- 优先数字出版日期(www.cnki.net): 2015-10-08
2. Department of Oriental Medicinal Material and Processing, College of Life Science, Kyung Hee University, 1 Seocheon-Dong, Yongin 446701, South Korea
2. Department of Oriental Medicinal Material and Processing, College of Life Science, Kyung Hee University, 1 Seocheon-Dong, Yongin 446701, South Korea
茯砖茶是传统微生物发酵茶,主产区为中国湖南省,历史上一直是中国南部和西部边境地区少数民族日常必需的饮料。茯砖茶在其独有的“发花”过程中,起主要作用的是一种“有益菌”冠突散囊菌[Eurotium cristatum (Raper & Fennell) Malloch & Cain],使茯砖茶具有独特的品质和风味。因该菌的菌落呈金黄色,所以又俗称“金花”[1]。散囊菌属(Eurotium)是曲霉属(Aspergillus)的有性型态,相对于曲霉属的研究力度,只有少数散囊菌被研究。经冠突散囊菌发酵后的茶叶,降血脂[2, 3]、降血压[4]、抗动脉粥样硬化[5]、耐缺氧[6, 7]等多种生物活性得到进一步的增强。冠突散囊菌发酵液能有效调节人体新陈代谢,并有较强的降脂降压调节糖类代谢的功效[2]。同时分泌的胞外酶可以促使碳水化合物分解、多酚氧化缩合以及蛋白质降解[8, 9, 10]。其次冠突散囊菌的发酵液有较强的抗癌和抑菌作用[11, 12, 13],且从中分离得到的化合物Flavoglaucin具有抗氧化作用[11],能显著地提高胃蛋白酶、胰蛋白酶以及α-淀粉酶活性而同时抑制脂肪酶的活性[14]。
在茯砖茶发酵最后阶段,茯砖茶表面长出许多黄色真菌(“金花”),只有“金花”出现了才可以证明茯砖茶发酵成功。最后,茶叶产品经过包装和储存在干燥的库房催熟(老化)至少半年,所以在此过程中黄色真菌的生长被认为是茯砖茶发酵成功的关键阶段。茯砖茶自然发酵期间生长出的真菌已被鉴定为数种散囊菌(Eurotium spp.)的混合物。我们研究目的在于运用纯培养方法筛选出茯砖茶发酵过程中的优势菌株,并且获得有关优势菌株在液体培养过程中一些生理生化动态变化信息,及确定优势菌株的最佳生长条件。这方面的知识将有助于阐明优势真菌菌株代谢过程,以及真菌和培养条件关系,可能有助于提高茯砖茶的质量。
1 材料与方法 1.1 实验材料 1.1.1 样品:茯砖茶,湖南白沙溪茶厂有限公司(湖南安化),商品货号:BSXTF1009。 1.1.2 培养基:PDA固体培养基、种子液体培养基、液体发酵培养基的配制见文献[15, 16]。 1.1.3 主要试剂:Taq Mix DNA聚合酶、DNA Marker购自大连宝生物工程有限公司;琼脂糖购自Spanish公司;柱式DNA胶回收试剂盒、PCR扩增引物购自上海生工生物工程技术有限公司;载体克隆试剂盒、感受态细胞购自北京全式金生物技术有限公司;1,1-二苯基-2-苦基肼(DPPH)、2,2′-连氮-二(3-乙基苯并噻唑啉-6-磺酸) [2,2′-zino-bis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS]购自北京中生瑞泰科技有限公司;其他均为常规试剂。 1.1.4 主要仪器:梅特勒电子天平ME204E购自苏州赛恩斯仪器有限公司;电热恒温水槽DK600购自上海精宏实验设备有限公司;电泳仪JY-SPCT购自北京六一仪器厂;台式高速离心机5424和Mastercycler pro梯度PCR仪购自美国Eppendorf公司;ChemiDoc MP全能型凝胶成像仪购自美国伯乐公司;生物显微镜44X3A购自上海光学仪器一厂。 1.2 研究方法 1.2.1 分离鉴定:(1) 茯砖茶发酵优势菌的分离培养及形态观察:参考牛天贵[16]稀释平板涂布法,在无菌环境下用灭菌镊子取块状茯砖茶内部茶叶(含有黄色斑点)均匀铺在PDA固体培养基表面,28 °C恒温培养1周后,挑取单菌落分离纯化。观察菌株的生长情况并记录菌落的形态特征。分离得到的菌株转接于斜面培养基中,待长满50%后放入4 °C保存,每3个月将菌株进行活化再次保藏。(2) ITS序列测定:参考林燕[17]的方法,采用CTAB法提取总DNA,以ITS1和ITS4为PCR扩增引物进行菌株ITS区域的扩增。对PCR产物进行切胶回收后按载体克隆试剂盒说明书进行克隆。阳性菌液由上海生工进行测序。 1.2.2 培养条件对生物量的影响:(1) 培养转速的影响:取活化的种子液按1%的接种量接种到发酵培养基。真菌的最佳培养温度一般在28 °C左右。因此本实验设定培养温度为28 °C,摇床转速分别设置为130、150、160、180、200r/min,连续发酵10 d,发酵终止后检测生物量,以确定最优的培养转速。(2) 培养时间的影响:取活化的种子液按1%接种量接种到发酵培养基中,培养温度28 °C,最优的培养转速,分别在第2、4、6、8、10、12、14天取发酵液进行生物量的检测,以确定最优发酵时间。(3) 培养温度的影响:取活化的种子液按1%接种量接种到发酵培养基,设定培养温度为15、19、22、25、28、30 °C,最优的培养转速,最优的培养时间取发酵液对生物量进行检测,以确定最优培养温度。 1.2.3 响应面实验设计:利用Design-Expert 8.0软件进行响应面实验设计,优化培养条件。综合单因素实验结果,选取培养转速、培养时间、培养温度3个因素,在单因素实验的基础上采用3因素3水平进行响应面分析(表1)。| 因素 Factors | 水平 Levels | ||
| −1 | 0 | 1 | |
| 转速 Speed (r/min) | 140 | 180 | 220 |
| 培养时间 Incubation time (d) | 8 | 10 | 12 |
| 培养温度 Temperature (°C) | 26 | 28 | 30 |
(1) 还原糖含量测定:采用DNS法[17]。标准曲线方程为Y=72.593X+0.024 9,R2=0.994 3。其中Y为吸光度,X为样品浓度,R2=0.994 3,线性范围为0−12 g/L。
(2) 多酚含量测定:取5 mL离心后的上清液,等体积乙酸乙酯萃取3次,萃取液合并浓缩定容至5 mL,采用Folin-Ciocalte法[18, 19]测定发酵液多酚(Extracellular polyphenol,EP)含量。用没食子酸(Gallic acid,GAE)的量来表示多酚的含量,没食子酸标准品标准曲线为Y=11.676X−0.086 7,R2=0.998 7。其中Y为吸光度,X为样品浓度,R2=0.998 7,线性范围为0−1.2 g GAE/mL。
(3) 胞外酶活的测定:按照曹春蕾等[20, 21]所述的方法测定发酵上清液中主要的4种胞外酶:羧甲基纤维素酶、漆酶、多酚氧化酶、蛋白酶。1) 羧甲基纤维素酶活力测定:1%羧甲基纤维素钠(CMC-Na)溶于0.1 mol/L pH 4.6 C2H3O2Na-C2H4O2缓冲液配制1.9 mL,发酵上清液0.5 mL,40 °C水浴保温30 min后,立即加入1.5 mL DNS试剂,煮沸5 min,取出冷却,用蒸馏水稀释至30 mL,500 nm测OD值,做3组,求平均值。以加热灭活的发酵上清液作对照。按葡萄糖标准曲线,计算CMC-Na被羧甲基纤维素酶分解的葡萄糖含量,1个酶活单位U定义为每分钟生成1 µmol葡萄糖所需要的酶量。2) 漆酶测定:l mL 0.5 mmol/L的ABTS,1 mL pH 4.0的0.2 mol/L Na2HPO4-C6H8O7缓冲液和0.5 mL发酵上清液。先将底物和缓冲液混匀,再加入发酵上清液启动反应,每隔10 min记录420 nm处OD值的变化,做3组,求平均值。以加热灭活的发酵上清液作对照。1个酶活单位U定义为每分钟每毫升酶液OD值的变化量。3) 多酚氧化酶测定:5.4 mL 0.2 mol/L pH 6.8 Na2HPO4-NaH2PO4缓冲溶液,0.4 mL 0.02 mol/L邻苯二酚溶液,0.5 mL酶液;在30 °C恒温水浴中进行酶促反应15 min,冷却后于420 nm波长测定OD值,做3组,求平均值。以加热灭活的发酵上清液作对照。1个酶活单位U定义为每分钟每毫升酶液OD 值的变化量。4) 蛋白酶活测定:取0.9 mL 0.5 %酪蛋白(预热至30 °C)于试管中,加入0.5 mL发酵上清液摇匀,30 °C保温10 min,加入1 mL 10 %的三氯乙酸,摇匀,静置,过滤,取0.5 mL滤液,加3 mL 0.55 mol/L Na2CO3,0.5 mL福林-酚试剂摇匀,30 °C保温15 min,于650 nm测定OD值,做3组,求平均值。以加热灭活的发酵上清液作对照。1个酶活单位U定义为每分钟每毫升酶液OD值的变化量。
(4) 抗氧化能力的测定:DPPH自由基清除率测定按韩乐琳等[22]方法进行。羟自由基清除率测定按汪海波等[23]方法进行。
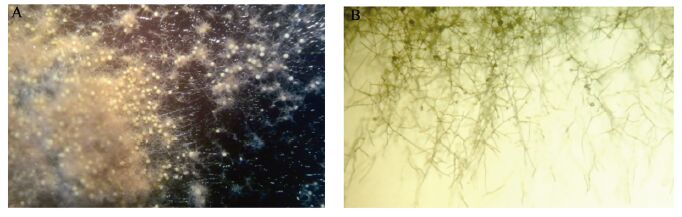
2 结果与分析 2.1 菌株的分离及其形态学特性PDA分离平板在28 °C恒温培养1周后,将分离平板上30个形态、颜色不同的单一菌落挑取重新转接到新的PDA平板上,28 °C恒温培养1周。其中20个平板内的菌落基本为黄色且显微镜下的形态特征相近,黄色菌落可能是茯砖茶“发花”过程中的优势菌株,因此选取该菌作为研究目标菌,将黄色的菌株重新挑取纯化培养并编号为MJAU EC021。其余10个菌株经ITS序列分析基本都是霉菌,主要由黑曲霉、毛霉、拟青霉、青霉等种类组成。菌株MJAU EC021在PDA培养基上28 °C培养10 d时菌落直径为2.99 cm,在显微镜下,边缘菌丝为黄色,中部菌丝颜色较深呈褐色,有少量黑褐色渗出液呈小滴状。子囊果为闭囊壳,通常为黄色,球形或近球形,具有一层细胞厚的拟薄壁,光滑,裸露或被稀疏的菌丝网(具饰菌丝)围绕。培养后期,培养基呈现黑褐色,色素扩散至基质中(图1)。产孢结构、分生孢子、子囊(图2)与《中国真菌志,第五卷》中冠突散囊E. cristatum描述相一致[24]。基于形态特征观察,初步将菌株MJAU EC021鉴定为冠突散囊菌。
|
|
图1
菌株形态特征
Figure 1
Morphological characteristics of strain
注:A:菌落表面子囊果;B:菌落边缘菌丝.
Note: A: Ascocarps on the surface of colony; B: Mycelium on the edge of colony. |
|
|
图2
菌株显微特征
Figure 2
Microstructure characters of strain
注:A:分生孢子;B:子囊孢子;C:子囊.
Note: A: Conidia; B: Ascospore; C: Perithecium. |
利用ITS通用引物(ITS1、ITS4)对菌株MJAU EC021的ITS序列进行PCR扩增,获得约600 bp的DNA单一条带,对克隆后的阳性菌液进行测序分析,菌株MJAU EC021的ITS序列长为635 bp。序列提交GenBank并进行比对,下载与菌株MJAU EC021相似性大于90%的序列,利用MEGA 6.0按照Neighbour-Joining法构建系统发育树,得到进化树(图3)。菌株MJAU EC021和冠突散囊菌SAB-A2-T的ITS序列(JX869560)相似性高达99%,该结果支持形态鉴定的结果,即菌株MJAU EC021为冠突散囊菌(E.cristatum)。菌株MJAU EC021的ITS序列的GenBank登录号为KT203369。

|
|
图3
菌株MJAU EC021的ITS序列NJ型进化树
Figure 3
NJ phylogenetic tree based on ITS sequences about strain MJAU EC021
注:分支点数值是基于邻接法重复分析数据1 000次后的自律值(>50%);括号内数值为GenBank的登录号;差异值(0.01)是1%的序列差异,即100个核苷酸序列有1个核苷酸缺失或者被置换突变.
Note:Numbers at nodes indicate the bootstrap values (>50%) based on neighbour-joining analyses of 1 000 resampled datasets; Numbers in parentheses are GenBank accession numbers; Bar: 1 nucleotide substitution per 100 nucleotides. |
|
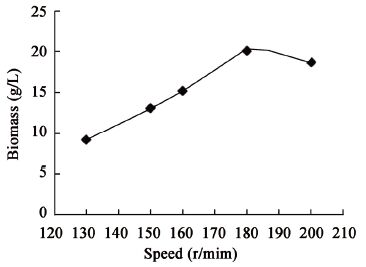
| 图4 培养转速对生物量的影响 Figure 4 Effect of speed on biomass |
|
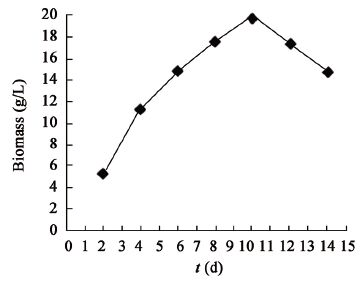
| 图5 培养时间对生物量的影响 Figure 5 Effect of time on biomass |
|
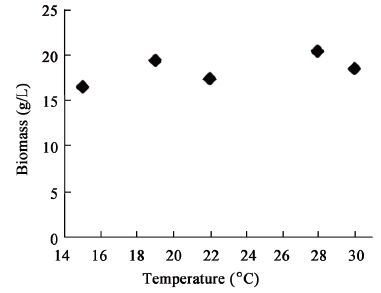
| 图6 培养温度对生物量的影响 Figure 6 Effect of temperature on biomass |
综上,单因素实验表明,菌株MJAU EC021生物量的最优转速为180 r/min,最优培养温度为28 °C,最优发酵时间为10 d。
2.4 菌株MJAU EC021生物量的响应面优化模型的建立及显著性检验:以转速(A)、培养时间(B)、培养温度(C)为实验因素,菌株MJAU EC021生物量为响应值(Y),进行3因素3水平响应面分析实验,实验设计与结果见表2。以生物量为响应值,利用Design-Expert软件对表2进行二次多元回归拟合,得到生物量对转速(A)、培养时间(B)、培养温度(C)的二次多项回归方程:Y=−1 754.702 63+ 2.010 62A+45.630 62B+96.972 88C−0.011 312 AB+ 2.531 25×10−3AC−0.258 13BC−5.271 25×10−3A2− 1.852 25B2−1.685 38C2,以及响应值(Y)和3个因素转速(A)、培养时间(B)、培养温度(C)之间交互作用的关系(图7)。通过Design-Expert软件计算并分析得到的各因素的最优条件为:转速186.97 r/min,培养时间为9.79 d,培养温度为28.16 °C,此模型下生物量理论产量为21.88 g/L。考虑到实际情况,进行调整后的最优发酵条件为:转速187 r/min,培养时间10 d,培养温度28 °C。在此条件下最终生物量产量为21.52 g/L。
| 序号 No. | 转速 Speed (r/min) | 时间 Time (d) | 温度 Temperature (°C) | 生物量 Biomass (g/L) |
| 1 | 180 | 10 | 28 | 7.03 |
| 2 | 140 | 12 | 28 | 10.81 |
| 3 | 140 | 8 | 28 | 3.54 |
| 4 | 140 | 10 | 26 | 21.80 |
| 5 | 180 | 10 | 28 | 6.01 |
| 6 | 180 | 10 | 28 | 21.21 |
| 7 | 180 | 10 | 28 | 10.81 |
| 8 | 220 | 10 | 26 | 8.39 |
| 9 | 220 | 8 | 28 | 2.30 |
| 10 | 180 | 8 | 30 | 21.03 |
| 11 | 180 | 10 | 28 | 6.02 |
| 12 | 220 | 12 | 28 | 10.17 |
| 13 | 180 | 8 | 26 | 22.00 |
| 14 | 140 | 10 | 30 | 3.91 |
| 15 | 220 | 10 | 30 | 3.01 |
| 16 | 180 | 12 | 26 | 21.99 |
| 17 | 180 | 12 | 30 | 5.66 |

|
| 图7 培养转速、时间和温度交互作用对生物量影响 Figure 7 Interaction effect of culture time,speed and temperature on biomass |
在菌株MJAU EC021的液体培养过程中,胞外酶的产生时间和酶活性都有很大差异(图8)。纤维素酶活性在接种初期迅速下降之后上升,酶活最大值出现在发酵培养的第4、10天,最大值是2.785 U/mL;多酚氧化酶酶活性在接种初期平稳,没有明显波动,在第6−10天时酶活性迅速提高达到最大值(1.078 U/mL),随后逐渐下降;蛋白酶酶活性在培养前期变化不大。在第10天蛋白酶酶活性达到最大值4.792 U/mL;漆酶在培养第6天时活力最低仅为0.24 U/mL,在第10天达到峰值2.23 U/mL。

|
|
图8
菌株液体培养过程中胞外酶酶活变化
Figure 8
Activity changes of extracellular enzyme of strain during liquid culture
注:A:纤维素酶;B:多酚氧化酶;C:蛋白酶;D:漆酶.
Note: A: Cellulase; B: Polyphenol oxidase; C: Protease; D: Laccase. |
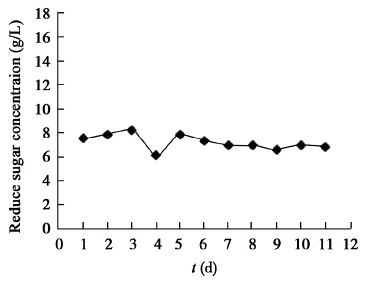
菌株MJAU EC021在液体培养初期,培养液还原糖的含量出现轻微波动,在第3−4天之间,还原糖含量急剧减少,可能在此期间菌丝体生长需要吸收营养用于自身生长。之后还原糖含量有所回升后基本保持在一定范围内波动(图9)。
|
| 图9 菌株液体培养过程中还原糖浓度的变化 Figure 9 The reducing sugar concentration of strain during liquid culture |
菌株MJAU EC021在液体培养初期胞外多酚含量都很低,随着培养时间的延长,胞外多酚含量逐渐增加。胞外多酚含量在4 d之后开始急剧增加,在第7天达到最大值0.588 g GAE/mL,随后保持在该水平没有明显变化(图10)。
|
| 图10 菌株液体培养过程中胞内外多酚含量的变化 Figure 10 The variation of the contents of EP during liquid culture of strain |
菌株MJAU EC021的发酵液对DPPH、羟自由基都有清除作用。在培养初期发酵液对DPPH自由基的清除率较低。在第5天清除率达到第一个峰值(74.3%),之后轻微下降。在第7天时,对DPPH自由基的清除率达到最大值90.93%。同样的在第7天,发酵液对羟自由基的清除率达到最大值94.35%。发酵液对DPPH、羟自由基清除率高时,胞外多酚含量也较高;而在培养初始阶段,胞外多酚含量都较低,发酵液的抗氧化活性也不高(图11)。发酵液抗氧化能力可能与其多酚含量有密切关系。

|
| 图11 菌株发酵液抗氧化活性 Figure 11 Antioxidant activity from fermentation liquid of strain |
PDA分离培养基中菌落多样性较低,同时含有霉菌菌落。这些霉菌是污染菌,必须控制其生长繁殖。虽然冠突散囊菌是主要的优势菌,但不能否认其他散囊菌存在,在发花过程中的作用也尚不明确。本次分离的优势菌株MJAU EC021为冠突散囊菌(E. cristatum),在Samson等[25]、Raper等[26]和齐祖同等[24]的研究基础上,Pitt[27, 28]将其重新定义为Eurotium cristatum,故国家标准中茯砖茶的参考质量指标“冠突曲霉(Aspergillus cristatus)”名称是一个无效的种名(异名)。Kozakiewicz[29]为本种的无性型取名为小冠曲霉(Aspergillus cristatellus)。
发酵过程中,菌株MJAU EC021在发酵初期可能处于对液体培养基适应期,所以在前3天几乎不利用还原糖,第4天还原糖含量有个短暂的下降,可能与菌丝生长利用了培养液中的葡萄糖(还原糖)有关,菌丝生长时自身也分泌还原性糖使其含量上升并在培养后期达到平稳期,没有明显波动。多酚类物质是冠突散囊菌的次级代谢产物,培养过程中胞外多酚含量在不同时期有着显著的区别,它的产生可能和相关酶(葡萄糖氧化酶、乙二醛氧化酶、硝基还原酶、醌还原酶等)有密切关系。发酵前期,菌株生长比较缓慢可能会导致相关酶的活性相对较低,因此多酚的产量较少。一旦菌株适应了新的生长环境,菌丝体显著增长并进入营养期,酶的活性提升,多酚的产量增多。随后菌丝体进入繁殖期,此时液体培养基营养物被消耗殆尽,同时次生代谢物增加,相关的酶活性就会受到抑制,从而导致多酚的量基本不再增加,甚至开始下降。相对于胞内多酚,胞外多酚提取更容易。在整个培养过程中发酵液抗氧化能力与胞外多酚含量呈正相关,即多酚含量高时,其抗氧化活性也强。说明多酚类物质是冠突散囊菌发酵液中抗氧化活性物质之一,具体活性成分需进一步研究。培养7 d时发酵液抗氧化能力最强,对自由基清除率均达到90%以上,说明该菌株的发酵产物可以作为潜在抗氧化添加剂。本研究分析了菌株MJAU EC021发酵过程中主要的胞外酶(多酚氧化酶、蛋白酶、漆酶、纤维素酶)酶活的变化,从酶活的变化可以初步了解菌株的生长状态。培养6 d时胞外酶酶活均较低,在第10天时酶活均达到峰值。这可能是因为菌株MJAU EC021在培养前期是处于营养生长期,培养基中的营养供菌丝的生长,分泌的胞外酶酶活相对较低。进入繁殖期菌丝生长稳定后,酶的表达量逐步增强导致胞外酶的分泌量上升并在第10天达到峰值。表3对本文菌株MJAU EC021的胞外酶酶活与陈桂梅等[10]的研究结果进行了比较,酶活差异性最大的是蛋白酶。根据分析推测有3种可能的因素导致蛋白酶酶活的差异:(1) 陈桂梅等是利用固体平板检测水解圈直径来估算对应的酶活力,这存在人为的误差。(2) 与样品产地有关。本实验茯砖茶来自于湖南安化县,陈桂梅等的样品来自于陕西咸阳市。两地位于不同的经纬度,因此湖南安化县的年平均温度大于陕西咸阳市。外界环境温度可能影响茯砖茶“发花”的过程,在较高的温度下“发花”产生的冠突散囊菌可能分泌出高活性的蛋白酶,并具有一定的遗传稳定性。(3) 与菌株的培养基类型有关。本实验采用的液体培养基,陈桂梅等则采用了固体培养基。液体培养过程中,菌株MJAU EC021与培养基充分接触更有利于菌株生长,且培养液中次生代谢产物可能对菌株MJAU EC021分泌出高活性的蛋白酶具有促进作用。黄群等[30]实验研究表明,冠突散囊菌72 h的发酵液对蛋白酶具有激活作用,可以提高蛋白酶酶活。这一实验结果从侧面可以证明液体发酵时可以增加蛋白酶酶活。
| 酶 Enzyme | 酶活 Enzyme activity (U/mL) | |
| A | B | |
| 纤维素酶 cellulase | 2.785 | 3.27 |
| 淀粉酶 amylase | − | 19.08 |
| 果胶酶 pectase | − | 69.31 |
| 蛋白酶 protease | 4.792 | 0.63 |
| 脂肪酶 lipase | − | N |
| 多酚氧化酶 polyphenol oxidase | 1.078 | − |
|
注:A:本文胞外酶酶活力;B:陈桂梅等[10]文中胞外酶酶活力. −:酶活未测定;N:未检测到该酶. Note:A: Extracellular enzyme activity in this paper; B: Extracellular enzyme activity from Chen et al[10]. −: Enzyme activity were not determined; N: Not detected the enzyme. |
||
| [1] | Wang ZG,Tong Z,Cheng SY. Analysis of the pros and cons and Eurotium identification and mould content from Fuzhuan Tea[J]. Food Science,1992(5): 1-5 (in Chinese) 王志刚,童哲,程苏云. 茯砖茶中霉菌含量和散囊菌鉴定及利弊分析[J]. 食品科学,1992(5): 1-5 |
| [2] | Martins F,Noso TM,Porto VB,et al. Maté tea inhibits in vitro pancreatic lipase activity and has hypolipidemic effect on high-fat diet-induced obese mice[J]. Obesity,2010,18(1): 42-47 |
| [3] | Lee SM,Kim CW,Kim JK,et al. GCG-rich tea catechins are effective in lowering cholesterol and triglyceride concentrations in hyperlipidemic rats[J]. Lipids,2008,43(5): 419-429 |
| [4] | Yung LM,Leung FP,Wong WT,et al. Tea polyphenols benefit vascular function[J]. Inflammopharmacology,2008,16(5): 230-234 |
| [5] | Young W,Hotovec RL,Romero AG. Tea and atherosclerosis[J]. Nature,1967,216(5119): 1014-1016 |
| [6] | Xu JH,Lu LH,Yan Y. Study on hypoxia tolerance in safflower tea[J]. Shandong Food Science and Technology,2002(8): 28-29 (in Chinese) 徐建华,卢连华,颜燕. 红花茶耐缺氧作用研究[J]. 山东食品科技,2002(8): 28-29 |
| [7] | Zheng SL,Wang LL,Zhang CJ,et al. Effect of scented tea on hypoxia tolerance a of passive smoking mice[J]. Journal of Anhui Agricultural Sciences,2009,37(10): 4520-4521 (in Chinese) 郑素玲,王玲玲,张彩娟,等. 花茶对被动吸烟小鼠耐缺氧能力的影响[J]. 安徽农业科学,2009,37(10): 4520-4521 |
| [8] | Mondal GC. Effect of hydrolytic enzymes of storage fungi on seed deterioration[J]. Acta Agronomica Hungarica,1987,36: 125-132 |
| [9] | Cai ZA,Liu SC,Liu ZH,et al. Cellulase enzymatic property of Eurotium cristatum from brick tea[J]. Journal of Tea Science,2010,30(1): 57-62 (in Chinese) 蔡正安,刘素纯,刘仲华,等. 茯砖茶中冠突散囊菌纤维素酶的酶学性质研究[J]. 茶叶科学,2010,30(1): 57-62 |
| [10] | Chen GM,Deng YL,Huang YY,et al. Activity changes in several extracellular enzymes of Eurotium cristatum fungi during its growth period[J]. Journal of Tea Science,2013,33(4): 306-310 (in Chinese) 陈桂梅,邓永亮,黄亚亚,等. 冠突散囊菌生长过程中几种胞外酶活性变化[J]. 茶叶科学,2013,33(4): 306-310 |
| [11] | Yang YC,Lu FH,Wu JS,et al. The protective effect of habitual tea consumption on hypertension[J]. Archives of Internal Medicine,2004,164(14): 1534-1540 |
| [12] | Almeida AP,Dethoup T,Singburaudom N,et al. The in vitro anticancer activity of the crude extract of the sponge-associated fungus Eurotium cristatum and its secondary metabolites[J]. Journal of Natural Pharmaceuticals,2010,1(1): 25-29 |
| [13] | Li JL,Hu BH,Zhao YB,et al. Antimicrobial activity of fermentation supernatants of Eurotium cristatum[J]. Food Science,2011,32(11): 157-160 (in Chinese) 李佳莲,胡博涵,赵勇彪,等. 冠突散囊菌发酵液的抑菌作用[J]. 食品科学,2011,32(11): 157-160 |
| [14] | Luo B. Study on biological characteristics of fermention fungus from fuzhuan brick tea and preparation of starter[D]. Xi’an: Master’s Thesis of Shaanxi University of Science and Technology,2014 (in Chinese) 罗冰. 茯砖茶发酵菌生物学特性及其发酵剂制备研究[D]. 西安: 陕西科技大学硕士学位论文,2014 |
| [15] | Li CT,Diao YY,Yu YH,et al. Nutrient composition analysis of cultured mycelia of Tricholoma matsutake[J]. Food Science,2012,33(22): 221-224 (in Chinese) 李长田,刁盈盈,于永辉,等. 发酵培养松茸菌丝体营养成分分析[J]. 食品科学,2012,33(22): 221-224 |
| [16] | Niu TG. Technology of Food Microbiology Experiment[M]. Beijing: China Agricultural University Press,2002: 130-131 (in Chinese) 牛天贵. 食品微生物学实验技术[M]. 北京: 中国农业大学出版社,2002: 130-131 |
| [17] | Lin Y. Research on deep cultivation of Inonotus obliquus and extraction technology and Antitumor activity of its polysaccharides[D]. Fuzhou: Master’s Thesis of Fujian Agriculture and Forestry University,2009 (in Chinese) 林燕. 桦褐孔菌深层培养及其多糖提取工艺和抗肿瘤活性研究[D]. 福州: 福建农林大学硕士学位论文,2009 |
| [18] | Folin-Ciocalteu比色法测定苹果渣中的多酚[J]. 食品科学,2010,31(4): 179-182 Han J,Wei FX. Determination of polyphenols in apple pomace by Folin-Ciocalteu colorimetry[J]. Food Science,2010,31(4): 179-182 (in Chinese) 韩菊,魏福祥. |
| [19] | Zhu JW,Xu XQ. The synthetics,chemical composition and antioxidant activity of polyphenols in submerged cultures of Inonotus obliquus[J]. Journal of Zhejiang Sci-Tech University,2011,28(4): 616-620 (in Chinese) 朱金卫,徐向群. 桦褐孔菌多酚的液体深层制备及抗氧化活性研究[J]. 浙江理工大学学报,2011,28(4): 616-620 |
| [20] | Cao CL,Cui BK,Qin WM. Activity changes of several extracellular enzymes in liquid culture of Phellinus mori[J]. Mycosystema,2011,30(2): 275-280 (in Chinese) 曹春蕾,崔宝凯,秦问敏. 桑木层孔菌液体培养过程中几种胞外酶活性的变化[J]. 菌物学报,2011,30(2): 275-280 |
| [21] | Wang YL. Lioqid cultural characteristics and extracellular enzymes of Flammulina velutipes[J]. Journal of Microbiology,2002,22(1): 34-35 (in Chinese) 王宜磊. 金针菇液体培养特性及胞外酶研究[J]. 微生物学杂志,2002,22(1): 34-35 |
| [22] | Han LL,Wei JC. A preliminary study on antioxidant ability of Antarctic lichen extract[J]. Mycosystema,2009,28(6): 846-849 (in Chinese) 韩乐琳,魏江春. 南极地衣提取物抗氧化能力的初步研究[J]. 菌物学报,2009,28(6): 846-849 |
| [23] | Wang HB,Xie BJ,Liu DC. A preliminary study on antioxidants in Oats[J]. Food Science,2003,24(7): 62-67 (in Chinese) 汪海波,谢笔钧,刘大川. 燕麦中抗氧化成分的初步研究[J]. 食品科学,2003,24(7): 62-67 |
| [24] | Qi ZT,Kong HZ,Sun ZM. Chinese Flora (Fifth Volumes)[M]. Beijing: Science Press,1997: 133-135 (in Chinese) 齐祖同,孔华忠,孙增美. 中国真菌志(第五卷)[M]. 北京: 科学出版社,1997: 133-135 |
| [25] | Samson RA,Hoekstra ES,van Oorschot CAN. Introduction to Food-borne Fungi[M]. Baarn,Delft: Centraalbureau voor Schimmelcultures,1981: 98-104 |
| [26] | Raper KB,Fennell DI,Austwick PKC. The genus Aspergillus[M]. Baltimore: The Williams and Wilkins Co,1965: 56-83 |
| [27] | Pitt JI. Nomenclatorial and taxonomic problems in the genus Eurotium[J]. Advances in Penicillium and Aspergillus Systematics,1986,102: 383-396 |
| [28] | Pitt JI. Species names in current use in the Trichocomaceae (Fungi,Eurotiales)[J]. Names in Current Use in the Families Trichocomaceae Cladoniaceae Pinaceae and Lemnaceae,1993: 13-57 |
| [29] | Kozakiewicz Z. Aspergillus species on stored products[J]. Mycological Papers,1989,161: 1-188 |
| [30] | Huang Q,Chen LJ,Li YP,et al. Study on the effect of dark tea fermentation liquid with Eurotium cristatum on the activity of digestive enzyme[J]. Microbiology China,2007,34(5): 917-920 (in Chinese) 黄群,陈林杰,李彦坡,等. 冠突散囊菌黑茶发酵液对消化酶活性影响的研究[J]. 微生物学通报,2007,34(5): 917-920 |
 2016, Vol. 43
2016, Vol. 43