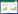扩展功能
文章信息
- 肖蓉, 孙海峰, 聂园军, 张春芬, 邓舒, 孟玉平, 王建斌, 曹秋芬
- XIAO Rong, SUN Hai-Feng, NIE Yuan-Jun, ZHANG Chun-Fen, DENG Shu, MENG Yu-Ping, WANG Jian-Bin, CAO Qiu-Fen
- 复合微生物菌剂对重茬苹果园土壤细菌群落的影响
- Effect of complex microbial agent on the soil bacterial communities in apple replanted orchard
- 微生物学通报, 2016, 43(2): 301-309
- Microbiology China, 2016, 43(2): 301-309
- 10.13344/j.microbiol.china.150339
-
文章历史
- 收稿日期: 2015-04-21
- 接受日期: 2015-07-27
- 优先数字出版日期(www.cnki.net): 2015-09-14
2. 山西省农业科学院生物技术研究中心 山西 太原 030031;
3. 山西大学化学化工学院 山西 太原 030006;
4. 山西省临猗县果业发展中心 山西 运城 044100;
5. 山西省农业科学院农业资源与经济研究所 山西 太原 030031;
6. 农业部黄土高原作物基因资源与种质创制重点实验室 山西 太原 030031
2. Biotechnology Research Center, Shanxi Academy of Agricultural Sciences, Taiyuan, Shanxi 030031, China;
3. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan, Shanxi 030006, China;
4. Fruit Industry Development Center of Linyi County, Yuncheng, Shanxi 044100, China;
5. Institute of Agricultural Resources and Economy, Shanxi Academy of Agricultural Sciences, Taiyuan, Shanxi 030031, China;
6. Key Laboratory of Crop Gene Resources and Germplasm Enhancement on Loess Plateau, Ministry of Agriculture, Taiyuan, Shanxi 030031, China
我国大部分苹果园都是20世纪八九十年代建立的,长期以来的粗放管理和片面追求高产导致相当一部分果园树势衰弱、病虫缠身,急需更新换代。而土地资源的限制使得新果园无地倒茬,重茬在所难免。重茬带来的定植成活率低、幼树生长迟缓、树体矮小、产量低和品质差等“再植问题”也接踵而至。
众多研究表明,重茬土壤微生物结构、功能的改变是再植病害的重要诱因之一。长期连作时,作物对土壤微生物的选择压力会增大,导致土壤中细菌数目减少,真菌数目上升,连作土壤微生物多样性降低,且由细菌主导型向真菌主导型转化[1, 2]。Shiomi等研究指出病原菌很难在微生物多样性高的土壤中滋生[3],土壤微生物多样性高、生物量大、功能平衡是抑病土的重要特征。植物病害生物防治是利用有益微生物和微生物代谢产物对病害进行有效防治的技术和方法[4]。在这些技术和方法的帮助下,受损的土壤微生物生态结构和生态功能得以恢复。谭兆赞等将含有多种有益微生物的生化腐植酸(BHA)应用到青枯病发病严重的连作番茄中,应用Biolog方法分析发现BHA处理的土壤微生物的各项多样性指数均明显高于对照,且在番茄的整个生育期保持较高水平,与青枯病的防效呈正相关[5]。肖逸等将具有生防作用的角担子菌B6应用于连作西瓜的重茬障碍防治,采用稀释平板法研究发现B6活菌丝的施用增加了重茬土壤细菌/放线菌的比例,真菌数量显著减少[6]。孔庆宇等将EM菌应用于甜樱桃,采用稀释平板法研究发现接种EM菌剂后樱桃根际土壤细菌、放线菌数量增多,真菌数量减少,有效改善了栽培条件下樱桃根际细菌多样性低的状态[7]。
自动核糖体内转录间隔区序列分析方法(Automated ribosomal intergenic spacer analysis,ARISA)以16S-23S rRNA基因间隔区为靶序列,在群体微生物调查研究方面具有快速、高效等独特优势,在国外广泛应用,但在国内还未见应用于重茬病害生物防治领域的微生物多样性研究的相关报道。本研究室前期研发出一种防治果树土传病害的复合微生物菌剂,大棚试验和大田试验均表现良好,已经于2014年获得国家发明专利授权[8]。本文以运城重茬苹果园土壤为研究对象,采用ARISA方法研究该复合微生物菌剂对土壤细菌菌群数量、多样性的影响及施用该菌剂后苹果园树体生长、果实产量等变化,以便进一步考察该菌剂对重茬土壤土传病害的生物防治效果。
1 材料与方法 1.1 试验地概况试验地位于山西省运城市临猗县西30 km的耽子镇西窑里村(110°33'38"N,35°8'8"E),属暖温带半湿润大陆性季风气候,海拔540 m,土壤质地为沙壤土,有机质含量1.2%,pH 1.2,土层深厚。试验园长120 m,宽12.5 m,总面积约1 500 m2,前茬植物为15年生矮化中间砧红富士苹果。拟将此老果园更新为短枝型秦星苹果园,砧木为八棱海棠。在相邻地带没有栽种过果树的空地建新园2 000 m2,同期定植秦星苹果苗,设为对照。重茬园在定植前采用复合微生物菌剂进行土壤处理,对照不处理,除此之外,两处理的栽培管理措施与常规管理相同。
1.2 土壤生物处理方法土壤微生物处理采用实验室前期研究并申请了国家发明专利的复合微生物菌剂[8],由枯草芽孢杆菌、蜡状芽孢杆菌、纳豆芽孢杆菌、解磷菌、解钾菌、放线菌X等菌种复合而成。菌剂处理于2011年秋进行,刨除老树后,清理残存物,深耕,整地,按3 m×4 m确定定植点,在定植点挖1 m×1 m×1 m的定植坑,将稀释后的菌液与有机肥、秸秆、土壤混匀后回填于定植坑内。然后大水漫灌,使坑内水分充足。最后用塑料薄膜密闭定植坑,保温保湿[8]。2012年春,揭开地膜,按常规方法种植高1.5−1.8 m独条苹果品种“秦星”大苗。
1.3 土样采集方法土壤样品于苹果苗定植两年时(即2013年7月)采集。在重茬园和新建园内分别随机选取5株苹果树,用土钻于苹果树干周围20 cm处分0−20 cm、20−50 cm土层采样。每株树的各土层随机采5个点混合作为一个样品,用无菌离心管保存于−20 °C备用。
1.4 ARISA指纹图谱的构建与数据分析 1.4.1 土壤微生物总DNA提取: 称取土样0.5 g于螺帽管中,加入1.5 mL磷酸缓冲液(pH 8.0,120 mmol/L)。上下颠倒充分混匀后,4 °C、12 000 r/min离心5 min。弃上清液,沉淀采用球磨法提取土壤样品中的总DNA[9]。粗提DNA用0.8%琼脂糖凝胶电泳检测完整性,用Nanodrop 2000分光光度计(Thermo fisher scientific incorporation,USA)测定其浓度,然后用无菌水稀释至浓度为10 mg/L,保存于−20 °C备用。 1.4.2 ARISA指纹图谱构建: 选用细菌通用引物ITS-F/ITS-R,用FAM荧光素标记ITS-R的末端[10],引物由北京奥科公司合成。PCR采用10 μL体系:10×PCR缓冲液1 μL,3.75 mol/L dNTPs 0.8 μL,10 μmol/L上下游引物各0.2 μL,rTaq DNA聚合酶[宝生物工程有限公司,大连] 0.15 μL,10 mg/L DNA模板1 μL,超纯水6.65 μL。PCR反应条件为:94 °C 3 min;94 °C 30 s,55 °C 1 min,72 °C 2 min,35个循环;72 °C 10 min。每个反应设两次重复,PCR产物经1%琼脂糖凝胶电泳检测合格后送中美泰和北京生物技术有限公司进行ARISA指纹图谱构建。 1.4.3 指纹图谱数据处理:利用GeneMarker软件对ARISA图谱上的片段进行数字转化处理,假定每一个DNA片段为1个操作分类单元(operational taxonomic unit,OTU),代表1个细菌类群,相应条带荧光强度占总OTUs荧光强度百分比代表该OTU在菌群的相对丰度。相对丰度>0.1%,且每个样本两次重复中均可以检测到的OTU才计为有效OTU,用于后续分析。相对丰度>0.5%的OTU为核心OTU。将获得的有效OTU及其相对丰度导入Paleontological statistics (PAST)软件包进行物种多样性分析。| 样本 Sample | 干周 Trunk girth (cm) | 中心干抽生新枝数 Number of new branch | 新梢长 Length of new shoots (cm) | 萌发枝条数 Total number of branches | 延长枝长度 Length of elongated branches (cm) | ||
| 长枝 Long branch | 中枝 Middle branch | 短枝 Short branch | |||||
| 处理 Treatment | 19.80A | 6.2A | 106.00A | 19.6a | 23.0a | 98.0A | 60.48a |
| 对照 Control | 15.82B | 3.8B | 90.13B | 17.2a | 17.6b | 66.8B | 55.44b |
|
注:同列不同大写字母代表在0.01水平上差异极显著;不同小写字母代表在0.05水平上差异显著. Note: Different letters (A, B) and (a, b) in the same column means the significant difference at 0.01 and 0.05 levels. |
|||||||
采用的物种多样性指数包括丰度(S)、Shannon-Weiner指数(H′)和群落相似性系数(Cs)。丰度即指OTU数量,描述细菌群落物种种数的多寡。Shannon-Weiner指数描述细菌群落分布情况,计算公式为:$H'=-\sum\limits_{i}^{s}{{{P}_{i}}}\ln {{P}_{i}}$
其中,S:OTU数;Pi:第i个条带的强度占总强度的比例。
相似性系数是根据两个群落中共同拥有物种的多少来判断相似程度。按Jaccard群落相似性系数公式计算:Cs=Nc /(Na +Nb −Nc)
当两个群落内的物种完全一样时,Cs取最大值为1;完全不同时,Cs取最小值为0。Na为群落a的全部条带数;Nb为群落b的全部条带数;Nc为群落a与b的共有条带数[11]。
1.5 苹果树生长、产量调查参照王建斌等的方法于2013年11月调查苹果树成活率、干周长、新梢长、百叶鲜重[12]。
2 结果与分析 2.1 苹果园土壤微生物分子指纹图谱图1是部分样本的分子指纹图谱,可以看出,样本中包含丰富的指纹信息,群落构成复杂,种类和数量都不尽相同。但大多数OTUs长度都集中在250−850 bp,且都在800 bp左右各有一个绝对优势条带。
|
|
图1
土壤微生物分子指纹图谱示例
Figure 1
Examples of soil microbial molecular fingerprint
注:A:菌处理20 cm土层;B:菌处理50 cm土层;C:对照20 cm土层;D:对照50 cm土层.
Note: A: 20 cm soil layer of microbial inoculant treatment; B: 50 cm soil layer of microbial inoculant treatment; C: 20 cm soil layer of the normal control; D: 50 cm soil layer of the normal control. |
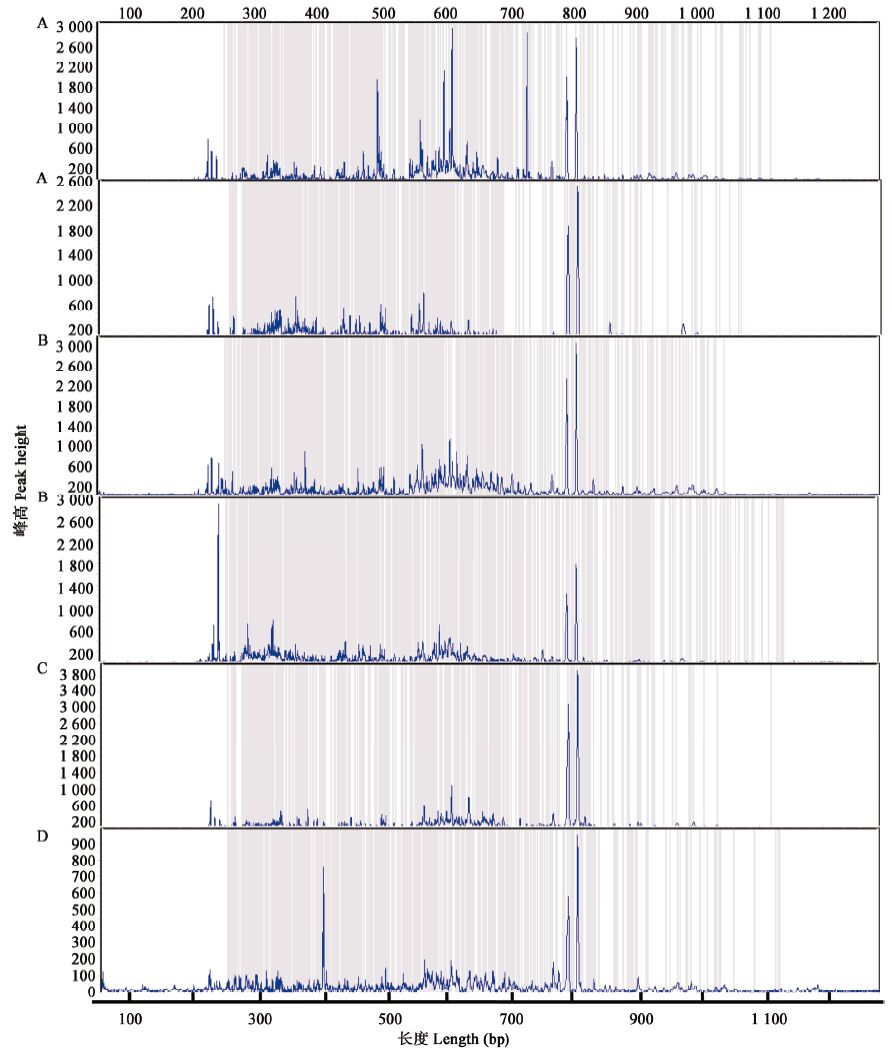
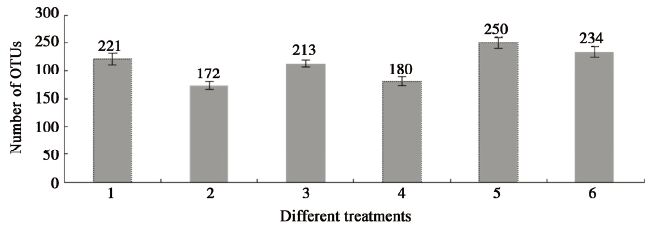
按1.4.3的方法经过一系列的剔除假阳性等数据处理,将指纹图谱转换成OTUs丰富度数据,经统计得到各处理所获得的OTUs数量(图2)。从图2可以看出,不论是20 cm土层还是50 cm土层,菌处理的OTUs数量均高于对照土壤。说明重茬土壤经复合菌剂处理两年后,土壤中的细菌群落在数量上已经恢复到正常水平,甚至略高于对照,但在统计学上还未达到显著水平。
|
|
图2
微生物菌剂处理后OTUs数量分析
Figure 2
Analysis of OTUs after the treatment with complex microbial agent
注:1:菌处理20 cm土层;2:对照20 cm土层;3:菌处理50 cm土层;4:对照50 cm土层;5:菌处理(不分土层);6:对照(不分土层).
Note: 1: 20 cm soil layer of microbial inoculant treatment; 2: 20 cm soil layer of the normal control; 3: 50 cm soil layer of microbial inoculant treatment; 4: 50 cm soil layer of the normal control; 5: Microbial inoculant treatment (regardless of soil layer); 6: The normal control (regardless of soil layer). |
为了观察菌剂处理后不同深度土层中的微生物响应变化,采样时分别取了20 cm和50 cm两个土层。从图2可以看出复合菌剂处理的20 cm土层和50 cm土层OTUs数量分别为221个和213个,二者差别仅8个;对照的两个土层中的OTUs数量也仅相差8个。说明20 cm土层和50 cm土层细菌在数量上没有明显差异。因此,若不分土层,统计得到复合菌剂处理后的土壤中OTUs总数为250,略高于对照(234),经One-Way ANOSIM法分析得到二者差异系数P为0.108 3,在0.05水平上差异不显著。
Shannon-Weiner指数包含两方面的意义:物种数和各个物种在分配上的均匀性。因此,常用Shannon-Weiner指数来比较群落间的物种多样性。从图3可以看出,在20 cm和50 cm两种土层深度样品中,复合菌剂处理的Shannon-Weiner指数均高于对照。说明采用复合菌剂进行土壤处理后,重茬土壤中的细菌群落多样性能够有效提高,经过两年时间能够恢复到比非重茬土壤细菌多样性稍高的水平,但单因素方差分析表明各土层多样性指数在统计学上差异不显著。因此,若不分土层,统计得到复合菌剂处理后的土壤中Shannon-Weiner指数为4.44,高于对照(3.81),经One-Way ANOSIM法分析得到二者差异系数P为0.084 3。

|
|
图3
微生物菌剂处理后Shannon-Weiner指数分析
Figure 3
Analysis of Shannon-Weiner indexes after compound microbial inoculant treatment
注:1:菌处理20 cm土层;2:对照20 cm土层;3:菌处理50 cm土层;4:对照50 cm土层;5:菌处理(不分土层);6:对照(不分土层).
Note: 1: 20 cm soil layer of microbial inoculant treatment; 2: 20 cm soil layer of the normal control; 3: 50 cm soil layer of microbial inoculant treatment; 4: 50 cm soil layer of the normal control; 5: Microbial inoculant treatment (regardless of soil layer); 6: The normal control (regardless of soil layer). |
虽然2.2的结果表明复合菌剂处理后的重茬土壤在经过两年恢复后,拥有与正常土壤相似的物种丰富度和多样性指数,但这还不能充分说明经微生物复合制剂处理后的重茬土壤与正常土壤间的细菌菌群结构完全一样。为此,对两种处理的核心OTUs进行了更为细致的分析。试验中将丰度>0.5%的OTUs定义为核心OTUs (或优势菌)。它们在群落中的地位是:数量上占一定优势;且是固定的,被检测到的频率非常高;它们的平衡稳定与群落的整体生态功能息息相关。
如图4所示,试验中复合菌剂处理共统计出152个核心OTUs,对照非重茬土壤中共统计出128个核心OTUs,二者共有的核心OTUs有89个。复合菌剂处理后的优势菌数量多于对照。根据Jaccard相似性系数算法,Cs取值0−0.25时,为极不相似;Cs取值0.25−0.75时,为中等相似;Cs取值0.75−1.00时,为极相似[11]。按照两个群落中共同拥有物种的多少来计算,二者的Jaccard群落相似性系数为0.47,处于中等相似水平。说明经复合菌剂处理两年后,土壤细菌种群结构发生改变,重茬土壤与非重茬土壤中的核心细菌类群拥有中等程度的相似性。

|
| 图4 微生物菌剂处理后重茬土与新茬土核心OTUs分析 Figure 4 Analysis of core and specific OTUs in treated and normal control soils |
全文主要讨论复合微生物菌剂处理对重茬果园土壤微生物多样性的影响,研究它的最终目的是要让受损的重茬土壤恢复健康。在植物-微生物-土壤共同构成的三角关系中,土壤微生物是土壤品质的重要方面,无法肉眼观察,但是可以通过植物的生长状况来侧面感知。因此,本文也同时调查了重茬果园和非重茬果园的果苗成活率及树体生长状况。
重茬果园土壤处理后即定植秦星苹果树,处理组和对照组的果苗成活率均为100%。表1是定植后第2年(2013年)菌剂处理组和对照组苹果树树体生长指标。可以看出,复合菌剂处理后两年,重茬果园的各项树体生长指标均高于非重茬果园,且干周长、中心干抽生新枝数、新梢长和每株新萌发的短枝数达到极显著差异,每株新萌发的中枝数和延长枝生长量差异显著,每株新萌发的长枝数在统计学上差异不显著。说明对重茬土壤进行复合微生物菌剂处理后,重茬果园的树体生长状况优于非重茬果园。
3 讨论许多研究表明,随着连作年限的延长,土壤中微生物多样性降低[13, 14],优势种群数量降低[15]或改变[16]。有效的抗重茬微生物菌剂应能够调节根区土壤微生物数量、组成和结构,对失衡的土壤微生态进行修复,使根域微环境有利于植物生长,减少重茬障碍的发生。付青霞等采用Biolog-Eco微平板法和DGGE研究施用添加了固氮菌、解磷菌、解钾菌的生物复混肥对猕猴桃果园土壤微生物群落的影响,发现生物复混肥处理的Shannon指数、Simpson指数、McIntosh指数均显著高于(LSD,P<0.05)其它化肥处理和不施肥处理,说明该生物复混肥能显著增加土壤微生物丰富度、优势度和均匀度[17]。赵兰凤等采用限制性片段长度多态性技术(RFLP)研究施用含有解磷菌、解钾菌和抗病功能菌的生物复混肥40 d后,香蕉枯萎病(一种严重的土传病原菌)发病指数降低,且该处理的土壤细菌OTU种类及丰富度都高于含有病原菌而不施肥处理,但低于不含病原菌的新茬土[18]。说明在短期施肥试验中,生物复混肥显示出防治枯萎病方面的优势,且提高了病土中的细菌多样性,但仍然低于新茬土。
本试验研究结果表明,经复合微生物菌剂处理两年后,重茬苹果园和新茬苹果园土壤OTUs总数分别为250和234,Shannon-Weiner指数分别为4.44和3.81,One-Way ANOSIM方差分析表明二者差异系数P分别为0.108 3和0.084 3。在0−20 cm土层与20−50 cm土层比较中,二者的微生物数量、Shannon-Weiner指数在统计学上差异不显著,这与赵国栋的研究结果相似,他指出黄土高原苹果根系土壤细菌、放线菌、真菌集中分布于0−40 cm土层[19]。另外,本试验中复合菌剂处理后重茬苹果园土壤中的优势菌数量多于新茬园,且二者共有的核心OTUs有89个,Jaccard群落相似性系数为0.47,相似程度中等。重茬果园的各项树体生长指标均高于非重茬果园,干周长、中心干抽生新枝数、新梢长和每株新萌发的短枝数达到极显著差异。表明在长达两年的试验中,复合微生物菌剂处理在恢复重茬苹果园土壤细菌群落多样性、提高优势菌群方面具有明显作用,在防治苹果重茬病害方面具有应用潜力。
从研究方法的角度来看,研究微生物群落结构的方法主要包括培养法、基于16s rRNA基因的分子指纹图谱法、基于代谢的Biolog微平板法、高通量测序等。每种方法都有各自的适用范围及优缺点,且随着分子生物学日新月异的蓬勃发展,曾经的“新技术”很快就面临淘汰。比如曾被世界各地实验室广泛使用的DGGE,为群落微生物的研究做出了很大的贡献。但随着自动毛细管电泳的出现,DGGE繁复的操作过程、重现性差、分离的条带数量少、涵盖的信息量有限等问题凸显,人们在群体微生物多样性研究方面更多的选择ARISA方法,它具有自动化程度高、操作更简单、重现性好、分离的条带多、更准确反应样本中的微生物多样性的特点。尤其是在微生物多样性很高、且样本数量又很多的试验中,ARISA方法是快速了解群落多样性的最合适方法。但是,ARISA方法最大的遗憾就是不能切胶测序,对后续深入的试验可能会有影响。因此,在实际中应根据研究目的将各种方法结合使用。Cherif等采用DGGE和ARISA两种方法研究了经城市固体垃圾堆肥改良后的农田土壤细菌群落多样性,并比较了这两种方法的优缺点,也得到了上述观点[20]。当然,倘若高通量测序的成本还能持续降低,在不久的将来,高通量测序将是大趋势。本研究首次将ARISA方法应用于微生物菌剂处理对重茬果园土壤细菌群落的影响研究,为快速评估复杂环境中的微生物多样性做出新的尝试。
| [1] | Xue C,Huang QW,Ling N,et al. Analysis,regulation and high-throughput sequencing of soil microflora in mono-cropping system[J]. Acta Pedologica Sinica,2011,48(3): 612-618 (in Chinese) 薛超,黄启为,凌宁,等. 连作土壤微生物区系分析、调控及高通量研究方法[J]. 土壤学报,2011,48(3): 612-618 |
| [2] | Wang GH,Jin J,Xu MN,et al. Effects of plant,soil and soil management on soil microbial community diversity[J]. Chinese Journal of Ecology,2006,25(5): 550-556 (in Chinese) 王光华,金剑,徐美娜,等. 植物、土壤及土壤管理对土壤微生物群落结构的影响[J]. 生态学杂志,2006,25(5): 550-556 |
| [3] | Shiomi Y,Nishiyama M,Onizuka T,et al. Comparison of bacterial community structures in the rhizoplane of tomato plants grown in soils suppressive and conductive towards bacterial wilt[J]. Applied and Environmental Microbiology,1999,65(9): 3996-4001 |
| [4] | Qiu DW. Current status and development strategy for biological control of plant diseases in China[J]. Plant Protection,2010,36(4): 15-18 (in Chinese) 邱德文. 我国植物病害生物防治的现状及发展策略[J]. 植物保护,2010,36(4): 15-18 |
| [5] | Tan ZZ,Liu KX,Liao ZW. The effect of BHA on soil microbial diversity and controlling bacterial wilt of tomato[J]. Humic Acid,2005(6): 23-27 (in Chinese) 谭兆赞,刘可星,廖宗文. 生化腐植酸对土壤微生物多样性及番茄青枯病的影响[J]. 腐植酸,2005(6): 23-27 |
| [6] | Xiao Y,Wang XX,Wang HW,et al. The effects of the addition of Ceratobasidum stevensii B6 and its growth on the soil microflora at a continuously cropped watermelon (Citrullus lanatus) site in China[J]. Acta Ecologica Sinica,2012,32(4): 1185-1192 (in Chinese) 肖逸,王兴祥,王宏伟,等. 施加角担子菌B6对连作西瓜土壤微环境和西瓜生长的影响[J]. 生态学报,2012,32(4): 1185-1192 |
| [7] | EM菌剂对甜樱桃幼苗根际微生物区系及根系呼吸的影响[J]. 沈阳农业大学学报,2013,44(4): 409-412 Kong QY,Qin SJ,Zhang YX,et al. Effects of EM on rhizosphere microbiota and root respiration of Cerasus avium moench. Seedling[J]. Journal of Shenyang Agricultural University,2013,44(4): 409-412 (in Chinese) 孔庆宇,秦嗣军,张英霞,等. |
| [8] | Cao QF,Meng YP,Sun HF,et al. Compound microbial inoculan and it’s application methods to prevent the fruit tree’s replantation disease: China,201310124682[P]. 2013-04-11 (in Chinese) 曹秋芬,孟玉平,孙海峰,等. 防治果树再植病的复合微生物菌剂及其防病方法: 中国,201310124682[P]. 2013-04-11 |
| [9] | Yu Z,Morrison M. Improved extraction of PCR-Quality community DNA from digesta and fecal samples[J]. Biotechniques,2004,36(5): 808-812 |
| [10] | Sun HF,Jami E,Harpaz S,et al. Involvement of dietary salt in shaping bacterial commuunities in European sea bass (Dicentrarchus labrax)[J]. Scientific Reports,2013,3: 1558 |
| [11] | Jaccard P. Étude comparative de la distribution florale dans une portion des Alpes et des Jura[J]. Bulletin del la Société vaudoise des Sciences Naturelles,1901,37(142): 547-579 |
| [12] | Wang JB,Meng YP,Cao QF. Experiment of replanted apple’s cultivation techniques for high yield and fine quality[J]. China Fruits,2014(5): 17-19 (in Chinese) 王建斌,孟玉平,曹秋芬. 重茬苹果园早果丰产优质栽培试验[J]. 中国果树,2014(5): 17-19 |
| [13] | Hu YS,Liu YF,Wu K,et al. Variation of microbial community structure in relation to successive cucumber cropping soil[J]. Chinese Journal of Soil Science,2006,37(1): 126-129 (in Chinese) 胡元森,刘亚峰,吴坤,等. 黄瓜连作土壤微生物区系变化研究[J]. 土壤通报,2006,37(1): 126-129 |
| [14] | Wu FZ,Wang XZ. Effect of monocropping and rotation on soil microbial community diversity and cucumber yield,quality under protected cultivation[J]. Scientia Agricultura Sinica,2007,40(10): 2274-2280 (in Chinese) 吴凤芝,王学征. 设施黄瓜连作和轮作中土壤微生物群落多样性的变化及其与产量品质的关系[J]. 中国农业科学,2007,40(10): 2274-2280 |
| [15] | Li K,Guo XW,Sun YN,et al. Effects of grape-replanting on soil bacterial and fungal populations[J]. Chinese Journal of Applied Ecology,2009,20(12): 3109-3114 (in Chinese) 李坤,郭修武,孙英妮,等. 葡萄连作对土壤细菌和真菌种群的影响[J]. 应用生态学报,2009,20(12): 3109-3114 |
| [16] | Zhu YB,Shi FY,Zhang RJ,et al. Comparison of bacterial diversity in rotational and continuous soybean cropping soils in Heilongjiang[J]. Acta Phytophylacica Sinica,2014,41(4): 403-409 (in Chinese) 朱英波,史凤玉,张瑞敬,等. 黑龙江大豆轮作和连作土壤细菌群落多样性比较[J]. 植物保护学报,2014,41(4): 403-409 |
| [17] | Fu QX. Effects of BIO-compound fertilizer on fruit quality of kiwifruit and soil micro-ecology[D]. Yangling: Master’s Thesis of Northwest A & F University,2014 (in Chinese) 付青霞. 生物复混肥对猕猴桃果实品质及果园土壤微生态的影响[D]. 杨凌: 西北农林科技大学硕士学位论文,2014 |
| [18] | RFLP法研究生物复混肥及香蕉枯萎病对土壤细菌群落多样性的影响[J]. 中国生物防治学报,2013,29(3): 406-416 Zhao LF,Zhang LJ,Hu W,et al. Effects of bio-compound fertilizer on banana wilt and soil bacterial community based on analysis with RFLP[J]. Chinese Journal of Biological Control,2013,29(3): 406-416 (in Chinese) 赵兰凤,张丽娟,胡伟,等. |
| [19] | Zhao GD. The growth and declining of soil microbe amount in root zone and their influence to the plant replantation in the apple orchard of loess plateau[D]. Yangling: Master’s Thesis of Northwest A & F University,2008 (in Chinese) 赵国栋. 黄土高原苹果园根区土壤微生物消长变化及对植株再植的影响[D]. 杨凌: 西北农林科技大学硕士学位论文,2008 |
| [20] | Cherif H,Ouzari H,Marzorati M,et al. Bacterial community diversity assessment in municipal solid waste compost amended soil using DGGE and ARISA[J]. World Journal of Microbiology and Biotechnology,2008,24(7): 1159-1167 |
 2016, Vol. 43
2016, Vol. 43