扩展功能
文章信息
- 吴杨芳, 冯骞, 薛朝霞, 杨雯, 施明杰
- WU Yang-Fang, FENG Qian, XUE Zhao-Xia, YANG Wen, SHI Ming-Jie
- 纳米氧化铈作用下活性污泥胞外聚合物及溶解性微生物产物特性
- Characterization of extracellular polymeric substance and soluble microbial products under impact of CeO2 nanoparticles
- 微生物学通报, 2016, 43(2): 262-269
- Microbiology China, 2016, 43(2): 262-269
- 10.13344/j.microbiol.china.150703
-
文章历史
- 收稿日期: 2015-09-16
- 接受日期: 2015-11-26
- 优先数字出版日期(www.cnki.net): 2015-12-01
2. 河海大学 浅水湖泊综合治理与资源开发教育部重点实验室 江苏 南京 210098
2. Key Laboratory of Integrated Regulation and Resource Development on Shallow Lakes, Ministry of Education, Hohai University, Nanjing, Jiangsu 210098, China
纳米氧化铈(CeO2 nanoparticles)是一种廉价的纳米稀土材料,自20世纪90年代以来,因其良好的储氧、释氧功能及氧化还原反应能力,在磨料、燃油添剂、紫外线吸收剂或抗氧化剂、气体传感器、离子薄膜等领域得到了广泛的应用[1, 2, 3]。然而在纳米氧化铈等人工纳米材料不断推广应用的同时,其环境效应也得到了越来越多的重视。相关研究显示,与纳米TiO2、纳米Ag和纳米Au相比,纳米CeO2对污水处理中的微生物抑制作用更强。地表水中1−100 nmol/L的纳米CeO2就可对环境生物[植物种子、水蚤(Daphnia pulex)、模糊网绞蚤(Ceriodaphnia)等]产生不利影响[4, 5, 6]。活性污泥系统中的异养菌和亚硝化细菌在短期接触纳米CeO2后,即可表现出较为明显的抑制效应,且抑制程度随浓度和接触时间的增加而增加[7]。因此,纳米CeO2在2008年就被世界经济合作与发展组织(OECD)列为优先监测的13种工程纳米材料之一[8]。
胞外聚合物(Extracellular polymeric substance,EPS)是存在于细胞外及微生物聚集体外,由微生物分泌或大分子细胞溶解、水解产生的一种高分子量化合物,通常含有蛋白质、多糖、腐殖质、少量的脂类和DNA等,根据其空间位置的不同,可分为紧密附着在细胞壁上的胞囊聚合物TB-EPS和以胶体和溶解状态松散于液相主体中的黏性聚合物LB-EPS。溶解性微生物产物(Soluble microbial products,SMP)则是微生物在降解污染物的同时,通过细胞裂解、细胞膜扩散、合成代谢损失等方式向周围环境中释放出的溶解性物质。由于微生物在毒性物质刺激下会通过分泌EPS形成对微生物的保护,而SMP中基质利用相关型产物生成速率与基质的分解速度成正比,生物量相关型产物生成速率与生物量水平成正比,因此这两类微生物代谢产物含量的变化,能够有效地体现毒性物质对基质降解、细胞生长、裂解、衰亡等微生物代谢过程的影响。Mu等[9]研究了纳米ZnO对污水处理中厌氧颗粒污泥的影响,结果表明10 mg/g TSS和50 mg/g TSS纳米ZnO并未对厌氧颗粒污泥中EPS组分及含量产生影响,当纳米ZnO剂量增加至200 mg/g TSS,EPS中的蛋白质、DNA、腐殖酸、脂类含量显著降低,而多糖含量未出现明显变化。Tan等[10]对活性污泥系统的研究表明,当纳米ZnO暴露浓度为1 mg/L时,随暴露时间的增加SMP的含量不断提高,蛋白质和多糖分别比初始时增加了44.5 mg/g MLVSS (70 d)和 33.3 mg/g MLVSS (100 d)。
相关研究已经证实,一定浓度的人工纳米材料能够显著改变微生物的代谢行为,影响微生物代谢产物中EPS和SMP的组分及含量。但目前的研究中,关于纳米氧化铈作用下活性污泥微生物代谢产物的研究仍然十分有限,尤其在纳米氧化铈作用下EPS分层组分的研究和SMP的特性分析方面。鉴于此,本文拟以实验室培养的厌氧-好氧活性污泥为对象,通过实验室小试,考察不同纳米氧化铈短期作用下活性污泥胞外聚合物分层组分含量的变化,比较溶解性微生物产物的差异,并利用三维荧光光谱对其特性进行分析,在此基础上尝试从代谢产物的角度进一步解读纳米氧化铈对活性污泥微生物的影响过程和机制。
1 材料与方法 1.1 试验材料纳米CeO2购于上海晶纯生化科技股份有限公司。称取100 mg纳米CeO2置于1 L超纯水(pH 6.9)超声1 h (25 °C,250 W,40 kHz),其悬浮液即为100 mg/L纳米CeO2悬浮液,悬浮液经动态光散射(Malvern Instruments Ltd.,UK)分析得平均粒径为70−150 nm。
试验过程中采用模拟生活污水进行污泥培养、驯化,进而开展试验研究。其中模拟生活污水以无水乙酸钠为碳源,NH4Cl为氮源、KH2PO4为磷源,并添加一定比例的其他微量元素。具体配水成分浓度如下(mg/L):污水乙酸钠385,NH4Cl 120,KH2PO4 24,CaCl2∙2H2O 30,MgSO4∙7H2O 20;此外还包括0.5 mL/L微量元素混合液。微量元素混合液组成浓度如下(mg/L):H3BO3 2.0,FeCl2·4H2O 2.0,EDTA (乙二胺四乙酸) 2.0,ZnCl2·4H2O 0.4,MnCl2·4H2O 0.8,(NH4)6MO7·4H2O 1.1,CuCl2·2H2O 0.2,NiCl2·6H2O 1.0。接种污泥取自南京江宁污水厂二沉池。试验前用蒸馏水冲洗接种污泥数遍后,曝气10 h,以去除原有基质对试验的影响。
1.2 试验方法试验开始前,先在反应器中进行污泥驯化培养。反应器运行周期为8 h,包括进水10 min,厌氧搅拌2 h,好氧曝气4 h,沉淀1 h,排水10 min,闲置40 min。污泥龄控制在15 d左右,排水比为50%。当系统的COD、氨氮和磷去除率分别稳定在90%、95%和85%以上时,认为系统进入稳定运行期。在稳定运行期,沉淀结束后从反应器中取出等量活性污泥,加入5个500 mL的平行烧杯中,再加入等量原水,使混合液悬浮固体浓度(MLSS)约为3 000 mg/L。向反应器中同时加入纳米CeO2悬浮液,使得反应器中浓度依次为1、10、25、50 mg/L,不投加纳米CeO2的反应器作为空白样,以厌氧-好氧方式运行6 h。运行结束后,测试出水中SMP的组分含量,同时检测活性污泥中EPS分层组分及含量,在此基础上,利用三维荧光光谱EEM,Hitachi,F7000对SMP和EPS进行分析。
1.3 分析方法SMP的测定方法参考Ni等[11]的研究。取10 mL 污泥悬浮液,2 325×g离心10 min,上清液经过0.45 μm滤膜过滤,用作SMP含量测定。
EPS提取方法参考Liang等[12]的研究。干污泥用超纯水恢复至10 mL,向悬浮液加0.06 mL甲酰胺(37%),在恒温振荡器中提取1 h (150 r/min,4 °C),取出离心15 min (5 000×g,4 °C),上清液经0.45 μm滤膜过滤,即为LB-EPS。上述底泥经磷酸缓冲液恢复至10 mL,加入CER后在恒温振荡器中振荡1 h (150 r/min,4 °C),取出离心15 min (10 000×g,4 °C),上清液经0.45 μm滤膜过滤,即为TB-EPS。
LB-EPS、TB-EPS以及SMP中的多糖采用蒽酮比色法[13]测定,以葡萄糖作为标准;蛋白质和腐殖酸采用改进Lowry法测定[14],分别以牛蛋白清与腐殖酸作为标准。提取得到的EPS和SMP采用荧光光谱的激发波长和发射波长范围均为200−700 nm,增量均为10 nm;激发和发射狭缝设为2.5 nm,扫描速度12 μm/min。采用Origin 8.5处理三维荧光光谱数据。
2 结果与讨论 2.1 纳米CeO2对胞外聚合物含量和组分的影响表1表明不同浓度纳米CeO2作用下胞外聚合物的分层组分与含量的变化。从表1可以看出,在纳米CeO2的短期作用下,EPS总量随着纳米CeO2浓度的增加逐渐提高。当纳米CeO2浓度为1 mg/L时,EPS总量与对照组基本相当。增加纳米CeO2浓度至10、25和50 mg/L时,相比对照组EPS总量增幅分别为4.12%、4.64%和15.29%。分析EPS中TB-EPS和LB-EPS的变化不难看出,在纳米CeO2的短期作用下,随浓度增加LB-EPS的增幅显著高于TB-EPS增幅。1 mg/L和10 mg/L纳米CeO2的短期作用下,纳米CeO2对LB-EPS、TB-EPS含量并未出现明显变化。当纳米CeO2浓度增加到25 mg/L时,LB-EPS、TB-EPS含量呈现不同程度增加,相比对照组LB-EPS和TB-EPS增幅分别为13.8%和0.50%。纳米CeO2浓度增加至50 mg/L时,EPS分层组分含量呈现明显增加,LB-EPS和TB-EPS与对照组相比增幅分别达到39.77%和4.24%。
| CeO2 NPs (mg/L) | LB-EPS (mg COD/g VSS) | TB-EPS (mg COD/g VSS) | Total EPS (mg COD/g VSS) | ||||
| 蛋白质 Protein | 多糖Polysaccharide | 总量 Total | 蛋白质 Protein | 多糖 Polysaccharide | 总量 Total | ||
| 0 | 10.80±1.20 | 7.30±0.80 | 18.10 | 27.40±1.20 | 12.70±1.10 | 40.10 | 58.20 |
| 1 | 11.00±1.00 | 7.20±0.90 | 18.20 | 29.20±1.10 | 11.10±1.00 | 40.30 | 58.50 |
| 10 | 12.30±1.00 | 7.40±0.20 | 19.70 | 27.60±1.60 | 13.30±0.80 | 40.90 | 60.60 |
| 25 | 12.50±0.90 | 8.10±0.50 | 20.60 | 26.50±0.80 | 13.80±1.70 | 40.30 | 60.90 |
| 50 | 14.60±0.60 | 10.70±0.80 | 25.30 | 29.30±1.00 | 12.50±1.20 | 41.80 | 67.10 |
相关研究证实,蛋白质、多糖和腐殖质是活性污泥EPS中主要物质,其中蛋白和多糖约占EPS总量的70%−80%[15]。进一步对比不同浓度纳米CeO2作用下TB-EPS和LB-EPS中多糖和蛋白组分含量(表1)可知,TB-EPS中多糖和蛋白质含量随纳米CeO2浓度增加变化不显著,而LB-EPS中多糖和蛋白质含量随纳米CeO2浓度增加则出现了明显递增,且增加幅度也随浓度增大不断加大。
EPS在抵御毒性胁迫中发挥着重要作用。随着纳米CeO2浓度的增加,EPS分泌量的增加是活性污泥微生物对纳米CeO2产生环境刺激的典型应激反应。TB-EPS是紧密附着在细胞壁上,而比较松散没有明显边缘的黏液层LB-EPS位于外层。虽然TB-EPS是总EPS主要的组成部分,但由TB-EPS扩散的LB-EPS提供巨大的比表面积与纳米颗粒直接相接触,从空间上延缓了纳米颗粒进入TB-EPS和细胞体内,也使得纳米CeO2对LB-EPS的影响程度明显高于TB-EPS。SEM对EPS的观察也证实微生物的LB-EPS具有粗糙且呈蜂窝空洞状的表面,这种结构有利于吸附水中的有毒有害物质,从而有效保护生物膜中的微生物[16]。纳米CeO2作用下,多糖和蛋白质的增加也与活性污泥微生物抵抗毒性物质作用有关。由于较大粒径的纳米CeO2粒子更难进入细胞体内,因此微生物可以通过分泌更多的胞外蛋白质和胞外多糖改变颗粒带电性能,促进纳米颗粒聚集,进而借助增加纳米颗粒的粒径,减少纳米CeO2对活性污泥的毒性。FTIR的分析证实,多糖中的C−O−C和蛋白质酰胺I中C=O、C−N键和酰胺III中C−H在其中起到了重要的作用[17]。
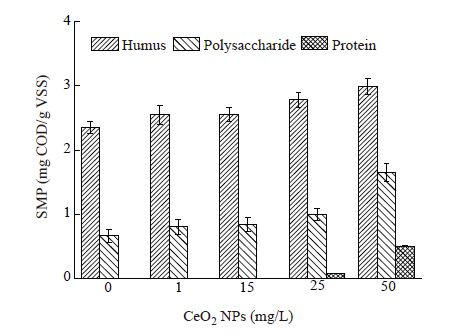
2.2 纳米CeO2对溶解性微生物产物的影响图1表明了不同浓度的纳米CeO2对SMP各组分含量的影响。从图1中可以看出,纳米CeO2浓度从0 mg/L增加到25 mg/L,SMP产量由3.01± 0.20 mg COD/g VSS增到3.84±0.21 mg COD/g VSS;进一步增加纳米CeO2浓度到50 mg/L,SMP产量由则达到5.14±0.27 mg COD/g VSS。Mei等[18]在研究纳米ZnO对MBR中微生物影响时,也发现了SMP产量随纳米ZnO浓度的增加而增加的现象。红外光谱分析显示,SMP产量的增加主要表现为有关蛋白质、多糖的氨基、酰胺基、羟基等官能团吸收峰强度的增长。进一步对比SMP中各组分变化程度不难看出,蛋白质和多糖的变化程度明显高于腐殖酸。与对照组相比,当纳米CeO2浓度为50 mg/L时,蛋白质浓度从0 mg COD/g VSS增加到0.5 mg COD/g VSS,多糖和腐殖酸则分别从0.66±0.10 mg COD/g VSS和2.35±0.10 mg COD/g VSS分别增加到1.65±0.14 mg COD/g VSS和2.99± 0.13 mg COD/g VSS,增幅分别为150%和27%。这一现象也说明,纳米CeO2的短期作用改变了微生物分泌产生SMP的过程,当浓度较高时,这种影响直接改变SMP的组分含量。此外,与EPS的变化相比,SMP对纳米CeO2毒性敏感程度高。
|
| 图1 不同纳米CeO2浓度对活性污泥微生物SMP的影响 Figure 1 Effects of different CeO2 NPs concentration on SMP of activated sludge |
根据统一理论的观点,EPS和SMP之间存在相互转化关系,溶解性的EPS实际上就是SMP,而SMP中微生物内源呼吸相关联的微生物产物(BAP)则源于EPS的水解[19]。因此,SMP中腐殖酸和多糖的增加,可归功于纳米CeO2刺激细胞分泌更多EPS的水解。由于低浓度的腐殖酸可以稳定纳米银悬浮液,高浓度则会诱导聚集[20]。当腐殖酸的浓度达到阈值后,纳米CeO2颗粒的毒性也因其尺寸的增加而降低。此外,部分纳米CeO2会被蛋白质中多肽吸附后相互作用达到稳定状态[21],也能在一定程度上减少纳米CeO2向细胞内的扩散。SMP产量的增加,也是微生物应对纳米材料毒性的除EPS分泌量增加外的另一种自主行为方式。
2.3 活性污泥微生物EPS和SMP的三维荧光光谱分析图2表明了不同浓度纳米CeO2投加下活性污泥微生物EPS和SMP的三维荧光光谱图。从图2A中均可观测到a、b和c三个荧光峰的存在,而图2B中则仅在纳米CeO2浓度25 mg/L以上时,观测到了荧光峰c的存在。相关研究表明[22],荧光峰a (270−280/350−370)为类溶解性微生物产物;荧光峰b (220−240/350−380)为芳香族蛋白I,主要由络氨酸引起;荧光峰c (230−240/350−370)为芳香族蛋白II,主要由色氨酸引起。进一步对比不同浓度下的荧光图谱,可以看出尽管不同浓度纳米CeO2的作用,会引起荧光峰位置细微的红移或蓝移现象,但并未出现荧光吸收峰重叠以及信号叠加的情况。这也反映出纳米CeO2的短期作用,没有改变EPS组分,仅改变了主要组分的含量;但高浓度纳米CeO2 (25 mg/L以上)的作用,使得SMP中蛋白组分发生了从无到有,从低到高的转变。本研究获得的结果与杨晓南等的研究一致[23],也从另一侧面验证了纳米材料不会改变EPS组分,只会改变其主要组分的含量。

|
| 图2 不同浓度纳米CeO2投加下EPS (a)和SMP (b)的荧光光谱图 Figure 2 Three-dimensional excitation-emission matrix fluorescence spectra of EPS and SMP at different CeO2 NPs concentration |
根据本研究的结果,结合前人相关研究,笔者利用纳米CeO2作用下活性污泥微生物主要代谢产物(EPS和SMP)监测,在充分认识EPS和SMP在活性污泥特性演变中重要作用的基础上,结合纳米CeO2进入细胞的途径,对纳米CeO2影响活性污泥微生物的过程和机制进行了初步探讨(图3)。

|
| 图3 纳米CeO2影响活性污泥微生物代谢产物的机制 Figure 3 The mechanism of activated microorganisms metabolites under impact of CeO2 NPs |
纳米CeO2进入废水处理系统中会发生以下作用:(1) 团聚;(2) 与其他混合物或微生物转化物反应;(3) 被EPS吸附。纳米CeO2进入污水系统后,会与水中存在的电解质离子和天然或人工有机质发生相互作用,会发生自团聚过程,形成水力学粒径较大的颗粒[24]。SMP中蛋白质和多糖的存在,也会改变纳米CeO2的表面性能,在静电力、范德华引力、氢键共价键的共同作用下,促使纳米CeO2进一步聚集。此外,微生物胞外聚合物的存在,也能够吸附纳米CeO2。Limbach等[21]的研究发现,当纳米CeO2浓度达到100 mg/L时,典型污水处理系统中大部分CeO2被吸附到活性污泥中。EPS的物理性屏障保护作用及其导致的延缓运输效应,使得污泥絮体中微生物细胞膜的完整性得以保存,也是微生物对待纳米CeO2毒性的应激反应。
低浓度纳米CeO2的短期作用下,随着纳米CeO2浓度的增加,EPS和SMP含量也会逐渐增大。由于纳米CeO2含量低,微生物细胞的EPS吸附作用,加上SMP中多糖、蛋白质的促团聚作用,已经足以抵御纳米CeO2带来的影响。但当纳米CeO2的浓度超过一定阈值后,随着纳米CeO2浓度的增加,EPS和SMP的作用不足以抵抗纳米CeO2的冲击。为减弱这种毒性对微生物细胞的影响,活性污泥微生物一方面借助大量产生的SMP与纳米CeO2的反应,增大纳米CeO2的颗粒尺寸,减少其质量浓度,减轻外部毒性作用;另一方面,则通过分泌更多的EPS,在细胞表面形成更厚的保护屏障,延缓纳米CeO2通过被动扩散、跨膜以及通过破损的细胞膜扩散等进入细胞体的速度。
3 讨论(1) 低浓度纳米CeO2 (25 mg/L以下)的短期作用,不会导致活性污泥中LB-EPS、TB-EPS含量的显著改变。高浓度纳米CeO2 (50 mg/L)的短期作用,能显著提高EPS分层组分含量,且LB-EPS的增幅显著高于TB-EPS增幅;LB-EPS中多糖和蛋白质含量的增加是导致EPS增加的主要因素。
(2) 低浓度纳米CeO2 (25 mg/L以下)的短期作用,SMP含量组分没有显著改变,当浓度25 mg/L以上时,SMP不仅出现蛋白质,多糖和腐殖酸的含量也明显增加。纳米CeO2的短期作用改变了微生物分泌产生SMP的过程,当浓度较高时,这种影响直接改变SMP的组分含量。
(3) 活性污泥微生物EPS和SMP的三维荧光光谱结果可知,试验浓度下纳米CeO2的短期投加并未改变EPS的组分,仅改变了其主要组分的含量;而25 mg/L以上纳米CeO2的作用,使得SMP中出现了蛋白质。这也说明出SMP对纳米CeO2毒性的敏感程度高于EPS,可用于纳米材料毒性的指示。
(4) 纳米CeO2进入废水处理系统中会发生团聚、与其他混合物或微生物转化物反应和被EPS吸附作用。其中EPS的物理性屏障保护作用及其导致的延缓运输效应,使得污泥絮体中微生物细胞膜的完整性得以保存,SMP中多糖和蛋白质与纳米CeO2的反应,则一方面促进了纳米CeO2的团聚,另一方面减少了水体中纳米CeO2的浓度。EPS和SMP的共同作用,构成了微生物细胞对纳米CeO2的毒性抵抗机制。
| [1] | Laberty-Robert C,Long JW,Lucas EM,et al. Sol-gel-derived ceria nanoarchitectures: synthesis,characterization,and electrical properties[J]. Chemistry of Materials,2006,18(1): 50-58 |
| [2] | Perez JM,Asati A,Nath S,et al. Synthesis of biocompatible dextran-coated nanoceria with pH-dependent antioxidant properties[J]. Small,2008,4(5): 552-556 |
| [3] | Tarnuzzer RW,Colon J,Patil S,et al. Vacancy engineered ceria nanostructures for protection from radiation-induced cellular damage[J]. Nano Letters,2005,5(12): 2573-2577 |
| [4] | Keller AA,McFerran S,Lazareva A,et al. Global life cycle releases of engineered nanomaterials[J]. Journal of Nanoparticle Research,2013,15(6): 1692 |
| [5] | Tiede K,Hassellöv M,Breitbarth E,et al. Considerations for environmental fate and ecotoxicity testing to support environmental risk assessments for engineered nanoparticles[J]. Journal of Chromatography A,2009,1216(3): 503-509 |
| [6] | Zhang HF,He XA,Zhang ZY,et al. Nano-CeO2 exhibits adverse effects at environmental relevant concentrations[J]. Environmental Science & Technology,2011,45(8): 3725-3730 |
| [7] | García A,Delgado L,Torà JA,et al. Effect of cerium dioxide,titanium dioxide,silver,and gold nanoparticles on the activity of microbial communities intended in wastewater treatment[J]. Journal of Materials,2012,199/200: 64-72 |
| [8] | Anonymous. Nanotechnology consumer product inventory[Z]. Washington,DC: Project on Emerging Nanotechnologies,Woodrow Wilson International Center or Scholars and the Pew Charitable Trusts,2011. http://www.nanotechproject.org/ comsumerproducts |
| [9] | Mu H,Zheng X,Chen YG,et al. Response of anaerobic granular sludge to a shock load of zinc oxide nanoparticles during biological wastewater treatment[J]. Environmental Science & Technology,2011,46(11): 5997-6003 |
| [10] | Tan M,Qiu GL,Ting YP. Effects of ZnO nanoparticles on wastewater treatment and their removal behavior in a membrane bioreactor[J]. Bioresource Technology,2015,185: 125-133 |
| [11] | Ni BJ,Rittmann BE,Yu HQ. Soluble microbial products and their implications in mixed culture biotechnology[J]. Trends in Biotechnology,2011,29(9): 454-463 |
| [12] | Liang ZW,Li WH,Yang SY,et al. Extraction and structural characteristics of extracellular polymeric substances (EPS),pellets in autotrophic nitrifying biofilm and activated sludge[J]. Chemosphere,2010,81(5): 626-632 |
| [13] | Dubois M,Gilles KA,Hamilton JK,et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3): 350-356 |
| [14] | Lowry OH,Rosebrough NJ,Farr AL,et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry,1951,193(1): 265-275 |
| [15] | Dignac MF,Urbain V,Rybacki D,et al. Chemical description of extracellular polymers: implication on activated sludge floc structure[J]. Water Science and Technology,1998,38(8/9): 45-53 |
| [16] | Hou WJ,Ma ZQ,Sun LL,et al. Extracellular polymeric substances from copper-tolerance Sinorhizobium meliloti immobilize Cu2+[J]. Journal of Hazardous Materials,2013,261: 614-620 |
| [17] | Hou J,Miao LZ,Wang C,et al. Effect of CuO nanoparticles on the production and composition of extracellular polymeric substances and physicochemical stability of activated sludge flocs[J]. Bioresource Technology,2015,176: 65-70 |
| [18] | Mei XJ,Wang ZW,Zheng X,et al. Soluble microbial products in membrane bioreactors in the presence of ZnO nanoparticles[J]. Journal of Membrane Science,2014,451: 169-176 |
| [19] | 黄兴. MBR中EPS,SMP和生物多样性的研究[D]. 天津: 天津大学硕士学位论文,2008 Huang X. Research on EPS,SMP and biodiversity in membrane biological reactor[D]. Tianjin: Master’s Thesis of Tianjin University,2008 (in Chinese) |
| [20] | Furman O,Usenko S,Lau BLT. Relative importance of the humic and fulvic fractions of natural organic matter in the aggregation and deposition of silver nanoparticles[J]. Environmental Science & Technology,2013,47(3): 1349-1356 |
| [21] | Limbach LK,Bereiter R,Müller E,et al. Removal of oxide nanoparticles in a model wastewater treatment plant: influence of agglomeration and surfactants on clearing efficiency[J]. Environmental Science & Technology,2008,42(15): 5828-5833 |
| [22] | Chen W,Westerhoff P,Leenheer JA,et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology,2003,37(24): 5701-5710 |
| [23] | Yang XN,Cui FY,Guo XC,et al. Effects of nanosized titanium dioxide on the physicochemical stability of activated sludge flocs using the thermodynamic approach and Kelvin probe force microscopy[J]. Water Research,2013,47(12): 3947-3958 |
| [24] | 马偲. 水中纳米颗粒的自团聚及与藻细胞的异团聚[D]. 杭州: 浙江大学硕士学位论文,2014 Ma S. Homo-aggregation and hetero-agglomeration with algal cells of nanoparticles in water[D]. Hangzhou: Master’s Thesis of Zhejiang University,2014 (in Chinese) |
 2016, Vol. 43
2016, Vol. 43