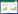扩展功能
文章信息
- 王娟娟, 张宇, 付娜, 康凯璇, 李晓晨, 邓学峰, 韩雨曦, 赵静
- WANG Juan-Juan, ZHANG Yu, FU Na, KANG Kai-Xuan, LI Xiao-Chen, DENG Xue-Feng, HAN Yu-Xi, ZHAO Jing
- 超低渗油藏微生物吞吐技术的矿场试验
- Microbial huff and puff field trial in ultra-low permeability reservoir
- 微生物学通报, 2016, 43(2): 241-253
- Microbiology China, 2016, 43(2): 241-253
- 10.13344/j.microbiol.china.150380
-
文章历史
- 收稿日期: 2015-05-11
- 接受日期: 2015-09-08
- 优先数字出版日期(www.cnki.net): 2015-11-06
2. 中国石油化工股份有限公司华北油气分公司工程技术管理部 河南 郑州 450006;
3. 大连奥普森生物工程有限公司研发中心 辽宁 大连 116023
2. Department of Engineering Technology Management, Gas and Oil North China Branch, Sinopec, Zhengzhou, Henan 450006, China;
3. R&D Center, Dalian OPUS Bioeng Co., Ltd., Dalian, Liaoning 116023, China
国内低渗油田石油地质储量丰富,渗透率小于50×10−3 μm2的非稠油低渗透未动用储量占全国未动用储量总数的50%以上[1]。低渗油田虽然储层地质条件差、有效开发难度大,但随着各国经济的高速发展,对石油产品的依赖和需求也越来越大,因此高效经济地开发低渗油田石油地质储量成为国际能源领域的研究热点[2]。影响超低渗油藏开发效果的主要因素分为以下几点[3, 4]:(1) 储层孔喉较小,比表面积大,导致渗透率低;(2) 渗流规律不遵循达西定律,为非达西流特征,启动压力梯度大;(3) 以消耗天然能量的方式开采,地层压力下降快,产量急剧递减;(4) 注水开采见效慢,产量上升不显著;(5) 油井见水后产液及产油指数大幅降低,提液及稳产难度大;(6) 砂岩油藏发生水窜、水淹现象严重。
微生物采油技术(Microbial enhanced oil recovery,MEOR)是利用微生物菌种在油藏中生长繁殖以及代谢产生的生物活性物质,改善油藏润湿性、乳化原油、降低原油粘度、降低流动阻力,从而提高原油采收率[5, 6, 7]。MEOR具有成本低廉、工艺简单、环境友好等优势,成为三次采油技术(化学驱、气驱、热力驱和微生物驱)中重要的一个领域而在国内外广泛应用[8, 9]。我国在低/超低渗油田开发中,积累了大量的MEOR理论基础和实践经验。大庆油田[10, 11]利用以短短芽孢杆菌和蜡状芽孢杆菌为主的配伍菌,开展了微生物吞吐和微生物驱现场试验,截止到2012年底,应用MEOR增产原油达12×104 t,其中微生物单井吞吐518口,累计增油6.30×104 t,实施微生物驱和调驱项目10项(45个井组),累计增油5.70×104 t,为大庆油田稳产发挥了重要作用。胜利油田[12]从1995年开始开展微生物采油技术研究,是我国目前规模最大的MEOR试验先导区,先后在7个区块开展了不同方式的微生物现场试验,已累计增油17.20×104 t。长庆油田[13]在鄂尔多斯盆地延安组A油田实施10个井组的微生物采油措施,对应生产井40口,见效井32口,措施有效率80%。截止2014年10月已累计增油4 340.11 t,平均单井增油118.89 t,综合含水由93.28%下降至75.80%,综合递减由15.70%下降至2.50%,收到了非常明显的效果。安塞油田[14]平均空气渗透率仅为1.29×10−3 μm2,有效孔隙度为12.40%,油井平均产能2 t/d,是典型的特低渗油藏。在王窑区块开展复合内源微生物驱油在低渗油藏的应用研究,12个注采井组现场试验年累计增油超过5 070 t,累计降水超过9 000 m3,投入产出比达到1:5.9。
渭北油田位于陕西省铜川市宜君县北部山区,构造上分布于鄂尔多斯盆地伊陕斜坡东南部,是典型的中生界致密低渗油藏,含油面积339.80 km2,石油储量为1.07×108 t。主力开发层长3的孔隙度为3.64%−15.72%,平均12.78%,渗透率为(0.33−1.59)×10−3 μm2,平均0.71×10−3 μm2,属于典型的浅层、常温、低压、致密低渗油藏,由于其特殊的储层物性,地层能量低,采用消费式开采方式导致压力下降快,造成产能递减快,开发难度加大[15]。如渭北某代表井初期日产液19.56 t,日产油7.82 t,含水率60%;生产115 d后,日产液下降到2.57 t,日产油下降到0.78 t,含水率69.80%,动液面为621 m,产量递减达90%。同时原油含蜡量相对较高,平均约为14%,随着开采过程蜡质不断析出,导致原油粘度升高,流度降低,单纯依靠弹性开采时油田采收率较低。针对渭北油田超低渗透浅层油藏的特性及原油物性,本文通过研究内源微生物的理化性质及功能特征,利用复配的内源-外源微生物体系来实施单井吞吐工艺,实现原位乳化降粘、降解原油中的蜡质、降低原油凝固点,提高原油的流动性,达到提高单井产量的效果,本项研究为开发适合于致密低渗透油藏的绿色生物采油体系,使其能高效、持久、稳定地发挥采油作用提供新的思路和技术支撑。
1 材料与方法 1.1 试验材料 1.1.1 试剂与仪器:葡萄糖、NaCl、NH4Cl、K2HPO4·12H2O、KH2PO4、CaCl2、FeSO4·7H2O、MnSO4、CuSO4·5H2O、琼脂粉、NaOH和HCl等购于天津市科密欧化学试剂开发中心,均为分析纯。NOVEL,N117M三目生物显微镜;JEM-2100,200 kV六硼化镧透射电子显微镜,中国科学院大连化学物理研究所。 1.1.2 原油和菌株来源:从渭北某致密低渗区块采集的原油样品(常温粘度≤20 mPa·s)中分离得到一株解烃菌WB-001以及大连奥普森生物工程有限公司实验室保藏的采油功能菌OPUS-HOB-001 (Bacillus subtilis)。 1.1.3 培养基:激活培养基(g/L):葡萄糖10,NH4Cl 2,FeSO4·7H2O 0.01,MnSO4 0.002,CuSO4·5H2O 0.002,pH 7.0−7.2。发酵培养基(g/L):葡萄糖10,NH4Cl 1.5,K2HPO4·12H2O 3,KH2PO4 0.5,CaCl2 0.01,FeSO4·7H2O 0.015,MnSO4 0.002,CuSO4·5H2O 0.002,pH 7.0−7.2。
原油培养基(g/L):原油10,NH4Cl 1.5,K2HPO4·12H2O 3,KH2PO4 0.5,CaCl2 0.01,FeSO4·7H2O 0.015,pH 7.0−7.2,固体培养基加入琼脂粉18。
1.2 实验方法 1.2.1 菌株WB-001的分离纯化及鉴定:菌液激活后采用稀释平板法进行分离纯化。选取稀释度为10−6和10−7的菌液涂布于固体培养基上过夜;挑取单菌落转接到发酵培养基中培养24 h;选取可降低表面张力的菌株接种到固体原油培养基上培养72 h;选取在原油平板上生长且产生较大透明圈的菌株作为实验菌株[16]。随后对该菌株进行菌体形态、生理生化和16S rRNA基因序列分析,并基于16S rRNA基因序列(上海生工测序)的结果确定菌株的种属[17]。菌体形态特征和大小通过透射电镜进行观察,将约500 μL的细菌悬液逐渐滴至有机碳膜上的载网上,干燥后在FEI透射电镜观察,拍照,电压100 kV。
1.2.2 菌株发酵液活性分析[18:]表面张力测定:取20 mL WB-001的发酵液于表界面张力仪的平皿中,设定好试验参数,利用QJZY-1自动界面张力仪测定菌株发酵液的表面张力,测定3次,取平均值。排油圈测定[19, 20]:在直径9 cm的平皿中加入60 mL蒸馏水,再将8 mL用苏丹红III染色的液体石蜡加到平皿中,待整个平板表面的液体石蜡形成一层均匀分散的薄膜后,在油膜中心慢慢滴入发酵液500 μL,观察排油圈大小。
乳化活性测定[21, 22]:取煤油和液体石蜡各5 mL,分别与等体积的发酵液混合,漩涡振荡器振荡1 min,混匀后静置24 h,观察两相体积变化,记录乳化层高度。
乳化液滴粒径测定[23]:在刻度试管中,加入体积比为1:1的原油与发酵液,室温条件下振荡1 min后静置过夜,取10 μL乳化层于载玻片上,利用盖玻片进行压片,在光学显微镜下观察,随机选取一定量的油粒测量直径(ScopePhoto软件图像法测定),计算出乳化后原油颗粒的平均直径。
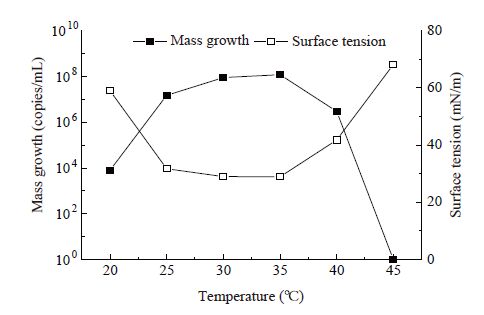
1.2.3 菌株环境适应性评价:温度适应性:配制发酵培养基,接种2%的菌株WB-001,在20、25、30、35、40和45 °C培养箱中培养3 d,稀释平板法测定发酵液中的菌体数量。酸碱度适应性[24]:配制发酵培养基,利用HCl或NaOH调节培养基的pH分别为4.0、5.0、6.0、7.0、8.0和9.0,接种量为2%,于最适温度条件下培养3 d,稀释平板法测定发酵液中的菌体数量。
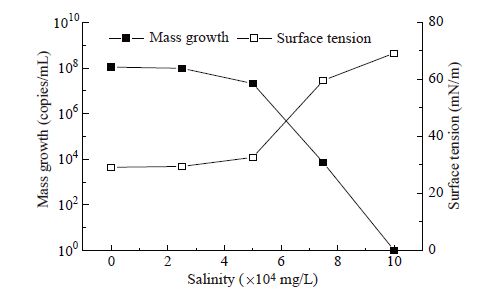
矿化度适应性[25]:配制pH值为7.0,总矿化度分别为0、2.50×104、5.00×104、7.50×104、10.00×104 mg/L的发酵培养基,接种2%的菌株WB-001,于最适温度和pH条件下培养3 d,稀释平板法测定发酵液中的菌体数量。
1.2.4 原油中蜡质降解效率:利用菌株WB-001与外源OPUS-HOB-001复配进行蜡质降解实验,设置复配比例分别为1:0,1:1,2:1,3:1和4:1,按1:50的体积比将几组复配菌液分别加入到液体原油培养基中,35°C、170 r/min培养7−10 d,采用有机溶剂萃取法进行原油中蜡含量的测定[26, 27]。蜡质降解率计算式如下:
降解率=(W0-W1)/W0×100%
W0:微生物菌株作用前的蜡质含量;W1:微生物菌株作用后的蜡质含量。
1.2.5 菌株室内模拟驱油实验:利用填砂管模型模拟地层环境条件来评价WB-001与OPUS-HOB-001的复配驱油能力。填砂管中饱和地层原油,老化7 d后1#填砂管用水驱至产出液不含原油,计算水驱效率;2#填砂管中注入WB-001与OPUS-HOB-001的复配菌液及营养液,35 °C条件下孵育7 d后水驱,直至产出液不含原油,计算驱替效率。二者的差值即为菌株WB-001与OPUS-HOB-001复配后的采收率提高率[28, 29]。 1.2.6 岩心驱油性能评价:将渭北长3的3 cm岩心置于105 °C烘箱中恒温烘干后进行预处理,建立饱和油后分别进行驱替实验。(1) 水驱:将配制好的模拟地层水装入中间容器中,驱替饱和油的岩心至不出油为止,读取油水分离器的刻度数及采油量,计算原油采出程度。(2) 菌液驱:按比例配制复配菌液,装入中间容器中,驱替饱和油的岩心10 PV,记录第1次采油量;关闭岩心前后端阀门,保持净围压为2 MPa,在夹持器中孵育7 d;用模拟地层水驱至不出油为止,记录第2次采油量;二次采油量之和为总的采油量,根据总采油量计算最终采出程度[30, 31]。 1.3 矿场试验 1.3.1 试验区块储层物性:渭北长3储层为主力开发层位,埋深300−550 m。以细粒、极细粒岩屑质长石砂岩和长石质岩屑砂岩为主,砂岩具有长石、岩屑含量高、石英相对少及成分成熟度低等特征。目的区块储层平均孔隙度9.32%,平均渗透率0.51×10−3 μm2;原油密度0.81 g/cm3,地层原油粘度6.64 mPa·s,地层原油体积系数1.03,凝固点6−20 °C,初馏点78.50−89.00 °C,属于轻质原油;地层水总矿化度为31 078.50 mg/L,氯根含量18 540.80 mg/L,水型CaCl2。结合各方面因素可以确定渭北油田长3储层属于典型的浅层、低丰度、低产、中型超低渗岩性非饱和油藏[15]。 1.3.2 试验井选择:试验井位于长3层位,油气显示2层,累计视厚35.50 m,没有对应注水井(表1)。初期投产不出液,2014年3月压裂后见油,但液量下降快,产油量低,累产油仅37 t;在2014年6月加深泵挂之后,产量提升并维持稳定。试验井在实施微生物单井吞吐措施前15天平均日产液1.68 t,日产油0.42 t,含水62.54%,总产油量为6.31 t。分析认为该井产量与测录井显示不匹配,出现低产主要原因是原油粘度大,地层压力不够。结合微生物采油筛选标准及室内研究结果,确定选该油井作为试验井实施微生物单井吞吐措施。| 层位 Position | 深度 Depth (m) | 视厚度 Apparent thickness (m) | 自然 伽马 GR (API) | 深感应 电阻率 Deep induction resistivity (Ω·m) | 声波 时差 SDT (μs/m) | 泥质 含量 Shaliness (%) | 孔隙度 Porosity (%) | 渗透率 Permeability (mD) | 含油 饱和度 Oil saturation (%) |
| Chang 331 | 786.20−815.70 | 29.50 | 87.00 | 32.90 | 233.90 | 9.40 | 11.40 | 0.77 | 36.90 |
| Chang 332 | 825.30−831.30 | 6.00 | 94.10 | 30.10 | 233.90 | 9.30 | 11.40 | 0.67 | 34.60 |

|
| 图1 微生物单井吞吐工艺模式图 Figure 1 Process model of microbials huff and puff |
| 段塞名称 Slug | 注入量 Inject volume (m3) | 成分名称 Element | 使用浓度 Concentration (%) | 使用量 Usage amount |
| 前置段塞 Pre-slug | 15 | 激活剂 | 2.000 | 0.3 m3 |
| 生物酶 | 0.002 | 1 kg | ||
| 主体段塞 Main slug | 110 | 采油菌剂 | 5.000 | 5.5 m3 |
| 营养液 | 2.500 | 2.7 m3 | ||
| 激活段塞 Activated slug | 20 | 激活剂 | 1.000 | 0.2 m3 |
| 顶替液 Displacement fluid | 30 | 清水 | − | 30 m3 |
从渭北长3致密低渗油藏中采集到的11份原油样品,经过初筛复筛获得3株具有显著功能的菌株,其中1株降低表面张力和降解原油的能力最强,将其命名为WB-001。该菌株平板培养初期菌落为淡黄色,随菌体细胞衰老逐渐变为黄绿色;菌落略凸起,表面光滑,较粘稠,边缘规则(图2A)。可以在以原油为唯一碳源的固体平板上生长,将原油降解,在菌落周围形成透明圈[34](图2B)。革兰氏染色为阴性,形态不一,大多成对排列,菌体大小为(0.60−0.80) μm×(3.00−3.50) μm,单端鞭毛(图3)。通过菌体形态观察、生理生化特性以及16S rRNA基因序列和系统进化分析,显示菌株WB-001与Pseudomonas aeruginosa DSM50071的同源性最高,鉴定为假单胞属的铜绿假单胞菌(图4)。
|
|
图2
菌株WB-001菌落形态
Figure 2
Colonies of strain WB-001
注:A:LB平板上的菌落;B:原油平板上的透明圈. Note: A: Colony morphology on LB plate; B: Transparent zones on crude oil plate. |

|
|
图3
菌株WB-001形态观察
Figure 3
Morphology of strain WB-001
注:A:革兰氏染色(100×);B:透射电镜观察(18 500×). Note: A: Gram staining under optical microscope (100×); B: Transmission electron microscope (18 500×). |

|
|
图4
菌株WB-001系统进化树
Figure 4
Phylogenetic tree of strain WB-001
注:括号内为菌株在GenBank登录号;分支点上的数字表示构建系统进化树时1 000次计算时形成该节点的百分比;标尺为进化距离. Note: The numbers in parentheses represent the accession number of the strain in the GenBank; The numbers in the branching points are bootstrap values expressed as percentages of 1 000 replications; Scale for evolutionary distance. |
表面张力、排油圈和乳化活性是衡量微生物产生的生物表面活性剂产量和稳定性的重要指标。由实验结果可知,培养24 h之后,菌株WB-001的发酵液表面张力由初始的67.32 mN/m降至29.04 mN/m,排油圈直径为7 cm (图5),对煤油和液体石蜡作用后乳化层高度分别为5.80 cm和5.50 cm。取10 μL 油水乳化体系滴在载玻片上,在光学显微镜下观察,发现原油被乳化成颗粒大小不一的液滴均匀分散在水相中,随机选取35个液滴测量直径,平均大小为68 μm。符合实验预期的效果,初步判断菌株WB-001产生的生物表面活性剂具有极强的降低表面张力的能力和较好的乳化活性[35]。

|
| 图5 菌株WB-001发酵液的排油圈 Figure 5 Oil drain of strain WB-001 fermentation broth |
对于应用到MEOR技术的功能微生物来说,环境条件如油藏温度、地层水的酸碱度和矿化度对微生物自身生长繁殖和代谢产物的积累影响很大。室内试验方法是选取各指标的不同数值,在不同条件下培养后测定菌液的浓度,从而确定微生物的最适生长指标。
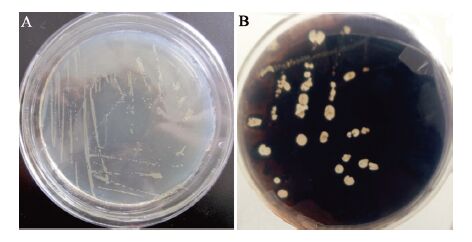
2.3.1 菌株WB-001的温度适应性:菌株WB-001从25−35 °C均表现出较强的生长能力,对温度的变化不敏感,菌体生长量≥106 copies/mL,此时发酵液的表面张力均小于31.00 mN/m。同时可以看出,菌株WB-001的最适生长温度为30−35 °C,在此温度下发酵液的表面张力也达到最低值,为28.93 mN/m,其它温度下由于微生物的生长受到抑制,导致表面张力降低幅度较小(图6)。菌株WB-001的温度适应性变化曲线也与渭北长3区块的平均油藏温度特征相吻合,分析原因为微生物生长及其代谢都是一些特异酶的催化反应,温度较低的情况下酶活也较低,随着温度升高酶活增大,但超过环境温度后酶逐渐失去活性,生长及代谢减弱。
|
| 图6 温度对菌株WB-001生长量和表面张力的影响 Figure 6 Effects of temperature on biomass and surface tension of strain WB-001 |
|
| 图7 酸碱度对菌株WB-001生长量和表面张力的影响 Figure 7 Effects of initial pH value on biomass and surface tension of strain WB-001 |
|
| 图8 矿化度对菌株WB-001生长量和表面张力的影响 Figure 8 Effects of different salinity conditions on biomass and surface tension of strain WB-001 |
因菌株WB-001单独作用原油后蜡质降解率仅为2.40%,故选取外源功能菌株OPUS-HOB-001进行复配,以达到高降解的效果。实验结果显示,内源菌株WB-001与外源菌株OPUS-HOB-001按照3:1比例进行复配后,蜡质含量由12.35%降至8.48%,降解率达到31.33%。虽然其它实验比例也可以使蜡质不同程度地降解,但降解率明显低于3:1这个复配比例(表3)。这是由于WB-001与OPUS-HOB-001复合体系中枯草芽孢杆菌产生脂肽类生物表面活性剂,铜绿假单胞菌产生糖脂类表面活性剂,二者综合作用使得表面活性剂的含量最大,形成大量水包油乳状液,可以促进微生物对原油的吸收及降解,同时增强了原油的脱附能力及溶解能力,有利于原油在地下孔喉的流动。同时脂肽类生物表面活性剂作用后可以改变蜡晶的形状,由致密状变成了疏松的枝状,降低了蜡质的凝固点[37],也可以增加原油的流动能力。在原油开采过程中,蜡质组分结晶沉积是低温浅层原油粘度高导致生产井堵塞的主要原因。改变晶核结构,阻止晶核生长,从而降低蜡质的沉积效率,降低原油粘度。由此后续的实验均以WB-001:OPUS-HOB-001为3:1的比例复配作为试验评估体系,以下简称复配体系。
| 比例 Ratio | 降解率 Degradation rate (%) |
| 1:0 | 2.40 |
| 1:1 | 7.90 |
| 2:1 | 23.48 |
| 3:1 | 31.33 |
| 4:1 | 12.47 |
1#空白填砂管水驱出77.08%的原油,注入复配体系孵育7 d后,2#填砂管水驱出84.57%的原油,较单纯水驱提高了9.72% (表4)。该结果说明在相同的条件下,注入复配体系的菌液和营养液后,微生物自身的生长及代谢过程产生生物表面活性剂、生物酶、小分子有机溶剂和生物气等活性物质,可以减小砂对原油的吸附,将原油从砂上剥离开来,并进一步乳化降解,降低粘度和凝固点,从而提高填砂管模拟驱油的驱替效率[38]。
| 样品 Test | 含油饱 和度 Oil saturation (mL) | 一次水驱 增油量 Water flooding oil increment (mL) | 一次水驱采出程度 Recovery of water (%) | 复配体系驱 增油量 Compounded system flooding oil increment (mL) | 复配体系采 出程度 Recovery of compounded system (%) | 复配体系提高采收率 Enhanced oil recovery (%) |
| 1# | 48.00 | 37.00 | 77.08 | − | − | − |
| 2# | 48.00 | − | − | 40.60 | 84.57 | 9.72 |
实验选用3个岩心,平均渗透率为1.56× 10−3 μm2,水驱采收率49.87%,利用复配体系作用后再次驱替,最终采收率为56.13%,相对采收率提高了12.54%。微生物菌液驱与水驱相比,采出程度具有一定程度的提高(表5)。扫描电镜观察岩心碎屑,观察到微生物的存在,分析微生物可沿微裂缝进入基质内部并生长,代谢的活性物质增加,实现提高采收率。同时可以看出,2#岩心渗透率和孔隙度最小,水驱效率和最终采收程度低,3#岩心渗透率和孔隙度最大,其水驱效率和最终采出程度也最高,该结果也充分证明了渗透率和孔隙度是制约原油相对采出程度的一个重要因素[39, 40]。
| 样品 Sample | 长度 Length (cm) | 直径 Diameter (cm) | 重量 Weight (g) | 渗透率 Permeability (mD) | 孔隙度 Porosity (%) | 水驱油效率 Recovery of water (%) | 最终驱油率 Final oil recovery (%) | 提高率 Enhanced oil recovery (%) |
| 1 | 4.533 | 2.498 | 52.642 | 1.590 | 11.90 | 51.70 | 57.60 | 11.41 |
| 2 | 4.662 | 2.492 | 52.620 | 0.859 | 11.75 | 43.10 | 48.50 | 12.53 |
| 3 | 5.097 | 2.477 | 54.931 | 2.225 | 13.23 | 54.80 | 62.30 | 13.69 |
|
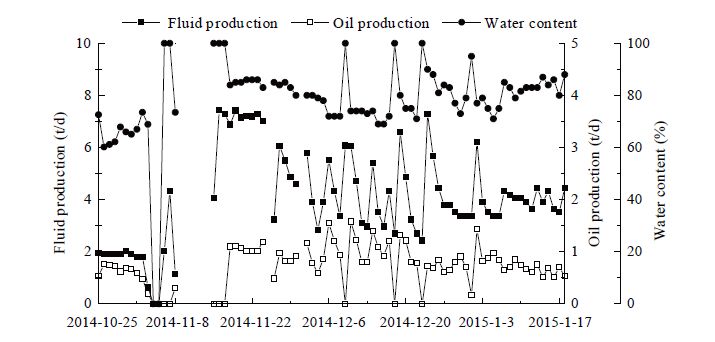
| 图9 微生物复配体系注入后产量情况 Figure 9 Single well production after microbials huff and puff |
|
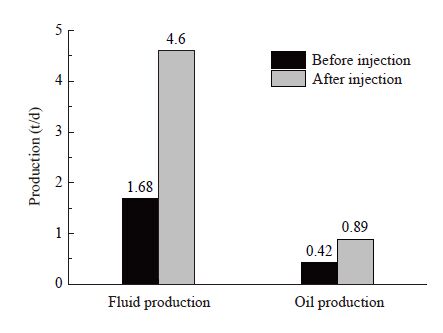
| 图10 微生物复配体系注入前后产量对比 Figure 10 Production comparisons before and after compounded system injection |
| 粘度 Viscosity (35 °C,mPa·s) | 凝固点 Freezing point (°C) | 表面张力 Surface tension (mN/m) | ||||||
| 作用前 Before | 作用后 After | 降低幅度 Reducing rate (%) | 作用前 Before | 作用后 After | 降低幅度 Reducing rate (%) | 作用前 Before | 作用后 After | 降低幅度 Reducing rate (%) |
| 12.05 | 10.64 | 11.70 | 8.50 | 7.70 | 9.41 | 67.40 | 54.64 | 18.93 |
(1) 从渭北某区块低渗透油藏的原油样品中分离得到的高产生物表面活性剂的解烃菌WB-001为铜绿假单胞菌,具有优良的降低表面张力、乳化原油、降粘降凝的性能,环境适应性良好。
(2) 填砂管和岩心模拟驱油实验结果表明采用内源菌株WB-001与外源功能菌OPUS-HOB-001按3:1比例复配作用后驱油效率较单纯水驱分别提高了9.72%和12.54%,增油效果显著。
(3) 试验井微生物单井吞吐后,平均日产油0.89 t,较措施前日增油0.47 t,累增油44.47 t。措施后监测结果显示,原油粘度降低11.70%,平均凝固点为7.70 °C,降低9.41%。采出水表面张力降低,降低幅度为18.93%。表明微生物体系能够对原油中蜡质含量进行有效降解,降低粘度和凝固点,这对于低温浅层油藏在改善原油流动性和提高举升效率有更为现实的意义。
结合渭北油藏MEOR初步研究和矿场结果,针对致密低渗油藏孔喉细小、连通性差、基质原油难以流动的实际情况,应打破常规的油气开采路线,
引用非常规、创新思路来解决开发中的难题和瓶颈。通过宏基因组技术、分子生态技术、原油指纹图谱、残余油渗流机制、微观驱油模型和矿场工艺等多学科、多水平的研究,了解改善原油物性的关键因素,探讨微生物及其代谢产物与提高致密低渗油藏采收率的关系;确定石蜡、胶质等粘度关键因素转化为短链分子的机制,完善后续监测技术指标,最终实现改善原油流动性、提高波及系数、提升基质驱油效率而进一步降低地层残余油饱和度。
同时建立适合于致密低渗油藏的绿色生物采油体系和工艺方法,这些理论研究和矿场实践将为致密低渗油藏的精细开发提供可靠的科学思路和有力的技术支撑。
致谢:衷心感谢中国石油化工股份有限公司华北油气分公司工程技术管理部、石油工程技术研究院和采油三厂等部门的工程师鼎力支持和热情帮助,在样品采集、数据分析、工艺设计和论文撰写过程中提供了很多建设性意见。感谢大连奥普森生物工程有限公司的研发团队,在项目进程中创新攻关,保证课题顺利进行。感谢中国科学院大连化学物理研究所、大连理工大学和大连海事大学在实验中提供的支持和帮助。
| [1] | Chen M. At home and abroad,the development of low permeability oilfield technology status[J]. China Petroleum and Chemical Standard and Quality,2012,32(1): 155 (in Chinese) 陈敏. 国内外低渗透油田开发技术现状[J]. 中国石油和化工标准与质量,2012,32(1): 155 |
| [2] | Li JY. Study on effective development strategy of permeability reservoir[J]. Inner Mongolia Petrochemical Industry,2013(12): 139-141 (in Chinese) 李佳营. 低渗透油田高效开发对策研究[J]. 内蒙古石油化工,2013(12): 139-141 |
| [3] | Yuan XJ,Ye XD,Bao W,et al. Difficulties and countermeasures on low permeability reservoir development[J]. Drilling & Production Technology,2006,29(4): 31-32 (in Chinese) 袁旭军,叶晓端,鲍为,等. 低渗透油田开发的难点和主要对策[J]. 钻采工艺,2006,29(4): 31-32 |
| [4] | Zhang YY. Low permeability reservoir and application of enhanced oil recovery[J]. Technology Wind,2012(15): 86 (in Chinese) 张莹莹,低渗透油田提高采收率技术研究及应用[J]. 科技风,2012(15): 86 |
| [5] | Zou JB. MEOR study of the low permeability reservoir for outer skirts in west Daqing Oilfields[D]. Beijing: Master’s Thesis of China University of Geosciences,2007 (in Chinese) 邹江滨. 大庆西部外围低渗透油田微生物采油技术研究[D]. 北京: 中国地质大学(北京)硕士学位论文,2007 |
| [6] | Wang WD. Laboratory research and field trials of microbial oil recovery technique[J]. Oil Drilling & Production Technology,2012,34(1): 107-113 (in Chinese) 汪卫东. 微生物采油技术研究及试验[J]. 石油钻采工艺,2012,34(1): 107-113 |
| [7] | Wiilliam KO,Thu N,Win NA,et al. EEOR success in Mann field,Myanmar[A]//SPE Enhanced Oil Recovery Conference[C]. Kuala Lumpur,Malaysia: Society of Petroleum Engineers,2011: 1-8 |
| [8] | Dong CY,Han WD,Wang YT. Simple discussion on microbial enhance oil recovery and development tendency[J]. China Petroleum and Chemical Standard and Quality,2013,33(13): 64 (in Chinese) 东长玉,韩卫东,王玉堂. 浅析微生物采油技术及发展趋势[J]. 中国石油和化工标准与质量,2013,33(13): 64 |
| [9] | Lazar I,Petrisor IG,Yen TF. Microbial enhanced oil recovery (MEOR)[J]. Petroleum Science and Technology,2007,25(11): 1353-1366 |
| [10] | Gai LX,Wang YL,Bai LL,et al. Application of MEOR technology in the low-permeability reservoirs of Daqing oilfield[J]. Petroleum Geology and Oilfield Development in Daqing,2011,30(2): 145-149 (in Chinese) 盖立学,王艳玲,柏璐璐,等. 微生物采油技术在大庆油田低渗透油藏的应用[J]. 大庆石油地质与开发,2011,30(2): 145-149 |
| [11] | Wu XL,Le JJ,Wang R,et al. Progress in pilot tests of microbial enhanced oil recovery in Daqing oilfield[J]. Microbiology China,2013,40(8): 1478-1486 (in Chinese) 伍晓林,乐建君,王蕊,等. 大庆油田微生物采油现场试验进展[J]. 微生物学通报,2013,40(8): 1478-1486 |
| [12] | Sun SD. Practices of MEOR and their knowledge in Shengli oilfield[J]. Journal of Oil and Gas Technology,2014,36(2): 149-152 (in Chinese) 孙磉礅. 胜利油田微生物驱油现场实践及分析[J]. 石油天然气学报,2014,36(2): 149-152 |
| [13] | Zhang XC,Sun W,Wang DY,et al. Displacing law and influencing factors of MEOR in low-permeability oilfields[J]. Journal of Northwest University (Natural Science Edition),2014,44(5): 801-807 (in Chinese) 张相春,孙卫,王德玉,等. 低渗透油田微生物驱油规律及其影响因素[J]. 西北大学学报: 自然科学版,2014,44(5): 801-807 |
| [14] | Liu JY,Cheng MM,Lei GL,et al. Laboratory evaluation and field trial of microbial oil displacement in Ansai ultra-low permeable oilfield[J]. Science Technology and Engineering,2014,14(12): 26-30,36 (in Chinese) 刘建英,程明明,雷光伦,等. 安塞特低渗油田微生物驱油室内研究及先导试验[J]. 科学技术与工程,2014,14(12): 26-30,36 |
| [15] | Li XC,Liu B,Li PT,et al. Researching reservoir characteristics of Long 3 for 2 river of Weibei oil field[J]. Shandong Chemical Industry,2014,43(2): 22-23,27 (in Chinese) 李显超,刘波,李朋涛,等. 渭北油田渭北2井区长3油藏储层特征研究[J]. 山东化工,2014,43(2): 22-23,27 |
| [16] | Wang YJ,Bi SN,Zuo YH,et al. Isolation and antifungal activity of a biosurfactant-producing bacterium[J]. Microbiology China,2012,39(3): 353-360 (in Chinese) 王彦杰,毕思宁,左豫虎,等. 一株表面活性剂产生菌的分离及抑菌活性[J]. 微生物学通报,2012,39(3): 353-360 |
| [17] | Dong XZ. Manual of Systematic and Determinative Bacteriology[M]. Beijing: Science Press,2001 (in Chinese) 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社,2001 |
| [18] | Yu J,Chen AH,Ma TL,et al. Analytic method of oil microbes and their metabolizing substances in the third oil recovery[J]. Xinjiang Oil & Gas,2008,4(4): 88-91 (in Chinese) 于娟,陈爱华,马天玲,等. 三次采油石油微生物及代谢产物分析评价方法[J]. 新疆石油天然气,2008,4(4): 88-91 |
| [19] | Youssef NH,Duncan KE,Nagle DP,et al. Comparison of methods to detect biosurfactant production by diverse microorganisms[J]. Journal of Microbiological Method,2004,56(3): 339-347 |
| [20] | Bi SN,Wang YJ,Zuo YH. Improvement and application of oil spreading to detect biosurfactant[J]. Journal of Heilongjiang Bayi Agricultural University,2009,21(6): 58-60 (in Chinese) 毕思宁,王彦杰,左豫虎. 生物表面活性剂排油圈检测方法的改进和应用[J]. 黑龙江八一农垦大学学报,2009,21(6): 58-60 |
| [21] | Teng XL,Pu WF,Li LC. A crude oil viscosity reducer made of lipo-polysaccharide bio-emulsifier[J]. China Surfactant Detergent and Cosmetics,2009,39(2): 97-100 (in Chinese) 滕小兰,蒲万芬,李露春. 一种脂多糖类生物乳化降黏剂[J]. 日用化学工业,2009,39(2): 97-100 |
| [22] | Li GQ,Ji KH,Li JB,et al. Bio-emulsifier produced by a thermophilic hydrocarbon-degrading strain DM-2[J]. Microbiology China,2014,41(4): 585-591 (in Chinese) 李国强,纪凯华,李佳斌,等. 嗜热解烃菌DM-2产生的生物乳化剂[J]. 微生物学通报,2014,41(4): 585-591 |
| [23] | Qi YB,Wang DW,Wu MM,et al. Effects of resin degradation and biological emulsification on the viscosity break of heavy oils[J]. Acta Petrolei Sinica,2012,33(4): 670-675 (in Chinese) 齐义彬,王大威,吴萌萌,等. 胶质降解和生物乳化在稠油降黏中的作用[J]. 石油学报,2012,33(4): 670-675 |
| [24] | Huang L,Xie J,Wang FM,et al. Cell-surface hydrophobicity and emulsification of a hydrocarbon-degrading strain[J]. Microbiology China,2013,40(9): 1609-1617 (in Chinese) 黄磊,谢晶,王芳梅,等. 一株石油烃降解菌的细胞疏水性及其乳化性质[J]. 微生物学通报,2013,40(9): 1609-1617 |
| [25] | Shen K,Li B,Huang ZW,et al. Application of composite indigenous microorganism oil displacement technology in low-permeability reservoirs[J]. Journal of Xi’an Shiyou University (Natural Science Edition),2013,28(3): 63-69 (in Chinese) 申坤,李斌,黄战卫,等. 复合本源微生物驱油技术在低渗透油藏的应用研究[J]. 西安石油大学学报: 自然科学版,2013,28(3): 63-69 |
| [26] | XDF-4性能[J]. 化工学报,2010,61(11): 2951-2959 Xia WJ,Dong HP,Yu L,et al. Characterization of a thermophilic and halotolerant strain Geobacillus sp. XDF-4[J]. CIESC Journal,2010,61(11): 2951-2959 (in Chinese) 夏文杰,董汉平,俞理,等. 一株耐温、耐盐烃降解菌Geobacillus sp. |
| [27] | Wang J,Ma T,Li W,et al. Characterization of a mucoidal thermophile hydrocarbon-degrading bacterium and experiments on profile flooding[J]. Journal of Chemical Industry and Engineering (China),2008,59(3): 694-700 (in Chinese) 王君,马挺,李蔚,等. 一株高温解烃产黏菌的特性及其调剖驱油效果[J]. 化学学报,2008,59(3): 694-700 |
| [28] | Zhang JH,Dong X,Ye YZ,et al. Effect of the gel and surfactant alternating injection after polymer flooding[J]. Journal of Daqing Petroleum Institute,2010,34(2): 85-88 (in Chinese) 张继红,董欣,叶银珠,等. 聚合物驱后凝胶与表面活性剂交替注入驱油效果[J]. 大庆石油学院学报,2010,34(2): 85-88 |
| [29] | Zhao W,Yang J,Huang XL,et al. Laboratory on enhancing oil recovery of Ansai low-permeability reservoir by microbial combination flooding process[J]. Xinjiang Petroleum Geology,2014,35(6): 699-702 (in Chinese) 赵文,杨剑,黄先利,等. 复合驱油菌株提高安塞低渗透油田采收率实验[J]. 新疆石油地质,2014,35(6): 699-702 |
| [30] | Li J,Liu JS,Trefry MG,et al. Interactions of microbial-enhanced oil recovery processes[J]. Transport in Porous Media,2011,87(1): 77-104 |
| [31] | Lei GL,Cheng MM,Gao XM,et al. Influence of injection parameter on microbial enhanced oil recovery[J]. Chemical Engineering of Oil and Gas,2014,43(3): 287-291 (in Chinese) 雷光伦,程明明,高雪梅,等. 注入参数对微生物提高采收率的影响研究[J]. 石油与天然气化工,2014,43(3): 287-291 |
| [32] | Xu DT,Liu T,Cao GZ,et al. Injection technology for microbial oil displacement[J]. Journal of Oil and Gas Technology,2012,34(11): 135-137,146 (in Chinese) 徐登霆,刘涛,曹功泽,等. 油田微生物驱油注入工艺研究[J]. 石油天然气学报,2012,34(11): 135-137,146 |
| [33] | Ke CY,Wu G,You J,et al. Monitoring of the organic acid in the produced liquid in microbial flooding process and effect of the organic acid on enhancing oil recovery factor[J]. Journal of Xi’an Shiyou University (Natural Science Edition),2013,28(3): 54-58 (in Chinese) 柯从玉,吴刚,游靖,等. 微生物驱油产出液中有机酸的监测及对提高采收率的作用研究[J]. 西安石油大学学报: 自然科学版,2013,28(3): 54-58 |
| [34] | Guo LY. Simulation experiment of microbial enhanced oil recovery and oil reduction study by combined strains[D]. Beijing: Master’s Thesis of Beijing University of Chemical Technology,2010 (in Chinese) 郭立云. 微生物采油室内填砂岩心模型实验及复合菌石油降粘研究[D]. 北京: 北京化工大学硕士学位论文,2010 |
| [35] | Wang DW,Zhang J,Lü X,et al. Study on characteristics of a rhamnolipid biosurfactant producing bacterium and rhamnolipid biosurfactant[J]. Biotechnology Bulletin,2012(7): 163-169 (in Chinese) 王大威,张健,吕鑫,等. 一株铜绿假单胞菌及其产生的鼠李糖脂特性研究[J]. 生物技术通报,2012(7): 163-169 |
| [36] | Xie KP,Zhou JT,Qu YY,et al. Studies on isolation,identification of halophil crude oil degrading bacteria and their degradation capability[J]. Marine Environmental Science,2009,28(6): 680-683 (in Chinese) 谢鲲鹏,周集体,曲媛媛,等. 一株耐盐原油降解菌的分离鉴定及其降解特性研究[J]. 海洋环境科学,2009,28(6): 680-683 |
| [37] | Z25研究[J]. 深圳大学学报: 理工版,2009,26(3): 234-239 Zheng CG,Yu L,Wu QH,et al. Rhodococcusruber Z25,a hydrocarbon-degradating strain[J]. Journal of Shenzhen University (Science and Engineering),2009,26(3): 234-239 (in Chinese) 郑成刚,俞理,吴庆红,等. 一株烃降解菌Rhodococcusruber |
| [38] | Wang DW,Liu YJ,Yang ZY,et al. Application of surfactin in microbial enhanced oil recovery[J]. Acta Petrolei Sinica,2008,29(1): 111-115 (in Chinese) 王大威,刘永建,杨振宇,等. 脂肽生物表面活性剂在微生物采油中的应用[J]. 石油学报,2008,29(1): 111-115 |
| [39] | Lu MS,Liu ZC,Tang SH. Experimental selection method and effect evaluation of microbial enhanced oil recovery[J]. Drilling & Production Technology,2012,35(2): 90-93 (in Chinese) 卢满生,刘志成,唐思洪. 微生物采油技术实验筛选方法与评价效果研究[J]. 钻采工艺,2012,35(2): 90-93 |
| [40] | Ke CY,Wu G,You J,et al. The growth,migration and distribution law of microbes during microbial displacement oil[J]. Microbiology China,2013,40(5): 849-856 (in Chinese) 柯从玉,吴刚,游靖,等. 采油微生物在微驱过程中的生长、运移及分布规律[J]. 微生物学通报,2013,40(5): 849-856 |
| [41] | Liu WL,Wang ZF,Li ZQ. Research of microbial enhanced oil recovery technology in low-permeability oil reservoir[J]. China Petroleum and Chemical Standard and Quality,2014(5): 62 (in Chinese) 刘文龙,王治富,李志强. 低渗透油藏环境下的微生物采油技术探析[J]. 中国石油和化工标准与质量,2014(5): 62 |
 2016, Vol. 43
2016, Vol. 43