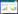扩展功能
文章信息
- 阮迪申, 曾加会, 晁元卿, 仇荣亮, 杨燕花, 王诗忠
- RUAN Di-Shen, ZENG Jia-Hui, CHAO Yuan-Qing, QIU Rong-Liang, YANG Yan-Hua, WANG Shi-Zhong
- 重金属胁迫下内生菌对宿主植物的解毒机制
- Role of endophytes in plant tolerance to heavy metal stress
- 微生物学通报, 2016, 43(12): 2700-2706
- Microbiology China, 2016, 43(12): 2700-2706
- DOI: 10.13344/j.microbiol.china.160051
-
文章历史
- 收稿日期: 2016-01-12
- 接受日期: 2016-05-05
- 优先数字出版日期(www.cnki.net): 2016-05-31
2. 广东省环境污染控制与修复技术重点实验室 广东 广州 510275
2. Guangdong Provincial Key Laboratory of Environmental Pollution Control and Remediation Technology, Guangzhou, Guangdong 510275, China
在众多土壤重金属污染修复技术中,植物修复因具有原位、经济、环保、二次污染小等优点而被广泛采用。但是植物生物量低,生长缓慢,且最有实际使用价值的植物对重金属的耐受性有限[1],这些特点制约了植物修复技术的发展。微生物修复则具有微生物生长迅速、吸附重金属快、吸附容量大等优点,但它只能将重金属稳定,无法彻底将重金属从土壤中去除。通过接种植物促生菌(Plant growth-promoting bacteria,PGPB)可以促进植物生长,提高重金属植物修复效率,已引起国内外研究者的重视[2-5]。PGPB依其分布的位置可分为植物根际促生菌(Plant growth-promoting rhizobacteria,PGPR)和植物内生促生菌(Plant growth-promoting endophytes,PGPE)。PGPB具有分泌植物促生物质、改变植物对重金属的吸收转运情况[6-7]、降低重金属对植物的毒害作用等功能。植物内生促生菌因生活在植物组织内,与植物联系更加紧密,被认为在协同宿主植物耐受重金属胁迫方面发挥着更重要的作用。
1 植物内生促生菌植物内生促生菌,是指生活史的某一阶段或整个阶段在植物体内完成,非但不使宿主植物表现出病症,反而促进其生长的一类微生物[8]。内生菌依其物种的不同,又可分为内生细菌、内生真菌和内生放线菌,其中内生细菌在种群密度和多样性方面具有优势[2]。
在重金属胁迫下,部分具有特定功能的细菌可进入植物体内成为内生菌,这些内生菌通常在重金属吸收、耐受和解毒方面具有优良的特性。内生菌与植物发生的作用包括直接效应和间接效应两方面[9]。直接效应即内生菌通过分泌各类次级代谢产物,如生长素(Indole-3-acetic acid,IAA)、铁载体、1-氨基环丙烷-1-羧酸(1-aminocyclopropane- 1-carboxylic acid,ACC)脱氨酶等,或是通过溶磷、固氮等作用,促进植物生长,调控植物的生理过程。间接效应体现在内生菌自身对重金属的吸收,以及内生菌对致病菌的生物防治作用等。内生菌影响植物生长、抗逆性及重金属的吸收转运,便是通过以上两种途径来实现的。
内生菌对植物生长的促进作用并不存在争议,大量研究表明重金属胁迫下,接种功能内生菌可以显著提高植物地上和地下部分的生物量:如接种铅耐受性内生菌Pseudomonas fluorescens G10和Microbacterium sp. G16显著提高了铅污染土地上油菜(Brassica napus L.)的生物量[10];接种Bacillus sp. E1S2等5株具有分泌ACC脱氨酶能力的内生菌均显著提高了镉、铅、锌复合污染土地上伴矿景天(Sedum plumbizincicola X. H. Guo et S. B. Zhou sp. nov.)的根长、株高及生物量[11]。对于内生菌对植物吸收重金属的影 响,不同研究者持不同看法[2],因此无法确定内生菌在抑制植物重金属吸收(植物避性)方面是否存在积极作用,但目前研究普遍认为内生菌在协助宿主植物重金属解毒(植物耐性)方面存在明显作用。
2 内生菌对宿主植物的解毒机制在长期协同进化的过程中,部分细菌对重金属产生了良好的耐受性和解毒机制,而且可以协同宿主植物耐受重金属胁迫(图 1)。内生菌对宿主植物的解毒机制主要有:(1) 吸收和吸附重金属离子;(2) 分泌铁载体、有机酸、蛋白质等与重金属形成络合物,降低植物内环境中重金属的生物有效性;(3) 分泌ACC脱氨酶,分解植物体内乙烯合成的前体ACC,解除应激乙烯对植物生长的抑制;(4) 促进植物对营养元素的吸收;(5) 促进植物的光合作用;(6) 协同植物增强抗氧化系统(Antioxidant system,AOS)。总体而言,内生菌一方面直接或间接降低植物体内重金属胁迫强度,另一方面对植物的表型产生影响,即提高植物本身对重金属的耐受性。

|
| 图 1 重金属胁迫下内生菌对宿主植物的解毒机制 Figure 1 The role of PGPE in plant heavy metal detoxification 注:SAMe:蛋氨酸-S-腺苷甲硫氨酸;ACC:1-氨基环丙烷-1-羧酸;AOS:抗氧化系统;PC:植物络合素;GSH:谷胱甘肽;IAA:吲哚-3-乙酸. 箭头表示传质过程或某种作用,箭头上的“+”表示促进作用,“-”表示抑制作用. Note:SAMe: S-adenosyl methionine; ACC:1-aminocyclopropane-1-carboxylic acid; AOS: antioxidant system; PC: Phytochelatins; GSH: Glutathione; IAA: Indole-3-acetic acid; PGPE: Plant growth-promoting endophytes. the arrow represents a certain effect or a substance delivery process and the “+” attached to the arrow indicates a promoting effect and the “-” indicates an inhibiting effect. |
|
|
2.1.1 内生菌对重金属的吸收和吸附:内生菌可以通过吸附和吸收两大过程固定重金属离子,从而降低植物体内重金属的胁迫强度。吸附过程又可分为物理吸附和胞外富集,其中物理吸附不涉及生物代谢,因此进行较快,在此过程中重金属离子通过螯合、离子交换、吸附、微沉淀等作用附着到细胞表面[12];胞外富集则与细菌分泌的胞外聚合物(Extracellular polymeric substances,EPS)有关。吸收过程即细菌将重金属转运至细胞内,涉及细菌的主动运输和区域化作用等。物理吸附过程是普遍存在的,对细菌的种类和存活状态没有要求,但使内生菌大量固定重金属离子的过程是胞内和胞外富集作用,因为这两个过程涉及代谢,所以内生菌对不同重金属的富集能力和富集机制存在差异。Luo 等[13]通过对龙葵内生菌Serratia sp. LRE07的研究发现,在只含单一重金属的培养基中,该内生菌在 72 h内对Cd2+和Zn2+的吸附量可达65% (初始浓度20 mg/L)和36% (初始浓度50 mg/L);在含有Cd2+、Cr6+、Pb2+、Cu2+、Zn2+五种重金属(初始浓度均为10 mg/L)的培养基中,该内生菌对Cd2+(40%)、Zn2+(24%)和Pb2+(32%)表现出较好的去除能力,而对其它两种金属几乎没有去除效果。
2.1.2 内生菌降低植物体内重金属的生物有效性:部分内生菌具有分泌铁载体、有机酸、蛋白质等物质的能力,这些物质可以与游离态的重金属离子形成络合物,使其不易转运至植物细胞内部,从而降低了重金属对植物的毒害作用。铁载体进入细胞需要特定的受体蛋白,Greenward等[14]通过对铜绿色假单胞菌(Pseudomonas aeruginosa)分泌的荧光铁载体(Pyoverdine)的研究,认为铁载体与二价重金属离子形成的络合物在和营养元素离子竞争细胞膜通道的过程中处于劣势,且因为构象不匹配(Conformational mismatching)无法被铁载体受体蛋白识别。值得一提的是,关于铁载体对植物重金属吸收的影响普遍存在争议,重金属积累量增加和减少在不同的研究中都可以观测到[15],但这与前述铁载体与重金属的络合物更难进入植物细胞不矛盾。因为植物对重金属的吸收是一个复杂的过程,取决于根际过程和植物本身的特性等,而重金属通常是进入到细胞膜内才能表现出毒害作用,所以仍可认为内生菌分泌的铁载体是解毒机制之一。对于有机酸的作用,Francis等[16]提出Cd、Cu、Ni、Pb等重金属在与柠檬酸形成络合物之后,其生物有效性降低,且络合物不易被降解。除了铁载体、小分子有机酸等常见的络合剂,一些细菌还具有分泌其它络合剂的能力:如黑色素、植物络合素、金属硫蛋白、新型金属硫蛋白(Metallohistins)[17]等,但只有个别文献报道。分泌这些络合剂作为细菌对重金属耐受和解毒的重要机制之一,在重金属胁迫下可被诱 导[18],从而协同宿主植物重金属解毒。
2.2 内生菌降低植物体内应激乙烯的含量应激乙烯合成是植物应对外界胁迫的重要机制之一。乙烯作为植物生长调节因子之一,其正常生理作用打破种子休眠、促进植物成熟和衰老等,正常情况下植物体内的乙烯含量维持在极低水平。在重金属胁迫下,乙烯的合成将大大增加,从而抑制植物生长,甚至导致植物死亡。通常认为植物体内乙烯的合成途径是由蛋氨酸-S-腺苷甲硫氨酸(S-adenosyl methionine,SAMe)经由ACC合成酶合成ACC,再经ACC氧化酶生成乙烯和氢氰酸。部分内生菌可以分泌ACC脱氨酶,分解ACC,生成氨和α-丁酮酸,从而降低植物体内的乙烯含量,打破应激乙烯的抑制作用,氨还可作为氮源被植物吸收利用。Madhaiyan等[19]通过对番茄(Lycopersicon esculentum L.)的研究发现,接种具有分泌ACC脱氨酶能力的两株菌Methylobacterium oryzae CBMB20和Burkholderia sp. CBMB40均显著降低了镉和镍胁迫下幼苗体内的乙烯含量,并显著提高了生物量。
2.3 内生菌对植物吸收营养元素的影响重金属胁迫给植物带来的伤害效应之一便是营养胁迫伤害,即阻碍植物吸收维持正常生理功能所必需的营养元素。短期实验表明,Cd胁迫下,豌豆苗内N、K等大量元素含量显著降低,其对Zn、Mn、Fe等微量元素的吸收也受到不同程度的抑 制[20]。内生菌除了可以通过溶磷、固氮作用为植物提供氮、磷元素,通过分泌铁载体促进植物对铁的吸收[21],还能通过一定的过程促进植物对其它微量元素的吸收。以50 μmol/L Cd处理龙葵(Solanum nigrum L.) 28 d后,相比不接种内生菌的处理,接种内生菌Serratia nematodiphila LRE07使根、茎、叶中的Mn元素含量分别提高49.47%、59.19%和7.24%,使茎、叶中的Zn元素含量分别提高33.22%和24.22%[22]。考虑到Zn、Mn、Fe等元素对植物的生理意义,内生菌促进这些微量元素的吸收也可能是内生菌协助宿主植物对重金属进行解毒的机制之一。
2.4 内生菌对植物光合系统的影响众多研究表明,重金属胁迫可对植物光合作用产生显著的抑制作用,且抑制程度与胁迫程度正相关,主要表现为叶绿素等光合色素含量的显著降低。研究表明,接种内生菌对宿主植物的光合色素含量有积极影响,从而提高重金属胁迫下植物的光合作用水平。Wan等通过对龙葵的研究发现,在 50 μmol/L Cd胁迫下,接种内生菌显著提高了植物叶片中的类胡萝卜素和叶绿素a、b的含量[22]。Mirzahossini等发现在90和180 mg/kg的Ni胁迫下,接种内生菌Epichloe显著提高了高羊茅(Festuca arundinacea Schreb.)中的总叶绿素含量[23]。考虑到铁元素是叶绿素合成有关酶的组成成分,有研究认为叶绿素含量的提高与细菌分泌的铁载体促进植物对铁元素的吸收有关[24]。
2.5 内生菌对植物抗氧化系统的影响在重金属胁迫下,植物体内的氧代谢发生失调,大量的活性氧(Reactive oxygen species,ROS)积累,如过氧化氢(H2O2)、超氧阴离子自由基()、羟基自由基(OH·)等,造成细胞膜脂过氧化损伤,膜脂被降解为丙二醛(Malondialdehyde,MDA)及其类似物,通透性增加,进而导致其他细胞结构的损伤[25]。植物的抗氧化系统能够对活性氧起到一定的去除作用,是植物耐受重金属的重要机制之一。抗氧化系统由酶促抗氧化剂和非酶促抗氧化剂组成,其中抗氧化系统酶主要有超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPX)等。众多研究表明,内生菌的接种对宿主植物的抗氧化系统具有积极意义,表现在MDA、H2O2等指标降低,以及各类抗氧化系统酶活性的增强。Naveed等通过二氨基联苯胺四盐酸盐(Diaminobenzidine tetrahydrochloride,DAB)染色法反映H2O2在玉米叶片中的分布情况,发现在有胁迫的条件下,叶片中H2O2明显增多,而分别接种两株内生菌Burkholderia phytofirmans PsJN和Enterobacter sp. FD17均能降低因胁迫积累的H2O2,且前者优于后者[26]。Wan等研究发现,在10 μmol/L和50 μmol/L Cd条件下,接种内生菌的龙葵植物叶片中的SOD、GPX、APX活性显著高于非接菌组[22]。
两大机制可以解释内生菌可以增强植物抗氧化系统酶活性。一方面,重金属胁迫本身可以诱导内生菌增强抗氧化系统,并能与植物的抗氧化系统产生协同作用。Abskharon等发现在不同浓度的Cu胁迫下,内生菌Escherichia coli ASU3的CAT、POD、APX活性相比无胁迫情况,均有不同程度提高[27]。另一方面,内生菌分泌的IAA也对抗氧化系统酶活性的增强存在潜在贡献。Kaya等[28]通过对玉米(Zea mays L.)进行叶面喷施纯IAA,发现可显著提高植株体内SOD、CAT等抗氧化系统酶活性,加强了植物的胁迫耐受性。El-Gaied等发现140 mg/L的IAA溶液浸泡番茄种子可提高幼苗体内的APX和CAT活性[29]。
在部分研究中,接种内生菌后植物体内抗氧化系统酶活性下降[30],这可能是因为该内生菌显著降低了植物体内重金属胁迫强度。作为植物的耐性机制之一,重金属本身可以诱导植物增强抗氧化系统,当内生菌通过吸收重金属等途径降低了胁迫强度,抗氧化系统酶活性也随之降低。
2.6 内生菌对植物重金属耐受性的其他潜在作用除了增强植物的抗氧化系统,内生菌分泌的IAA在促进植物合成植物络合素方面具有潜在作用,从而促进植物对重金属的络合解毒作用。研究表明微量外源IAA处理可以提高番茄植株体内的谷胱甘肽(Glutathione,GSH)水平[31]。由于GSH是植物络合素合成的前体,可以认为IAA处理对植物络合素的合成起一定的贡献作用。IAA作为信号分子之一,在植物重金属耐受性中发挥重要作用,但目前仍没有证据表明IAA是直接调控植物络合素的合成,还是通过抗氧化系统、乙烯信号系统[32]等途径间接调控。
除了分泌IAA,部分内生菌还具有分泌其它植物生长调节因子的能力。Shi等[33]从甜菜中分离出3株IAA产量较高的内生菌,发现它们还同时具有分泌赤霉素(Gibberellin,GA)、脱落酸(Abscisic acid,ABA)和玉米素核苷(Zeatin riboside,ZR)的能力,并能极显著提高相应的植物内源激素含量水平。植物生长调节因子作为基因表达和信号传导的关键物质,对植物的生命活动起着深远的影响,尤其是在植物抗逆性方面[34-36]。因此内生菌对植物重金属耐性的影响仍有许多关键过程待揭示。
3 展望在重金属污染土壤植物修复的过程中,如何提高植物对重金属的耐受性备受关注。相比采用化学调控措施,PGPB调控具有廉价、风险相对较低的优势。相比根际菌,内生菌生活在相对稳定的植物内环境,无需与土壤致病菌竞争,与植物的联系更加紧密,因此在实际应用中具有巨大的潜力。研究重金属胁迫下内生菌对宿主植物的解毒机制,尤其是内生菌增强植物重金属耐性的分子机制,具有重要意义。现有的研究大部分是考察接种内生菌后,植物的生物量及各项生理生化指标的变化情况,而要深入研究重金属胁迫下植物和微生物的互作机制,还需从亚细胞结构、基因组学和蛋白组学等方面进行研究。如研究接种内生菌对重金属在植物亚细胞结构中分布的影响,以及植物重金属耐性有关基因和蛋白的表达情况等。
重金属-植物-微生物是一个非常复杂的体系,要理清重金属胁迫下内生菌对宿主植物的解毒机制,还需将还原论和整体论有机结合起来[37]。依据还原论的思想,可单独对重金属胁迫下内生菌的响应情况,以及施用内生菌代谢产物的纯物质对植物重金属耐性的影响进行研究,如明确内生菌分泌的各植物生长调节因子影响植物信号系统的途径,这部分内容可与植物逆境生理学进行学科交叉。依据整体论的思想,可研究内生菌不同次级代谢产物对植物重金属耐性的贡献大小,以及内生菌对植物耐性基因表达的影响属于直接影响还是间接影响等。此外,内生菌与宿主植物的互作是一个动态过程,现有的研究大部分是对接种内生菌后某一时间点植物各生理生化指标进行考察,而要客观反映和全面阐述内生菌和植物的互作机制,则需要对接种内生菌后的各指标进行连续监测。因此,探索适合的在线监测和直观反映的方法,将有助于今后深入开展内生菌对宿主植物解毒机制的研究。
| [1] | Huo W, Cai QS. The advance of the enhancement of plant heavy metal resistance by plant growth-promote bacteria[J]. Microbiology China 2010, 37(9) : 1374–1378. (in Chinese) 霍伟, 蔡庆生. 植物促生菌提高植物重金属耐受性研究进展[J]. 微生物学通报 2010, 37(9) : 1374–1378. |
| [2] | Sessitsch A, Kuffner M, Kidd P, et al. The role of plant-associated bacteria in the mobilization and phytoextraction of trace elements in contaminated soils[J]. Soil Biology and Biochemistry 2013, 60 : 182–194. DOI:10.1016/j.soilbio.2013.01.012 |
| [3] | Ma Y, Prasad MNV, Rajkumar M, et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils[J]. Biotechnology Advances 2011, 29(2) : 248–258. DOI:10.1016/j.biotechadv.2010.12.001 |
| [4] | Glick BR. Using soil bacteria to facilitate phytoremediation[J]. Biotechnology Advances 2010, 28(3) : 367–374. DOI:10.1016/j.biotechadv.2010.02.001 |
| [5] | Gao Y, Miao CY, Mao L, et al. Improvement of phytoextraction and antioxidative defense in Solanum nigrum L. under cadmium stress by application of cadmium-resistant strain and citric acid[J]. Journal of Hazardous Materials 2010, 181(1/3) : 771–777. |
| [6] | Chen YM, Bai J, Yang YX, et al. Phytoremediation of Pb polluted soil by kenaf with assistance of plant growth promoting rhizobacterium (PGPR)[J]. Journal of Agro-Environment Science 2013, 32(11) : 2159–2167. (in Chinese) 陈燕玫, 柏珺, 杨煜曦, 等. 植物根际促生菌辅助红麻修复铅污染土壤[J]. 农业环境科学学报 2013, 32(11) : 2159–2167. |
| [7] | Chen FB, Bai J, Lin QQ, et al. Application of plant growth-promoting rhizobacteria (PGPR) for reducing zinc stress on paddy rice[J]. Journal of Agro-Environment Science 2012, 31(1) : 67–74. (in Chinese) 陈佛保, 柏珺, 林庆祺, 等. 植物根际促生菌(PGPR)对缓解水稻受土壤锌胁迫的作用[J]. 农业环境科学学报 2012, 31(1) : 67–74. |
| [8] | Akello J, Dubois T, Coyne D, et al. Endophytic Beauveria bassiana in banana (Musa spp.) reduces banana weevil (Cosmopolites sordidus) fitness and damage[J]. Crop Protection 2008, 27(11) : 1437–1441. DOI:10.1016/j.cropro.2008.07.003 |
| [9] | Ma Y, Luo YM, Teng Y, et al. Effects of endophytic bacteria enhancing phytoremediation of heavy metal contaminated soils[J]. Acta Pedologica Sinica 2013, 50(1) : 195–202. (in Chinese) 马莹, 骆永明, 滕应, 等. 内生细菌强化重金属污染土壤植物修复研究进展[J]. 土壤学报 2013, 50(1) : 195–202. |
| [10] | Sheng XF, Xia JJ, Jiang CY, et al. Characterization of heavy metal-resistant endophytic bacteria from rape (Brassica napus) roots and their potential in promoting the growth and lead accumulation of rape[J]. Environmental Pollution 2008, 156(3) : 1164–1170. DOI:10.1016/j.envpol.2008.04.007 |
| [11] | Ma Y, Oliveira RS, Nai FJ, et al. The hyperaccumulator Sedum plumbizincicola harbors metal-resistant endophytic bacteria that improve its phytoextraction capacity in multi-metal contaminated soil[J]. Journal of Environmental Management 2015, 156 : 62–69. DOI:10.1016/j.jenvman.2015.03.024 |
| [12] | Vijayaraghavan K, Yun YS. Bacterial biosorbents and biosorption[J]. Biotechnology Advances 2008, 26(3) : 266–291. DOI:10.1016/j.biotechadv.2008.02.002 |
| [13] | Luo SL, Wan Y, Xiao X, et al. Isolation and characterization of endophytic bacterium LRE07 from cadmium hyperaccumulator Solanum nigrum L. and its potential for remediation[J]. Applied Microbiology and Biotechnology 2011, 89(5) : 1637–1644. DOI:10.1007/s00253-010-2927-2 |
| [14] | Greenward J, Zeder-Lutz G, Hagege A, et al. The metal dependence of pyoverdine interactions with its outer membrane receptor FpvA[J]. Journal of Bacteriology 2008, 190(20) : 6548–6558. DOI:10.1128/JB.00784-08 |
| [15] | Wang YL, Lin QQ, Li Y, et al. Application potential of siderophore-producing rhizobacteria in phytoremediation of heavy metals-contaminated soils: a review[J]. Chinese Journal of Applied Ecology 2013, 24(7) : 2081–2088. (in Chinese) 王英丽, 林庆祺, 李宇, 等. 产铁载体根际菌在植物修复重金属污染土壤中的应用潜力[J]. 应用生态学报 2013, 24(7) : 2081–2088. |
| [16] | Francis AJ, Dodge CJ, Gillow JB. Biodegradation of metal citrate complexes and implications for toxic-metal mobility[J]. Nature 1992, 356(6365) : 140–142. DOI:10.1038/356140a0 |
| [17] | Haferburg G, Kothe E. Metallomics: lessons for metalliferous soil remediation[J]. Applied Microbiology & Biotechnology 2010, 87(4) : 1271–1280. |
| [18] | Haferburg G, Groth I, Mllmann U, et al. Arousing sleeping genes: shifts in secondary metabolism of metal tolerant actinobacteria under conditions of heavy metal stress[J]. BioMetals 2009, 22(2) : 225–234. DOI:10.1007/s10534-008-9157-4 |
| [19] | Madhaiyan M, Poonguzhali S, Sa T. Metal tolerating methylotrophic bacteria reduces nickel and cadmium toxicity and promotes plant growth of tomato (Lycopersicon esculentum L.)[J]. Chemosphere 2007, 69(2) : 220–228. DOI:10.1016/j.chemosphere.2007.04.017 |
| [20] | Sandalio LM, Dalurzo HC, Gómez M, et al. Cadmium-induced changes in the growth and oxidative metabolism of pea plants[J]. Journal of Experimental Botany 2001, 52(364) : 2115–2126. |
| [21] | Rajkumar M, Ae N, Prasad MNV, et al. Potential of siderophore-producing bacteria for improving heavy metal phytoextraction[J]. Trends in Biotechnology 2010, 28(3) : 142–149. DOI:10.1016/j.tibtech.2009.12.002 |
| [22] | Wan Y, Luo SL, Chen JL, et al. Effect of endophyte-infection on growth parameters and Cd-induced phytotoxicity of Cd-hyperaccumulator Solanum nigrum L.[J]. Chemosphere 2012, 89(6) : 743–750. DOI:10.1016/j.chemosphere.2012.07.005 |
| [23] | Mirzahossini Z, Shabani L, Sabzalian MR, et al. ABC transporter and metallothionein expression affected by Ni and Epichloe endophyte infection in tall fescue[J]. Ecotoxicology and Environmental Safety 2015, 120 : 13–19. DOI:10.1016/j.ecoenv.2015.05.025 |
| [24] | Dimkpa CO, Merten D, Svatoš A, et al. Siderophores mediate reduced and increased uptake of cadmium by Streptomyces tendae F4 and sunflower (Helianthus annuus), respectively[J]. Journal of Applied Microbiology 2009, 107(5) : 1687–1696. DOI:10.1111/jam.2009.107.issue-5 |
| [25] | Schützendübel A, Polle A. Plant responses to abiotic stresses: heavy metal-induced oxidative stress and protection by mycorrhization[J]. Journal of experimental botany 2002, 53(372) : 1351–1365. DOI:10.1093/jexbot/53.372.1351 |
| [26] | Naveed M, Mitter B, Reichenauer TG, et al. Increased drought stress resilience of maize through endophytic colonization by Burkholderia phytofirmans PsJN and Enterobacter sp. FD17[J]. Environmental and Experimental Botany 2014, 97 : 30–39. DOI:10.1016/j.envexpbot.2013.09.014 |
| [27] | Abskharon RNN, Hassan SHA, Kabir MH, et al. The role of antioxidants enzymes of E. coli ASU3, a tolerant strain to heavy metals toxicity, in combating oxidative stress of copper[J]. World Journal of Microbiology & Biotechnology 2010, 26(2) : 241–247. |
| [28] | Kaya C, Ashraf M, Dikilitas M, et al. Alleviation of salt stress-induced adverse effects on maize plants by exogenous application of indoleacetic acid (IAA) and inorganic nutrients-A field trial[J]. Australian Journal of Crop Science 2013, 7(2) : 249–254. |
| [29] | El-Gaied LF, Abu El-Heba GA, El-Sherif NA. Effect of growth hormones on some antioxidant parameters and gene expression in tomato[J]. GM Crops & Food 2014, 4(1) : 67–73. |
| [30] | Mirzahosseini Z, Shabani L, Sabzalian MR, et al. Neotyphodiumendophytes may increase tolerance to Ni in tall fescue[J]. European Journal of Soil Biology 2014, 63 : 33–40. DOI:10.1016/j.ejsobi.2014.05.004 |
| [31] | Tyburski J, Tretyn A. Glutathione and glutathione disulfide affect adventitious root formation and growth in tomato seedling cuttings[J]. Acta Physiologiae Plantarum 2010, 32(2) : 411–417. DOI:10.1007/s11738-009-0418-9 |
| [32] | Song YJ, Joo JH, Ryu HY, et al. Reactive oxygen species mediate IAA-lnduced ethylene production in mungbean (Vigna radiata L.) hypocotyls[J]. Journal of Plant Biology 2007, 50(1) : 18–23. DOI:10.1007/BF03030595 |
| [33] | Shi YW, Lou K, Li C. Promotion of plant growth by phytohormone-producing endophytic microbes of sugar beet[J]. Biology and Fertility of Soils 2009, 45(6) : 645–653. DOI:10.1007/s00374-009-0376-9 |
| [34] | Nitta Y, Ding PT, Zhang YL. Heterotrimeric G proteins in plant defense against pathogens and ABA signaling[J]. Environmental and Experimental Botany 2015, 114 : 153–158. DOI:10.1016/j.envexpbot.2014.06.011 |
| [35] | Li SW, Leng Y, Feng L, et al. Involvement of abscisic acid in regulating antioxidative defense systems and IAA-oxidase activity and improving adventitious rooting in mung bean[Vigna radiata (L.)Wilczek] seedlings under cadmium stress[J]. Environmental Science and Pollution Research 2014, 21(1) : 525–537. DOI:10.1007/s11356-013-1942-0 |
| [36] | Ha S, Vankova R, Yamaguchi-Shinozaki K, et al. Cytokinins: metabolism and function in plant adaptation to environmental stresses[J]. Trends in Plant Science 2012, 17(3) : 172–179. DOI:10.1016/j.tplants.2011.12.005 |
| [37] | Philippot L, Raaijmakers JM, Lemanceau P, et al. Going back to the roots: the microbial ecology of the rhizosphere[J]. Nature Reviews Microbiology 2013, 11(11) : 789–799. DOI:10.1038/nrmicro3109 |
 2016, Vol. 43
2016, Vol. 43