扩展功能
文章信息
- 罗玮, 姜宏亮, 马浩
- LUO Wei, JIANG Hong-Liang, MA Hao
- 一株乙草胺降解菌的分离及其降解特性研究
- Isolation and degradation characteristics of an acetochlor-degrading strain
- 微生物学通报, 2016, 43(12): 2678-2685
- Microbiology China, 2016, 43(12): 2678-2685
- DOI: 10.13344/j.microbiol.china.150768
-
文章历史
- 收稿日期: 2015-10-10
- 接受日期: 2016-09-14
- 优先数字出版日期(www.cnki.net): 2016-09-30
随着我国经济的快速发展,局部地区种植业已经开始向集约化发展,除草剂的使用量也在快速增加。乙草胺在我国旱田化学除草剂中占有相当重要的地位,可与众多的除草剂复配,是我国生产量和使用量最多的三大除草剂之一[1]。乙草胺是由美国孟山都公司于1971年研制,通用名称为乙草胺(Acetochlor),商品名称有禾耐斯、消草安等,化学名称为2-氯代-乙基-6-甲基-N-(乙氧甲基)乙酞替苯胺。乙草胺对人畜低毒,但对鱼类有较强的毒性,另外具有较强致癌性,被美国环保局定为B-2类致癌物[2]。乙草胺对土壤微生物种群数量及土壤中细菌、放线菌和真菌生长速率均有一定的抑制作用,对土壤微生物呼吸作用具有明显的抑制作用[3-5]。
乙草胺在自然界中的降解方式主要包括水解、光解、以及微生物降解,其中微生物降解为最主要方式。目前,关于利用土壤微生物降解酰胺类除草剂的研究已有不少报道,但是关于乙草胺微生物降解的报道较少[6]。朱九生等[7]研究表明,乙草胺在未灭菌土壤中防除稗草的持效期显著短于灭菌土壤,可见微生物的存在缩短了乙草胺在土壤中的滞留时间,从而降低了乙草胺防除稗草的持效性。尽管如此,乙草胺的好氧生物降解性较差,属于难生物降解有机物,含乙草胺的废水为高难度处理有机废水[8]。
目前,国内外筛选出纯种菌株进行乙草胺降解的研究非常有限。倪俊等[9]从长期受乙草胺污染的污泥中分离到一株能以乙草胺为唯一碳源生长的菌株,经鉴定为申氏杆菌属(Shinella sp.),对乙草胺的降解率达到83.3%。董滨等[10]从农药厂污泥和长期受乙草胺污染的土壤中分离到一株能以乙草胺为唯一氮源生长的粘着剑菌(Ensifer adhaerens),该菌株在含10 mg/L乙草胺的无机盐培养基中培养 10 d后对乙草胺的降解率为33.6%,培养基中的盐浓度影响该菌株的生长和对乙草胺的降解,在NaCl浓度为0.5%时,降解率可达35%;但当NaCl浓度达到7%时,对乙草胺的降解率仅有2.6%。Xu等[11]从生产乙草胺的农药厂筛选出一株以乙草胺为碳源的菌株食油假单胞菌(Pseudomonas oleovorans),该菌株7 d时间对7.6 mg/L乙草胺的降解率为98.0%,而且可以耐受高浓度的乙草胺,但是降解周期较长、降解率明显下降。Xu等[12]从受乙草胺污染的土壤中分离出4个可以降解乙草胺的微生物种群,4个微生物种群混合培养时4 d可以完全降解55 mg/L乙草胺,4个微生物种群包含了17种菌株,但是没有一种菌株可以单独降解乙草胺。本文拟采用富集培养试图从农药厂附近长期受乙草胺污染的土壤中分离出降解乙草胺的微生物,研究不同因素对其降解乙草胺的影响,确定其降解乙草胺的最佳条件,为进行乙草胺污染生物修复提供技术支持和微生物资源。
1 材料与方法 1.1 主要试剂和仪器乙草胺原药(93.1%)购于无锡禾美农药有限公司,乙草胺标准品(99.5%)购于西格玛奥德里奇(上海)贸易有限公司。其他试剂为分析纯或生物试剂。振荡培养箱(HYL-C),江苏太仓强乐实验设备有限公司;显微镜(CX23),奥林巴斯(中国)有限公司;液相色谱仪(LC-20AD),配置SPD-20AV检测器和Agilent TC C18色谱柱(长25 cm,内径4.6 mm,膜厚0.5 μm),日本岛津公司。
1.2 培养基LB培养基(g/L):蛋白胨10.0,酵母膏5.0,NaCl 10.0,pH 7.0,1×105 Pa湿热灭菌20 min。
无机盐培养基(g/L):NaCl 1.0,K2HPO4 1.5,KH2PO4 0.5,MgSO4 0.2,1 mL的微量元素液,pH 7.0,1×105 Pa湿热灭菌20 min后使用。
微量元素液(mg/L):MnSO4·H2O 39.9,ZnSO4·H2O 42.8,(NH4)6Mo7O4·4H2O 34.7。
1.3 乙草胺降解菌的筛选及培养取乙草胺生产工厂附近表层0-20 cm的土壤,称量采集到的土壤5 g接种到100 mL的LB培养基中,37 ℃、180 r/min培养48 h;取2.5 mL通过增殖培养获得的菌液,添加到乙草胺浓度为5 mg/L的25 mL的无机盐培养基中。培养7 d后,吸取培养液转接到新鲜的添加乙草胺的无机盐培养基中,反复转接并逐级提高乙草胺浓度到20 mg/L。取终末选择性培养液,划线接种于添加了10 mg/L乙草胺的无机盐琼脂培养基平板上倒置于恒温培养箱中培养合适的时间。挑取生长较好的单菌落,进一步分离纯化3-4次。
以乙草胺作为唯一碳氮源或者其他碳氮源添加到上述无机盐中制备成培养基,按照2% (体积比)接种经过分离纯化的菌株A-1到上述培养基中去,37 ℃、180 r/min培养,每组实验重复3次。其间定时取样或者在培养5 d后取样分析生物量和乙草胺浓度。生物量分析采用分光光度计,将菌悬液稀释至合适浓度后置于600 nm处测定其OD值。数据采用其平均值并标注标准差,应用SPSS 19.0进行统计学分析,各组间采用One-Way ANOVA进行统计学分析,多重比较采用LSD法。
1.4 乙草胺的分析方法采用外标法进行乙草胺浓度的定量,根据标准曲线计算溶液中乙草胺的浓度。乙草胺标准曲线制备:配制一系列梯度浓度的乙草胺标准溶液,采用液相色谱法进行分析,根据乙草胺的浓度和峰面积制作其标准曲线。
样品分析:从含有乙草胺的无机盐培养基中吸取适量菌液到1.5 mL离心管中,置于离心机中,12 000 r/min离心10 min,取上清,过膜孔0.45 μm的水膜处理。取1 mL上清液用液相色谱测定样液中乙草胺的含量。液相色谱条件:检测波长为 215 nm,流动相为甲醇-水(80/20,体积比),流速1.0 mL/min,进样量:10 μL。
1.5 微生物菌株的形态学及分子生物学鉴定对分离菌株采用平板形态观察、革兰氏染色和显微镜观察等手段进行形态学初步分析[13-14]。
微生物基因组DNA提取、PCR反应与16S rRNA基因测序由上海生工生物工程技术服务有限公司完成。16S rRNA基因引物为27f (5′-CAGAGT TTGATCCTGGCT-3′)和1540r (5′-AGG AGGTGA TCCAGCCGCA-3′)。PCR反应体系(25 μL)包含基因组模板1 μL,上下游引物(10 μmol/L)各0.5 μL,dNTPs (各10 mmol/L) 0.5 μL,10×PCR buffer 2.5 μL,Taq聚合酶0.2 μL,ddH2O补足至25 μL。PCR扩增条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 35 s,72 ℃ 1 min,35个循环;72 ℃ 8 min。反应产物纯化后进行测序。对于获得的序列采用MEGA 6.0软件进行多序列比对及系统发育树构建[15]。
1.6 正交试验设计方法选择葡萄糖、蛋白胨和乙草胺等因素设计正交试验,其因素及水平安排如表 1所示。
| 水平 Level | 葡萄糖 (G) Glucose (g/L) | 蛋白胨 (P) Peptone (g/L) | 乙草胺 (A) Acetochlor (mg/L) |
| 1 | 10.0 | 7.5 | 10.0 |
| 2 | 2.0 | 2.5 | 20.0 |
| 3 | 5.0 | 5.0 | 5.0 |
通过划线分离获得多株可降解乙草胺的菌株,其中A-1菌落生长最快,菌落最大,呈圆润淡黄色,其菌落形态如图 1所示。经结晶紫简单染色后置于光学显微镜下观察,菌株A-1菌体细长且长短不一,有时呈球杆状或线状,成对或短链状排列,革兰氏染色呈阴性。

|
| 图 1 菌株A-1在乙草胺平板上的菌落形态 Figure 1 Colonial morphology of the strain A-1 in the acetochlor solid medium |
|
|
根据上海生工分析测序结果,用BLAST程序对菌株A-1的16S rRNA基因序列与GenBank数据库中已收录的其他相似序列进行核酸序列同源性比较。结果表明该菌与铜绿假单胞菌(Pseudomonas aeruginosa)具有100%相似性,因此将其确定为该种菌,GenBank登录号为KX426044.1。构建的系统发育树如图 2所示。

|
| 图 2 菌株A-1与相关菌株的系统发育树 Figure 2 Phylogenetic tree of strain A-1 and its relatives 注:线段0.005表示序列差异的分支长度;发育树节点的数值表示Bootstrap值;括号内的数值为GenBank数据库中的登录号. Note:Bar=0.5% nucleotide divergence; Number at notes present bootstrap percentages (based on 1 000 sampling); Those in parentheses are the GenBank accession number. |
|
|
前期研究表明,菌株A-1能以乙草胺作为唯一碳源和氮源生长,其降解乙草胺能力大小与其生长情况密切相关,但是农药的毒性通常抑制菌体的生长,制约菌体的降解能力。通常情况下,微生物对农药的降解能力与外界环境中农药浓度、营养物质等也有着密切的关系。因此对上述几个影响因素进行了研究。
2.2.1 菌株A-1以乙草胺作为唯一碳氮源的降解曲线及其生长曲线:添加10 mg/L乙草胺作为唯一碳氮源,定时取样,获得菌株A-1的生长情况和乙草胺的降解率(图 3)。可以看出,菌株A-1的生长曲线和乙草胺的降解曲线趋势相吻合,说明菌株A-1对乙草胺的降解能力是随着其在培养基中的生长而提高,菌株的降解能力和菌株的数量成正相关。1-5 d是菌体的对数生长期,此时乙草胺的降解率提高速度最快,表明由于处于对数生长期的菌体大量增殖,使乙草胺的降解速度加快;5 d后菌株A-1的生长能力和对乙草胺的降解能力逐渐趋于平衡。其原因可能是达到一定时间后,培养液中菌株可利用的有效物质减少,并且微生物在降解乙草胺的过程中会产生抑制菌体生长的次代谢产物,所以菌体生长量下降,对乙草胺的降解率趋于不变。以5 d计算,该菌株对乙草胺的平均降解速率是0.78 mg/(L·d)。
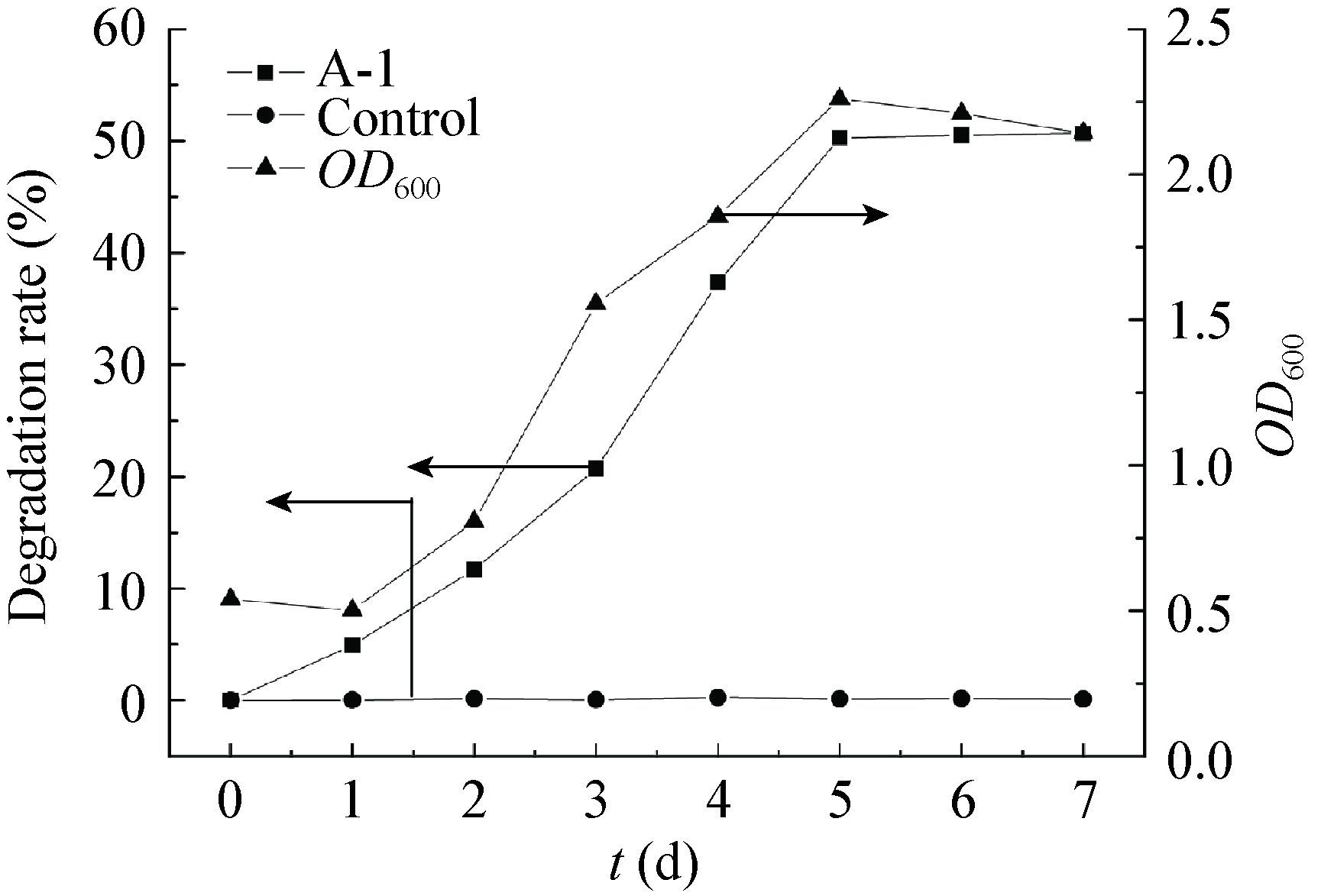
|
| 图 3 乙草胺的降解曲线与菌株的生长曲线 Figure 3 The degradation curve of acetochlor and the growth curve of the strain |
|
|
2.2.2 初始乙草胺浓度对乙草胺降解的影响:将菌株A-1接种于初始乙草胺浓度不同的培养基中,其生物量和乙草胺降解情况如图 4所示。在乙草胺初始浓度为10 mg/L时,A-1对乙草胺的降解最完全,降解率达到了48.7%,与其他组别的降解率差异显著(p<0.05)。同样培养条件下,当乙草胺的浓度下降时,菌株A-1对乙草胺的降解率也随之降低,而当乙草胺浓度增加时,菌株A-1对乙草胺的降解率也呈下降趋势。由此可知,菌株A-1只能对一定浓度范围内的乙草胺具有较充分强的降解。乙草胺浓度小于10 mg/L时,菌株A-1对于乙草胺的降解能力下降,可能是因为较低浓度的乙草胺不能够为菌体的生长提供足够的碳源和能源,生物量(OD)较低,从而导致降解能力的下降。当乙草胺的浓度在20-100 mg/L时,高浓度的乙草胺对菌株A-1的生长产生了明显的毒害作用,抑制了菌体的生长,从而限制了其对乙草胺的降解程度。从降解效率角度来说,在0-100 mg/L的浓度范围内,较高初始浓度乙草胺能被降解的绝对量要大大高于低初始浓度乙草胺。
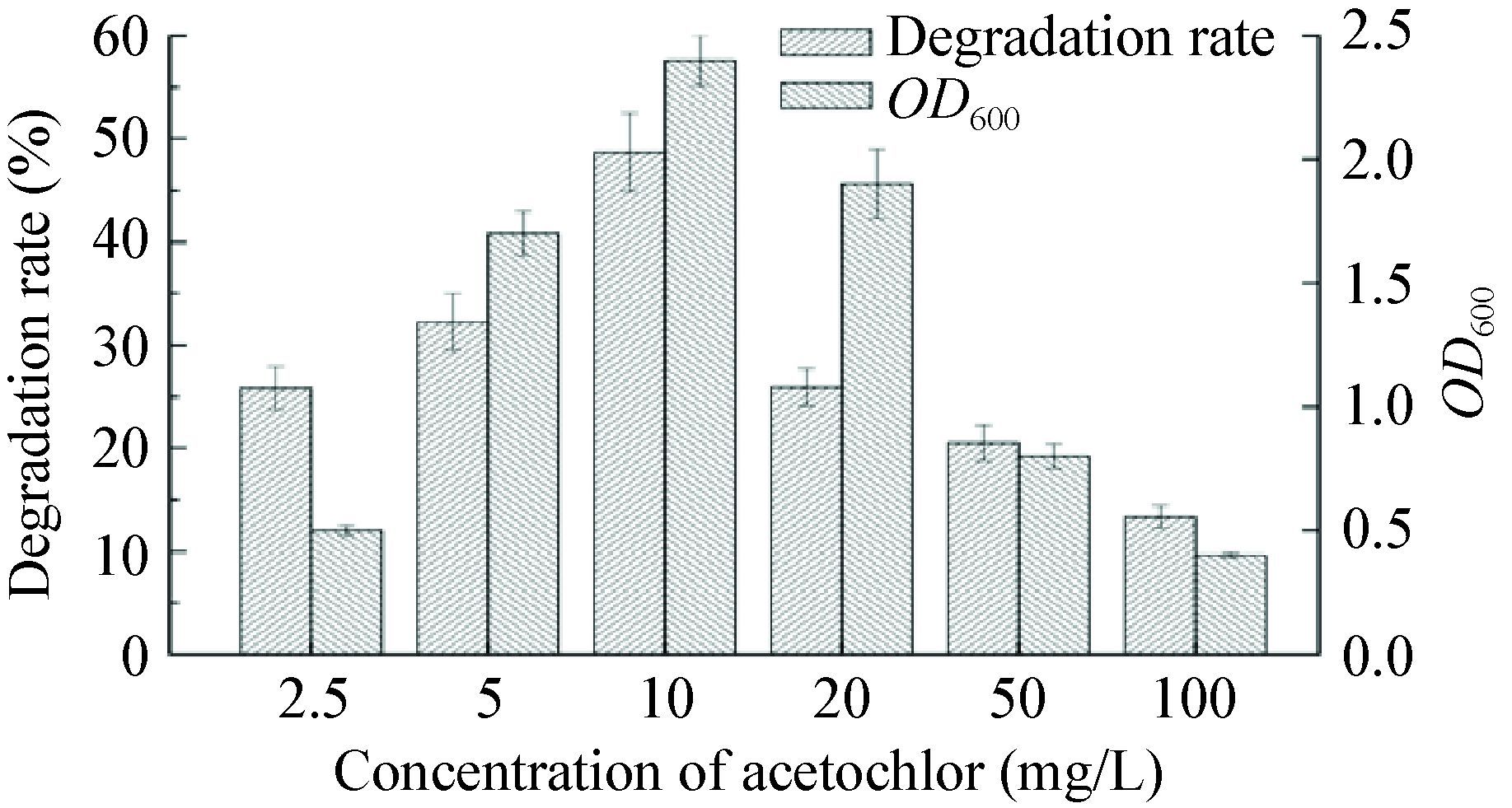
|
| 图 4 初始乙草胺浓度对乙草胺降解的影响 Figure 4 Effect of the initial acetochlor concentration on its degradation |
|
|
2.2.3 外加碳源对乙草胺降解的影响:培养基中的碳源种类会影响菌株的生长和对乙草胺的降解,本实验分析了不同外加碳源(柠檬酸三钠、淀粉、蔗糖、葡萄糖)对菌株A-1降解乙草胺的影响。将菌株A-1接种于含有上述几种碳源(5 g/L)或者不添加碳源(对照)的无机盐培养基中,测定10 mg/L乙草胺的降解情况,结果如图 5所示。多重比较结果表明,与未添加碳源的对照组相比,碳源的添加明显促进了乙草胺的降解(p<0.05)。其中添加葡萄糖时A-1对乙草胺的降解效果最明显,降解率达到了65.6%,与对照相比差异极显著(p<0.01)。这表明葡萄糖的添加能明显促进菌体生长,增加乙草胺相关降解酶系的含量。

|
| 图 5 不同外加碳源对乙草胺降解的影响 Figure 5 Effect of additional carbon source on the degradation of acetochlor |
|
|
2.2.4 外加氮源对乙草胺降解的影响:分析不同外加氮源(蛋白胨,酵母粉,NaNO3)对菌株A-1降解乙草胺的影响。将菌株A-1接种于10 mg/L的乙草胺,并分别添加上述几种氮源(5 g/L)或者不添加氮源(对照)的无机盐培养基中培养,测定乙草胺的降解情况(图 6)。多重比较可知,外加氮源能显著促进乙草胺降解,与对照相比差异显著(p<0.05),但是蛋白胨和酵母粉实验组间并无统计学差异。

|
| 图 6 不同外加氮源对乙草胺降解的影响 Figure 6 Effect of additional nitrogen source on the degradation of acetochlor |
|
|
为提高菌株A-1对乙草胺的降解能力,采用正交试验方法确定菌株A-1的最佳培养条件。根据之前的研究结果,外加碳源以葡萄糖对于促进乙草胺降解效果最好,氮源中蛋白胨为最佳,另外初始乙草胺浓度对于其降解影响非常明显。因此选取葡萄糖、蛋白胨、乙草胺进行正交试验,采用L9(34)正交表来安排试验,为确保试验的准确性,每组试验设置两个平行,试验结果取其平均值。
2.3.1 极差分析:表 2中的K1、K2、K3分别表示在各因素各水平下菌株A-1对乙草胺降解率的总和,k1、k2、k3分别表示在各因素各水平下乙草胺降解率的平均值。用同一因素各水平下平均降解率的极差R (极差=平均提取量的最大值-平均提取量的最小值)来反映各因素的水平变动对降解率影响的大小。极差大就表示该因素的水平变动对试验结果的影响大,极差小就表示该因素的水平变动对试验结果的影响小。
| 实验号 Trial No. | 葡萄糖 (G) Glucose (g/L) | 蛋白胨 (P) Peptone (g/L) | 乙草胺 (A) Acetochlor (mg/L) | 降解率 Degradation rate (%) |
| 1 | 10.0 | 7.5 | 10.0 | 55.3±3.5 |
| 2 | 10.0 | 2.5 | 20.0 | 52.4±2.8 |
| 3 | 10.0 | 5.0 | 5.0 | 70.3±4.8 |
| 4 | 2.0 | 7.5 | 20.0 | 44.4±3.7 |
| 5 | 2.0 | 2.5 | 5.0 | 66.2±6.1 |
| 6 | 2.0 | 5.0 | 10.0 | 57.6±4.4 |
| 7 | 5.0 | 7.5 | 5.0 | 63.5±5.7 |
| 8 | 5.0 | 2.5 | 10.0 | 72.2±5.8 |
| 9 | 5.0 | 5.0 | 20.0 | 44.7±3.1 |
| K1 | 178.0 | 163.2 | 185.1 | |
| K2 | 168.2 | 190.8 | 141.5 | |
| K3 | 180.4 | 172.6 | 200.0 | |
| k1 | 59.3 | 54.4 | 61.7 | |
| k2 | 56.1 | 63.6 | 47.2 | |
| k3 | 60.1 | 57.5 | 66.7 | |
| R | 4.1 | 9.2 | 19.5 |
由表 2得到本次实验因素的主次顺序依次为:乙草胺浓度(A)、蛋白胨含量(P)、葡萄糖含量(G)。同时可以得到各因素的最佳搭配为G3P2A3。即最佳的搭配为:葡萄糖5.0 g/L,蛋白胨2.5 g/L,乙草胺 5.0 mg/L。按此搭配的试验在正交表的9次试验中并没有出现,需要做补充试验进行验证。
2.3.2 方差分析:正交试验的极差分析法简便、直观、计算量小,但不能估计试验误差,即不能区分试验结果的差异是由各因素的水平变化而导致,还是由试验的随机波动而导致。为了解决此问题,需要对试验结果做方差分析。对上述试验结果采用Excel软件做了方差分析,结果如表 3所示。由表 3可知各因素对试验结果的影响程度,乙草胺(A)对结果影响最大,蛋白胨(P)次之,而最后是葡萄糖(G),这个结果与极差分析的结果一致。
2.3.3 验证试验:根据正交试验分析的结果,G3P2A3为最佳组合,即葡萄糖5.0 g/L,蛋白胨2.5 g/L,乙草胺5.0 mg/L。将菌株A-1接种于该培养基中,为保证实验的精确性,每组实验进行3次。结果显示乙草胺降解率达到80.2%,高于正交试验中最高的72.2%,在此条件下的平均降解速率达到0.95 mg/(L·d)。
| 因素 Factor | 平方和 Sum of square | 自由度 Degree of freedom | 方差 Variance | F |
| 葡萄糖 (G) Glucose (G) | 27.8 | 2 | 13.9 | 0.4 |
| 蛋白胨 (P) Peptone (P) | 131.3 | 2 | 65.6 | 1.8 |
| 乙草胺 (A) Acetochlor (A) | 616.1 | 2 | 308.1 | 8.4 |
| 误差项 Error term | 73.5 | 2 | 36.7 | 1.0 |
| Note: F0.25(2,2)=3.00,F0.10(2,2)=9.00. | ||||
乙草胺作为国内外广泛使用的一种除草剂,为农业增产增收做出了巨大贡献。但是长期大量使用也对环境和农业生态系统造成明显的危害,目前尚缺少有限手段解决此问题。除此以外,氯乙酰胺类除草剂的巨大产能伴随着大量富含乙草胺、丁草胺等工业生产废水的处理等问题。而环境生物技术的发展为上述问题提供了解决方案,特别是微生物菌种资源的不断发掘给氯乙酰胺类除草剂的生物修复带来希望。尽管如此,目前国内外在此领域研究报道较少。
本研究从长期受乙草胺污染的土壤中分离获得一株能以乙草胺为唯一碳氮源的微生物菌株,为革兰氏阴性菌,初步鉴定为铜绿假单胞菌。除草剂对微生物细胞具有毒性,过高浓度对菌体产生明显毒性,造成菌体无法生长,从而丧失降解能力。添加营养物质能减弱除草剂对细胞的毒性,提高细胞降解能力[16-17]。本研究通过额外添加碳源、氮源提高了菌株A-1对乙草胺的降解能力,并通过进一步正交试验设计和优化使其对乙草胺(5-10 mg/L)降解率达到72%-80%,与Xu等[11]获得的降解速率[1.07 mg/(L·d)]相当,远高于董滨等[10]获得的降解速率[0.33 mg/(L·d)]。本研究分离获得的乙草胺降解纯培养物为乙草胺的生物修复提供了菌种资源,其对乙草胺降解能力的基因资源有待进一步开发和利用。
| [1] | Wang LX. A survey and development trend of Chinese pesticide industry[J]. Pesticides 1999, 38(10) : 1–8. |
| [2] | Cai XY, Sheng GY, Liu WP. Degradation and detoxification of acetochlor in soils treated by organic and thiosulfate amendments[J]. Chemosphere 2007, 66(2) : 286–292. DOI:10.1016/j.chemosphere.2006.05.011 |
| [3] | Li XY, Su ZC, Li X, et al. Assessing the effects of acetochlor on soil fungal communities by DGGE and clone library analysis[J]. Ecotoxicology 2010, 19(6) : 1111–1116. DOI:10.1007/s10646-010-0493-0 |
| [4] | Guo XH, Qiao YH, Zhao J, et al. Indication and response of soil microbe to acetochlor[J]. Chinese Journal of Eco-agriculture 2009, 17(5) : 960–963. (in Chinese) 郭兴华, 乔玉辉, 赵晶, 等. 土壤微生物对除草剂乙草胺污染的响应和指示[J]. 中国生态农业学报 2009, 17(5) : 960–963. DOI:10.3724/SP.J.1011.2009.00960 |
| [5] | Jing RY, Wang LY, Tan HB, et al. Influence of acetochlor on soil microorganisms and soil respiration[J]. Chinese Journal of Soil Science 2011, 42(2) : 298–301. (in Chinese) 荆瑞勇, 王丽艳, 谭焕波, 等. 乙草胺对土壤微生物数量及土壤呼吸的影响[J]. 土壤通报 2011, 42(2) : 298–301. |
| [6] | Xu J, Qiu XH, Cao H, et al. Progresses on degradation of chloroacetanilide herbicides[J]. Chinese Journal of Applied and Environmental Biology 2004, 10(3) : 389–393. (in Chinese) 徐军, 邱星辉, 曹宏, 等. 氯乙酰胺类除草剂微生物降解研究进展[J]. 应用与环境生物学报 2004, 10(3) : 389–393. |
| [7] | Zhu JS, Qiao XW, Wang J, et al. Biodegradation of acetochlor in soil and its persistence against Echinochloa crusgalli[J]. Chinese Journal of Applied Ecology 2006, 17(3) : 489–492. (in Chinese) 朱九生, 乔雄梧, 王静, 等. 土壤中乙草胺的微生物降解及其对防除稗草持效性的影响[J]. 应用生态学报 2006, 17(3) : 489–492. |
| [8] | Qu FP, Yang YY, Feng XD, et al. Aerobic biodegradability of pesticides containing nitrogen and counter measure for the treatment of pesticide wastewater[J]. Environmental Science 1999, 20(4) : 12–15. (in Chinese) 瞿福平, 杨义燕, 冯旭东, 等. 含氮农药的好氧生物降解性能及废水治理对策[J]. 环境科学 1999, 20(4) : 12–15. |
| [9] | Ni J, Shen WL, Yan X, et al. Isolation and characterization of a acetochlor-degrading strain Y-4 and its degrading characteristics[J]. Journal of Agro-environment Science 2011, 30(5) : 946–951. (in Chinese) 倪俊, 沈维亮, 闫新, 等. 乙草胺降解菌Y-4的分离鉴定及降解特性研究[J]. 农业环境科学学报 2011, 30(5) : 946–951. |
| [10] | Dong B, Wang FH, Lin AJ, et al. Isolation and degradation characteristics of acetochlor-degrading strain A-3[J]. Environmental Science 2011, 32(2) : 542–547. (in Chinese) 董滨, 王凤花, 林爱军, 等. 乙草胺降解菌A-3的筛选及其降解特性[J]. 环境科学 2011, 32(2) : 542–547. |
| [11] | Xu J, Qiu XH, Dai JY, et al. Isolation and characterization of a Pseudomonas oleovorans degrading the chloroacetamide herbicide acetochlor[J]. Biodegradation 2006, 17(3) : 219–225. DOI:10.1007/s10532-005-4220-0 |
| [12] | Xu J, Yang M, Dai JY, et al. Degradation of acetochlor by four microbial communities[J]. Bioresource Technology 2008, 99(16) : 7797–7802. DOI:10.1016/j.biortech.2008.01.060 |
| [13] | Alper H, Miyaoku K, Stephanopoulos G. Characterization of lycopene-overproducing E. coli strains in high cell density fermentations[J]. Applied Microbiology and Biotechnology 2006, 72(5) : 968–974. DOI:10.1007/s00253-006-0357-y |
| [14] | Yoon SH, Lee YM, Kim JE, et al. Enhanced lycopene production in Escherichia coli engineered to synthesize isopentenyl diphosphate and dimethylallyl diphosphate from mevalonate[J]. Biotechnology and Bioengineering 2006, 94(6) : 1025–1032. DOI:10.1002/(ISSN)1097-0290 |
| [15] | Wang HB, Sun WT, Li HP, et al. Discharge characteristics of atmospheric-pressure radio-frequency glow discharges with argon/nitrogen[J]. Applied Physics Letters 2006, 89(16) : 161504. DOI:10.1063/1.2362631 |
| [16] | Luo W, Zhao YH, Ding HT, et al. Co-metabolic degradation of bensulfuron-methyl in laboratory conditions[J]. Journal of Hazardous Materials 2008, 158(1) : 208–214. DOI:10.1016/j.jhazmat.2008.02.115 |
| [17] | Luo W, Zhu XC, Chen WT, et al. Mechanisms and strategies of microbial cometabolism in the degradation of organic compounds-chlorinated ethylenes as the model[J]. Water Science and Technology 2014, 69(10) : 1971–1983. DOI:10.2166/wst.2014.108 |
 2016, Vol. 43
2016, Vol. 43