扩展功能
文章信息
- 陈婷, 王伟
- CHEN Ting, WANG Wei
- 毒死蜱乳油对辣椒根围土壤细菌群落结构的影响
- Effect of chlorpyrifos on bacterial community structure in pepper rhizosphere
- 微生物学通报, 2016, 43(12): 2657-2666
- Microbiology China, 2016, 43(12): 2657-2666
- DOI: 10.13344/j.microbiol.china.160021
-
文章历史
- 收稿日期: 2016-01-08
- 接受日期: 2016-05-13
- 优先数字出版日期(www.cnki.net): 2016-05-31
土壤微生物是土壤微生态中起调节作用的主要群体,其生命活动及代谢产物对土壤的肥力、有机质的矿化和腐化等各个方面都具有重要作用[1]。日常生态系统活动,如垃圾降解、促进植物生长、养分循环以及污染物或农药的生物降解等,都需要微生物的参与[2],而微生物多样性是保持其适当生态作用的重要条件。
有机磷农药作为一种高效、广谱的内吸性杀虫剂,被广泛应用于防治粮食等经济作物害虫。滥用有机磷农药会造成其在环境中的残留量逐步上升,对土壤污染日益严重,使土壤中微生物个体的数量大大减少,严重破坏土壤的微生态平衡[3]。毒死蜱[Chlorpyrifos,O, O-二乙基-O (3, 5, 6-三氯-2-吡啶基)硫代磷酸酯 ,CPF]是一种中等毒性有机磷杀虫剂、杀螨剂,是有机磷农药的代表之一[4]。毒死蜱杀虫谱广泛,几乎对大部分农作物上发生的虫害都能有效防护,特别是能有效保护一些主要作物如水稻、小麦、棉花等免受害虫侵蚀,多数国家还将其应用于白蚁的防治与控制[5]。毒死蜱在水中溶解度较小(25 ℃时2 mg/L),易与土壤中的有机质结合,能有效防治地下害虫,防治时间长达30 d [6]。
鉴于微生物在土壤中的重要作用,农药与土壤微生物间的相互作用一直被广泛研究(包括微生物碳,微生物氮,微生物群落,微生物功能多样性,微生物呼吸,酶活性,氮循环)。在20世纪 90年代就有学者研究毒死蜱对土壤微生物的影响情况[2]。在农田土壤中,毒死蜱以推荐用量10 μg/g和300 μg/g施药时,土壤细菌总量会减少,氮固定细菌显著减少,间接影响固氮效果,但真菌群落和反硝化细菌并不因毒死蜱的施入而受影响[7]。另有研究表明[8],在有机磷农药污染的土壤中,细菌群落的生长受到限制,而真菌群落却呈增加趋势,逐渐变成优势菌群;当这种现象严重时,会导致某些微生物灭迹,物种多样性下降,从而破坏微生态平衡。现阶段,已从污染土壤中分离出一部分高效有机磷农药降解菌[9-11],但是关于污染土壤中微生物种群的变化并没有很深入的研究。因此,有必要选取更有效的手段研究有机磷农药对土壤微生物群落结构的影响。
本研究结合平板计数、末端限制性片段多样性分析等方法研究毒死蜱对植物根围土壤细菌群落的影响,并用PRIMER 5多角度分析土壤微生物群落变化,从宏观意义上研究有机磷农药对土壤微生物的整体影响情况,全面了解毒死蜱的污染机制,对进一步修复土壤中毒死蜱污染具有指导性作用。
1 材料与方法 1.1 实验材料1.1.1 实验样品:毒死蜱(480 g/L乳油;美国默赛技术公司,农药登记号PD20084731) 。
室内盆栽实验所用土壤采自上海市奉贤区近 6年内未使用过农药的农田,去除表层土壤,收集近地面0-30 cm处的土壤,迅速运至实验室。在实验室内将备用土壤风干,过2 mm筛,混合均匀,将过筛土壤在室温下放置一周,盆栽试验备用。
1.1.2 主要试剂和仪器:细菌通用引物由生工生物工程(上海)有限公司合成;限制性内切酶,宝生物工程(大连)有限公司;ExTaq酶,北京康为世纪生物科技有限公司;琼脂糖凝胶DNA回收试剂盒,天根生物科技有限公司。
XW80-A旋窝混合器,上海青浦沪西仪器厂;FA2004分析天平,上海恒平科学仪器有限公司;HWS12型电热恒温水浴锅,上海一恒科学仪器有限公司;Centrifuge 5430/5430R高速离心机,微量移液器(2.5,10 µL),Bio Spectrometer Basic核酸定量仪,Eppendorf公司;hoefer eps 2A200电泳仪,Hoefer公司;S1000TM PCR仪,Bio-Rad公司;Gel Doc-It凝胶成像仪,UVP公司;ABI 3730XL测序仪,ABI公司。
1.1.3 培养基:Luria-Bertani培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,NaCl 5.0,琼脂15.0,pH 7.4。
1.2 室内盆栽试验实验选取农田常用品种朝天椒(Capsicum frutescens L.)的种子,根据GB/T3543.4-1995的方法进行纸上辣椒催芽育苗,待辣椒成苗后移栽入直径10 cm的圆形塑料花盆。每盆装600 g过筛土样,待辣椒苗成活后,去除长势弱的苗,留下3株备用。根据农田推荐用量,将毒死蜱(480 g/L乳油;美国默赛技术公司,农药登记号:PD20084731) 浓度分别设为:1.5、15、150 μg/g (表 1),每组3个重复。所有盆栽均在光照培养箱中培养,培养温度28 ℃,光照12 h,含水量保持为田间最大含水量的60%,每2 d浇水一次,保证水能使土壤湿润,且不漏出花盆。共栽培60 d。每10 d记录辣椒生长状况以及土壤取样。
| 编号 Number | 绝对体积 Absolute volume (μL/0.6 kg soil) | 土壤相对含量 Relative contents (μg/g) |
| CP1 | 1.875 | 1.5 |
| CP2 | 18.750 | 15.0 |
| CP3 | 187.500 | 150.0 |
将盆内辣椒连根拔起,不断抖动辣椒根部,收集土壤。去除土壤中植物根须、细石等杂质后过40目筛,置-20 ℃保存,作为根围土壤备用。
取10 g根围土壤,按1:2.5的比例配制成土壤悬液,150 r/min振荡15 min,静置30 min,用pH计测定土壤pH。平行处理3次,记录数据。土壤含水量采用烘干称重法进行测定[12],重复3次,取平均值。土壤有机碳采用重铬酸钾氧化法测定[12],总氮采用半微量开氏法测定[12],土壤粒径通过激光粒度仪(型号LS230) 分析法进行测定[13]。
1.4 土壤毒死蜱残留检测所有土壤中毒死蜱含量委托青岛科标化工分析检测有限公司用气相色谱-质谱对预处理后的溶液进行定量检测。根据GB/T19648-2006修改得到土壤毒死蜱残留检测方案的加标回收率为97.6%,该方法检出限为0.05 μg/g,适用于本次试验土壤中毒死蜱残留的检测。
根据《化学农药环境安全评价试验准则》农药在土壤的降解特性试验方法,通过降解半衰期t0.5来表示480 g/L毒死蜱乳油在土壤中的降解速率。经GC-MS检测得到土壤毒死蜱残留量,经指数回归方程计算得出本次试验中毒死蜱在室内盆栽土壤中的半衰期t0.5为22.06 d。
1.5 土壤可培养细菌计数准确称取根围土壤5 g至装有玻璃珠灭菌玻璃瓶,加45 mL无菌水,200 r/min振荡30 min,使土壤颗粒充分破碎,以此为10-1土壤悬液,制备10-4、10-5、10-6悬液涂布于Luria-Bertani培养基,正面朝上放置20-30 min,然后倒置于37 ℃恒温培养箱内培养72 h,计数。每一稀释梯度设6个重复,每个处理重复3次。
1.6 T-RFLP对土壤细菌多样性分析土壤总DNA提取是在Lamontagne等[14]的基础上改进,加入研磨、振荡等步骤,不断优化以提高总DNA的提取效率。
选用细菌通用型引物27F (5′-AGAGTTTGATC CTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTA CGACTT-3′)[15]扩增土壤细菌16S rRNA基因片段,上游引物5′末端用荧光物质6-FAM进行标记。
细菌16S rRNA基因的扩增条件和体系参照Don等[16],采用Touch-Down PCR对土壤总DNA中的细菌群落16S rRNA基因进行扩增,扩增产物用琼脂糖凝胶DNA回收试剂盒纯化回收,最后选用限制性内切酶Hae Ⅲ和HhaⅠ进行酶切[17]。酶切产物交由生工生物工程(上海)股份有限公司进行STR检测。
1.7 数据分析将经STR分析所得的末端限制性片段(Terminal restriction fragments,TRFs)数据去除片段长度小于50 bp和大于500 bp的数据以及荧光单位小于50的数据。计算筛选后每个TRF所占总峰面积的百分比,用于后续分析。
从土壤微生态群落结构角度,选用大型多元统计分析软件PRIMER 5 version 6.1.9 (PRIMER-E Ltd.,Plymouth,UK)对所得T-RFLP数据进行多角度分析[18]。通过非度量多维尺度模型(Non-metric multidimensional scaling approach,nMDS)和聚类分析(CLUSTER)对整体数据做相似性等级区分[19],通过非参数多元方法(ANOSIM)对全部数据进行相似性分析以及不同水平之间的配对比较,通过SIMPER分析得到不同毒死蜱处理组与对照组之间起主导作用的T-RFs[18]。其中nMDS、CLUSTER、ANOSIM都基于Bray-Curtis相似性矩阵。Bray-Curtis相似性矩阵先将所有数据标准化,再通过log(x+1) 对TRFs所有数据进行转化用于突出稀少和优势TRFs。
将由SIMPER分析得到的对毒死蜱影响下辣椒根围土壤微生物群落多样性贡献最大的几个TRFs利用Microbial community analysis III (http://mica.ibest.uidaho.edu/)的分析软件Virtual Digest (ISPaR)与RDP数据库进行在线比对,得到具体的相关细菌群落信息[20]。
采用单因素方差分析(One-way ANOVA)检验各组间数据的差异性。P<0.05认为差异显著。相关分析均采用SPSS 19.0 (IBM corporation)完成。
2 结果与分析 2.1 毒死蜱对辣椒根围土壤可培养细菌数量的影响本次盆栽实验所用的土壤为壤土,呈弱酸性(表 2)。毒死蜱处理(1.5 μg/g和15 μg/g)对土壤可培养细菌出现抑制-恢复的趋势。第10天,土壤可培养细菌数量与对照组相比,无差异 (P=0.575) ;第20天,各处理组可培养细菌属均低于空白对照,特别是15 μg/g毒死蜱处理组,差异显著(P=0.021) 。该抑制作用一直持续到第40天,而后恢复至对照水平;毒死蜱150 μg/g处理下,土壤可培养细菌出现抑制-促进-恢复的趋势。第20天,土壤可培养细菌数量显著低于空白对照(P=0.014) ;第30天,土壤可培养细菌数量显著高于空白对照(P=0.014) ;第40天恢复至对照水平(图 1)。这些说明毒死蜱处理20 d后对辣椒根围土壤可培养细菌有明显的影响。
| 土壤性质 Soil properties | 农田土壤 farmland soil |
| pH | 7.86±0.20 |
| 总氮 Total nitrogen (μg/g) | 1.33±0.09 |
| 有机碳 Organic carbon (μg/g) | 10.21±1.18 |
| 有机质含量 Organic matter content (μg/g) | 1.67±1.54 |
| 砂粒含量 Sand (50-2 000 μm,%) | 17.08 |
| 粉粒含量 Silt (2-50 μm,%) | 79.86 |
| 粘粒含量 Clay (<2 μm,%) | 3.06 |
| 土壤质地 Soil type | Loam |

|
| 图 1 毒死蜱对辣椒根围土壤可培养细菌数的影响 Figure 1 The effect of chlorpyrifos on the cultivable bacterial community of pepper rhizosphere soil |
|
|
T-RFLP数据中筛选得到的限制性片段长度为57-500 bp,对筛选所得数据计算每个TRF所占总峰面积的百分比,最后利用PRIMER 5对所有数据进行统计学分析,探讨不同浓度的毒死蜱乳油对土壤中细菌群落的影响。
2.2.1 Hae Ⅲ酶切所得的细菌群落结构差异:限制性内切酶Hae Ⅲ酶切扩增产物共得到34个相对有效片段,其中平均含量在1%以上的优势片段为TRF125、TRF231、TRF233、TRF236、TRF286、TRF288和TRF307,平均含量最高的3个优势片段为TRF231 (5.87%)、TRF233 (3.57%)和TRF307 (3.52%)。
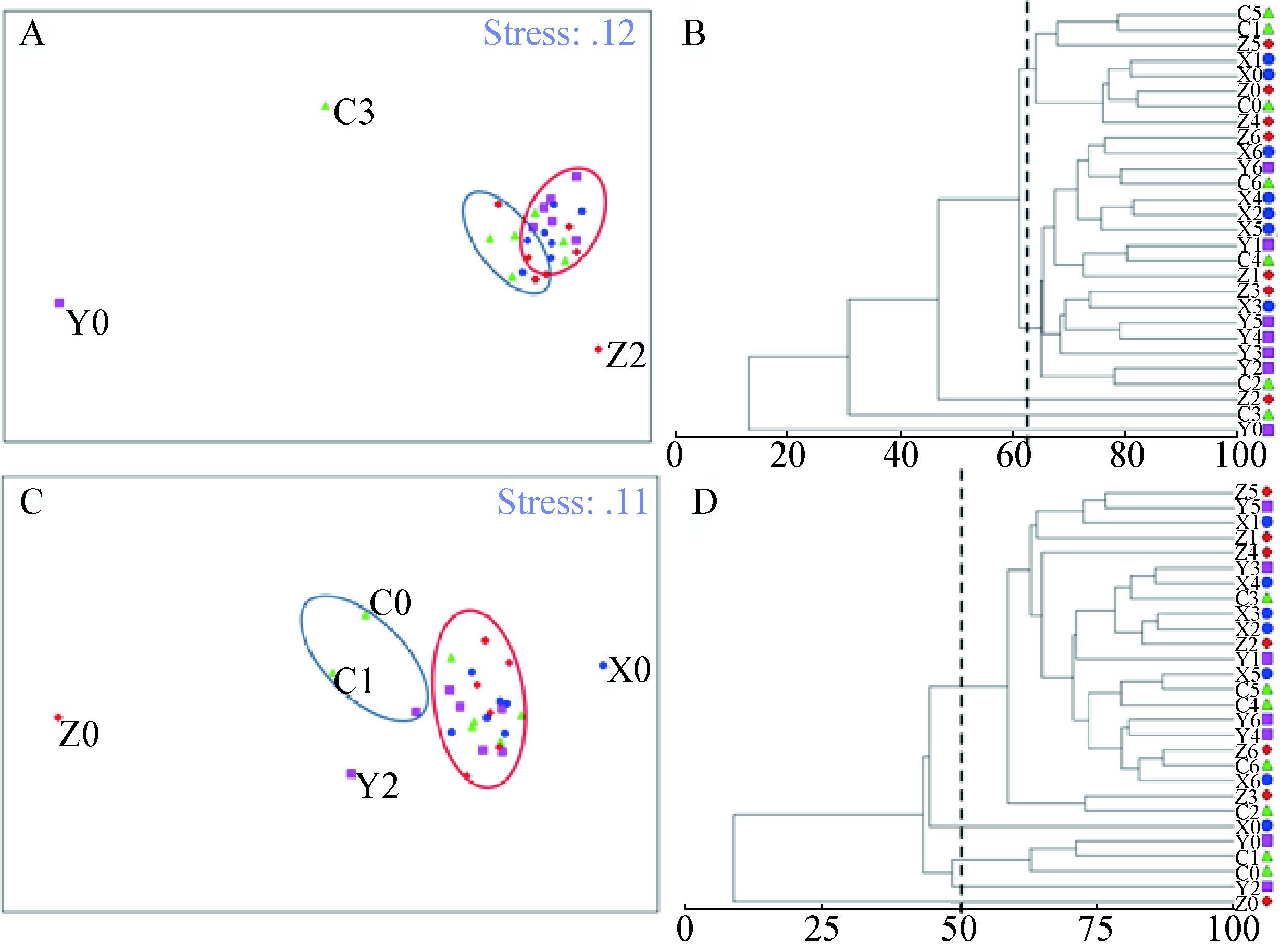
图 2反应了整个辣椒生长周期,不同毒死蜱处理组(1.5、15、150 μg/g)每个土壤样品中细菌群落的差异性。在室内培养第0天到第60天中,Hae Ⅲ酶切所得的CLUSTER聚类结果在60%水平上(虚线所示),可划分为5个组,其中对照组C3 (对照组第30天土样)、处理组Y0 (15 μg/g处理组第0天土样)和Z2 (150 μg/g处理组第2天土样)的细菌群落结构较整体群落结构聚类较远(图 2A、B)。基于Bray-Curtis相似性矩阵的ANOSIM分析结果显示,经Hae III酶切后,以加入不同浓度的毒死蜱分组,各组间细菌群落组成差异不显著(Global R=0.041,P=0.168) ,而以不同取样时间分组时,细菌群落组成差异显著(Global R=0.304,P=0.001) ,该差异性在第50天和第60天表现最为明显(P=0.029)。
|
|
图 2 辣椒根围土壤中微生物群落结构基于STR数据的多变量分析
Figure 2 Multivariate statistical analyses of the bacterial community of pepper rhizosphere soil based on STR data
注:图A、C:非度量多维尺度分析(nMDS);图B、D:聚类分析(cluster),基于Bray-Curtis相似性矩阵通过PRIMER-E分析得到;图A、B:由限制性内切酶Hae Ⅲ酶切所得的数据分析;图C、D:由限制性内切酶HhaⅠ酶切所得数据分析. |
|
|
SIMPER分析表明了不同毒死蜱处理组间,引起细菌群落差异的主要TRF片段(以累积贡献率表示)。施用毒死蜱浓度1.5 μg/g与150 μg/g时,TRF240、TRF239、TRF241累积贡献最大,在2个浓度中分别为11.52%、12.53%;而在毒死蜱浓度为15 μg/g的土壤中,TRF240、TRF289贡献最大,2个片段的累积贡献率为9.10%。从土壤中是否施用毒死蜱的角度看,当施用毒死蜱浓度为 1.5 μg/g及15 μg/g时,TRF240的平均丰富度均呈下降趋势;但毒死蜱浓度增加到150 μg/g时,较对照TRF240的平均丰富度出现上升趋势。在这3种土壤中,TRF240均属于较丰富的群落片段,对整个土壤细菌群落的贡献分别为4.40%、5.01%、4.47% (表 3)。Hae III酶切数据中TRF240贡献率较大,在线比对的结果显示该片段包含的细菌群落有芽孢八叠球菌属(Sporosarcina sp.)、梭菌属(Clostridium sp.)、动性杆菌属(Planomicrobium sp.)、动性球菌属(Planococcus sp.)。
|
毒死蜱浓度1.5 μg/g vs. 0 μg/g,平均差异=40.16% Effect of chlorpyrifos (1.5 μg/g) across all time groups, average dissimilarity=40.16 |
||||
| TRF | Av.Abund (0 μg/g) | Av.Abund (1.5 μg/g) | Contrib (%) | Cum. (%) |
| 240 | 0.06 | 0.01 | 4.40 | 4.40 |
| 239 | 0.10 | 0.15 | 3.78 | 8.17 |
| 241 | 0.09 | 0.13 | 3.35 | 11.52 |
| 219 | 0.01 | 0.01 | 3.10 | 14.62 |
|
毒死蜱浓度15 μg/g vs. 0 μg/g,平均差异=42.19% Effect of chlorpyrifos (15 μg/g) across all time groups, average dissimilarity=42.19 |
||||
| TRF | Av.Abund (0 μg/g) | Av.Abund (15 μg/g) | Contrib (%) | Cum. (%) |
| 240 | 0.06 | 0.04 | 5.01 | 5.01 |
| 289 | 0.02 | 0.01 | 4.09 | 9.10 |
| 239 | 0.10 | 0.11 | 3.97 | 13.07 |
| 241 | 0.09 | 0.12 | 3.56 | 16.63 |
|
毒死蜱浓度150 μg/g vs. 0 μg/g,平均差异=48.69% Effect of chlorpyrifos (150 μg/g) across all time groups, average dissimilarity=48.69 |
||||
| TRF | Av.Abund (0 μg/g) | Av.Abund (150 μg/g) | Contrib (%) | Cum. (%) |
| 239 | 0.10 | 0.10 | 4.56 | 4.56 |
| 240 | 0.06 | 0.09 | 4.47 | 9.03 |
| 241 | 0.09 | 0.13 | 3.50 | 12.53 |
| 85 | 0.00 | 0.03 | 3.33 | 15.86 |
| 288 | 0.04 | 0.02 | 3.27 | 19.13 |
| 注:对照组毒死蜱处理组间TRF的平均丰富度和丰富高的TRF (以%表示). Contrib是每个片段对整个群落的贡献,Cum.为累积贡献. 分别显示了1.5 μg/g与对照组、15 μg/g与对照组、150 μg/g与对照组间片段的丰富度. Note: Average abundances and contributions of the most abundant TRFs (expressed as %) to the dissimilarity between CPF-treated and untreated soil samples as well as the most contrasting time groups. Contrib stands for the contribution of one TRF to the whole community abundance, cum. stands for the accumulated contributions. | ||||
2.2.2 HhaⅠ酶切所得的细菌群落结构差异:经限制性内切酶HhaⅠ酶切后共得到51个相对有效片段,平均相对含量在3%以上的优势片段有TRF208、TRF231、TRF239、TRF240、TRF241、TRF288,其中含量最高的3个片段为TRF239 (10.81%)、TRF240 (7.62%)和TRF241 (8.71%)。
在整个生长周期中,HhaⅠ酶切CLUSTER聚类结果在50%水平上(虚线所示),可划分为5个组,其中150 μg/g的毒死蜱处理组(Z0) 在第0天表现出最大的群落差异(图 2C、D)。ANOSIM分析结果显示,经HhaⅠ酶切后,不同毒死蜱浓度处理组间的差异不显著(Global R=-0.04,P=0.842) ,但不同取样时间之间,细菌群落结构的差异具有统计学意义(Global R=0.28,P=0.001) 。
3个毒死蜱处理组中对整个群落丰富度贡献最大的均为TRF240、TRF239,3组的累积贡献分别为11.22%、12.08%、12.32%。与对照组相比,150 μg/g毒死蜱处理组TRF240的丰富度较对照有所升高,对群落多样性的贡献为6.01%,其余两组均是下降趋势,而TRF239在这3种处理组中平均丰富度变化相对较小,无明显的上升和下降趋势。HhaⅠ酶切数据显示,毒死蜱对经HhaⅠ酶切所得的细菌种群毒害较大,每个处理组及对照组间都表现出明显差异。其中TRF239片段含量最高,在0-20 d时,各处理组该片段均呈不断上升趋势,之后不断下降趋于对照水平,可见毒死蜱对该片段所代表的细菌群落具有刺激作用(表 4)。
|
毒死蜱浓度1.5 μg/g vs. 0 μg/g,平均差异=39.28% Effect of chlorpyrifos(1.5 μg/g) across all time groups, average dissimilarity=39.28 |
||||
| TRF | Av.Abund (0 μg/g) | Av.Abund (1.5 μg/g) | Contrib (%) | Cum. (%) |
| 240 | 0.06 | 0.01 | 5.89 | 5.89 |
| 239 | 0.10 | 0.15 | 5.33 | 11.22 |
| 241 | 0.09 | 0.13 | 4.50 | 15.71 |
| 58 | 0.03 | 0.03 | 3.81 | 19.52 |
| 219 | 0.01 | 0.01 | 3.01 | 22.52 |
|
毒死蜱浓度15 μg/g vs. 0 μg/g,平均差异=48.78% Effect of chlorpyrifos(15 μg/g) across all time groups, average dissimilarity=48.78 |
||||
| TRF | Av.Abund (0 μg/g) | Av.Abund (15 μg/g) | Contrib (%) | Cum. (%) |
| 240 | 0.06 | 0.04 | 6.67 | 6.67 |
| 239 | 0.10 | 0.11 | 5.41 | 12.08 |
| 58 | 0.03 | 0.05 | 4.68 | 16.76 |
| 241 | 0.09 | 0.12 | 4.46 | 21.22 |
| 286 | 0.02 | 0.01 | 4.33 | 25.55 |
|
毒死蜱浓度150 μg/g vs. 0 μg/g,平均差异=43.42% Effect of chlorpyrifos (150 μg/g) across all time groups, average dissimilarity=43.42 |
||||
| TRF | Av.Abund (0 μg/g) | Av.Abund (150 μg/g) | Contrib (%) | Cum. (%) |
| 239 | 0.10 | 0.10 | 6.31 | 6.31 |
| 240 | 0.06 | 0.09 | 6.01 | 12.32 |
| 241 | 0.09 | 0.13 | 4.65 | 16.97 |
| 288 | 0.04 | 0.02 | 4.28 | 21.26 |
| 85 | 0.00 | 0.03 | 4.13 | 25.39 |
| 注:对照组毒死蜱处理组间TRF的平均丰富度和丰富高的TRF (以%表示). Contrib是每个片段对整个群落的贡献,Cum.为累积贡献. 分别显示了1.5 μg/g与对照组、15 μg/g与对照组、150 μg/g与对照组间片段的丰富度. Note: Average abundances and contributions of the most abundant TRFs (expressed as %) to the dissimilarity between CPF-treated and untreated soil samples as well as the most contrasting time groups. Contrib stands for the contribution of one TRF to the whole community abundance, cum. stands for the accumulated contributions. | ||||
经过在线比对,能明显得出辣椒根围土壤中具有代表性的细菌群落,这里有土壤中的常见细菌种群,如放线菌属(Actinobacterium sp.)、芽孢杆菌属(Bacillus sp.)、假单胞菌属(Pseudomonas sp.)、地芽孢杆菌属(Geobacillus sp.)等。
3 讨论本研究采用室内盆栽实验,综合使用微生物平板计数法和T-RFLP技术,分析有机磷农药毒死蜱施用后辣椒根围细菌群落的变化。可培养细菌的结果显示,与对照组相比,毒死蜱施入后第 20天,能显著降低土壤中可培养细菌的含量。Hindumathy等[21]的研究也得到相同的结果,认为在有机磷农药毒死蜱污染的土壤中,细菌难以存活。这可能由于毒死蜱的初级代谢产物3, 5, 6-三氯-2-吡啶酚具有抗菌作用[22]。本次实验中,农药施入初期土壤细菌数显著下降可能就是由于此类抗菌物质的产生所致[23]。
在盆栽实验和可培养微生物计数法基础上,采用T-RFLP技术分析根围细菌群落结构的变化。T-RFLP中,采用两种限制性内切酶Hae Ⅲ和HhaⅠ单独进行酶切,得到具有最优丰富度和均匀度的TRFs。经过比较两种酶的酶切结果,发现HhaⅠ可获得数量更多、分布更均的TRFs。
T-RFLP的结果选择PRIMER-E进行统计分析。首先,采用nMDS和CLUSTER对每个土壤样品(不同时间、不同处理组)进行等级区分。结果显示受毒死蜱处理过的根围土壤细菌群落结构只在实验的前30天与对照组有明显不同。同样,Chen等[24]也得到了类似的结果。他们将农田土壤用终质量分数5 μg/g和20 μg/g毒死蜱处理,同时以不施用毒死蜱为对照,定期采集土样进行毒死蜱残留测定并提取土壤DNA,用变性梯度凝胶电泳(DGGE指纹图谱技术)和主成分分析(PCA分析)对其细菌群落进行分析。结果与本实验一致,在30 d以内与对照组细菌群落结构存在差异,而到第 60天则恢复到对照水平。毒死蜱对细菌群落的扰动集中在植物生长的前30 d,这可能是由于毒死蜱较易与土壤中有机质与腐殖质相结合[25],随着毒死蜱在土壤中的时间推移,其毒性也逐渐减小,对土壤细菌群落的影响也不断减小。因此,在后期的辣椒生长过程中,根围细菌群落结构虽有波动,但波动程度不大,总体上对辣椒根围细菌群落结构的影响较小。但当毒死蜱浓度增加到150 μg/g时,土壤细菌群落表现出明显差异,可能是由于毒死蜱的有毒代谢产物3, 5, 6-三氯-2-吡啶酚(TCP)在土壤中不断积累[26],而TCP具有显著的抑菌性[4, 27],因此根围细菌受TCP的抑制更为显著。
ANOSIM分析同时研究了不同毒死蜱浓度以及不同取样时间对辣椒根围细菌群落结构的影响。以HhaⅠ的分析结果为例,不同浓度毒死蜱处理组间未表现出明显的群落结构差异,而不同时间内差异显著。ANOSIM分析是对nMDS和CLUSTER的补充分析,分析结果总体一致,均表明根围细菌群落结果在毒死蜱施入后,受时间的影响更大。这可能归因于高浓度的毒死蜱不仅自身会降低土壤细菌数,随着时间的推移,可能会产生更多具抑菌作用的代谢产物TCP,这种双重毒性使得土壤细菌种群发生了显著性变化。
SIMPER分析阐述了T-RFLP数据中对群落丰度贡献较大的TRF,经过比对已知这些TRFs所代表的主要菌群为放线菌属、芽孢杆菌属、假单胞菌属、地芽孢杆菌属等。Akbar等[28]采用DGGE指纹图谱技术对毒死蜱污染后的细菌群落进行分析,发现种群丰度明显增加的菌群有假单胞菌属、不动杆菌属、寡养单胞菌属等,部分结果与本次实验相似,但由于土壤类型、是否有植物生长以及毒死蜱浓度的差异,个别菌群存在差异。相同的菌群中,Pseudomonas sp.和Bacillus sp.是土壤中的主要细菌种群,这些类群有一部分能有效抑制植物病害[11, 16, 29-30],是潜在的生防菌。因此,后续会针对这些潜在的生防菌做进一步研究。
本研究是第一个通过室内模拟正常自然环境下的植物生长,采用不依赖于培养的T-RFLP技术,探究不同浓度毒死蜱施用后辣椒根围细菌群落结构的变化,在核酸水平上通过对特定核苷酸片段长度的测定来分析比较微生物群落结构和功能。现阶段,多数研究采用DGGE分析农药对土壤细菌种群的影响。与DGGE相比,T-RFLP技术操作更加简便、通量更高、重复性更好。与统计分析软件PRIMER-E联合使用后,分析结果更加深入和全面,为后续变化菌群的定量分析以及变化菌群与土壤状态、植物生长的联系研究提供了理论基础。
4 结论通过平板计数法和T-RFLP技术相结合,低浓度的毒死蜱会对土壤细菌群落结构产生短暂扰动,而高浓度毒死蜱能显著降低辣椒根围土壤细菌群落丰度,影响细菌群落结构。本研究较为系统地评价了毒死蜱对辣椒根围细菌群落整体结构的影响,为毒死蜱的科学、合理、安全施用,田间残留的监测以及土壤中毒死蜱的生物修复提供了重要的理论基础和技术支撑。
| [1] | Conrad R. Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)[J]. Microbiological Reviews 1996, 60(4) : 609–640. |
| [2] | Jacobsen CS, Hjelmsø MH. Agricultural soils, pesticides and microbial diversity[J]. Current Opinion in Biotechnology 2014, 27 : 15–20. DOI:10.1016/j.copbio.2013.09.003 |
| [3] | Xu PY, Wu DS. New progresses of organophosphorus pesticide toxicity studies[J]. Journal of Preventive Medicine Information 2004, 20(4) : 389–392. (in Chinese) 徐培渝, 吴德生. 有机磷农药毒性研究新进展[J]. 预防医学情报杂志 2004, 20(4) : 389–392. |
| [4] | Singh BK, Walker A, Morgan JAW, et al. Biodegradation of chlorpyrifos by Enterobacter strain B-14 and its use in bioremediation of contaminated soils[J]. Applied and Environmental Microbiology 2004, 70(8) : 4855–4863. DOI:10.1128/AEM.70.8.4855-4863.2004 |
| [5] | Guillade AC, Folgarait PJ. Natural enemies of Atta vollenweideri (Hymenoptera: Formicidae) leaf-cutter ants negatively affected by synthetic pesticides, chlorpyrifos and fipronil[J]. Journal of Economic Entomology 2014, 107(1) : 105–114. DOI:10.1603/EC12498 |
| [6] | Yadav M, Shukla AK, Srivastva N, et al. Utilization of microbial community potential for removal of chlorpyrifos: a review[J]. Critical Reviews in Biotechnology 2015, 36(4) : 727–742. |
| [7] | Martinez-Toledo MV, Salmeron V, Gonzalez-Lopez J. Effect of the insecticides methylpyrimifos and chlorpyrifos on soil microflora in an agricultural loam[J]. Plant and Soil 1992, 147(1) : 25–30. DOI:10.1007/BF00009367 |
| [8] | Chen XS, Tang L, Li S, et al. Optimization of medium for enhancement of ε-poly-L-lysine production by Streptomyces sp. M-Z18 with glycerol as carbon source[J]. Bioresource Technology, 2011, 102(2) : 1727-1732 |
| [9] | Huang YL, He XK, Zhang LP, et al. Microbial remediation of pesticide contaminated soil[J]. Modernizing Agriculture 2011(9) : 1–4. (in Chinese) 黄亚丽, 何宪科, 张丽萍, 等. 农药污染土壤的微生物修复研究进展[J]. 现代化农业 2011(9) : 1–4. |
| [10] | Zhou JH, Yuan YH, Zhu ZB, et al. A review on bioremediation technologies of organic pollutants contaminated soils[J]. Ecology and Environmental Sciences 2015, 24(2) : 343–351. (in Chinese) 周际海, 袁颖红, 朱志保, 等. 土壤有机污染物生物修复技术研究进展[J]. 生态环境学报 2015, 24(2) : 343–351. |
| [11] | Abraham J, Silambarasan S. Biodegradation of chlorpyrifos and its hydrolyzing metabolite 3, 5, 6-trichloro-2-pyridinol by Sphingobacterium sp. JAS3[J]. Process Biochemistry 2013, 48(10) : 1559–1564. DOI:10.1016/j.procbio.2013.06.034 |
| [12] | Bao SD. Soil and Agricultural Chemistry Analysis[M].3rd edition. Beijing: China Agriculture Press, 2000 . (in Chinese) 鲍士旦. 土壤农化分析[M].第3版. 北京: 中国农业出版社, 2000, . |
| [13] | Wang D, Fu BJ, Chen LD, et al. Fractal analysis on soil particle size distributions under different land-use types: a case study in the loess hilly areas of the Loess Plateau, China[J]. Acta Ecologica Sinica 2007, 27(7) : 3081–3089. (in Chinese) 王德, 傅伯杰, 陈利顶, 等. 不同土地利用类型下土壤粒径分形分析——以黄土丘陵沟壑区为例[J]. 生态学报 2007, 27(7) : 3081–3089. |
| [14] | LaMontagne MG, Michel Jr FC, Holden PA, et al. Evaluation of extraction and purification methods for obtaining PCR-amplifiable DNA from compost for microbial community analysis[J]. Journal of Microbiological Methods 2002, 49(3) : 255–264. DOI:10.1016/S0167-7012(01)00377-3 |
| [15] | Polz MF, Cavanaugh CM. Bias in template-to-product ratios in multitemplate PCR[J]. Applied and Environmental Microbiology 1998, 64(10) : 3724–3730. |
| [16] | Don RH, Cox PT, Wainwright BJ, et al. ‘Touchdown' PCR to circumvent spurious priming during gene amplification[J]. Nucleic Acids Research 1991, 19(14) : 4008. DOI:10.1093/nar/19.14.4008 |
| [17] | Yamada T, Araki S, Ikeda-Ohtsubo W, et al. Community structure and population dynamics of ammonia oxidizers in composting processes of ammonia-rich livestock waste[J]. Systematic and Applied Microbiology 2013, 36(5) : 359–367. DOI:10.1016/j.syapm.2013.02.001 |
| [18] | Clarke K, Warwick R. Changein in Marine Communities: An Approach to Statistical Analysis and Interpretation[J]. 2nd ed. United Kingdom: PRIMER-E Ltd 2001. |
| [19] | Zhu CS, Yu JM. Nonmetric multidimensional scaling corrects for population structure in association mapping with different sample types[J]. Genetics 2009, 182(3) : 875–888. DOI:10.1534/genetics.108.098863 |
| [20] | Shyu C, Soule T, Bent SJ, et al. MiCA: a web-based tool for the analysis of microbial communities based on terminal-restriction fragment length polymorphisms of 16S and 18S rRNA genes[J]. Microbial Ecology 2007, 53(4) : 562–570. DOI:10.1007/s00248-006-9106-0 |
| [21] | Hindumathy CK, Gayathri V. Effect of pesticide (chlorpyrifos) on soil microbial flora and pesticide degradation by strains isolated from contaminated soil[J]. Bioremediation & Biodegradation 2013, 4(2) : 1000178. |
| [22] | Baskaran S, Kookana RS, Naidu R. Contrasting behaviour of chlorpyrifos and its primary metabolite, TCP (3, 5, 6-trichloro-2-pyridinol), with depth in soil profiles[J]. Soil Research 2003, 41(4) : 749–760. DOI:10.1071/SR02062 |
| [23] | Singh BK, Walker A, Wright DJ. Bioremedial potential of fenamiphos and chlorpyrifos degrading isolates: influence of different environmental conditions[J]. Soil Biology and Biochemistry 2006, 38(9) : 2682–2693. DOI:10.1016/j.soilbio.2006.04.019 |
| [24] | Chen LZ, Li YL, Yu YL. Soil bacterial and fungal community successions under the stress of chlorpyrifos application and molecular characterization of chlorpyrifos-degrading isolates using ERIC-PCR[J]. Journal of Zhejiang University Science B 2014, 15(4) : 322–332. DOI:10.1631/jzus.B1300175 |
| [25] | Fenoll J, Ruiz E, Flores P, et al. Reduction of the movement and persistence of pesticides in soil through common agronomic practices[J]. Chemosphere 2011, 85(8) : 1375–1382. DOI:10.1016/j.chemosphere.2011.07.063 |
| [26] | Menon P, Gopal M, Prasad R. Dissipation of chlorpyrifos in two soil environments of semi-arid India[J]. Journal of Environmental Science and Health, Part B 2004, 39(4) : 517–531. DOI:10.1081/PFC-200026697 |
| [27] | Chishti Z, Arshad M. Growth linked biodegradation of chlorpyrifos by Agrobacterium and Enterobacter spp[J]. International Journal of Agriculture and Biology 2013, 15(1) : 19–26. |
| [28] | Akbar S, Sultan S, Kertesz M. Bacterial community analysis in chlorpyrifos enrichment cultures via DGGE and use of bacterial consortium for CP biodegradation[J]. World Journal of Microbiology and Biotechnology 2014, 30(10) : 2755–2766. DOI:10.1007/s11274-014-1699-8 |
| [29] | Dubey KK, Fulekar MH. Chlorpyrifos bioremediation in Pennisetum rhizosphere by a novel potential degrader Stenotrophomonas maltophilia MHF ENV20[J]. World Journal of Microbiology and Biotechnology 2012, 28(4) : 1715–1725. DOI:10.1007/s11274-011-0982-1 |
| [30] | Fang H, Yu Y, Wang XG, et al. Effects of repeated applications of chlorpyrifos on its persistence and soil microbial functional diversity and development of its degradation capability[J]. Bulletin of Environmental Contamination and Toxicology 2008, 81(4) : 397–400. DOI:10.1007/s00128-008-9514-6 |
 2016, Vol. 43
2016, Vol. 43