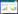扩展功能
文章信息
- 李双, 颜鹏, 曾晨, 张宏建, 毛忠贵, 唐蕾
- LI Shuang, YAN Peng, ZENG Chen, ZHANG Hong-Jian, MAO Zhong-Gui, TANG Lei
- Genome shuffling筛选ε-聚赖氨酸高产菌及其对代谢流量分配的影响
- Effect of genome shuffling on ε-poly-L-lysine synthesis and metabolic flux
- 微生物学通报, 2016, 43(12): 2568-2577
- Microbiology China, 2016, 43(12): 2568-2577
- DOI: 10.13344/j.microbiol.china.151070
-
文章历史
- 收稿日期: 2015-12-29
- 接受日期: 2016-03-31
- 优先数字出版日期(www.cnki.net): 2016-04-18
2. 江南大学生物工程学院 江苏 无锡 214122
2. School of Biotechnology, Jiangnan University, Wuxi, Jiangsu 214122, China
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种由25-30个赖氨酸残基经α-COOH和ε-NH2形成酰胺键连接而成的赖氨酸聚合物,具有抗菌谱广、耐高温、有效作用域pH较广等优点[1]。Hiraki等[2]通过14C-放射法研究证实了ε-PL作为食品添加剂的高安全性。2014年我国已批准ε-PL为食品添加剂新品种(2014年第5号,关于批准ε-聚赖氨酸等4种食品添加剂新品种等的公告)[3]。
目前ε-PL的生产菌株以链霉菌为主,野生型菌株的合成能力偏低,摇瓶产量大多低于1 g/L,因此采用不同的育种方法获得产量提高的突变菌株,降低生产成本成为ε-PL工业发酵研究的一个重要方面[4]。在菌种改造中最有成效的当数Hiraki等[5]的研究报道,即通过常规诱变手段,筛选L-Lys结构类似物S-(2-氨乙基)-L-半胱氨酸抗性突变株,降低L-Lys对天冬氨酸激酶的反馈抑制,提高单体赖氨酸的合成量,从而将白色链霉菌(Streptomyces albulus) ε-PL产量增加至2.11 g/L。但是后续的研究报告指出,仅增加赖氨酸量已不能进一步提升ε-PL产量[6]。Genome shuffling (GS)是一种通过多轮递进式原生质体融合,快速提高融合子表型的一种高效育种方法,近年来已成功应用于提高次级代谢产物产量、增强毒性物质耐受性等方面[7],本课题组率先将该方法用于ε-PL的菌种改造中,提高了ε-PL的产量[8],然而对于GS导致产量提升的机理尚不明确。
由于GS是基于菌株全基因组水平上的一种重组方式,因此从合成代谢流整体通量变化的角度应更能反应出GS菌株表型变化的原因。代谢通量分析是利用胞内主要化学反应的化学计量模型及胞内的物料平衡计算胞内物质的代谢流量,为代谢网络定量分析的基本方法之一[9]。近十几年,随着13C标记、核磁共振以及多种分析方法联用和计算机技术的应用使得代谢通量分析迅速发展,逐渐成为代谢工程中强有力的分析方法[10]。
本文试图从已有不同表型的ε-PL菌株出发,在进行GS获得高产菌株的同时,采用代谢通量分析手段构建ε-PL代谢网络及流量平衡方程,比较亲本菌株与GS菌株在代谢通量上的变化,从代谢流分布的角度提出GS菌株产量提升的原因,进而为ε-PL生产菌株的进一步遗传改造打下基础。
1 材料与方法 1.1 实验材料1.1.1 菌种:葡萄糖耐受型Streptomycessp. AS32和ε-PL耐受型Streptomyces albulus F15为本实验室保藏菌株,ε-PL摇瓶产量分别为2.30±0.08 g/L和2.40±0.05 g/L。
1.1.2 培养基:斜面和平板培养基(BTN)、液体再生培养基(LRM)、固体再生培养基(SRM)和半固体再生培养基(SSRM)参照文献[11]。
筛选培养基(g/L):甘油60.0,酵母粉8.0,(NH4)2SO4 5.0,K2HPO4 2.0,MgSO4·7H2O 1.0,ZnSO4·7H2O 0.04,FeSO4·7H2O 0.03,用1 mol/L NaOH调pH至7.5,6.7×104 Pa灭菌15 min。
种子培养基(g/L):葡萄糖50.0,酵母粉8.0,(NH4)2SO4 5.0,K2HPO4 2.0,MgSO4·7H2O 1.0,ZnSO4·7H2O 0.04,FeSO4·7H2O 0.03,用1 mol/L NaOH调pH至7.5,6.7×104 Pa灭菌15 min。
发酵培养基(g/L):葡萄糖50.0,(NH4)2SO4 10.0,K2HPO4 2.0,MgSO4·7H2O 1.0,2 mL微量元素溶液(成分同LRM),1×105 Pa灭菌20 min,用50% (体积比)氨水调pH至6.9。
1.1.3 主要试剂和仪器:ε-PL样品,河南郑州拜纳佛生物工程有限公司,纯度95%;溶菌酶,上海生工生物工程有限公司;其它试剂均为分析纯,中国医药集团上海试剂公司。UV-2100分光光度计,尤尼柯上海仪器有限公司;GI100T型立式自动压力蒸汽灭菌器,厦门致微仪器有限公司;SW-CJ-1FD型超净台,苏州泰安空气技术有限公司;3K15台式冷冻离心机,上海实维实验仪器技术有限公司;KLF2000比欧发酵罐,瑞士比欧生物工程公司。
1.2 实验方法1.2.1 培养方法:斜面和平板培养:用接种环或无菌牙签挑取少量孢子接种于斜面或平板上,放入培养箱中,30 ℃培养10-14 d。
菌种初筛:将孢子(两环)接种至含有40 mL筛选培养基的250 mL摇瓶中,30 ℃、200 r/min培养4 d,取10 mL培养液,4 500 r/min离心10 min,取上清测定ε-PL含量。
菌种复筛:将孢子(两环)接种至含有40 mL筛选培养基的250 mL摇瓶中,30 ℃、200 r/min培养24-38 h,转接3 mL种子液至含有40 mL筛选培养基的250 mL摇瓶中(每株3瓶),30 ℃、200 r/min,培养72 h。同上取上清测定ε-PL含量。
种子培养:将孢子(两环)接种至含有40 mL种子培养基的250 mL摇瓶中,30 ℃、200 r/min培养24-28 h。
分批发酵:将80 mL种子液接入3 L发酵罐,罐中预装已灭菌的发酵培养基2.3 L (接种量约为3%),初始通风量2 L/min,初始搅拌转速200 r/min,温度30 ℃,pH电极实时监测发酵液中的pH,溶氧电极实时监测发酵液中的溶氧(DO),最高转速为700 r/min,此过程中随着转速的提高,菌体形态由丝状出现部分菌球形态。当pH值从6.9自然下降到4.0时,反馈式自动补加碱液使pH值保持在4.0。其中碱液为体积比浓度为50%的氨水。每隔4 h取样进行葡萄糖、ε-PL、菌体干重和胞外游离氨基酸的测定,直至葡萄糖耗尽。
1.2.2 GS:以AS32和F15作为对象制备原生质体,将菌株进行种子培养后,分别转入不含有机氮源的筛选培养基中,30 ℃、200 r/min培养24 h,取10 mL菌液,4 500 r/min离心5 min,弃上清液,加10 mL无菌水,振荡混匀,再次离心去上清。用PB高渗液[11]洗涤两次菌体,加入PB高渗液定容至5 mL。参照文献[11],菌株AS32和菌株F15分别采用0.5%的溶菌酶,30 ℃酶解120 min,随后菌株AS32于70 ℃热灭活60 min,菌株F15使用15 W紫外灭活70 min,30% PEG6000于37 ℃温育10 min。将融合菌液分为两部分,一部分采用双层平板法再生,28 ℃培养7-10 d以获得单菌落,并且进一步测定其ε-PL产量来验证其是否有所提高;另一部分加入含有1 g/L的ε-PL的LRM中培养并收集菌丝体进行下一轮GS。以此类推进行3轮GS,具体流程如图 1所示。
|
| 图 1 GS流程图 Figure 1 The flow chart of genome shuffling |
|
|
1.2.3 分析方法:ε-PL浓度的测定参考文献[12]。葡萄糖浓度的测定:4 500 r/min,10 min离心发酵液,取上清(300 μL),加入无水乙醇(700 μL),12 000 r/min离心10 min,取上清用HPLC法(DIONEX,U-2000,USA);Aminex HPX-87H色谱柱(300 mm×7.8 mm,9 μm,Hercules,CA);RI检测器(Shodex RI-101,Japan);流动相5 mmol/L硫酸;柱温55 ℃;流速0.6 mL/min;进样量10 μL)进行测定。菌体干重的测定:将10 mL发酵液 4 500 r/min离心10 min,弃上清,菌体用已称重的滤纸(Φ7 cm,中速,SCRC)进行抽滤,105 ℃过夜至恒重后对菌体的干重(DCW)进行测定。氨基酸浓度测定:将10 mL发酵液4 500 r/min离心10 min,取上清按1׃1比例加入10%的三氯乙酸,混匀静置1-2 h,12 000 r/min,离心10 min,取上清用HPLC法(AGI100,U-2000,USA);色谱柱(250 mm×4.6 mm,5 μm,ODS HYPERSIL);DAD检测器(1260 Infinity,America);流动相A相(称取8 g结晶乙酸钠溶解并定容至1 L,再加入325 μL三乙胺,搅拌并滴加5%醋酸使pH调至7.20±0.05;加入5 mL四氢呋喃,混合后备用),B相(称取8 g结晶乙酸钠溶解并定容至400 mL,搅拌并滴加2%醋酸使pH调至7.20±0.05,将此溶液加入800 mL乙腈和800 mL甲醇,混合后备用);柱温40 ℃;流速200 μL/min;进样量1 μL)进行测定。
2 结果与讨论 2.1 GS及融合子筛选GS是将不同表型的亲本进行多轮递进式原生质体融合及筛选,以获得目的性状菌株的一种育种方式。GS虽可在较大范围内对亲本菌株进行优化组合,但其定向性不强,筛选强度大。本文选用了前期研究获得的具有底物葡萄糖耐受的AS32和具有产物ε-PL耐受的F15,以ε-PL为筛子,在连续 3轮的GS中,逐步提高LRM中ε-PL浓度。挑选每一轮在SRM中形成的融合子进行ε-PL测定,当把LRM中ε-PL浓度提升至7 g/L进行第四轮融合时,培养基中融合子较难再生,GS终止。ε-PL作为一种抑菌剂,在高浓度时对生产菌自身也会产生影响,进而抑制菌体活力和产物ε-PL的合成。鉴于筛选赖氨酸结构类似物的方法基于单体赖氨酸的合成,对ε-PL产量进一步提升的局限性[6],本文采用筛选终产物ε-PL耐受型菌株,从中获得产量提高者的策略。结果显示(表 1),随着LRM中ε-PL浓度的升高,ε-PL高产融合子所占的数量逐渐增高,而且ε-PL产量逐步提升。
| Rounds of shuffling | Concentration of ε-PL (g/L) | Frequency of shuffled strains with higher ε-PL productivity (%)A | Mean production (g/L)B | The highest productivity (g/L) |
| 1st round | 1 | 7.27 (8/110) | 2.47±0.08 | 2.56±0.05 |
| 2nd round | 3 | 15.45 (19/123) | 2.67±0.12 | 2.84±0.02 |
| 3rd round | 5 | 27.69 (18/65) | 2.94±0.09 | 3.42±0.03 |
| 注:A:括号中的数字为产量高于亲本F15的GS菌株/筛选的菌株数目;B:产量高于F15的GS菌株ε-PL产量的平均值;数据为平均值±标准差. Note: A: Numbers in parentheses mean the number of shuffled strains producing more ε-PL than the highest starting strain F15 and the number of colonies screened, respectively; B: Mean production shows the mean value of yield of shuffled strains, which can produce more ε-PL than that of F15; Data represent the mean ± standard deviations. | ||||
融合子经初筛与复筛最终获得了高产且稳定的GS菌株AF3-44。该菌株在摇瓶中ε-PL的产量达到了3.10±0.07 g/L较亲本菌株AS32和F15分别提高了34%和29%。对AF3-44进行传代实验,结果显示其ε-PL产量稳定在3.0 g/L (表 2)。
| Subculture times | ε-PL (g/L) |
| 1 | 3.10±0.05 |
| 2 | 3.07±0.02 |
| 3 | 2.95±0.02 |
| 4 | 3.00±0.02 |
| 5 | 3.03±0.03 |
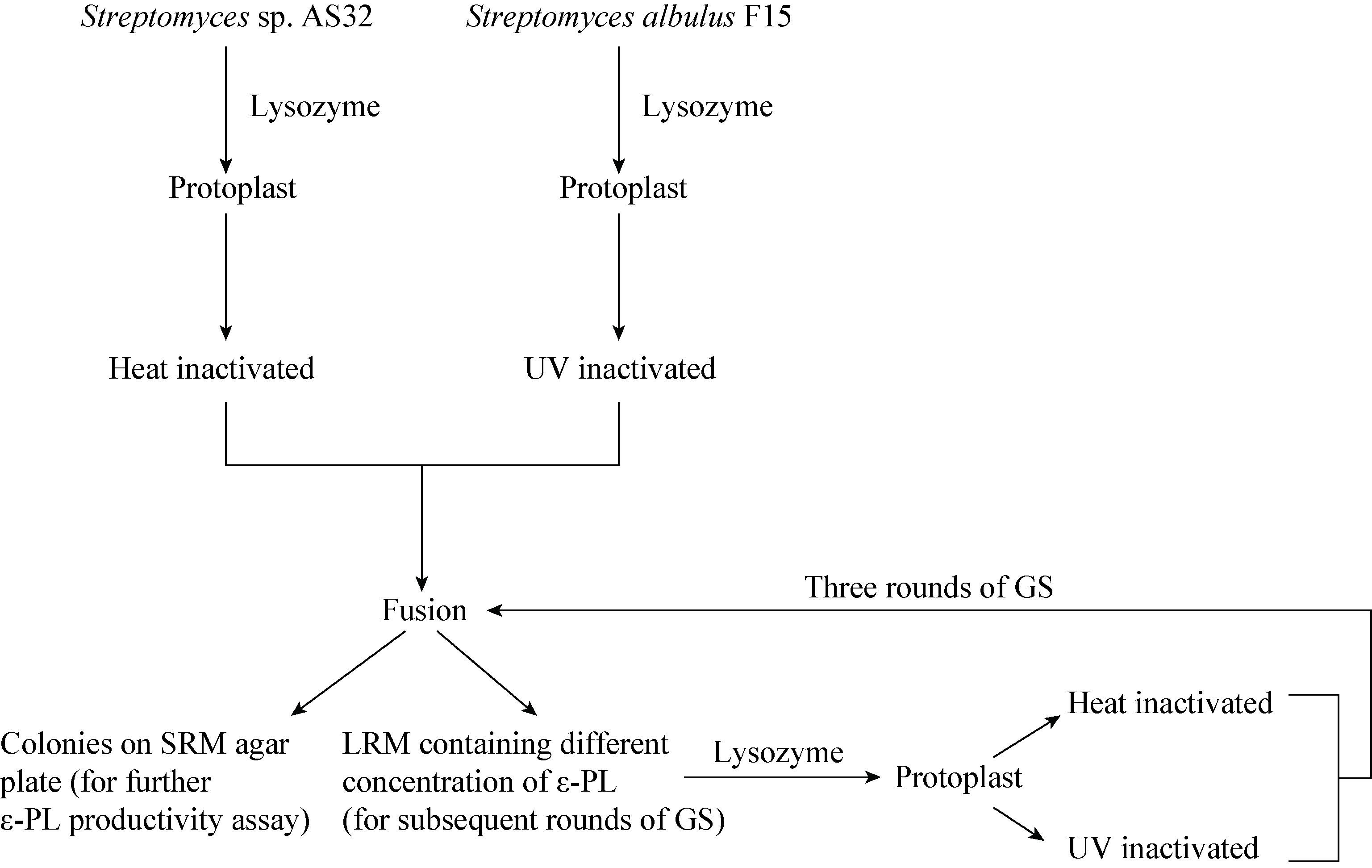
2.2.1 Streptomyces sp.代谢网络的构建:由于细胞代谢所涉及的代谢网络非常复杂,对其进行简化处理十分必要,以葡萄糖作为唯一碳源进行分批发酵,参照研究室的前期研究工作[13-14]加以进一步的完善,构建链霉菌代谢网络(图 2)。该网络主要包括糖酵解途径(EMP)、戊糖磷酸途径(PPP)、回补途径、三羧酸循环(TCA)、生物量及二氨基庚二酸途径(DAP)等代谢途径。其中假设:
|
| 图 2 Streptomyces sp.合成ε-PL代谢网络 Figure 2 Metabolic network of ε-PL synthesis by Streptomyces sp. 注:(1) G6P:6-磷酸葡萄糖;(2) Ribu5P:5-磷酸核酮糖;(3) R5P:5-磷酸核糖;(4) X5P:5-磷酸木酮糖;(5) E4P:4-磷酸赤藓糖;(6) S7P:7-磷酸景天庚酮糖;(7) F6P:6-磷酸果糖;(8) GAP:3-磷酸甘油醛;(9) 3PG:3-磷酸甘油酸;(10) Ser:丝氨酸;(11) PEP:磷酸烯醇式丙酮酸;(12) Pyr:丙酮酸;(13) Leu:亮氨酸;(14) Ala:丙氨酸;(15) AcCoA:乙酰辅酶A;(16) Ici:异柠檬酸;(17) α-KG:α-酮戊二酸;(18) OAA:草酰乙酸;(19) Asp:天冬氨酸;(20) Thr:苏氨酸;(21) Lys:赖氨酸;(22) ε-PL:ε-聚赖氨酸;(23) NADPH:烟酰胺腺嘌呤二核苷酸磷酸;黑色箭头表示中心碳代谢流向;灰色箭头表示氨基酸的合成;空心箭头表示生物质合成;黑色框内为胞外代谢物;下标ex表示分泌到胞外的代谢物. Note: (1) G6P: Glucose-6-phosphate; (2) Ribu5P: Ribulose-5-phosphate; (3) R5P: Ribose-5-phosphate; (4) X5P: Xylulose-5-phosphate; (5) E4P: Erythrose-4-phosphate; (6) S7P: Sedoheptulose-7-phosphate; (7) F6P: Fructose-6-phosphate; (8) GAP: Glyceraldehyde-3-phosphate; (9) 3PG: 3-phosphoglycerate; (10) Ser: Serine; (11) PEP: phosp hoenol pyruvate; (12) Pyr: Pyruvate; (13) Leu: Leucine; (14) Ala: Alanine; (15) AcCoA: Acetyl coenzyme A; (16) Ici: Isocitrate; (17) α-KG: α-ketoglutarate; (18) OAA: Oxaloacetate; (19) Asp: Aspartate; (20) Thr: Threonine; (21) Lys: Lysine; (22) ε-PL: ε-poly-L-lysine; (23) NADPH: Nicotinamide adenine dinucleotide phosphate; Black arrows represent carbon fluxes within the central metabolism of Streptomyces sp.; Grey arrows represent carbon fluxes of amino acid synthesis; Hollow arrows represent carbon fluxes of biomass synthesis; Extracellular substances are included in boxes with solid lines; The subscript ex indicates extracellular pools of products. |
|
|
(1) 细胞内中间代谢物在整个反应中不积累;
(2) 只考虑NADPH供需平衡,不考虑ATP平衡;
(3) 不考虑除代谢网络简图以外的循环;
(4) 固定比例的反应及无分支点的反应都认为是一步反应;
(5) 因ε-PL的分子量非定值,为方便计算,将其视为赖氨酸单体处理;
| $1\text{ }Lys+1\text{ }ATP=1\text{ }\varepsilon -PL$ |
(6) 假设生物质成分均由细胞中心代谢系统的11种前体合成得到,且菌体组成部分的含量在细胞生长过程中不变。因缺少链霉菌细胞组成前体需求系数的相关数据,根据相关文献报道细胞组成成分高达20%的差异对Streptomyces lividans代谢通量的分布不会造成影响[15],以及马红武[16]在研究枯草芽孢杆菌的需求系数误差对计算结果的影响时得出的结论,即流向生物大分子的支流即11种前体的需求速率与碳代谢流的主干中心代谢网络相比较小,因而需求系数的误差对计算结果的影响较小,同时考虑到枯草芽孢杆菌能够合成γ-聚谷氨酸与链霉菌合成ε-PL一样均属于非核糖体酶合成体系[17],因此本文选取枯草芽孢杆菌作为参照文献 [16]。
2.2.2 Streptomyces sp.代谢网络流量平衡方程:代谢网络计量学模型的基础为准稳态假设,假设细胞内的中间代谢物均处于拟稳态[18],即其浓度变化速率为0。该网络则有:
| $d{{X}_{met}}/dt=0$ |
其中,Xmet为胞内中间代谢物的浓度向量。采用矩阵形式表示如下:
| $S\cdot r=0$ |
式中,S为该网络的计量矩阵m×n,m为胞内反应的个数,n为中间代谢物的个数,r为代谢反应速率向量。可得到如下方程(速率均针对碳摩尔数)[19]:
EMP:
r1: 1 Glc —〉1 G6P
r8: 1 G6P〈—〉1 F6P
r9: 1 F6P —〉2 GAP
r10: 1 GAP —〉1 3PG
r12: 1 3PG〈—〉1 PEP
r13: 1 PEP —〉1 Pyr
PPP:
r2: 1 G6P —〉1 Ribu5P+2 NADPH
r3: 1 Ribu5P〈—〉1 R5P
r4: 1 Ribu5P〈—〉1 X5P
r5: 1 X5P+1 R5P〈—〉1 S7P+1 GAP
r6: 1 S7P+1 GAP〈—〉1 F6P+1 E4P
r7: 1 X5P+1 E4P〈—〉1 F6P+1 GAP
回补途径:
r17: 1 Pyr —〉1 OAA
TCA循环:
r16: 1 Pyr —〉1 AcCoA
r18: 1 AcCoA+1 OAA —〉1 Ici
r19: 1 Ici —〉1 α-KG
r20: 1 α-KG —〉1 OAA
氨基酸合成途径:
r11: 1 3PG+1 Glu —〉1 Serex +1 α-KG
r14: 1 Glu+1 AcCoA+2 Pyr —〉1 Leuex+1 α-KG
r15: 1 Pyr+1 Glu〈—〉Alaex+1 α-KG
r21: 1 OAA+1 Glu〈—〉1 Asp+1 α-KG
r22: 1 Asp+2 NADPH —〉1 Threx
r23: 1 Asp+1 Glu+1 Pyr+2 NADPH —〉1 Lys+1 α-KG
r24: 1 Lys —〉1 Lysex
产物合成:
r25: 1 Lys —〉1 ε-PL
细胞物质组成:
r26: 0.001 071 α-KG+0.001 923 OAA+0.016 06 NADPH+ 0.002 132 AcCoA+0.003 09 Pyr+0.000 711 PEP+ 0.000 194 GAP+0.000 19 F6P+0.000 154 G6P+0.000 816 R5P+0.000 308 E4P+0.001 353 3PG—〉Biomass[16]
Streptomyces sp. ε-PL代谢网络中的各个组分,都符合质量守恒定律,对每一种组分列出质量平衡方程(表 3)。
| Extracellular substance | The mass balance equation |
| G6P | 1 r1-1 r2-1 r8-0.000 154 r26 =0 |
| Ribu5P | 1 r2-1 r3-1 r4=0 |
| X5P | 1 r4-1 r5-1 r7=0 |
| R5P | 1 r3-1 r5-0.000 816 r26=0 |
| S7P | 1 r5-1 r6=0 |
| E4P | 1 r6-1 r7-0.000 308 r26=0 |
| F6P | 1 r6+1 r7+1 r8-1 r9-0.000 19 r26=0 |
| GAP | 1 r5+1 r7+2 r9-1 r6-1 r10-0.000 194 r26=0 |
| 3PG | 1 r10-1 r11-1 r12-0.001 353 r26=0 |
| PEP | 1 r12-1 r13-0.000 711 r26=0 |
| Pyr | 1 r13-2 r14-1 r15-1 r16-1 r17-1 r23-0.003 09 r26=0 |
| AcCoA | 1 r16-1 r14-1 r18-0.002 132 r26=0 |
| Ici | 1 r18-1 r19=0 |
| α-KG | 1 r11+1 r14+1 r15+1 r19+1 r21+1 r23-1 r20-0.001 071 r26=0 |
| OAA | 1 r17+1 r20-1 r18-1 r21-0.001 923 r26=0 |
| Asp | 1 r21-1 r22-1 r23=0 |
| Lys | 1 r23-1 r24-1 r25=0 |
| NADPH | 2 r2-2 r22-2 r23-0.016 06 r26=0 |
其中,方程组为18个,未知数为26个,方程自由度为26-18=8个,即测得8个代谢组分的代谢速率即可求解方程。
2.2.3 亲本与GS菌株代谢流量分布:对亲本菌株及GS菌株进行分批发酵,结果如图 3所示,在对数生长中期,ε-PL产物积累速率较快,生物量快速增加。本实验室前期研究也证明菌体的生长与ε-PL产物的合成密切相关[13],因此可认为该阶段细胞处于拟稳态。

|
| 图 3 菌株AS32 (A)、F15 (B)和AF3-44 (C)控制pH 4.0分批发酵参数 Figure 3 pH 4.0 control strategy of batch fermentation by AS32 (A), F15 (B) and AF3-44 (C) 注:虚线框时间段为对数生长中期. Note: Mid-log phase is included in boxes with dotted lines. |
|
|
分别以对应菌株的葡萄糖的摄取率[AS32: 1.46 mmol/(g DCW·h);F15:0.64 mmol/(g DCW·h);AF3-44:1.37 mmol/(g DCW·h)]假定为100,测定Glucose、Serex、Leuex、Alaex、Threx、Lysex、ε-PL和Biomass的浓度变化,计算其代谢速率(表 4),再根据表 3质量平衡方程通过Matlab 7.0软件计算出代谢网络中各反应的代谢速率[20],得出菌株的代谢流量分布(表 5)。
| Extracellular substance | AS32 (Mid-log phase 28-36 h) | F15 (Mid-log phase 40-48 h) | AF3-44 (Mid-log phase 28-36 h) | |||||
| Change in the concentration (g/L) | Metabolic flux | Change in the concentration (g/L) | Metabolic flux | Change in the concentration (g/L) | Metabolic flux | |||
| Glucose | 11.38 | 100 | 6.61 | 100 | 16.52 | 100 | ||
| Serex | 2.55×10-3 | 0.09 | 0.59×10-3 | 0.015 | 0.06×10-3 | 0.00 | ||
| Leuex | 8.11×10-3 | 0.29 | 9.38×10-3 | 0.194 | 4.47×10-3 | 0.04 | ||
| Alaex | 2.03×10-3 | 0.07 | 18.57×10-3 | 0.567 | 1.90×10-3 | 0.02 | ||
| Threx | 2.90×10-3 | 0.11 | 2.36×10-3 | 0.054 | 2.64×10-3 | 0.02 | ||
| Lysex | 9.12×10-3 | 0.33 | 11.58×10-3 | 0.215 | 8.73×10-3 | 0.06 | ||
| ε-PL | 0.46 | 4.97 | 0.31 | 5.81 | 1.17 | 8.71 | ||
| Biomass | 2.60 | 4.11 | 2.57 | 6.99 | 5.55 | 6.05 | ||
| 注:下标ex表示分泌到胞外的代谢物. Note: The subscript exindicates extracellular pools of products. | ||||||||
| Metabolic pathway | Reaction No. | AS32 | F15 | AF3-44 |
| EMP | r1 r8 r9 r10 r12 r13 | 100 60.94 83.12 176.28 170.62 161.15 | 100 36.65 72.31 160.68 151.19 132.07 | 100 41.71 74.89 164.84 156.66 143.09 |
| PPP | r2 r3 r4 r5 r6 r7 | 38.43 15.47 22.96 12.11 12.11 10.85 | 62.27 25.28 36.99 19.57 19.57 17.42 | 57.36 23.03 34.33 18.09 18.09 16.23 |
| Anaplerotic pathway | r17 | 6.55 | 14.15 | 9.27 |
| TCA | r16 r18 r19 r20 | 142.60 133.54 133.54 140.30 | 103.67 88.56 88.56 93.94 | 115.72 102.79 102.79 113.95 |
| Amino acid synthesis | r11 r14 r15 r21 r22 r23 r24 | 0.09 0.30 0.07 5.40 0.10 5.30 0.33 | 0.01 0.19 0.57 6.08 0.05 6.02 0.21 | 0 0.04 0.02 8.80 0.02 8.77 0.06 |
| ε-PL synthesis | r25 | 4.96 | 5.81 | 8.71 |
| Biomass synthesis | r26 | 4.11 | 6.99 | 6.05 |
由表 5可知,亲本菌株AS32 TCA通量最高,F15 PPP通量最高。AF3-44 ε-PL合成的通量最高,而TCA和PPP通量位于两亲本菌株的中间水平。PPP为合成ε-PL的前体物Lys提供NADPH (图 2)。Kawai等[21]研究表明ε-PL的合成是以赖氨酸的腺苷酸化为第一步,而TCA为Lys合成ε-PL提供腺苷酸化所需的ATP。Xu等[22]研究发现添加0.5%的正十二烷提高溶氧,能够增大回补途径以及TCA代谢通量,使更多的碳流量流向OAA,为ε-PL的合成提供了更多的碳源以及ATP,最终提高了ε-PL产量。李凤[23]通过考察野生菌株Streptomyces padanus LS-L5与融合菌F2-7代谢通量分布发现融合菌较野生菌从OAA流向l-Asp的代谢通量得到提高,使更多的碳流量流向ε-PL合成途径,进一步提高了ε-PL产量。本文的研究结果表明,高的ε-PL合成通量、以及PPP和TCA的重新分配导致了AF3-44 ε-PL产量的提高。
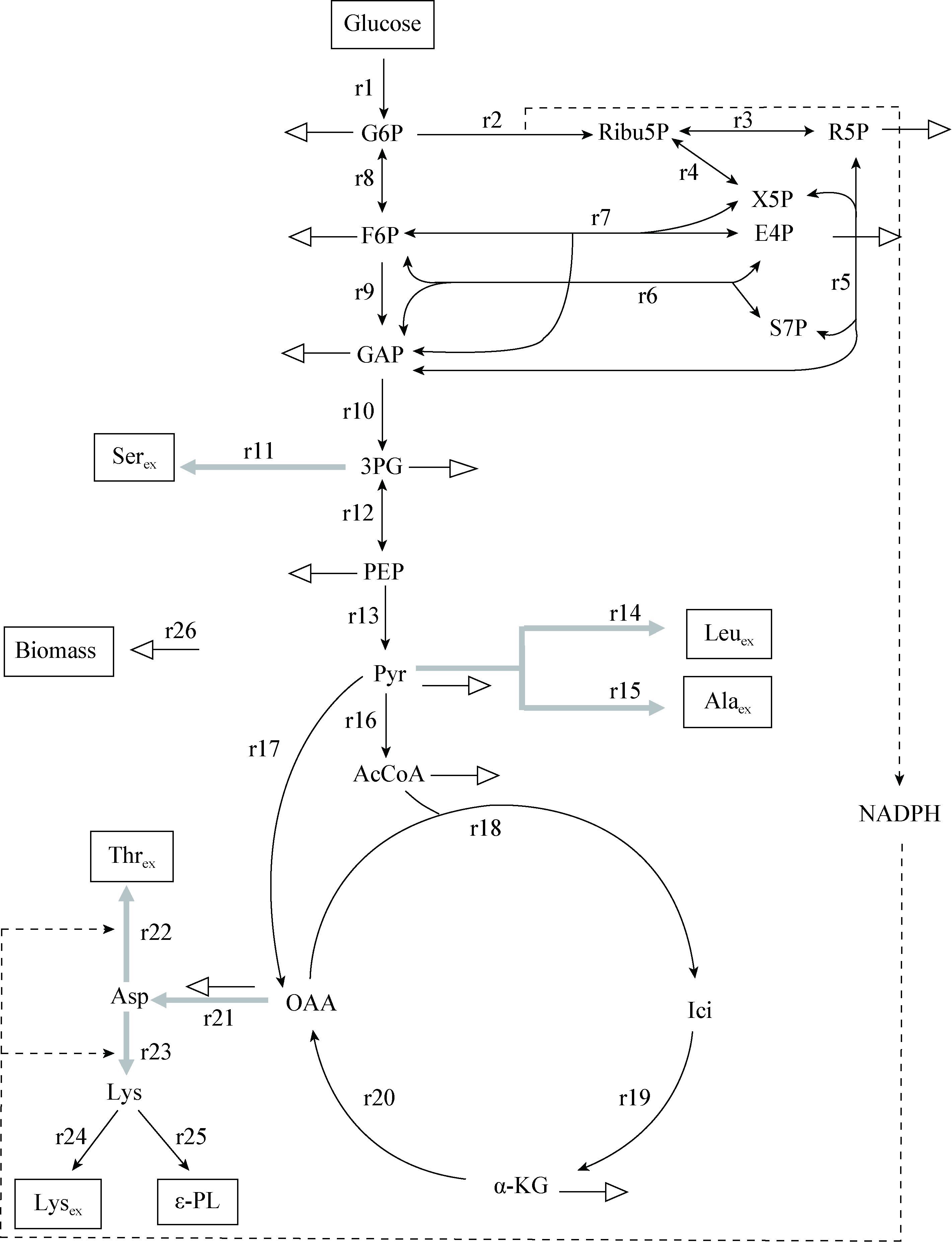
2.2.4 亲本与GS菌株关键节点流量分析:G6P是代谢流向EMP和PPP的分流节点,其中PPP是细胞产生还原力(NADPH)的主要途径,同时也是细胞内不同结构糖分子的重要来源,包括核糖及其衍生物等。同时氨基酸的合成与NADPH的利用紧密相关[24]。但若不断增强PPP通量会造成底物碳源物质的损失,Bommareddy等通过改变甘油醛3-磷酸脱氢酶的特异性来提供NADPH,在不改变PPP代谢通量的情况下,增加了谷氨酸棒杆菌中赖氨酸的产量[24]。本研究的代谢通量分析显示,在3种菌株中F15流向PPP的通量最高(r2) ,GS菌株AF3-44次之,AS32最低(图 4A)。AF3-44流向5-磷酸核酮糖的通量分别为AS32和F15的149%和92%。
|
| 图 4 亲本与GS菌株关键节点G6P (A)和OAA (B)处流量分配 Figure 4 Flux distribution of parent strains and shuffled strain at key nodes G6P (A)node and OAA (B) 注:空心箭头代表流向合成生物质的碳流量;黑色框内数值为中心碳代谢通量值. Note: Hollow arrows represent carbon fluxes of biomass synthesis; Flux values in the central metabolism are included in boxes with solid lines. |
|
|
OAA是代谢流向天冬氨酸的节点,也是ε-PL代谢的关键节点之一[25],由图 4B可知AF3-44流向天冬氨酸的通量最高(r21) ,分别为AS32和F15的162%和145%,从而为ε-PL提供了合成前体l-Lys所需的高代谢通量。TCA是绝大多生物体主要的分解代谢途径,许多合成代谢中都利用TCA的中间产物作为生物合成的前体来源,而且TCA提供了ε-PL合成所需的ATP。但TCA通量也并不是越高越好,TCA增大会相应减小PPP通量,造成前体赖氨酸合成所需NADPH的不足。图 4B节点分析显示,由OAA流向异柠檬酸的通量AS32最高(r18) ,F15最低,GS菌株AF3-44处于中间水平,分别为AS32和F15的77%和116%。
3 结论通过GS的方法筛选得到一株高产菌株,应用代谢通量分析方法构建了ε-PL合成代谢网络,通过GS菌株与亲本菌株进行代谢通量分析表明:GS菌株AF3-44实现了亲本F15的高PPP通量和亲本AS32高TCA通量的重新分配,以及流向前体赖氨酸和ε-PL通量的增加,使得ε-PL产量在原有基础上进一步提高。本研究证实了通过GS方式获得代谢流重新分布,进而提高产物产量的实例,为进一步通过代谢工程方式改良菌种奠定了基础。
| [1] | Shima S, Sakai H. Poly-L-lysine produced by Streptomyces. Part II. Taxonomy and fermentation studies[J]. Agricultural and Biological Chemistry 1981, 45(11) : 2497–2502. |
| [2] | Hiraki J, Ichikawa T, Ninomiya SI, et al. Use of ADME studies to confirm the safety of ε-polylysine as a preservative in food[J]. Regulatory Toxicology and Pharmacology 2003, 37(2) : 328–340. DOI:10.1016/S0273-2300(03)00029-1 |
| [3] | National Health and Family Planning Commision of the People's Republic of China. Announcement on the approval of ε-polylysine and other four new food additives (No. 5, 2014)[J]. China Food Additives 2014(3) : 213–221. (in Chinese) 中华人民共和国国家卫生和计划生育委员会. 关于批准ε-聚赖氨酸等4种食品添加剂新品种等的公告(2014年第5号)[J]. 中国食品添加剂 2014(3) : 213–221. |
| [4] | Guo JX, Xu SX, Liu JL, et al. Improved ε-polylysine production progress[J]. China Brewing 2013, 32(3) : 13–15. (in Chinese) 郭稼祥, 徐淑霞, 刘教练, 等. 提高ε-聚赖氨酸产量的研究进展[J]. 中国酿造 2013, 32(3) : 13–15. |
| [5] | Hiraki J, Hatakeyama M, Morita H, et al. Improved ε-poly-L-lysine production of an S-(2-aminoethyl)-L-cysteine resistant mutant of Streptomyces albulus[J]. Seibutsu-kogaku Kaishi 1998, 76(12) : 487–493. |
| [6] | Hirohara H, Takehara M, Saimura M, et al. Biosynthesis of poly(ε-L-lysine)s in two newly isolated strains of Streptomyces sp[J]. Applied Microbiology and Biotechnology 2006, 73 : 321–331. DOI:10.1007/s00253-006-0479-2 |
| [7] | Gong JX, Zheng HJ, Wu ZJ, et al. Genome shuffling: progress and applications for phenotype improvement[J]. Biotechnology Advances 2009, 27(6) : 996–1005. DOI:10.1016/j.biotechadv.2009.05.016 |
| [8] | Li S, Li F, Chen XS, et al. Genome shuffling enhanced ε-poly-L-lysine production by improving glucose tolerance of Streptomyces graminearus[J]. Applied Biochemistry and Biotechnology 2012, 166(2) : 414–423. DOI:10.1007/s12010-011-9437-2 |
| [9] | Zhang B. Metabolic Engineering[M]. Tianjin: Tianjin University Press, 2003 . (in Chinese) 张蓓. 代谢工程[M]. 天津: 天津大学出版社, 2003, . |
| [10] | Li XJ, Chen T, Chen X, et al. Advances in 13C metabolic flux analysis[J]. Progress in Chemistry 2006, 18(7) : 995–1001. (in Chinese) 李晓静, 陈涛, 陈洵, 等. 13C代谢通量分析[J]. 化学进展 2006, 18(7) : 995–1001. |
| [11] | Zhou YP. Genome shuffling and metabolic regulation analysis of ε-poly-L-lysine producing strains[D]. Wuxi: Master's Thesis of Jiangnan University, 2015 (in Chinese) 周永鹏. ε-聚赖氨酸产生菌的基因组重排与代谢调控分析[D]. 无锡: 江南大学硕士学位论文, 2015 |
| [12] | Itzhaki RF. Colorimetric method for estimating polylysine and polyarginine[J]. Analytical Biochemistry 1972, 50(2) : 569–574. DOI:10.1016/0003-2697(72)90067-X |
| [13] | Chen XS. Enhancement of ε-poly-L-lysine production through carbon source supply strategy optimization and fermentation process regulation by Streptomyces sp. M-Z18[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2011 (in Chinese) 陈旭升. Streptomyces sp. M-Z18发酵生产ε-聚赖氨酸的碳源供给策略与过程调控研究[D]. 无锡: 江南大学博士学位论文, 2011 |
| [14] | Liao LJ. Isolation and breeding of ε-poly-L-lysine producing strain and enhancement on production process[D]. Wuxi: Master's Thesis of Jiangnan University, 2010 (in Chinese) 廖莉娟. ε-聚赖氨酸的菌种选育及合成过程强化[D]. 无锡: 江南大学硕士学位论文, 2010 |
| [15] | Daae EB, Ison AP. Classification and sensitivity analysis of a proposed primary metabolic reaction network for Streptomyces lividans[J]. Metabolic Engineering 1999, 1(2) : 153–165. DOI:10.1006/mben.1998.0112 |
| [16] | Ma HW. Metabolic network analysis by stoichiometric relatioship based on fermentation and genomic information[D]. Tianjin: Doctoral Dissertation of Tianjin University, 2001 (in Chinese) 马红武. 由发酵实验数据和基因组信息基于计量关系分析代谢网络[D]. 天津: 天津大学博士学位论文, 2001 |
| [17] | Shi QS, Feng FP. Advanced in studying of cyanophycin[J]. Journal of Yunnan University (Natural Sciences) 2004, 26(6A) : 82–86. (in Chinese) 施庆珊, 冯方平. 蓝细菌肽研究进展[J]. 云南大学学报: 自然科学版 2004, 26(6A) : 82–86. |
| [18] | Yan SQ, Li J, Fang HS. Development and software application of flux balance analysis[J]. Pharmaceutical Biotechnology 2015, 22(3) : 269–274. (in Chinese) 颜思奇, 李娟, 方慧生. 通量平衡分析的进展与应用[J]. 药物生物技术 2015, 22(3) : 269–274. |
| [19] | D'Huys PJ, Lule I, Vercammen D, et al. Genome-scale metabolic flux analysis of Streptomyces lividans growing on a complex medium[J]. Journal of Biotechnology 2012, 161(1) : 1–13. DOI:10.1016/j.jbiotec.2012.04.010 |
| [20] | Song C. Application of metabolic network in the astaxanthin biosynthesis[D]. Dalian: Master's Thesis of Dalian Polytechnic University, 2010 (in Chinese) 宋超. 代谢网络在虾青素生物合成中的应用[D]. 大连: 大连工业大学硕士学位论文, 2010 |
| [21] | Kawai T, Kubota T, Hiraki J, et al. Biosynthesis of ε-poly-L-lysine in a cell-free system of Streptomyces albulus[J]. Biochemical and Biophysical Research Communications 2003, 311(3) : 635–640. DOI:10.1016/j.bbrc.2003.10.033 |
| [22] | Xu ZX, Bo FF, Xia J, et al. Effects of oxygen-vectors on the synthesis of epsilon-poly-lysine and the metabolic characterization of Streptomyces albulus PD-1[J]. Biochemical Engineering Journal 2015, 94 : 58–64. DOI:10.1016/j.bej.2014.11.009 |
| [23] | Li F. ε-poly-L-lysine producing strain breeding by genome shuffling[D]. Wuxi: Master's Thesis of Jiangnan University, 2012 (in Chinese) 李凤. Genome shuffling技术选育ε-聚赖氨酸高产菌[D]. 无锡: 江南大学硕士学位论文, 2012 |
| [24] | Bommareddy RR, Chen Z, Rappert S, et al. A de novo NADPH generation pathway for improving lysine production of Corynebacterium glutamicum by rational design of the coenzyme specificity of glyceraldehyde 3-phosphate dehydrogenase[J]. Metabolic Engineering 2014, 25 : 30–37. DOI:10.1016/j.ymben.2014.06.005 |
| [25] | Zhang Y, Feng XH, Xu H. Biosynthesis of ε-poly-L-lysine—a review[J]. Acta Microbiologica Sinica 2011, 51(10) : 1291–1296. (in Chinese) 张扬, 冯小海, 徐虹. ε-聚赖氨酸生物合成研究进展[J]. 微生物学报 2011, 51(10) : 1291–1296. |
 2016, Vol. 43
2016, Vol. 43