扩展功能
文章信息
- 冉军舰, 徐剑宏, 赫丹, 胡晓丹, 史建荣
- RAN Jun-jian, XU Jian-hong, HE Dan, HU Xiao-dan, SHI Jian-rong
- 小麦赤霉病原菌拮抗菌Bacillus amyloliquefaciens 7M1产抗菌素的研究
- Identification of antagonistic bacterium strain Bacillus amyloliquefaciens 7M1 against Fusarium graminearum and characterization of the antibiotics from the target strain
- 微生物学通报, 2016, 48(11): 2437-2447
- Microbiology China, 2016, 48(11): 2437-2447
- DOI: 10.13344/j.microbiol.china.151013
-
文章历史
- 收稿日期: 2015-12-07
- 接受日期: 2016-01-03
- 优先数字出版日期(www.cnki.net): 2016-01-04
2. 河南科技学院食品学院 河南 新乡 453003
2. School of Food Science, Henan Institute of Science and Technology, Xinxiang, Henan 453003, China
小麦赤霉病(wheat scab,Fusarium head blight,FHB)是由多种镰孢属真菌侵染小麦引起的一种典型的土传加气传病害,是世界温暖潮湿和半潮湿地区小麦的重要病害,会造成小麦大量的减产和品质的降低。引起小麦赤霉病的主要病原菌主要是以下5种:禾谷镰刀菌(F. graminearum)、黄色镰刀菌(F. culmorum)、梨孢镰刀菌(F. poae)、燕麦镰刀菌(F. avenaceum)以及雪腐镰刀菌(Microdochium nival),在我国绝大部分地区优势的小麦赤霉病病原和赤霉毒素产生菌为禾谷镰刀菌(F. graminearu)。鉴于防治赤霉病的必要性,国内外学者采用了多种防治措施,其中生物防治是目前研究的重点和热点,许多细菌能够产生抗菌活性物质,这些物质对植物抵抗病原菌侵入、潜伏、扩展蔓延等有非常重要的作用。解淀粉芽孢杆菌(Bacillus amyloliquefaciens)是广泛存在于自然界的一种非致病性细菌,在其生长过程中会产生小分子量抗菌素、抗菌蛋白或者多肽类物质,从而抑制多种植物病原菌,在生物防治中发挥了重要的作用[1]。据报道,芽孢杆菌产生的抗菌物质主要有脂肽类化合物、抗菌蛋白、聚酮类化合物等[2-3],其中通过非核糖体途径合成的丰原素(Fengycin)、伊枯草菌素(Iturin)和表面活性素(Surfactin)等脂肽类抗菌素[4]是芽孢杆菌发酵过程中产生的主要抗菌素,在抑制真菌病害中起着重要作用。Ongena等发现伊枯草菌素可以破坏酵母细胞的细胞膜,使钾离子和其他重要物质渗透,造成酵母细胞的死亡[5]。枯草芽孢杆菌产的抗霉枯草菌素(伊枯草菌素家族的重要活性物质)可以抑制多种酵母的生长,但对黄曲霉(Aspergillus spp.)的抑制是效果最好的[6]。丰原素能够影响真菌细胞膜的表面张力,导致微孔的形成,钾离子及其他重要离子渗漏,引起细胞死亡,但是对尖孢镰刀菌的形态和细胞结构没有显著影响[7]。Zhao等研究认为B. subtilis SG6产生的丰原素和表面活性素在抑制禾谷镰刀菌(F. graminearum)生长的过程中起主要作用[8]。
菌株7M1是从小麦根际土壤中分离筛选到的一株细菌,对小麦赤霉病禾谷镰刀菌有较强抑制作用,但是对于该菌的鉴定及其产生的抗菌素尚没有研究。为了能够将该菌产生的抗菌素用于生物防治,需要进一步对该菌产生的抗菌素种类进行鉴定,以期在一定程度上确定解淀粉芽孢杆菌7M1抗菌素相关基因,明确解淀粉芽孢杆菌在防治小麦赤霉病中的作用。
1 材料与方法 1.1 试验菌株菌株7M1:从江苏省农业科学院六合实验基地采集的小麦根基土壤中筛选分离保存的菌株;禾谷镰刀菌GZ3639:实验室保藏菌株。
1.2 培养基LB培养基[8]用于解淀粉芽孢杆菌7M1的培养。
PDA培养基[8]用于禾谷镰刀菌GZ3639的培养及拮抗活性测定。
1.3 主要仪器DHZ-D恒温冷冻振荡器,江苏省太仓市实验设备厂;GNP-9080BS-Ⅲ隔水式恒温培养箱,上海新苗医疗器械制造有限公司;DL-CJ-2N超级洁净工作台,北京东联哈尔仪器制造有限公司;Kendro D-37520高速冷冻离心机,德国Heraeus公司;Alpha1-2LD plus冷冻干燥机,德国Chirst公司;Lambda 25紫外可见光分光光度计,美国Perkin Elmer公司;Labcycler Standard Plus梯度PCR仪,德国SENSO公司。
1.4 试验方法 1.4.1 抑菌活性测定: 菌株7M1的抑菌活性测定:用灭菌枪头蘸取单菌落,加入装有2 mL LB的无菌试管中,30 ℃、180 r/min培养24 h,测定OD600,用无菌LB调节培养液OD600=0.8,取3.5 μL菌悬液,滴至平板厚度一致的PDA培养基上,30 ℃培养48 h后,将禾谷镰刀菌孢子液(孢子数1×105个/mL)均匀喷在培养后的平板上,28 ℃培养48 h,每个试验重复3次。用十字交叉法测定抑菌圈直径,抑菌圈直径(mm)=总直径(mm)−菌落直径(mm)。 抗菌素的抑菌活性测定:在平板厚度一致的PDA培养基上均匀涂布指示菌禾谷镰刀菌的孢子液,放置灭过菌的牛津杯,加入20 μL的样品,28 ℃培养48 h,观察结果,用十字交叉法测量抑菌圈直径[抑菌圈直径(mm)=总直径(mm)−牛津杯直径(mm)],每个实验重复3次,以未接菌的用相同方法处理的培养液为空白对照。 1.4.2 生长曲线及抗菌活性曲线测定: 将保藏的7M1菌株划线于LB固体培养基上30 ℃培养过夜,挑选单菌落于LB液体培养基中,30 ℃、200 r/min振荡培养24 h。将活化好的菌悬液以1%接种量转接至LB液体培养基中,30 ℃、200 r/min振荡培养,每隔2 h测定一次OD600值,当OD600值趋于稳定时停止测定。采用1.4.1所述方法测定菌株不同生长时期的抑菌活性,然后作7M1菌株的生长曲线和抑菌活性曲线。 1.4.3 菌种的鉴定: 提取菌株7M1基因组DNA作为模板,使用芽孢杆菌16S rRNA[9]基因通用引物扩增。16S rRNA基因引物为27F (5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′)。反应体系:10×Taq buffer (Mg2+ free) 5.0 μL,MgCl2(25 mmol/L) 3.0 μL,dNTP mixer (10 mmol/L)1.0 μL,primer 27F (10 μmol/L) 1.5 μL,primer 1492R (10 μmol/L) 1.5 μL,模板(DNA) 0.7 μL,rTaq (5 U/μL) 0.3 μL,ddH2O 37 μL。PCR程序:98 ℃ 2 min;98 ℃ 15 s,55 ℃ 30 s,72 ℃1.5 min,30个循环;72 ℃ 10 min。所得PCR产物纯化后通过T-A克隆到pMD-19T载体,转入E. coli DH5α感受态细胞,鉴定阳性克隆,菌液送至上海生工生物工程技术服务有限公司进行纯化测序,将得到的基因序列通过BLAST在GenBank中进行同源比对,通过邻近法构建系统进化树,并自举分析(Bootstrap)进行置信度检测,自举数据集1 000次,初步确定拮抗菌种属。 1.4.4 抗菌素的提取: 抗菌素的提取方法参考文献[10]并做了一定的修改:取100 mL发酵培养液,10 000 r/min离心15 min,上清冷冻干燥后溶于10 mL去离子水,加入等体积的乙酸乙酯,在超声波辅助条件下提取15 min (40 Hz,200 w),然后旋转蒸发溶于1 mL甲醇,再经0.22 μm有机滤膜过滤,收集滤液保存在4 ℃待用。 1.4.5 光照培养箱防治实验: 从麦田中取扬花期的小麦,除去叶子,将麦穗修剪成25 cm长,选取麦穗大小一致的样品置于无菌水中。在麦穗部位均匀喷洒提取的抗菌素,对照药剂50%多菌灵可湿粉以500倍液喷洒在麦穗,在25 ℃光照培养箱中放置过夜,再吸取1 μL禾谷镰刀菌孢子液(孢子数1×105个/mL)注入穗轴中部麦小穗的颖片中,并作记号,以接禾谷镰刀菌孢子液、未喷洒抗菌素和对照药剂的样品为空白对照,每个处理15株,3次重复。置于温度25 ℃、湿度80%的光照培养箱中培养,15 d后调查小麦穗的发病情况,统计发病率和病情指数,计算相对防治效果[11]。 防治效果(%)=[(对照病情指数−处理病情指数)/对照病情指数]×100 1.4.6 拮抗物质稳定性的测定: 对热的稳定性:将经过硫酸铵沉淀的2 mL粗提液分别在40、50、60、70、80、90、100 ℃不同温度条件下水浴处理30 min,在0.107 MPa的灭菌锅中静置30 min,以未经温度处理的粗提液作为对照,测定经过不同温度处理的粗提液的抑菌活性,每个处理重复3次[12]。对蛋白酶的稳定性:取3份经过硫酸铵沉淀的2 mL粗提液,分别加入1 g/L的胰蛋白酶、胃蛋白酶、蛋白酶K溶液20 μL,30 ℃水浴处理60 min,采用牛津杯法测定处理后的粗提液的抑菌活性,以加入20 μL PBS缓冲液(pH 7.0)处理的粗提溶液作为对照,每个处理重复3次[13-14]。对pH的稳定性:将经过硫酸铵沉淀的2 mL粗提溶液用0.2 mol/L磷酸氢二钠和0.1 mol/L柠檬酸不同比例的混合液与1 mol/L氢氧化钠溶液,分别调pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,12 h后调节pH至中性,以未经处理的粗提溶液为对照,采用牛津杯法,测定不同pH处理后的粗提液的抑菌活性,每个处理重复3次[15]。对紫外线的稳定性:将经过硫酸铵沉淀的2 mL粗提液倒入细胞培养板(直径35 mm)置于30 W紫外光下,距离30 cm,照射0.25、0.5、1.0、1.5、2.0 h,以不用紫外光照射的粗提液为对照,采用牛津杯法,取20 μL检测其抑菌活性[15]。 1.4.7 引物设计: 芽孢杆菌溶素、伊枯草菌素、杆菌抗霉素等合成必需基因的PCR合成引物参考文献[16],扩增bamD、bacAB、ituC等基因引物序列如表 1所示。产物大小预测值分别为482、749、594 bp。设计的引物在上海生工生物工程有限公司合成。| 抗菌素 Antibiotics |
基因 Gene |
引物 Primer |
序列 Primer sequence (5′→3′) |
产物大小 PCR product size (bp) |
| 芽孢杆菌溶素 Bacilysin |
bacAB | BACD-F | AAAAACAGTATTGGTYATCGCTGA | 749 |
| BACD-R | CCATGATGCCTTCKATRCTGAT | |||
| 伊枯草菌素 Iturin |
ituC | ITUC-F | CCCCCTCGGTCAAGTGAATA | 594 |
| ITUC-R | TTGGTTAAGCCCTGATGCTC | |||
| 杆菌抗霉素D Bacillomycin D |
bamD | ITUD-F | TTGAAYGTCAGYGCSCCTTT | 482 |
| ITUD-R | TGCGMAAATAATGGSG TCGT |
抑菌圈直径采用十字交叉法测量,每个试验3次重复,采用平均值±标准误差。
2 结果与分析 2.1 生长曲线及抑菌活性曲线菌株7M1的生长曲线及抗菌活性曲线如图 1所示,培养时间对菌株产生抗菌素的抑菌效果有很大的影响。随着菌株的生长,抑菌圈直径逐渐增加,在22 h达到最大值;随着时间的延长,抑菌圈逐渐减小,由此可见,抗菌素主要在菌体生长的对数阶段;在生长后期抑菌活性下降可能是因为培养时间过长使部分抗菌素失活或者被菌体吸附。
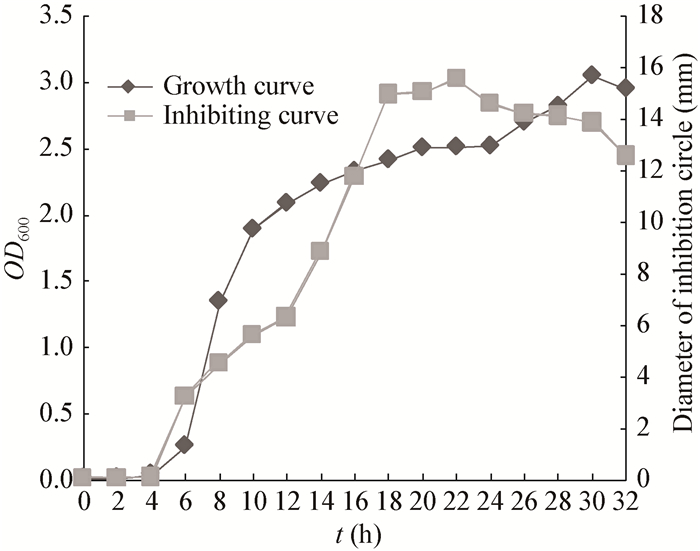
|
| 图 1 菌株7M1生长曲线及抑菌活性曲线 Figure 1 Curve on growth of strain 7M1 and antimicrobial activity |
|
|
通过对菌株7M1的16S rRNA基因进行PCR扩增,得到了1 458 bp的基因片段,与GenBank数据库中序列进行BLAST比对后,发现与菌株7M1相似性最高的类群为Bacillus amyloliquefaciens,相似性达98%。利用MEGA 5.0的Neighbor-Joining构建系统发育树,结果如图 2所示。初步鉴定7M1为解淀粉芽孢杆菌。
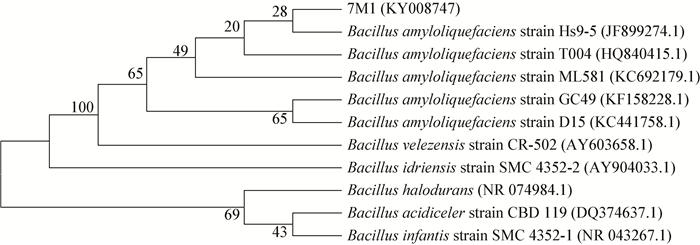
|
| 图 2 菌株7M1的16S rRNA基因系统进化树 Figure 2 Phylogenetic tree of strain 7M1 and telated species based on 16S rRNA gene sequences 注:发育树节点的数值表示Bootstrap值;括号内的数值为GenBank数据库中的登录号. Note: Number at notes present bootstrap percentages; GenBank accession number are shown in parentheses. |
|
|
通过1.4.4方法提取解淀粉芽孢杆菌7M1产抗菌素,利用1.4.1方法做抑菌试验,同时与解淀粉芽孢杆菌7M1的抑菌效果作比较,结果如图 3所示,7M1菌体和抗菌素提取物都有明显的抑菌圈,其抑菌圈直径分别为16.33±0.13 mm和15.43±0.21 mm,以甲醇做空白对照没有抑菌圈出现。

|
| 图 3 解淀粉芽孢杆菌7M1和产抗菌素抑制禾谷镰刀菌效果 Figure 3 Inhibition of Bacillus amyloliquefaciens 7M1 and its antibiotic against Fusarium graminearum |
|
|
从表 2可知,菌株7M1抗菌素粗提液处理的小麦穗在接种禾谷镰刀菌孢子液15 d后的发病率为24.33%,病情指数为22.51%,防治效果为76.41%;对照药剂50%多菌灵可湿粉500倍液处理的发病率为35.54%,病情指数为19.77%,防治效果为79.28%。说明菌株7M1对小麦赤霉病有较好的预防效果,菌株7M1及其代谢产物可以作为生防药剂用于小麦赤霉病的防治。
| 处理 Treatment |
发病率 Incidence (%) |
病情指数 Disease index (%) |
防治效果 Control efficacy (%) |
|
| 7M1抗菌素 7M1 antibiotics |
37.46±1.32 | 22.51±1.47 | 76.41±0.76 | |
| 50%多菌灵可湿粉 Carbendazim WP (500×) |
35.54±1.09 | 19.77±1.54 | 79.28±0.76 | |
| 阳性对照 Positive control |
100.00±0.00 | 95.43±1.43 | − | |
抗菌素粗提液的稳定测定结果如图 4所示,解淀粉芽孢杆菌7M1产生的抗菌素受温度的影响较小,当温度低于80 ℃时,虽然抗菌素抑菌活性有所下降,但下降幅度不大,总体上比较稳定;在温度达到90 ℃时,抗菌素抑菌活性大幅下降,温度达到100 ℃时抗菌素才失去活性,说明抗菌素有很好的热稳定性;经蛋白酶处理后的粗提液与未经蛋白酶处理的粗提液相比,抑菌活性明显下降,特别是胃蛋白酶的影响最大,说明抗菌素粗提液对蛋白酶敏感,从而也证实了抗菌素的蛋白质性质;抗菌素粗提液的抑菌活性在酸性条件下影响很大,抗菌素粗提液在中性条件下比较稳定,在强酸性和强碱性条件下不稳定,在pH值达到10.0以上或者5.0以下才失去抑菌活性,说明抗菌素粗提液的抑菌活性会受到酸碱的影响;随着紫外线照射时间的延长,粗提液的稳定性受到影响,抑菌活性有一定的降低。
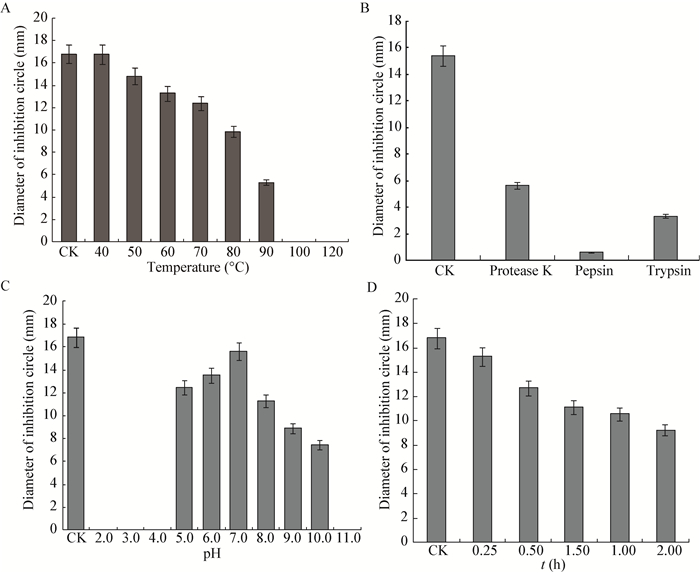
|
| 图 4 不同因素对抗菌素抑菌活性的影响 Figure 4 Inhibitory activity of antibiotics treated by different factors 注:A:温度;B:蛋白酶;C:pH;D:时间. Note: A: Temperature; B: Protease; C: pH; D: Time. |
|
|
利用设计的3对引物分别进行PCR扩增,并获得了3条目的条带(图 5),将PCR产物的测序结果在BLAST中比对,结果表明从解淀粉芽孢杆菌7M1扩增的bacAB基因与Bacillus subtilis isolate ME488 (EU334356.1)中调控基因bacilysin synthetase B (bacB)和bacilysin synthetase A (bacA)的相似性为99%;扩增的ituC基因与Bacillus amyloliquefaciens (KP453870.1)中的调控基因Iturin A synthetase C的相似性为99%;扩增的bamD基因与Bacillus subtilis (AF184956.1)中的Mycosubtilin操纵子相似性为99%。根据比对结果可以推测该菌的基因组DNA中可能存在芽孢杆菌溶素、伊枯草菌素和杆菌抗霉素D代谢合成操纵子序列,该菌可能代谢产生3种抗菌素。
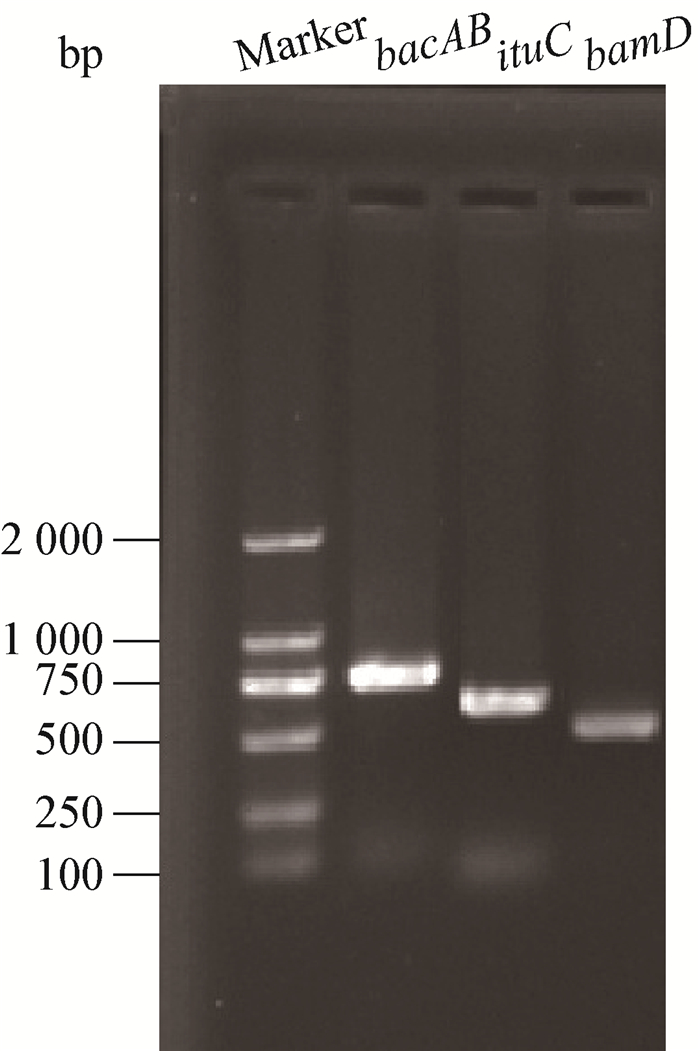
|
| 图 5 解淀粉芽孢杆菌7M1抗菌素合成基因的PCR扩增 Figure 5 PCR amplification of gene for antibiotics synthetase of Bacillus amyloliquefaciens 7M1 |
|
|
通过氨基酸的比对分析可以看出解淀粉芽孢杆菌7M1的bacAB基因编码产物的氨基酸序列与GenBank中的芽孢杆菌溶素合成酶有较高的相似性,解淀粉芽孢杆菌7M1的ituC基因编码产物的氨基酸序列与GenBank中的伊枯草菌素素合成酶有较高的相似性,解淀粉芽孢杆菌7M1的bamD基因编码产物的氨基酸序列与GenBank中的杆菌抗霉素D合成酶有较高的相似性。通过邻接法构建的系统发育树(图 6)也证实解淀粉芽孢杆菌7M1的抗菌素合成相关基因的系统进化关系。
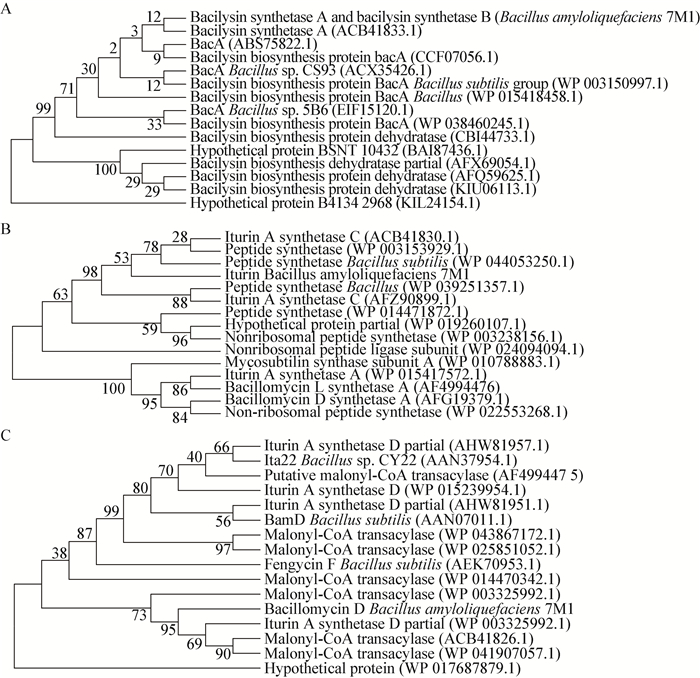
|
| 图 6 3种基因编码产物的氨基酸序列及系统发育树 Figure 6 Amino acid sequence of the encoded product of three genes and phylogenetic tree 注:发育树节点的数值表示Bootstrap值;括号内的数值为GenBank数据库中的登录号. A:bacAB;B:ituC;C:bamD. Note: Number at notes present bootstrap percentages; GenBank accession number are shown in parentheses. A: bacAB; B: ituC; C: bamD. |
|
|
在线软件蛋白预测结果显示,bacAB编码产物的相对分子量为13.23 kD,理论等电点为6.82,带负电的残基数(Asp+Glu)为15个,带正电荷的残基数(Arg+Lys)为15个,分子式为C597H936N156O173S5,原子数1 867,脂肪系数86.55,总平均疏水指数−0.24,不稳定系数25.42%,说明该蛋白较稳定,出现频率较高的氨基酸残基为Leu (10.3%)、Asp (8.6%)和Lys (7.8%),不含有Pyl和Sec。预测在N端的序列是Met,哺乳动物网织红细胞(体外)半衰期为30 h,酵母细胞(体内)半衰期为20 h,大肠杆菌细胞(体内)半衰期为10 h。
ituC编码产物的相对分子量为9.62 kD,理论等电点为8.07,带负电的残基数(Asp+Glu)为12个,带正电荷的残基数(Arg+Lys)为13个,分子式为C422H677N121O132S2,原子数1 354,脂肪系数71.46,总平均疏水指数−0.87,不稳定系数30.47%,说明该蛋白较稳定,出现频率较高的氨基酸残基为Thr (12.2%)、Glu (9.8%)和Gln (8.5%),不含有Pyl和Sec。预测在N端的序列是Leu,哺乳动物网织红细胞(体外)半衰期为5.5 h,酵母细胞(体内)半衰期为3 min,大肠杆菌细胞(体内)半衰期为2 min。
bamD编码产物的相对分子量为10.98 kD,理论等电点为9.57,带负电的残基数(Asp+Glu)为8个,带正电荷的残基数(Arg+Lys)为12个,分子式为C485H799N139O138S6,原子数1 567,脂肪系数105.63,总平均疏水指数−0.27,不稳定系数68.14%,说明该蛋白不稳定。出现频率较高的氨基酸残基为Leu (13.5%)、Lys (8.3%)和Asn (8.3%),不含有Pyl和Sec。预测在N端的序列是Met,哺乳动物网织红细胞(体外)半衰期为5.5 h,酵母细胞(体内)半衰期为3 min,大肠杆菌细胞(体内)半衰期为2 min。
2.9 解淀粉芽孢杆菌7M1抗菌素的氨基酸跨膜螺旋信号分析跨膜蛋白是由跨越脂质膜的片段(通常是螺旋)以及膜外连接这些片段的卷曲区域组成的。跨膜的片段往往含有较高比例的疏水残基,长度常常在20个残基以上,这种相对较长的疏水残基片段在可溶性球蛋白中很少见,因而可以依靠疏水残基片段来进行预测。跨膜螺旋是可以根据序列数据比较准确预测的蛋白质特性之一。解淀粉芽孢杆菌7M1抗菌素的氨基酸跨膜螺旋信号分析结果如表 3所示。
| 项目Projects | bacAB | ituC | bamD |
| 氨基酸数目 Number of amino acid |
116 | 82 | 96 |
| 预测的跨膜螺旋数 Prediction of transmembrane helical number |
0 | 0 | 0 |
| 跨膜螺旋中的氨基酸残基数 Amiono acid residue number of transmembrane helical |
0.006 15 | 0 | 0.101 13 |
| 前60个氨基酸残基数 The front 60 amino acid residue number |
0.001 14 | 0 | 0.101 13 |
| N端在细胞膜内的可能性 The possibility of N-terminal within the cell membrane |
0.056 87 | 0.063 12 | 0.444 36 |
由表 3可知,解淀粉芽孢杆菌7M1抗菌素合成相关基因(bacAB,ituC,bamD)编码产物的氨基酸跨膜螺旋中的氨基酸残基数分别是0.006 15、0和0.101 13,跨膜蛋白判定的相关标准显示[17],如果预测蛋白前60个氨基酸的跨膜螺旋中有数个氨基酸残基数,预测跨膜螺旋中的氨基酸残基数大于18,则氨基酸很有可能存在跨膜序列,并且蛋白的N端可能存在信号肽。由此可以说明解淀粉芽孢杆菌7M1抗菌素合成相关基因(bacAB,ituC,bamD)编码产物不具有明显的跨膜结构,而且N端不存在信号肽。
3 讨论目前有越来越多关于生防菌的研究,杨洪凤等[18]从樟树叶中分离获得的解淀粉芽孢杆菌对禾谷镰刀菌等多种病原真菌的生长有抑制作用;李峰等[19]从小麦植株体内分离到多粘类芽孢杆菌能抑制禾谷镰刀菌菌丝的生长,5倍稀释的无菌发酵液可完全抑制禾谷镰刀菌分生孢子萌发。本研究利用的是小麦根基土壤中筛选出的解淀粉芽孢杆菌7M1,该菌及其产生的抗菌素对禾谷镰刀菌有很好的抑制效果,其抗菌素粗提液对禾谷镰刀菌的抑制作用与多菌灵可湿粉500倍液产生的抑制效果相当,在实际应用过程中多菌灵可湿粉的有效用药浓度为800倍液[20],由此推测低浓度的7M1抗菌素在生产中也具有良好的防治赤霉病的效果,可以为替代化学农药用于小麦赤霉病的防治提供新途径。解淀粉芽孢杆菌7M1产生抗菌素有良好的热稳定性,在90 ℃仍具有活性,对蛋白酶部分敏感,以上特点说明菌株7M1产生的抗菌素至少由多肽和非多肽两类不同代谢物组成[21]。除耐高温外,菌株7M1产生的抗菌素在pH 5.0−10.0之间具有良好的抑菌活性,而且紫外线的照射对其抑菌活性影响也不明显,说明菌株7M1产生的抗菌素性质稳定,能够适应田间环境,具有实际应用的价值。
解淀粉芽孢杆菌属于芽孢杆菌属,与枯草芽孢杆菌有很高的亲缘性,在生长过程中能产生多种次级代谢产物抑制植物病原菌的生长[22],其中小分子脂肽类抗菌素如丰原素(Fengycin)、伊枯草菌素(Iturin)和表面活性素(Surfactin)等是主要的抗菌物质,为了进一步研究解淀粉芽孢杆菌7M1产生的抗菌素的种类,需要通过基因手段进行分析,本研究利用抗菌素相关基因的特异性引物对解淀粉芽孢杆菌7M1基因组DNA进行PCR扩增,发现该菌基因组中存在抗菌素的合成相关基因bacAB、ituC和bamD,推测解淀粉芽孢杆菌7M1基因组中可能存在芽孢杆菌溶素、伊枯草菌素和杆菌抗霉素D代谢合成操纵子序列,该菌可能代谢产生这3种抗菌素。通过生物信息学分析3种基因编码产物,各分子量跟文献报道的结果有所差异[23],可能是因为不同物种相关基因存在着分子量差异,并表现出多态性。依据不稳定系数需小于40才是稳定蛋白的标准[24],可判断bacAB编码蛋白和ituC编码蛋白是稳定蛋白,bamD编码蛋白是不稳定蛋白,这与软件分析的结果一致,另外解淀粉芽孢杆菌7M1抗菌素合成相关基因(bacAB,ituC,bamD)编码产物不具有明显的跨膜结构,而且N端不存在信号肽,说明产物可以大量分泌到胞外,可直接利用发酵液作为生防材料。
本研究不仅为小麦赤霉病生物防治提供材料,而且为抗菌素合成机制提供了研究基础,为验证解淀粉芽孢杆菌7M1在小麦赤霉病生防中的应用性,本研究将继续进行赤霉病防治效果的田间试验及活性物质的分离、纯化和结构鉴定。
| [1] | Li C, Wu WZ, Wu WL, et al. Ability of Bacillus amyloliquefaciens to inhibit growth of Anabaena flos-aquae and the inhibition mechanism[J]. Acta Scientiae Circumstantiae 2011, 31(8) : 1602–1608. (in Chinese) 李超, 吴为中, 吴伟龙, 等. 解淀粉芽孢杆菌对鱼腥藻的抑藻效果分析与机理初探[J]. 环境科学学报 2011, 31(8) : 1602–1608. |
| [2] | Gong AD, Li HP, Yuan QS, et al. Antagonistic mechanism of iturin A and plipastatin A from Bacillus amyloliquefaciens S76-3 from wheat spikes against Fusarium graminearum[J]. PLoS One 2015, 10(2) : e0116871. DOI:10.1371/journal.pone.0116871 |
| [3] | Yang H, Li X, Li X, et al. Identification of lipopeptide isoforms by MALDI-TOF-MS/MS based on the simultaneous purification of iturin, fengycin, and surfactin by RP-HPLC[J]. Analytical and Bioanalytical Chemistry 2015, 407(9) : 2529–2542. DOI:10.1007/s00216-015-8486-8 |
| [4] | Tsuge K, Akayama T, Shoda M. Cloning, sequencing and characterization of the iturin a operon[J]. Journal of Bacteriology 2001, 183(21) : 6265–6273. DOI:10.1128/JB.183.21.6265-6273.2001 |
| [5] | Ongena M, Jacques P. Bacillus lipopeptides: versatile weapons for plant disease biocontrol[J]. Trends in Microbiology 2008, 16(3) : 115–125. DOI:10.1016/j.tim.2007.12.009 |
| [6] | Fickers P, Guez JS, Damblon C, et al. High-level biosynthesis of the anteiso-C17 isoform of the antibiotic mycosubtilin in bacillus subtilis and characterization of its candidacidal activity[J]. Applied and Environmental Microbiology 2009, 75(13) : 4663–4640. |
| [7] | Zhao PC, Quan CS, Wang YG, et al. Bacillus amyloliquefaciens Q-426 as a potential biocontrol agent against Fusarium oxysporum f. sp. Spinaciae[J]. Journal of Basic Microbiology 2014, 54(5) : 448–456. DOI:10.1002/jobm.v54.5 |
| [8] | Zhao YJ, Selvaraj JN, Xing FG, et al. Antagonistic Action of Bacillus subtilis strain SG6 on Fusarium graminearum[J]. PLoS One 2014, 9(3) : e92486. DOI:10.1371/journal.pone.0092486 |
| [9] | Lotte R, Durand M, Mbeutcha A, et al. A rare case of histopathological bladder necrosis associated with Actinobaculum schaalii: the incremental value of an accurate microbiological diagnosis using 16S rDNA sequencing[J]. Anaerobe 2014, 26 : 46–48. DOI:10.1016/j.anaerobe.2014.01.005 |
| [10] | Zhang RS, Wang XY, Luo CP, et al. Identification of the lipopeptides from Bacillus amyloliquefaciens Lx-11 and biocontrol efficacy of surfactin against bacterial leaf streak[J]. Scientia Agricultura Sinica 2013, 46(10) : 2014–2021. (in Chinese) 张荣胜, 王晓宇, 罗楚平, 等. 解淀粉芽孢杆菌Lx-11产脂肽类物质鉴定及表面活性素对水稻细菌性条纹病的防治作用[J]. 中国农业科学 2013, 46(10) : 2014–2021. |
| [11] | Ma GH, Zhou CY, Xiao CG, et al. Identification of the endophytic bacterial isolate Itb57 from tobacco plant and its control efficacy on tobacco black shank caused by Phytophthora nicotianae[J]. Acta Phytophylacica Sinica 2010, 37(2) : 148–152. (in Chinese) 马冠华, 周常勇, 肖崇刚, 等. 烟草内生细菌Itb57的鉴定及其对烟草黑胫病的防治效果[J]. 植物保护学报 2010, 37(2) : 148–152. |
| [12] | Chung S, Kong H, Buyer JS, et al. Isolation and partial characterization of Bacillus subtilis ME488 for suppression of soilborne pathogens of cucumber and pepper[J]. Applied Microbiology and Biotechnology 2008, 80(1) : 115–123. DOI:10.1007/s00253-008-1520-4 |
| [13] | Leelasuphakul W, Sivanunsakul P, Souwalak Phongpaichit S. Purification, characterization and synergistic activity of β-l, 3-glucanase and antibiotic extract from an antagonistic Bacillus subtilis NSRS 89-24 against rice blast and sheath blight[J]. Enzyme and Microbial Technology 2006, 38(7) : 990–997. DOI:10.1016/j.enzmictec.2005.08.030 |
| [14] | Holt JG, Sneath PHA, Krieg NR. Bergey's Manua l of Systematic Bacteriology[M].4th edition. Baltimore: Wiliams and Wilkins, 1986. 2. : 1104 -1138. |
| [15] | Peng HW, Li QQ, Meng JR, et al. Characterization of antagonistic protein from Bacillus sp. B11 and its mechanism against Fusarium oxysporum on water melon[J]. Plant Protection 2003, 29(5) : 22–25. (in Chinese) 彭好文, 黎起秦, 蒙娇荣, 等. 芽孢杆菌B11拮抗蛋白性质及其对西瓜枯姜病菌的作用机理[J]. 植物保护 2003, 29(5) : 22–25. |
| [16] | Wang QJ, Chen SW, Yu ZN. Study on the property of antagonistic substances produced by Bacillus subtilis isolate B6-1[J]. Journal of Xiaogan University 2008, 28(3) : 82–84. (in Chinese) 王启军, 陈守文, 喻子牛. 枯草芽胞杆菌B6-1产拮抗物质性质的研究[J]. 孝感学院学报 2008, 28(3) : 82–84. |
| [17] | Cao HP, He S, Wang HC, et al. Analysis of antibiotics related genes from antagonistic bacillus amyloliquefaciens against Aeromonas hydrophila[J]. Food Science 2013, 34(1) : 171–174. (in Chinese) 曹海鹏, 何珊, 王会聪, 等. 嗜水气单胞菌拮抗芽孢杆菌抗生素相关基因分析[J]. 食品科学 2013, 34(1) : 171–174. |
| [18] | Yang HF, Yu XY, Xue YR, et al. Colonization of endophytic Bacillus amyloliquefaciens CC09 in wheat roots observed under transmission electron microscopy and its biocontrol efficiency against diseases[J]. Chinese Journal of Biological Control 2014, 30(6) : 839–844. (in Chinese) 杨洪凤, 余向阳, 薛雅蓉, 等. 内生解淀粉芽孢杆菌CC09在小麦根部定殖的电镜观察及防病效果[J]. 中国生物防治学报 2014, 30(6) : 839–844. |
| [19] | Li F, Xu DY, Wang GL, et al. Screening and fungistatic activity of an endophytic bacterial strain from wheat against Fusarium graminearum[J]. Chinese Journal of Ecology 2011, 30(8) : 1738–1743. (in Chinese) 李峰, 徐大勇, 王光利, 等. 一株拮抗赤霉病的小麦内生细菌的筛选和抑菌活性[J]. 生态学杂志 2011, 30(8) : 1738–1743. |
| [20] | Ji LJ, Wang ST, Hu TL, et al. Control effect of carbendazim, horizon and its mixture on the controlling of Fusarium head blight[J]. Chinese Agricultural Science Bulletin 2007, 23(3) : 352–355. (in Chinese) 纪莉景, 王树桐, 胡同乐, 等. 多菌灵、好力克及其复配对小麦赤霉病的防治效果[J]. 植物农学通报 2007, 23(3) : 352–355. |
| [21] | He F, Xu DL, Zhang QZ. Screening of antagonistic bacterium strain against Saprolegnia sp. and characterization of the antifungal stability of culture broth from the target strain[J]. Microbiology China 2015, 42(6) : 1067–1074. (in Chinese) 贺凤, 许德麟, 张其中. 水霉拮抗菌的筛选及其拮抗活性物质稳定性初步研究[J]. 微生物学通报 2015, 42(6) : 1067–1074. |
| [22] | Dunlap CA, Bowman MJ, Schisler DA, et al. Genomic analysis and secondary metabolite production in Bacillus amyloliquefaciens AS43.3: a biocontrol antagonist of Fusarium head blight[J]. Biological Control 2013, 64(2) : 166–175. DOI:10.1016/j.biocontrol.2012.11.002 |
| [23] | Zeriouh H, Romero D, García-Gutiérrez L, et al. The iturin-like lipopeptides are essential components in the biological control arsenal of Bacillus subtilis against bacterial diseases of cucurbits[J]. Molecular Plant-Microbe Interactions 2011, 24(12) : 1540–1552. DOI:10.1094/MPMI-06-11-0162 |
| [24] | Zhang YL, Zhang ZJ, Yang FS, et al. Cloning and bioinformatics analysis of PmNHX1 gene from Xinjiang halophyte plantago maritima[J]. China Biotechnology 2009, 29(1) : 27–33. (in Chinese) 张雨良, 张智俊, 杨峰山, 等. 新疆盐生植物车前PmNHX1基因的克隆及生物信息学分析[J]. 中国生物工程 2009, 29(1) : 27–33. |
 2016, Vol. 48
2016, Vol. 48




