扩展功能
文章信息
- 刘俊梅, 王庆, 王丹, 杨盼盼, 丁伟, 朴春红, 王玉华, 于寒松
- LIU Jun-Mei, WANG Qing, WANG Dan, YANG Pan-Pan, DING Wei, PIAO Chun-Hong, WANG Yu-Hua, YU Han-Song
- 紫外线和硫酸二乙酯复合诱变选育PHB 高产菌株
- Mutagenesis of poly-β-hydroxybutyricacid producing strain by UV and diethyl sulfate
- 微生物学通报, 2016, 43(10): 2242-2248
- Microbiology China, 2016, 43(10): 2242-2248
- DOI: 10.13344/j.microbiol.china.150889
-
文章历史
- 收稿日期: 2015-11-09
- 接受日期: 2016-03-14
- 优先数字出版日期(www.cnki.net): 2016-03-18
2. 吉林医药学院 吉林 吉林 132013
2. Jilin Medical College, Jilin, Jilin 132013, China
聚β-羟基丁酸酯(poly-β-hydroxybutyricacid,PHB)是一种生物可降解材料,由多种微生物在碳氮比失衡的条件下作为自身的能源物质时所积累[1-2]。由于PHB具有相对较低的溶解性和相对较大的摩尔质量,因此可以在细菌胞内大量存储而不影响胞内外的渗透压[3]。PHB与传统的聚丙烯塑料有相似的材料学性质,还具有生物相容性和生物降解性等独特性质,在工业、农业、食品和环保等领域具有十分广阔的应用前景[4-6]。目前PHB的生产方法主要采用微生物合成法,但其出发菌株产率较低,生产成本较高,是当前PHB生产和应用的瓶颈问题。硫酸二乙酯(DES)是一种诱变谱较为广泛的烷化剂,能与DNA中碱基的磷酸部分发生烷化作用,从而引起DNA复制时碱基错误配对而引起的突变[7]。紫外诱变是微生物育种中最常用和最有效的诱变方法之一[8],核酸在波长254 nm处有最大吸收峰,而紫外诱变时常采用的波长为200-300 nm,这样阻碍碱基间的正常配对,从而有可能引起基因突变。目前采用紫外线和硫酸二乙酯复合诱变的方法获取高产PHB菌种还未见报道。本试验以实验室前期筛选获得的Pseudomonas koreensisPK3菌株为出发菌株,采用紫外线和硫酸二乙酯相结合的复合诱变方法进行多轮诱变,以期获得一株PHB产量高和遗传稳定好的突变菌株。
1 材料与方法 1.1 菌种出发菌株:假单胞菌属Pseudomonas koreensis PK3[9]菌株由实验室前期筛选所获得,以下称为PK3。
1.2 培养基筛选固体培养基(g/L):发酵培养基+2%琼脂粉+尼罗蓝,培养基中尼罗蓝的终浓度为50 mg/L。
1.3 主要试剂PHB标准品购自Sigma-Aldrich公司;尼罗蓝购自上海生物科技有限公司。
1.4 菌体生长曲线的测定将菌株接种于种子培养基上,32 °C恒温摇床中150 r/min培养24 h,然后按5%接种于液体种子培养基培养,培养18 h,每隔2 h用紫外分光光度法测定波长为620 nm下的OD值,计算菌株生长情况。
1.5 菌悬液的制备将菌种活化后,接种于装有100 mL种子培养基的250 mL三角瓶中,于32 °C、150 r/min培养8 h后,吸取5 mL培养液,加入装有45 mL生理盐水和玻璃珠的三角瓶振荡20 min,使菌体得到充分搅拌。采用血球计数板检测菌体浓度,使其为107-108个/mL。
1.6 紫外诱变育种将稀释好的菌液各取10 mL放入10个无菌培养皿中,依次放置于距15 W紫外灯30 cm照射,时间分别为0、10、20、30、40、50、60、70和80 s (做3组平行样)。在暗光环境下,分别取经紫外线诱变的菌悬液0.2 mL涂布于10个含有尼罗蓝的固体平板培养基上,倒置于32 °C恒温培养箱中避光培养48 h。培养好的菌种在紫外透射仪下观察菌落情况,计算致死率。通过致死率选取合适的诱变时间的菌悬液,涂布在有尼罗蓝的固体培养基上,挑取具有荧光且菌落较大的菌株20个,用试管斜面培养保存,同时取对应的菌株接入含100 mL发酵培养基的250 mL摇瓶中,置于32 °C、150 r/min培养28 h后,测定PHB产量和PHB所占细胞干重的量。
1.7 硫酸乙酯(DES)诱变以紫外线诱变所得产PHB高的菌株作为出发菌株,进行硫酸二乙酯诱变。取5 mL菌悬液 20份,与浓度为2%的DES溶液5 mL混合,在32 °C振荡处理,分别振荡处理0、10、20、30、40、50、60、70和80 min,最后加入1 mL 25%硫代硫酸钠溶液中止反应。将诱变处理的菌液稀释到10-5,以未经化学诱变处理的出发菌为对照,在32 °C恒温培养箱中培养48 h。将培养好的平板取出,菌落计数,计算致死率。挑取具有荧光且菌落较大的菌株20个,用试管斜面培养保存,同时取对应的菌株接入含100 mL培养基的250 mL摇瓶中,置于32 °C、150 r/min培养28 h后,测定PHB产量和PHB所占细胞干重的量。
1.8 致死率计算诱变菌株致死率(%)=(未诱变平板菌落数-诱变后平板菌落数)/未诱变平板菌落数×100。
1.9 遗传突变菌株稳定性试验将经过紫外线和DES复合诱变筛选出的PHB产量最高的菌株连续9代传代培养后,测定PHB产量和PHB所占细胞干重的量。
1.10 PHB的测定通过超声破碎机对细胞破碎处理,条件为:功率600 W,工作时间5 s,间隔时间5 s,连续20次。然后在8 000×g条件下离心10 min,去上清,烘干菌体,取10 mg干菌体,加入5 mL氯仿溶液,60 °C水浴1 h,获得含PHB的抽提溶液。然后吸取0.5 mL的抽提溶液于试管中,80 °C水浴加热除去氯仿,然后加入10 mL浓硫酸,密封试管后置于100 °C水浴加热10 min,冷却至室温,采用紫外分光光度计在235 nm处测定溶液的OD值。
1.11 胞内产物定性分析分别称取10 mg菌粉、PHB标品于两个试管中,向每个试管中加入1 mL氯仿和1 mL酸化甲醇(含3%浓硫酸,体积比),密封试管,放置于100 °C水浴中加热4 h,然后冷却至室温,加入1 mL蒸馏水充分振荡后,转移到5 mL离心管中,5 000 r/min离心5 min,下层即为溶有胞内产物的氯仿相,进行气相色谱分析。气相色谱条件:3.5% PEGA,柱长为2 m,以氮气作为载体,流速为40 mL/min,进样器温度为200 °C,FID检测器温度为250 °C,柱温80 °C维持2 min,然后以20 °C/min升高至195 °C,维持3 min。
2 结果与分析 2.1 菌体生长曲线的绘制2环新鲜活化斜面菌种Pseudomonas koreensis PK3接种到种子培养基中,在培养温度32 °C条件下,180 r/min振荡培养16-18 h,然后接菌量5%移入新鲜发酵培养基中培养,每隔2 h用紫外分光光度法测波长为620 nm下的OD值,绘出菌体的生长曲线,如图 1所示。

|
| 图 1 生长曲线 Figure 1 Growth curve |
|
|
选用对数生长中后期的细菌细胞进行诱变处理,此时的细胞不但菌浓合适、生理状态同步,而且绝大多数细胞对理化因素敏感,有利于诱变的作用。由图 1可看出,Pseudomonas koreensisPK3在培养2 h后开始进入对数生长期,在培养12 h后达到对数生长末期,因此选取培养10 h的菌体来进行诱变处理。
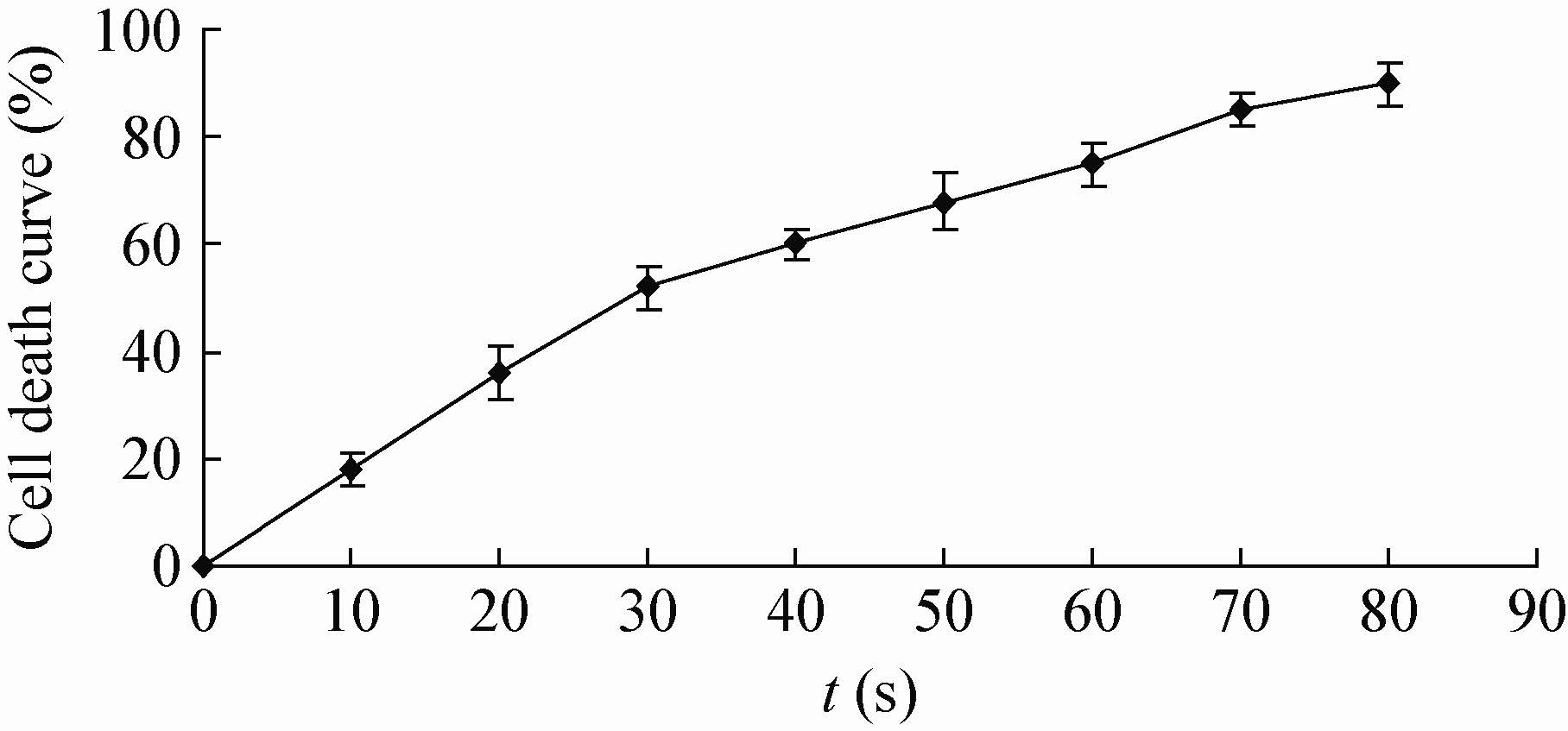
2.2 诱变条件的选择2.2.1 紫外诱变:测定紫外线的不同照射时间对出发菌株致死率的影响,结果如图 2所示。
|
| 图 2 紫外致死曲线 Figure 2 UV lethal curve |
|
|
根据图 2所示结果可以看出,出发菌株对紫外线比较敏感,致死率与紫外线照射时间呈正相关。用诱变剂处理菌株后,只有当致死率达到70%左右时得到的突变株才能满足诱变筛选的条件[12]。本研究中,对菌种PK3紫外线照射时间为60 s时,致死率为75%。所以,将紫外诱变60 s的菌悬液涂布在含有尼罗蓝固体培养基上,在32 °C条件下培养48 h。由于在筛选培养基中添加尼罗蓝染料,当细菌生长时,尼罗蓝能透过细胞壁进入细胞体内,并能特异性地与胞内的PHB结合,在365 nm紫外灯照射下产生橙红色荧光。因此,通过在含有尼罗蓝的固体培养基中上挑选菌落较大、橙红色荧光较强的菌落,作为诱变后正向突变的菌株。本研究中挑取具有荧光且菌落较大的菌株20个,接入含100 mL发酵培养基的摇瓶中,置于32 °C、150 r/min培养28 h后,测定PHB产量和PHB所占细胞干重的量。见表 1。
| 菌株 Strains | PHB所占细胞的干重 PHB accounted DCW (%) | PHB产量 PHB yield (g/L) |
| PK3 | 24.60±0.12 | 4.42±0.11 |
| UV-1 | 63.03±0.11 | 11.30±0.12 |
| UV-2 | 63.50±0.13 | 11.56±0.11 |
| UV-3 | 64.02±0.14 | 12.08±0.15 |
| UV-4 | 61.66±0.15 | 10.06±0.11 |
| UV-5 | 62.59±0.12 | 11.03±0.12 |
| UV-6 | 63.89±0.13 | 11.72±0.13 |
| UV-7 | 63.69±0.14 | 11.55±0.08 |
| UV-8 | 62.06±0.06 | 10.85±0.12 |
| UV-9 | 62.14±0.13 | 10.88±0.12 |
| UV-10 | 63.98±0.11 | 11.91±0.14 |
| UV-11 | 63.42±0.12 | 11.51±0.14 |
| UV-12 | 64.63±0.11 | 12.87±0.12 |
| UV-13 | 62.89±0.14 | 11.26±0.11 |
| UV-14 | 65.41±0.15 | 13.75±0.13 |
| UV-15 | 64.33±0.13 | 12.54±0.09 |
| UV-16 | 61.78±0.12 | 10.50±0.12 |
| UV-17 | 61.99±0.09 | 10.65±0.11 |
| UV-18 | 63.72±0.11 | 11.64±0.12 |
| UV-19 | 64.06±0.12 | 12.01±0.13 |
| UV-20 | 62.77±0.13 | 11.23±0.11 |
| 注:菌株培养在发酵培养基中,置于32 °C、150 r/min培养28 h后,测定PHB产量和PHB所占细胞干重的量,每组数据测定3次,取平均值. Note: After the strain was cultured in a fermentation medium,placed in 32 °C,150 r/min shaking culture 28 h,measured PHB and PHB yield percentage of the amount of cell dry weight. Each set of data was measured three times and used the average. | ||
从表 1可以看出,紫外诱变对菌种诱变效果较好,诱变所得到的20个菌株与出发菌株相比,PHB产量和PHB所占细胞的干重都明显提高。其中UV-14的PHB产量达到13.75 g/L,PHB所占细胞的干重达到65.41%。所以,选择UV-14作为DES诱变的出发菌株。
2.2.2 DES诱变:实验采用终浓度为1% (体积比)的DES于37 °C进行诱变处理,DES诱变时间与致死率的关系如图 3所示。

|
| 图 3 DES 致死曲线 Figure 3 DES lethal curve |
|
|
从图 3可以看出,用DES诱变30 min时细胞致死率为72%。所以选择诱变3.0 min的菌悬液涂布在含有尼罗蓝的固体培养基上,在32 °C条件下培养48 h,挑取具有荧光且菌落较大的菌株20个,接入液体培养基中,置于32 °C、150 r/min培养 28 h后,测定PHB产量和PHB所占细胞干重的量。结果如表 2所示。
| 菌株 Strains | PHB所占细胞的干重 PHB accounted DCW (%) | PHB产量 PHB yield (g/L) |
| UV-14 | 65.41±0.11 | 13.75±0.12 |
| UVCN-1 | 67.03±0.12 | 14.88±0.12 |
| UVCN-2 | 67.50±0.12 | 14.97±0.13 |
| UVCN-3 | 68.02±0.14 | 15.21±0.15 |
| UVCN-4 | 66.66±0.12 | 14.06±0.11 |
| UVCN-5 | 68.72±0.13 | 15.88±0.11 |
| UVCN-6 | 66.89±0.13 | 14.21±0.13 |
| UVCN-7 | 67.69±0.12 | 15.11±0.08 |
| UVCN-8 | 66.06±0.08 | 14.01±0.12 |
| UVCN-9 | 66.14±0.11 | 14.13±0.12 |
| UVCN-10 | 68.98±0.12 | 15.71±0.16 |
| UVCN-11 | 69.42±0.11 | 15.98±0.11 |
| UVCN-12 | 68.63±0.12 | 15.65±0.13 |
| UVCN-13 | 67.89±0.13 | 15.32±0.14 |
| UVCN-14 | 67.41±0.08 | 15.02±0.12 |
| UVCN-15 | 68.33±0.14 | 15.34±0.09 |
| UVCN-16 | 67.78±0.12 | 15.15±0.12 |
| UVCN-17 | 66.99±0.12 | 14.95±0.11 |
| UVCN-18 | 69.59±0.12 | 16.03±0.12 |
| UVCN-19 | 69.06±0.12 | 15.91±0.13 |
| UVCN-20 | 68.48±0.14 | 15.40±0.12 |
| 注:菌株培养在发酵培养基中,置于32 °C、150 r/min摇床培养28 h后,测定PHB产量和PHB所占细胞干重的量,每组数据测定3次,取平均值. Note: After the strain was cultured in a fermentation medium,placed in 32 °C,150 r/min shaking culture 28 h,measured PHB and PHB yield percentage of the amount of cell dry weight. Each set of data was measured three times and used the average. | ||
从表 2中可以看出,经DES诱变后的菌株PHB产量和PHB所占细胞干重都明显提高。其中UVCN-18的PHB产量可达到16.03 g/L,PHB占细胞干重达69.59%。
2.3 菌种遗传稳定性及稳产试验将菌株UVCN-18在种子培养基固体斜面上连续转接9次,测定其遗传标记与PHB产量情况,结果见表 3。
| 传代数 The number of generations | PHB占细胞干重 PHB accounted DCW (%) | PHB产量 PHB yield (g/L) |
| 1 | 69.60±0.12 | 16.06±0.14 |
| 2 | 69.58±0.08 | 16.01±0.12 |
| 3 | 69.57±0.12 | 15.97±0.11 |
| 4 | 69.51±0.11 | 15.89±0.12 |
| 5 | 69.52±0.14 | 15.91±0.12 |
| 6 | 69.55±0.12 | 15.93±0.09 |
| 7 | 69.52±0.13 | 15.91±0.14 |
| 8 | 69.52±0.12 | 15.91±0.13 |
| 9 | 69.48±0.12 | 15.89±0.11 |
| 平均 Average | 69.54±0.14 | 15.94±0.15 |
| 注:通过固体培养基连续传代9次,每次传代后接入液体发酵培养基中,置于32 °C、150 r/min摇床培养28 h后,测定PHB产量和PHB所占细胞干重的量,每组数据测定3次,取平均值 . Note: Through solid medium serially passaged 9 times,then access liquid fermentation medium ,placed in 32 °C,150 r/min shaking culture 28 h to measure PHB and PHB yield percentage of the amount of cell dry weight. Each set of data was measured three times and used the average. | ||
从表 3中可以看出,UVCN-18的遗传稳定,连续传代9次后的PHB产量和PHB所占细胞干重分别为15.94 g/L和69.54%。对菌种PK3采用紫外诱变法和硫酸二乙酯复合诱变,并没有影响菌种正常生理生长,可能产生突变的PHB合成关键酶的相关基因遗传稳定,所以诱变后的菌种PHB的产量没有下降。
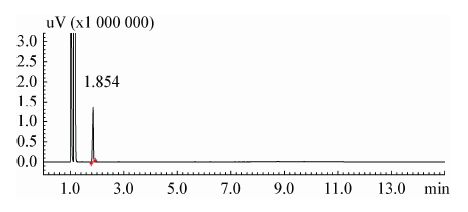
2.4 产物鉴定结果采用气相色谱法对菌种UVCN-18的胞内产物进行定性分析,PHB标品结果如图 4所示,样品结果如图 5所示。
|
| 图 4 PHB 标品气相图谱 Figure 4 GC spectrum of PHB standard |
|
|

|
| 图 5 样品气相色谱 Figure 5 GC spectrum of samples |
|
|
通过气相色谱图可以看出,通过氯仿抽提获得的胞内产物和PHB标准品的校正保留时间均为1.854,完全一致,应为同一物质,所以确定UVCN-18菌种能积累PHB。
3 讨论本研究采用紫外线和硫酸二乙酯复合诱变选育PHB高产菌株,从研究结果来看,紫外线和DES对该菌种的致死率较高。当用紫外照射60 s时,对菌种的致死率就达到75%;DES诱变30 min时,对菌种的致死率达到72%。最终获得的突变体UVCN-18连续转接9次后,平均可积累PHB产量达15.94 g/L,占细胞干重69.54%,较原出发菌株Pseudomonas koreensisPK3 (4.42 g/L)提高了2.61倍。在近几年的报道中可以看出,对于从野外筛选获得的产PHB菌株,直接用于发酵生产PHB,所获得的PHB产量相对较少。在2013年,董静[13]在土壤中筛选获得的甲烷氧化混合菌,在供氧条件下,培养基丰富的条件下培养5 d,然后饥饿培养15 d,PHB含量可以达到细胞干重的35.5%。在2014年,Han等[14]从绿藻中分理出一株产PHB的菌株UMI-21,在以淀粉为碳源时合成PHB可达细胞干质量的45.5%。以前也有人采用转基因植物来合成PHB,John等[15]将产PHB的关键基因与棉花纤维特异启动子相连构建了表达载体,导入棉花植物中,在纤维成熟时积累PHB水平为30-3 440 μg/g干纤维。但当PHB积累时会抑制植物生长,所以目前转基因合成PHB依然没有大规模应用。也有人利用活性污泥来合成PHB,但由于活性污泥环境中杂菌较多,导致合成的PHB纯度低,所以对PHB的分离提纯很困难。采用诱变的方法选育高产PHB菌株,不仅成本低、操作简单,而且所选育的菌种PHB产量高、遗传稳定。
近年来,采用紫外线和硫酸二乙酯复合对菌种诱变的报道较多,在2012年,罗跃中等[16]曾经利用紫外线与硫酸二乙酯复合诱变,选育出一株遗传稳定的高效油脂降解菌株,其脂肪酶活性为14.85 U/mL,比出发菌株提高了15.2%;在2012年,张卫兵等[17]利用紫外线与硫酸二乙酯复合诱变,筛选获得一株凝乳活力较高且水解活力较低的突变株DES-6,其凝乳活力为184.65 SU/mL,比原菌株增加了15.41%,水解活力为23.35 U/mL,比原菌株降低了64.80%。可见紫外线和硫酸二乙酯复合对菌种诱变效果显著,其主要原因在于这两种诱变方式均能使细胞中的遗传物质DNA发生突变,硫酸二乙酯是一种诱变谱较为广泛的烷化剂,能与DNA中碱基的磷酸部分发生烷化作用,从而引起DNA复制时碱基错误配对而引起的突变。在产PHB的菌种中,PHB聚合酶是PHB合成过程中的关键酶。DES可能导致编码PHB聚合酶的基因phbC发生突变,影响了PHB聚合酶的活性中心位置,使其酶活性提高,加快了对PHB合成所需的前体物质(R)-3-羟基丁酰辅酶A的聚合速度,进而提高了胞内的PHB积累量。对于确定诱变处理合成PHB相关基因的影响,还需通过分子生物学手段进一步探讨。
4 结论(1) 通过气相色谱检测,诱变后的菌株依然能够在胞内积累PHB。并且采用紫外诱变法和硫酸二乙酯复合诱变出发菌株Pseudomonas koreensis PK3,筛选获得PHB产量较高且遗传稳定性好的菌株Pseudomonas koreensisUVCN-18,UVCN-18的PHB产量可达到16.03 g/L,PHB占细胞干重达69.59%。
(2) 将菌株Pseudomonas koreensisUVCN-18连续转接9次后,经摇瓶培养,在转速180 r/min、初始pH 7.6、接菌量5%,温度为32 °C,发酵28 h条件下,平均可积累PHB产量达15.94 g/L,占细胞干重69.54%。较原出发菌株Pseudomonas koreensis PK3 (4.42 g/L)提高了2.61倍。该突变菌株具有良好的遗传稳定性。
| [1] | Chen DJ, Xu D, Li MS, et al. Proteomic analysis of bacillus thuringiensis ΔphaC mutant BMB171/PHB(-1) reveals that the PHB synthetic pathway warrants normal carbon metabolism[J]. Journal of Proteomics , 2012, 75 (17) : 5176–5188. DOI:10.1016/j.jprot.2012.06.002 |
| [2] | Xue F, Liu Y, Hong CL, et al. Pathway analysis of the leptospiral polyhydroxybutyrate (PHB) synthesis[J]. Microbiology China , 2013, 40 (11) : 2047–2056. (in chinese) 薛峰, 刘媛, 洪彩玲, 等. 钩端螺旋体聚Beta羟基丁酸(PHB)生物合成途径分析[J]. 微生物学通报 , 2013, 40 (11) : 2047–2056. |
| [3] | Wang HF, Hao XH, Li K. The Research progress of biodegradable material poly-β-hydroxybutyrate[J]. Packaging Journal , 2013, 5 (2) : 5–9. (in chinese) 王会芬, 郝喜海, 李奎. 生物降解材料聚β-羟基丁酸酯的研究进展[J]. 包装学报 , 2013, 5 (2) : 5–9. |
| [4] | Qian YY, Zhao M, Pan JB, et al. Research progress of a new kind of biodegradable plastics poly-β-hydroxybutyrate (PHB)[J]. Heilongjiang Medicine Journal , 2010, 23 (6) : 895–898. (in chinese) 钱永雨, 赵敏, 潘俊波, 等. 新型可降解塑料聚-β-羟基丁酸(PHB)的研究进展[J]. 黑龙江医药 , 2010, 23 (6) : 895–898. |
| [5] | Liu ZG, Wang YP, He N, et al. Optimization of polyhydroxybutyrate (PHB) production by excess activated sludge and microbial community analysis[J]. Journal of Hazardous Materials , 2011, 185 (1) : 8–16. DOI:10.1016/j.jhazmat.2010.08.003 |
| [6] | Hiroe A, Ushimaru K, Tsuge T. Characterization of polyhydroxyalkanoate (PHA) synthase derived from Delftia acidovorans DS-17 and the influence of PHA production in Escherichia coli[J]. Journal of Bioscience and Bioengineering , 2013, 115 (6) : 633–638. DOI:10.1016/j.jbiosc.2012.12.015 |
| [7] | Liu B. Complex mutagenesis of keratinose degrading strain with ultraviolet ray and diethyl sulfate[D]. Nanjing: Master’s Thesis of Nanjing Agricultural University, 2012 (in Chinese) 刘宝. 角蛋白降解菌的紫外线和硫酸二乙酯复合诱变[D]. 南京: 南京农业大学硕士学位论文, 2012 |
| [8] | Li XY, Wang G, Fei ZQ, et al. Screening of high amylase-producing strains by mutagenesis with ultraviolet ray and nitrosoguanidine[J]. Chinese Journal of Biologicals , 2012, 25 (11) : 1543–1546. (in chinese) 李旭媛, 王刚, 费卓群, 等. 紫外-亚硝基胍复合诱变筛选高产淀粉酶菌株[J]. 中国生物制品学杂志 , 2012, 25 (11) : 1543–1546. |
| [9] | Liu JM, Wang L, Li ZW, et al. Screening and 16SrDNA identification about poly-β-hydroxybutyrate production strain[J]. Cereals and Oils Processing (Electronic Version) , 2014 (4) : 71–75. (in chinese) 刘俊梅, 王璐, 李琢伟, 等. 产聚β-羟基丁酸酯(PHB)菌种的筛选及16SrDNA鉴定[J]. 粮油加工: 电子版 , 2014 (4) : 71–75. |
| [10] | Wang W, Cheng FQ, Li LY. Hydroxy fatty acid polyester producing bacteria breeding[J]. Journal of Wuxi University of Light Industry , 1995, 15 (4) : 303–307. (in chinese) 王武, 陈富强, 李礼尧. 羟基脂肪酸聚酯产生菌选育[J]. 无锡轻工大学学报 , 1995, 15 (4) : 303–307. |
| [11] | Li HS, Zhang CY, Zhang W, et al. Strain selection and fermentation conditions of production poly-β-hydroxybutyrate[J]. Petrochemical Industry Technology , 1997, 4 (4) : 212–215. (in chinese) 郦和生, 张春元, 张伟, 等. 生产聚-β-羟基丁酸酯(PHB)的菌种选育及发酵条件[J]. 石化技术 , 1997, 4 (4) : 212–215. |
| [12] | Wen YJ, Feng GL, Yan D. Screening of high acidic protease-producing strains by combined mutagenesis by UV and DES[J]. Liquor-Making Science & Technology , 2011 (5) : 50–52. (in chinese) 温拥军, 冯刚利, 鄢东. 紫外线与硫酸二乙酯复合诱变选育酸性蛋白酶高产菌株[J]. 酿酒科技 , 2011 (5) : 50–52. |
| [13] | Dong J. Biosynthesis of poly (β-hydroxybutaryte) by methane-utilizing mixed culture[D]. Harbin: Doctoral Dissertation of Harbin University of Commerce, 2013 (in Chinese) 董静. 利用甲烷氧化混合菌生物合成聚β-羟基丁酸酯[D]. 哈尔滨: 哈尔滨商业大学博士学位论文, 2013 |
| [14] | Han XR, Satoh Y, Kuriki Y, et al. Polyhydroxyalkanoate production by a novel bacterium massilia sp. UMI-21 isolated from seaweed, and molecular cloning of its polyhydroxyalkanoate synthase gene[J]. Journal of Bioscience and Bioengineering , 2014, 118 (5) : 154–519. |
| [15] | John ME, Keller G. Metabolic pathway engineering in cotton: biosynthesis of polyhydroxybutyrate in fiber cells[J]. Proceedings of the National Academy of Sciences of the United States of America , 1996, 93 (23) : 12768–12773. DOI:10.1073/pnas.93.23.12768 |
| [16] | Luo YZ, Lan LX, Wu YY. Ultraviolet and diethyl sulfate mutagenesis breeding efficient oil degrading strains[J]. Jiangsu Agricultural Sciences , 2012, 40 (2) : 295–297. (in chinese) 罗跃中, 兰立新, 吴永尧. 紫外线与硫酸二乙酯复合诱变选育高效油脂降解菌株[J]. 江苏农业科学 , 2012, 40 (2) : 295–297. |
| [17] | Zhang WB, Liang Q, Qiao HJ, et al. Study on mutation breeding of Bacillus licheniformis producing chymosin by ultra violet and diethyl sulfate[J]. Science and Technology of Food Industry , 2012, 33 (5) : 174–176. (in chinese) 张卫兵, 梁琪, 乔海军, 等. 紫外线和硫酸二乙酯诱变高产凝乳酶地衣芽孢杆菌的研究[J]. 食品工业科技 , 2012, 33 (5) : 174–176. |
 2016, Vol. 43
2016, Vol. 43