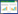扩展功能
文章信息
- 张军高, 漆永红, 郭成, 苏建红, 李敏权, 李雪萍, 曹素芳, 刘丹
- ZHANG Jun-Gao, QI Yong-Hong, GUO Cheng, SU Jian-Hong, LI Min-Quan, LI Xue-Ping, CAO Su-Fang, LIU Dan
- 甘肃大葱贮藏期镰孢菌腐烂病病原鉴定
- Identification of pathogens causing shallot storage Fusarium rot disease in Gansu province, China
- 微生物学通报, 2016, 43(10): 2216-2224
- Microbiology China, 2016, 43(10): 2216-2224
- DOI: 10.13344/j.microbiol.china.150440
-
文章历史
- 收稿日期: 2015-06-07
- 接受日期: 2016-04-19
- 优先数字出版日期(www.cnki.net): 2016-05-24
2. 甘肃省农业科学院植物保护研究所 甘肃 兰州 730070 ;
3. 甘肃省农业科学院 甘肃 兰州 730070 ;
4. 甘肃省农业科学院林果花卉研究所 甘肃 兰州 730070 ;
5. 吐鲁番市高昌区农业技术推广中心 新疆 吐鲁番 838000
2. Institute of Plant Protection, Gansu Academy of Agricultural Sciences, Lanzhou, Gansu 730070, China ;
3. Gansu Academy of Agricultural Sciences, Lanzhou, Gansu 730070, China ;
4. Institute of Fruit and Floriculture Research, Gansu Academy of Agricultural Sciences, Lanzhou, Gansu 730070, China ;
5. Gaochang District Agricultural Technical Extension and Service center of Turpan City, Turpan, Xinjiang 838000, China
大葱(Allium fistulosum L.)为百合科葱属草本植物,原产于亚洲西部地区,在我国栽培范围广泛,种植历史悠久,其食用功能强,是良好的调味品,内含丰富的营养元素和矿物质,具有开胃消食、保健和杀菌防病等功能[1- 2]。我国是世界上大葱的主要生产国和出口贸易国之一[3],目前我国大葱栽种面积已达12万hm2[4]。近年来甘肃省临洮县和正宁县大葱规模化生产发展迅速,种植面积达数千hm2,已成为当地农民增收致富的重要作物。然而,近年来大葱病害发生严重,尤其大葱镰孢菌腐烂病已成为贮藏期的主要真菌性病害之一,常造成大量的大葱腐烂难以销售和食用,给农户和贸易商带来了严重的经济损失。
目前,关于葱蒜类鳞茎腐烂病的研究报道有限。漆永红等[5]通过单孢分离和致病性测定,根据病原菌形态学特征确定甘肃省嘉峪关地区洋葱干腐病的主要致病菌为尖孢镰孢菌(Fusarium oxysporum)、串珠镰孢菌(F. moniliforme)和茄病镰孢菌(F. solani),其中尖孢镰孢菌是该病害的优势种。Sang等[6]在韩国研究发现,巴西青霉菌(Penicillium brasilianum)也是洋葱鳞茎腐烂病的病原菌。然而,关于大葱贮藏期镰孢菌腐烂病病原的研究尚未见报道,本文对甘肃省大葱贮藏期镰孢菌腐烂病的病原菌进行了分离鉴 定研究,以期明确其病原菌种类及其致病性,并为甘肃地区大葱贮藏期镰孢菌腐烂病的生物防控技术和抗病育种提供理论基础。
1 材料与方法 1.1 病样采集2014年6-8月在甘肃省兰州市安宁区、西固区、七里河区、城关区的蔬菜市场对大葱贮藏期真菌性病害病情进行调查,采集兰州白葱品种的大葱镰孢菌腐烂病样品共16份,分装于自封袋后带回实验室备用。
1.2 病原菌的分离参照Leslie等[7]和Burgess等[8]的方法对大葱病样的鳞茎和叶片部位进行病原菌的分离、纯化。采用稀释分离法进行单孢分离,将纯化菌株转接于CLA培养基(g/L)[9](康乃馨叶片,琼脂15.0,水1.0)上,置于25 ℃恒温培养箱黑暗培养;统计病原菌分离频率,确定优势病原。
1.3 病原菌的鉴定1.3.1 形态学鉴定:主要依据Leslie[7]分类鉴定方法,并参照Burgess等[8]分类系统和Nelson等[10]的鉴定方法,结合PDA培养基[11]上的培养性状,72 h后的菌落直径,CLA培养基上大、小型分生孢子的有无,分生孢子的形态及产生方式, 厚垣孢子的有无以及着生方式,瓶梗类型等特征进行形态鉴定[11]。
1.3.2 分子鉴定:以形态学鉴定结果为基础,选取分离自大葱标样的代表菌株GSLZA-F-8、GSLZA-F-9、GSLZA-A-2分别接种至铺在PDA培养基的玻璃纸上,25 ℃恒温培养5 d,取0.1 g菌丝,采用CTAB法[12]提取病原菌基因组DNA。
rDNA-ITS扩增采用真菌核糖体基因转录间隔区通用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)引物;当扩增EF-1a(tef)基因时,使用引物EF-1H (5'-ATGGGTAAGGAAGACAAGAC-3′)和EF-2T (5'-GGAAGTACCAGTGATCATGTT-3′) (由北京天一公司合成)。以25 μL反应体系进行PCR扩 增[13-14],反应完成后,取2 μL PCR产物进行1%琼脂糖凝胶电泳检测,扩增产物送北京天一辉远生物科技有限公司测序,通过BLAST软件与NCBI GenBank中的已知序列进行同源性比对后,再利用Mega 5.0软件分别构建系统发育树,从而确定各菌株的分类地位。
1.4 致病性测定及再分离病原菌的接种方式分为有伤接种和无伤接种[15]。选取健康的兰州白葱,用纯水洗干净,接种时用75%的酒精擦洗几次进行消毒,然后用灭菌水冲洗3次,风干后备用。在PDA平板上将培养4-5 d的代表菌株GSLZA-F-8、GSLZA-F-9、GSLZA-A-2、GSLZA-F-8-9-2菌落的边缘用打孔器(Ф=5 mm)打取菌饼,其中菌株GSLZA-F-8-9-2由菌株GSLZA-F-8、GSLZA-F-9和GSLZA-A-2各自配制成106个/mL的孢子悬浮液后按照1:1:1的比例混匀配制成106个/mL的混合菌液后涂布于PDA平板上培养得到。有伤接种时用灭菌刀片切伤大葱鳞茎或用灭菌针刺伤大葱叶片后,将菌饼接于伤口处,置于室温25 ℃条件下保湿培养,7 d后观察发病情况,评价病原菌的致病性[16-17],以切伤或刺伤不接菌饼和无伤不接菌饼的大葱作为对照。每个处理5个重复。
大葱病斑面积(cm2)=(π×长径×短径)/4
从接种发病的大葱组织上分离致病菌,在PDA培养基平板上获得纯培养,并与原接种菌株进行比较[18],从而明确其致病性。
2 结果与分析 2.1 大葱贮藏期镰孢菌腐烂病的发病症状大葱贮藏期,镰孢菌侵染大葱鳞茎和叶片,可引起大葱镰孢菌腐烂病,该病害发病率较高,危害较重,在环境条件适宜时,其致病镰孢菌生长旺盛,病部迅速扩展,以致病情加重。发病初期,大葱叶片逐渐皱缩腐烂、大葱鳞茎局部开始干枯凹陷、腐烂,病斑呈渍状,边缘灰色或浅褐色;发病后期,整株大葱呈干缩状腐烂,病部布满灰白色霉层(图 1A、B)。

|
| 图 1 大葱贮藏期镰孢菌腐烂病发病症状 Figure 1 The natural symptom of shallot storage Fusarium rot diseases 注:A:大葱镰孢菌腐烂病的发病初期症状;B:大葱镰孢菌腐烂病的发病后期症状;C:健康大葱. Note: A: The primary symptom of shallot Fusarium rot diseases; B: The late symptom of shallot Fusarium rot diseases; C: healthy shallots. |
|
|
2.2.1 病原镰孢菌种类及分离频率:在兰州市4个区的16份大葱镰孢菌腐烂病标样中分离得到80株镰孢菌,单孢分离后经形态学初步鉴定,将这些菌株分属3个种,包括层出镰孢菌(F. proliferatum)、尖孢镰孢菌(F. oxysporum)和燕麦镰孢菌(F. avenaceum),其中层出镰孢菌分离频率较多,属优势病原,三者分离频率分别为52.50%、37.50%、10.00% (表 1)。
| 病原菌 Pathogen species | 分离菌株数 Isolate number | 分离频率 Isolation frequency (%) |
| 层出镰孢菌(F. proliferatum) | 42 | 52.50 |
| 尖孢镰孢菌(F. oxysporum) | 30 | 37.50 |
| 燕麦镰孢菌(F. avenaceum) | 8 | 10.00 |
2.2.2 病原镰孢菌形态特征:层出镰孢菌(F. proliferatum Nirenberg):在PDA培养基上28 ℃恒温培养72 h的菌落生长速度为23 mm/72 h。菌落生长较旺盛,气生菌丝浅紫色或灰白色呈羊卷毛状,边缘呈丝状辐射,正面呈浅粉色,背面由深红色变成近黑色。在CLA培养基上极少产生大型分生孢子,其产生于淡橘黄色分生孢子座上,细而较直,通常3-5隔;小型分生孢子数量多,棍棒形或梨形,通常0隔膜,以短链状形式串生于具分支的单瓶梗上;无厚垣孢子(图 2)。

|
| 图 2 层出镰孢菌形态特征 Figure 2 The morphological characteristics of F. proliferatum 注:A:在PDA 上的菌落背面形态;B:大型分生孢子;C:小型分生孢子;D:短链状小型分生孢子. Note: A: The colony morphology of F. proliferatum at the back of PDA; B: Macroconidia; C: Microconidia; D: Microconidia in short chain. |
|
|
尖孢镰孢菌(F. oxysporum Schlecht):在PDA 培养基上25 ℃ 恒温培养72 h 的菌落生长速度为30.5 mm/72 h。菌落平坦,边缘较整齐,菌丝白色呈羊毛状,背面无色素。在CLA 培养基上大型分生孢子产生于大量的淡橘黄色分生孢子座上,薄壁,镰刀形,稍弯,通常3 隔膜,顶胞有轻微的钩状,钩状近直,基胞有明显足跟;小型分生孢子卵形、椭圆形或肾形,以假头状着生短瓶梗上,通常0 隔膜。厚垣孢子易产生,球形,单生或串生。产孢细胞单瓶梗,梗短(图 3)。
|
| 图 3 尖孢镰孢菌形态特征 Figure 3 The morphological characteristics of F. oxysporum 注:A:在PDA 上的菌落正面形态;B:大型分生孢子;C:小型分生孢子;D:厚垣孢子;E:短瓶梗. Note: A: The colony morphology of F. oxysporum in the face of PDA; B: Macroconidia; C: Microconidia; D: Chlamydospores; E: Short monophialide. |
|
|
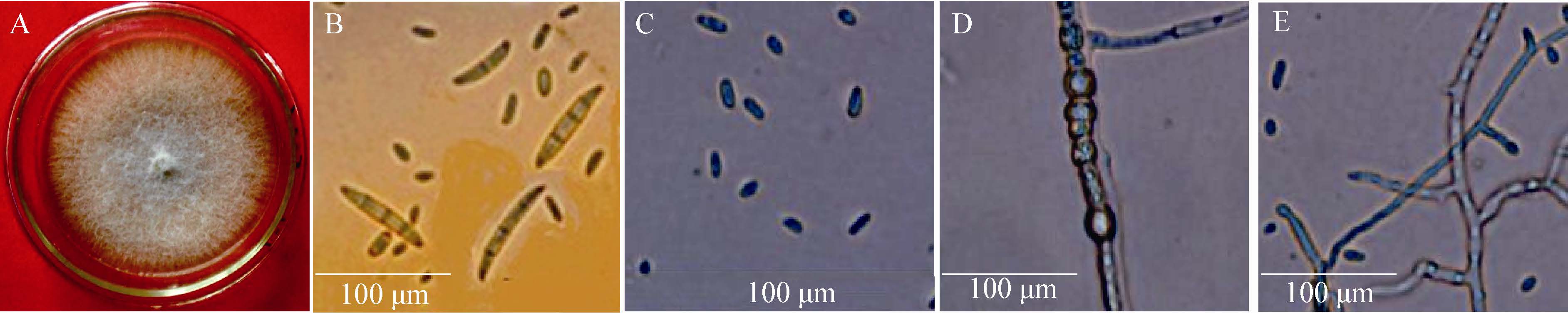
燕麦镰孢菌(F. avenaceum Saccardo):在PDA培养基上25 ℃恒温培养72 h的菌落生长速度较慢,为17.3 mm/72 h。菌落较全缘,中央少部分呈浅黄色,周围及边缘白色,菌丝白色呈絮状,背面有橘黄色色素。在CLA培养基上大型分生孢子产生于淡橘黄色分生孢子座上,长而细,稍弯近直,有瘦钩,通常5隔膜,顶胞呈锥形,基胞有凹口;小型分生孢子呈梭形或棍棒形,0隔膜;不产生厚垣孢子;产孢细胞单瓶梗,梗短(图 4)。
|
| 图 4 燕麦镰孢菌形态特征 Figure 4 The morphological characteristics of F. avenaceum 注:A:在PDA 上的菌落正面形态;B:大型分生孢子;C:小型分生孢子;D:产孢瓶梗. Note: A: The colony morphology of F. avenaceum in the face of PDA; B: Macroconidia; C: Microconidia; D: Monophialides. |
|
|
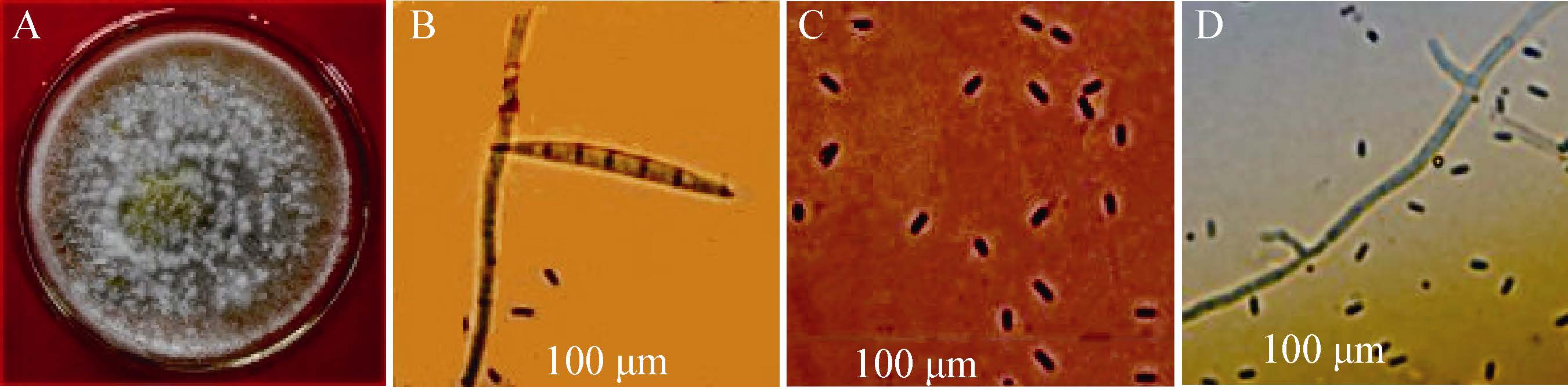
2.2.3 病原菌rDNA-ITS扩增、tef基因扩增及序列分析: 用引物ITS1和ITS4对菌株GSLZA-F-8、GSLZA-F-9、GSLZA-A-2的rDNA-ITS进行PCR扩增,分别得到长度为 550、525、538 bp (GenBank登录号分别为KX029333、KX029334和KX029335)的扩增片段(图 5A)。在GenBank中用BLAST进行序列同源性比对后,构建系统发育树。结果表明GSLZA-F-8与GenBank中登记的层出镰孢菌KJ767072、KJ767073的相似性均为100%,亲缘关系最近,聚为一类;GSLZA-F-9与尖孢镰孢菌HM179531、KM282626、JN400682的相似性均在99%以上,亲缘关系最近,聚为一类;GSLZA-A-2与燕麦镰孢菌KJ562378、KF939132的相似性均在99%以上,亲缘关系最近,聚为一类(图 6)。
|
| 图 5 镰孢菌株的PCR 产物电泳图 Figure 5 Electrophoregrams for PCR products of Fusarium pathogens 注:A:rDNA-ITS;B:tef 基因;M:DL2000 DNA marker;1:菌株GSLZA-F-8;2:菌株GSLZA-F-9;3:菌株GSLZA-A-2. Note: A: rDNA-ITS; B: tef gene; M: DL2000 DNA marker; 1:Isolate GSLZA-F-8; 2: Isolate GSLZA-F-9; 3: Isolate GSLZA-A-2. |
|
|

|
| 图 6 3 种镰孢菌基于rDNA-ITS 序列的系统发育树 Figure 6 Phylogenetic tree constructed on rDNA-ITS sequences of 3 Fusarium pathogens species 注:分支点数值是基于邻接法重复分析数据1 000 次后的自律值(>50%);括号内数值为GenBank 的登录号;差异值(0.01)是1%的序列差异,即100 个核苷酸序列有1 个核苷酸缺失或者被置换突变. Note: Numbers at nodes indicate the bootstrap values (>50%) based on Neighbour-Joining analyses of 1 000 resampled datasets; Numbers in parentheses are GenBank accession numbers; Bar: 1 nucleotide substitution per 100 nucleotides. |
|
|
菌株GSLZA-F-8、GSLZA-F-9、GSLZA-A-2的tef基因扩增片段长度分别为699、684、645 bp (图 5B),GenBank登录号分别为KX029336、KX029337 和KX029338。在GenBank中比对后,构建基于tef基因的系统发育树,结果表明GSLZA-F-8与层出镰孢菌(GenBank登录号为KF575340、KM675672、KC584810)的相似性均在99%以上,亲缘关系最近,聚为一类;GSLZA-F-9与尖孢镰孢菌GU170539、KF918540、DQ837689的相似性均在99%以上,亲缘关系最近,聚为一类;GSLZA-A-2与燕麦镰孢菌KP674214、JX397838的相似性均在99%以上,亲缘关系最近,聚为一类(图 7)。因此,结合形态学特征和序列分析,将菌株GSLZA-F-8鉴定为层出镰孢菌(F. proliferatum Nirenberg)、GSLZA-F-9鉴定为尖孢镰孢菌(F. oxysporum Schlecht.)、GSLZA-A-2鉴定为燕麦镰孢菌(F. av enaceu m Sacc.)。
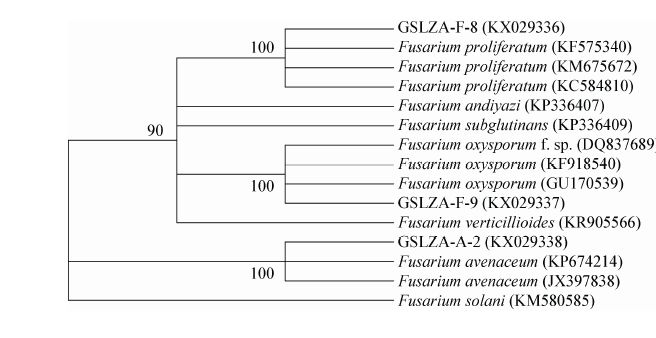
|
| 图 7 3 种镰孢菌基于tef 基因序列构建的系统发育树 Figure 7 Phylogenetic tree constructed on tef gene sequences of 3 Fusarium pathogens species 注:分支点数值是基于邻接法重复分析数据1 000 次后的自举值(>70%);括号内数值为GenBank 的登录号. Note: Numbers at nodes indicate the bootstrap values (>70%) based on Neighbour-Joining analyses of 1 000 resampled datasets; Numbers in parentheses are GenBank accession numbers. |
|
|
室内在大葱鳞茎和葱叶部位接种3种致病菌培养3 d后,有伤接种病原菌的大葱均开始发病,接种葱叶先发病;7 d后有伤接种层出镰孢菌和尖孢镰孢菌的大葱全部发病,接种发病率为100%,接种部位产生白色疏松的气生菌丝,鳞茎开始变色呈干腐收缩状。燕麦镰孢菌基本不侵染大葱鳞茎,主要侵染大葱叶片,接种葱叶发病率为100%;病部菌丝白色、生长茂盛,葱叶逐渐褪色腐烂。有伤接种复合镰孢菌的大葱均发病,发病率为100%,病部布满灰白色、灰色的菌丝,鳞茎和葱叶逐渐收缩以至干腐。3种镰孢菌接种后的大葱发病症状与其相应的自然症状表现基本一致,而无伤接种的镰孢菌始终未能在大葱鳞茎或葱叶上寄生成功,没有表现出其致病性,与对照一样大葱均未发病(图 8),表明伤口是这3种致病镰孢菌的主要侵染途径。致病性测定结果表明,层出镰孢菌对大葱鳞茎的致病力最强,病斑扩展面积为2.38 cm2;燕麦镰孢菌对大葱鳞茎的致病力最弱,病斑扩展面积为0.02 cm2,但其对葱叶的致病力最强,病斑扩展面积为 2.52 cm2 (表 2)。经对其接种了3种镰孢菌的发病大葱进行病原菌再分离,均获得了与原接种菌株一样的病菌,因此,确定层出镰孢菌、尖孢镰孢菌、燕麦镰孢菌均为贮藏期大葱镰孢菌腐烂病的致病菌。

|
| 图 8 3 种镰孢菌对大葱的致病性测定结果 Figure 8 The effects of inoculation in the shallots with 3 Fusarium pathogens species 注:A:在鳞茎上接种层出镰孢菌的发病症状(7 d);B:在鳞茎上接种尖孢镰孢菌的发病症状(7 d);C:在鳞茎上接种燕麦镰孢菌的发病症状(7 d);D:在葱叶上接种燕麦镰孢菌的发病症状(7 d);E:在鳞茎上接种复合镰孢菌的发病症状(7 d);F:CK (7 d). Note: A: The symptoms of disease inoculated with F. proliferatum in the shallot bulbs (7 d); B: The symptoms of disease inoculated with F.oxysporum in the shallot bulbs (7 d); C: The symptoms of disease inoculated with F. avenaceum in the shallot bulbs (7 d); D: The symptoms of disease inoculated with F. avenaceum in the shallot leaves (7 d); E: The symptoms of disease inoculated with mixed Fusarium pathogens in the shallot bulbs (7 d); F: CK (7 d). |
|
|
| 接种镰孢菌 Fusarium pathogens | 接种部位 Inoculated parts | 接种数 Total quantities | 发病数 Quantities of disease | 发病率 Incidence rate (%) | 平均病斑面积 Average spots areas of disease (cm) | |
| 鳞茎 (Bulb) | 葱叶 (Leaf) | |||||
| F. proliferatum | 鳞茎 | 5 | 5 | 100 | 2.38(±0.23) aA | 1.94(±0.20) cC |
| 葱叶 | 5 | 5 | 100 | |||
| F. oxysporum | 鳞茎 | 5 | 5 | 100 | 1.77(±0.15) bB | 2.33(±0.13) aAbB |
| 葱叶 | 5 | 5 | 100 | |||
| F. avenaceum | 鳞茎 | 5 | 1 | 20 | 0.02(±0.02) cC | 2.52(±0.17) aAB |
| 葱叶 | 5 | 5 | 100 | |||
| F. proliferatum (unwounded inoculation) | 鳞茎 | 5 | 0 | 0 | 0.00 dD | 0.00 dD |
| 葱叶 | 5 | 0 | 0 | |||
| F. oxysporum (unwounded inoculation) | 鳞茎 | 5 | 0 | 0 | 0.00 dD | 0.00 dD |
| 葱叶 | 5 | 0 | 0 | |||
| F. avenaceum (unwounded inoculation) | 鳞茎 | 5 | 0 | 0 | 0.00 dD | 0.00 dD |
| 葱叶 | 5 | 0 | 0 | |||
| CK | 鳞茎 | 5 | 0 | 0 | 0.00 dD | 0.00 dD |
| 葱叶 | 5 | 0 | 0 | |||
| 注:表中大小写字母分别表示在0.01和0.05水平上的差异显著性. Note: The large and lowercase letters respectively represented the differences among all treatments at 0.01 and 0.05 levels. | ||||||
葱进行病原菌再分离,均获得了与原接种菌株一样的病菌,因此,确定层出镰孢菌、尖孢镰孢菌、燕麦镰孢菌均为贮藏期大葱镰孢菌腐烂病的致病菌。
3 结论与讨论本文主要从病原学的角度出发,通过形态学特征和rDNA-ITS、tef基因序列分析及致病性测定,确定了引起甘肃大葱贮藏期镰孢菌腐烂病的病原菌有层出镰孢菌(F. proliferatum)、尖孢镰孢菌(F. oxysporum)及燕麦镰孢菌(F. avenaceum),三者分离频率分别为52.50%、37.50%和10.00%,其中层出镰孢菌为大葱镰孢菌腐烂病的优势致病菌。致病性测定结果表明上述3种镰孢菌对大葱鳞茎和叶部的侵染性存在差异,其中层出镰孢菌对大葱鳞茎的致病力最强,燕麦镰孢菌对大葱鳞茎的致病力最弱,但对葱叶的致病力最强。
层出镰孢菌、尖孢镰孢菌和燕麦镰孢菌作为贮藏期大葱镰孢菌腐烂病的病原属国内首次报道,本文研究结果与Dugan等[19]报道的引起大蒜腐烂病的镰孢菌种群(F. proliferatum、F. oxysporum f. sp. cepae、F. verticillioides)的结论略有差异,表明不同寄主上的镰孢菌种类存在差异;Vu等[20]和Sintayehu等[21]认为大葱鳞茎腐烂病是由F. oxysporum f. sp. cepae引起的。漆永红等[5]研究认为甘肃嘉峪关地区洋葱干腐病的优势病菌为尖孢镰孢菌,表明尖孢镰孢菌能够侵染葱蒜类蔬菜,造成其腐烂。虽然镰孢菌为害不同寄主植物或不同品种,但致病力存在差异,表明病原镰孢菌存在致病力分化现象。
镰孢菌在贮藏期多侵染鳞茎部位,从而引起大葱腐烂。在大葱贮藏期,如果温度高,湿度大,则有利于各种微生物的生长和繁殖,往往引起多种病原菌的复合侵染,显著加重了大葱的腐烂病情,可造成重大损失。另外,许多镰孢菌是真菌毒素的产生菌[11],食用后其分泌的毒素进一步危害人体健康,因此,大葱镰孢菌腐烂病应引起注意。本文以上述3种致病镰孢菌为着重点,为进一步研究其生物学特性及该病害的发生发展规律提供了良好的思路,根据病原镰孢菌存在致病力分化现象,可从分子水平研究其致病基因,以期为大葱贮藏期保鲜防腐技术的开发及大葱抗腐烂病品种的选育提供理论方向。
| [1] | Tian GY. Studies on the technology of high-yield and better-quality cultivation and comparison on export Welsh onion varieties[J]. Taian: Master’s Thesis of Shandong Agricultural University, 2006 (in Chinese) 田光英. 出口大葱品种比较及高产优质栽培技术研究[J]. 泰安: 山东农业大学硕士学位论文, 2006 |
| [2] | Gao LM, Chen YQ, Gao XY, et al. Analysis of some nutrition composition in Welsh onion[J]. Shandong Agricultural Sciences , 2008 (4) : 50–51. (in chinese) 高莉敏, 陈运起, 高秀云, 等. 大葱不同类型品种主要营养成分分析[J]. 山东农业科学 , 2008 (4) : 50–51. |
| [3] | Li PX. Cultivation techniques supplied of export fresh shallot anniversary[J]. Vegetables , 2014 (7) : 39–40. (in chinese) 李培习. 出口保鲜大葱周年供应栽培技术[J]. 蔬菜 , 2014 (7) : 39–40. |
| [4] | Zhu Y. Risk analysis and key safety techniques of pesticide use in scallion for export[J]. Journal of Henan Agricultural Sciences , 2012, 41 (1) : 95–99. (in chinese) 朱莺. 出口大葱农药使用风险分析及安全生产技术关键点研究[J]. 河南农业科学 , 2012, 41 (1) : 95–99. |
| [5] | Qi YH, Xu D, Zhang YM, et al. Identification of onion basal plate rot disease in Jiayuguan and fungicide testing[J]. Acta Prataculturae Sinica , 2013, 22 (5) : 339–344. (in chinese) 漆永红, 徐冬, 张彦梅, 等. 嘉峪关市洋葱基盘腐烂病病原鉴定及药剂室内毒力测定[J]. 草业学报 , 2013, 22 (5) : 339–344. |
| [6] | Sang MK, Han GD, Oh JY, et al. Penicillium brasilianum as a novel pathogen of onion (Allium cepa L.) and other fungi predominant on market onion in Korea[J]. Crop Protection , 2014, 65 : 138–142. DOI:10.1016/j.cropro.2014.07.016 |
| [7] | Leslie JF, Summerell BA. The Fusarium Laboratory Manual[M]. USA: Blackwell Publishing, 2006 . |
| [8] | Burgess LW, Summerell BA, Bullock S. Laboratory Manual for Fusarium Research[M]. Sydney: The University of Sydney, 1994 . |
| [9] | Li JH, Wang D, Chai ZX, et al. Isolation and identification of the dominant pathogens causing potato Fusarium dry rot in Gansu Province[J]. Acta Phytopathologica Sinica , 2011, 41 (5) : 456–463. (in chinese) 李金花, 王蒂, 柴兆祥, 等. 甘肃省马铃薯镰刀菌干腐病优势病原的分离鉴定[J]. 植物病理学报 , 2011, 41 (5) : 456–463. |
| [10] | Nelson PE, Toussoun TA, Marasas WFO. Fusarium Species: An Illustrated Manual for Identification[M]. London: Pennsylvania State University Press, 1983 . |
| [11] | Guo C, Wei HY, Guo MK, et al. Isolation, identification and biological characteristics of Fusarium verticillioides from maize ear rot samples in Gansu Province[J]. Acta Phytopathologica Sinica , 2014, 44 (1) : 17–25. (in chinese) 郭成, 魏宏玉, 郭满库, 等. 甘肃玉米穗腐病样品中轮枝镰孢菌的分离鉴定及生物学特性[J]. 植物病理学报 , 2014, 44 (1) : 17–25. |
| [12] | Chen KS, Li F, Xu CJ, et al. An efficient macro-method of genomic DNA isolation from Actinidia chinensis leaves[J]. Hereditas , 2004, 26 (4) : 529–531. (in chinese) 陈昆松, 李方, 徐昌杰, 等. 改良CTAB法用于多年生植物组织基因组DNA的大量提取[J]. 遗传 , 2004, 26 (4) : 529–531. |
| [13] | Smith WJ, Brett AS, Gunn L. Molecular Techniques for the Study of Soilborn Fungal Plant Panthology[M]. Sydney: Sydney University Press, 2003 . |
| [14] | Song XH, Sun DM, Wang MG, et al. Occurrence of the pomegranate fruit rot and identification of its pathogen[J]. Journal of Plant Protection , 2011, 38 (1) : 93–94. (in chinese) 宋晓贺, 孙德茂, 王明刚, 等. 陕西石榴干腐病发生及病原菌鉴定[J]. 植物保护学报 , 2011, 38 (1) : 93–94. |
| [15] | Du J, Liu Z, Liu SY, et al. Studies on inoculation method and the pathogenicity differences of Sclerotinia sclerotiorum strains in XinJiang[J]. Journal of Shihezi University (Natural Science) , 2008, 26 (6) : 691–694. (in chinese) 杜娟, 刘昭, 刘少云, 等. 菌核病接种方法及新疆核盘菌致病力差异的初步研究[J]. 石河子大学学报: 自然科学版 , 2008, 26 (6) : 691–694. |
| [16] | Xu D, Li MQ, Zhang YM. Pathogens identification and pathogenic testing of onion dry rot disease in Xincheng Town of Jiayuguan City[J]. Journal of Gansu Agricultural University , 2010, 45 (6) : 110–113. (in chinese) 徐冬, 李敏权, 张彦梅. 嘉峪关市新城镇洋葱干腐病病原鉴定及致病性测定[J]. 甘肃农业大学学报 , 2010, 45 (6) : 110–113. |
| [17] | Li ZM, Chen JB, Zhou HP, et al. Studies on the identification and biological characteristic of Chinese prickly ash[J]. Journal of Yunnan Agricultural University , 2006, 21 (5) : 591–595. (in chinese) 李智明, 陈建斌, 周惠萍, 等. 花椒根腐病病原鉴定和生物学特性研究[J]. 云南农业大学学报 , 2006, 21 (5) : 591–595. |
| [18] | Fang ZD. Research Methods of Plant Disease[M]. Beijing: Chinese Agricultural Press, 1998 . (in chinese) 方中达. 植病研究法[M]. 北京: 中国农业出版社, 1998 . |
| [19] | Dugan FM, Hellier BC, Lupien SL. Pathogenic fungi in garlic seed cloves from the United States and China, and efficacy of fungicides against pathogens in garlic germplasm in Washington State[J]. Journal of Phytopathology , 2007, 155 (7) : 437–445. |
| [20] | Vu HQ, El-Sayed MA, Ito SI, et al. Discovery of a new source of resistance to Fusarium oxysporum, cause of Fusarium wilt in Allium fistulosum, located on chromosome 2 of Allium cepa aggregatum group[J]. Genome , 2012, 55 (10) : 797–807. |
| [21] | Sintayehu A, Sakhuja PK, Fininsa C, et al. Management of Fusarium basal rot (Fusarium oxysporum f. sp. cepae) on shallot through fungicidal bulb treatment[J]. Crop Protectio , 2011, 30 (5) : 560–565. DOI:10.1016/j.cropro.2010.12.027 |
 2016, Vol. 43
2016, Vol. 43