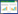扩展功能
文章信息
- 申光辉, 冯孟, 张志清, 黎杉珊, 秦文, 刘书亮
- SHEN Guang-Hui, FENG Meng, ZHANG Zhi-Qing, LI Shan-Shan, QIN Wen, LIU Shu-Liang
- 一株蜂粮源拮抗细菌的分离鉴定及其抑菌物质特性
- Isolation, identification of an antagonistic bacteria from bee bread and characteristics of antimicrobial substances
- 微生物学通报, 2016, 43(10): 2197-2206
- Microbiology China, 2016, 43(10): 2197-2206
- DOI: 10.13344/j.microbiol.china.150857
-
文章历史
- 收稿日期: 2015-11-01
- 接受日期: 2016-03-22
- 优先数字出版日期(www.cnki.net): 2016-04-08
蜂粮,也称蜂面包、蜂巢花粉,是采粉蜂将腺体分泌物混入花粉团进行初步加工后,在多种有益微生物的作用下,经过复杂的生理生化过程自然发酵而成的蜂花粉酿制产物[1]。蜂粮作为幼蜂的全价营养源[2],较新鲜蜂花粉具有良好的耐储藏性。已有研究发现蜂粮中的微生物种类丰富,其代谢产物有机酸、蛋白水解酶、碳水化合物分解酶类能有效抑制蜂粮中杂菌的生长繁殖,在蜂粮的贮藏过程中具有十分重要的防腐作用[3-4]。蜂粮作为多种微生物参与的自然发酵产物,其耐储藏性与其中的微生物密切相关,但目前对蜂粮中拮抗性微生物的研究较少。因此,分离研究其中的抑菌活性菌株对揭示蜂粮的抑菌作用机理及拮抗微生物资源开发利用均具有重要意义。
本研究对益母草花、荷花及油菜花天然成熟老巢脾蜂粮中的拮抗性微生物进行分离筛选,获得 17株抑菌活性微生物,其中1株细菌PC2具有抑菌活性较强、抑菌谱广、发酵培养基成分简单的特点。本文主要通过形态学特征、生理生化特性和16S rRNA基因序列对菌株PC2进行分类鉴定,并测定无菌发酵液中抑菌活性物质对温度、pH、紫外线、蛋白酶的稳定性,初步分析其抑菌活性成分,旨在为菌株PC2发酵液抑菌活性成分分离鉴定及菌株资源的开发利用提供依据。
1 材料与方法 1.1 材料1.1.1 蜂粮:益母草花、荷花及油菜花天然成熟老巢脾蜂粮,由湖南省益阳市南县蜂农梦蜜蜂园养蜂场提供。
1.1.2 供试菌株:金黄色葡萄球菌(Staphyloccocus aureus)、大肠杆菌(Escherichia coli)、藤黄微球菌(Micrococcus luteus)、酿酒酵母(Saccharomyces cerevisiae)、枯草芽胞杆菌(Bacillus subtilis)、红酵母(Rhodotorula sp.)、番茄镰刀果腐病菌(Fusarium oxysporum)、番茄绵腐病菌(Pythium aphanidermatum)、番茄青霉果腐病菌(Penicillium expansum),均保存于四川省农产品贮藏与加工重点实验室。
1.1.3 培养基:分离培养基:营养琼脂培养基(NA)、马铃薯葡萄糖琼脂培养基(PDA)、MRS培养基[5]。发酵培养基:其中马铃薯葡萄糖液体培养基(PDB)、营养肉汤培养基(NB)、MRS液体培养基、牛肉膏酵母葡萄糖液体培养基(NYDB)参照文献[5]配制,发酵培养基1 (Culture media 1,g/L)[6]:可溶性淀粉18.8,牛肉膏17.6,酵母膏7.4,KH2PO4 2.5,K2HPO4 1.0,(NH4)2SO4 0.8;发酵培养基 2 (Culture media 2,g/L)[7]:玉米粉32.0,蛋白胨9.0,MnCl2 0.005,初始发酵pH 5.0。其他培养基:LB液体培养基[5]。所有培养基均1×105 Pa灭菌20 min。
1.1.4 主要试剂和仪器:细菌基因组DNA提取试剂盒(DP302)、PCR试剂盒及蛋白酶K,天根生化科技(北京)有限公司;胃蛋白酶、碱性蛋白酶,上海源叶生物科技有限公司。MyCyclerTM Thermal Cycler PCR仪和Gel Doc XR+凝胶成像分析仪,美国Bio-Rad公司;S-4800型冷场发射扫描电镜,日本Hitachi公司。
1.2 方法1.2.1 蜂粮拮抗菌株的分离筛选:取蜂粮分别用NB、PDB、MRS液体培养基于30 ℃、120 r/min进行增菌培养24 h,采用稀释平板法分别在NA、PDA、 MRS固体平板上28 ℃培养2-3 d,根据菌落的形态、颜色、透明度等特征,挑取不同形态单菌落进行划线纯化3-4次,相应斜面4 ℃保存备用。
将待筛菌株分别接种于NB、PDB、MRS液体培养基,于37、28、32 ℃条件下180 r/min摇瓶发酵培养24 h,取发酵液于4 ℃条件下8 000 r/min冷冻离心20 min,收集上清液经0.22 μm微孔滤膜过滤得无菌发酵液,4 ℃保存备用。改良牛津杯双层平板法进行抗菌活性初筛,以金黄色葡萄球菌作指示菌,以15 mL NA培养基作下层培养基,凝固后距离平板中央2.5 cm处均匀放置4个灭菌牛津杯,最后倒入10 mL混有金黄色葡萄球菌的LB培养基作上层培养基。牛津杯中加入150 μL无菌发酵液,置37 ℃培养24 h,观察抑菌圈的有无并测量其直径大小。
将初筛得到的菌株分别用大肠杆菌、酿酒酵母、藤黄微球菌为指示菌进行抑菌活性复筛,选择抑菌谱最广、抑菌圈最大的菌株进一步研究。
1.2.2 拮抗菌株PC2抑菌谱测定:将筛选得到的拮抗作用最强的菌株PC2用PDB培养基37 ℃发酵24 h,按1.2.1方法获得无菌发酵液并测定其对金黄色葡萄球菌、大肠杆菌、藤黄微球菌、枯草芽胞杆菌、酿酒酵母、红酵母、番茄镰刀菌果腐病菌、番茄绵腐病菌、番茄青霉果腐病菌等菌株的抑菌效果。其中细菌37 ℃恒温培养,真菌28 ℃恒温培养,24-48 h后观察抑菌圈的有无,并采用十字交叉法测量抑菌圈直径大小,各处理重复3次。
1.2.3 拮抗菌株PC2发酵培养基的筛选:将菌株PC2分别用PDB、NB、MRS液体、NYDB、发酵培养基1、发酵培养基2于37 ℃条件下180 r/min摇瓶发酵培养24 h。按1.2.1方法获得无菌发酵液对酿酒酵母的抑菌活性,观察抑菌圈的有无并测量其直径大小,每个处理重复3次。
1.2.4 拮抗菌株PC2分类鉴定:参照《常见细菌系统鉴定手册》[8]对拮抗菌株进行形态特征观察和生理生化试验,参考张艳群等[9]方法制备样品,用日立S-4800扫描电镜观察菌体和芽胞形态。
菌株PC2的16S rRNA基因序列测定:采用细菌基因组DNA提取试剂盒提取菌株基因组DNA,以16S rRNA基因通用引物27F和1492R扩增。25 μL PCR反应体系:2×Taq Plus PCR Master Mix 12.5 μL,引物(10 μmol/L)各1 μL,基因组DNA 1 μL,加ddH2O补至25 μL。PCR反应程序:94 ℃ 4 min;94 ℃ 1 min,57 ℃ 55 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。PCR产物交由上海立菲生物技术有限公司进行纯化测序。将测序结果提交到NCBI数据库进行基因序列相似性搜索比对,选择相似度较高的模式菌株序列,用Clustalx 1.83与MEGA 5.1软件,采用NJ法(Neighbor-Joining method)构建系统发育树。
1.2.5 无菌发酵液抑菌活性稳定性测定:按照1.2.1制备菌株无菌发酵液。热稳定性:取无菌发酵液10 mL于无菌具塞试管,分别在40、60、80、100、121 ℃下处理30 min。
酸碱稳定性:取无菌发酵液10 mL于无菌具塞试管,分别用1 mol/L HCl或1 mol/L NaOH溶液调至不同pH (1.0、3.0、5.0、8.0、10.0、12.0、14.0)。25 ℃静置2 h后调回发酵液初始pH 7.0,以无菌水定量各处理至同一体积,保证各处理抑菌物质浓度相同。
紫外线稳定性:取无菌发酵液10 mL于90 mm灭菌培养皿,分别在15 W紫外灯下30 cm处开盖照射10、20、30、40、50、60 min。
蛋白酶稳定性:取无菌发酵液2 mL分别加入蛋白酶K、胃蛋白酶、碱性蛋白酶,酶最终质量浓度为0.01 g/mL,37 ℃处理1 h,经0.22 μm微孔滤膜过滤。
以番茄绵腐病菌为指示菌,按1.2.2方法检测上述不同处理无菌发酵液的抑菌活性,以未处理发酵液为对照,37 ℃培养48 h,测定抑菌圈直径,各处理重复3次。
1.2.6 无菌发酵液抑菌活性物粗提取分离:采用2种方法对发酵液抑菌活性物质进行粗提取分离。硫酸铵沉淀法提取抑菌粗蛋白:取10 mL无菌发酵液,缓慢加入硫酸铵,分别调节饱和度至30%、40%、50%、60%、70%、80%和90%,4 ℃静置12 h后10 000 r/min、4 ℃离心20 min,收集沉淀,加入0.02 mol/L pH 7.0磷酸盐缓冲液5 mL溶解,透析12 h除盐,获得不同饱和度抑菌粗蛋白提取物,同时将上清液透析12 h除盐,获得相应除盐上清液。
盐酸沉淀有机溶剂抽提法提取抑菌粗脂肽:取10 mL无菌发酵液,用6 mol/L盐酸调pH值至2.0,4 ℃静置12 h后10 000 r/min、4 ℃离心20 min,取上清液用2 mol/L NaOH调pH至7.0得盐酸沉淀上清液,沉淀分别加入2 mL甲醇、乙醇、正丁醇、丙酮、乙酸乙酯、石油醚抽提3次,合并抽提液,冻干后用5 mL 0.02 mol/L pH 7.0磷酸盐缓冲液溶解,0.22 μm微孔滤膜过滤,得不同有机溶剂提取物。
分别以大肠杆菌、金黄色葡萄球菌和酿酒酵母为指示菌,按1.2.2方法检测抑菌粗蛋白提取物和对应除盐上清液的抑菌活性,及不同溶剂提取物和盐酸沉淀上清液抑菌活性。
1.2.7 数据统计分析:实验数据以平均值±标准偏差表示,采用DPS 7.5软件,用Duncan法进行多重比较。
2 结果与分析 2.1 蜂粮拮抗菌株分离筛选从3种蜂粮中共分离得到85株菌,其中NA平板上28株,PDA平板上28株,MRS平板上29株。通过菌落形态和细胞形态,初步确定从 3种培养基上分离到的微生物主要是细菌、酵母菌和放线菌。采用牛津杯双层平板法筛选出17株对金黄色葡萄球菌具有较明显抑菌圈的菌株,其中分离自PDA平板的一株细菌菌株PC2对金黄色葡萄球菌的抑菌圈最大,直径达27.04 mm,且抑菌圈透明(图 1)。

|
| 图 1 菌株PC2无菌发酵液对金黄色葡萄球菌的抑菌圈 Figure 1 Inhibitory zone of cell-free fermentation broth of strain PC2 against S. aureus |
|
|
采用摇瓶发酵法,将菌株PC2接种于PDB液体培养基,于37 ℃条件下180 r/min发酵24 h,进行抑菌试验,由表 1可见菌株PC2无菌发酵液对金黄色葡萄球菌、大肠杆菌、酿酒酵母、藤黄微球菌、番茄镰刀果腐病菌、番茄绵腐病菌、番茄青霉果腐病菌有抑菌效果,其中对酿酒酵母抑菌作用最强,抑菌圈直径达40.44 mm (图 2B),但对枯草芽胞杆菌和红酵母无抑菌作用。菌株PC2产生的抑菌物质对革兰氏阳性细菌、革兰氏阴性细菌及丝状真菌均有抑菌效果,表明菌株PC2无菌发酵液具有较宽的抑菌谱。
| 指示菌株 Tested strains | 抑菌圈直径 Inhibition zone diameter (mm) |
| Staphyloccocus aureus | 27.04±0.98 |
| Escherichia coli | 23.04±0.99 |
| Saccharomyces cerevisiae | 40.44±0.26 |
| Micrococcus luteus | 15.74±0.50 |
| Bacillus subtilis | - |
| Rhodotorula sp. | - |
| Fusariu oxysporum | 17.54±0.68 |
| Pythium aphanidermatum | 21.51±0.62 |
| Penicillium expansum | 17.33±0.62 |
| 注:-:无拮抗作用. | |
| Note: -: no inhibitory effect. | |

|
| 图 2 菌株PC2无菌发酵液的抑菌作用效果 Figure 2 Inhibitory effect of cell-free fermentation broth of strain PC2 against four test strains 注:A:大肠杆菌;B:酿酒酵母;C:藤黄微球菌;D:番茄镰刀果腐病菌. Note:A: Escherichia coli; B: Saccharomyces cerevisiae; C: Micrococcus luteus; D: Fusarium oxysporum. |
|
|
通过比较6种不同培养基发酵液抑菌活性试验发现,PDB发酵培养基获得菌株PC2发酵液对酿酒酵母的抑菌活性最强,达40.44 mm (表 2)。
| 发酵培养基 Culture media | 抑菌圈直径 Inhibition zone diameter (mm) |
| PDB | 40.44±0.26 |
| NB | 17.04±0.30 |
| MRS | - |
| NYDB | - |
| Culture media 1 | - |
| Culture media 2 | - |
| 注:-:无拮抗作用. 下同. | |
| Note: -: no inhibitory effect. the same below. | |
2.4.1 形态特征:拮抗菌PC2在PDA平板上37 ℃培养36 h后,菌落呈圆形或椭圆形,边缘不规则,乳白色不透明,表面粗糙(图 3A);液体静置培养有菌膜产生。菌体细胞呈杆状,革兰氏染色阳性,芽胞椭圆形,中生或次端生(图 3B)。扫描电镜观察可见菌体(图 3C)表面光滑,两端钝圆。

|
| 图 3 菌株PC2形态特征 Figure 3 Morphology of strain PC2 注:A:PDA平板上菌落形态;B:革兰氏染色菌体和芽胞形态(1 000×);C:菌体扫描电镜照片(2 500×). Note:A: Colony morphology on PDA plate; B: Gram staining thalli and spore (1 000×); C: Thalli scanning electron microscope (2 500×). |
|
|
2.4.2 生理生化特性:菌株PC2能发酵葡萄糖、蔗糖、甘露糖产酸,不发酵麦芽糖、半乳糖、乳糖;硫化氢试验呈阴性;能够水解明胶、淀粉;赖氨酸脱羧酶试验阳性;不能形成吲哚;不能分解尿素。根据形态及生理生化特征初步鉴定菌株PC2属于芽胞杆菌属Bacillus。
2.4.3 16S rRNA基因同源性鉴定:对菌株PC2提取基因组DNA后,利用16S rRNA基因通用引物PCR扩增16S rRNA基因,将回收的16S rRNA基因片段进行序列测定,得到全长1 437 bp序列(GenBank登录号:KP219718)。将测得的16S rRNA基因序列用BLAST程序比对,对其进行同源分类鉴定,发现与NCBI数据库中芽胞杆菌属多个种的序列相似度均>99%,进一步选择相关模式菌株序列构建系统发育树(图 4),发现PC2菌株与Bacillus amyloliquefaciens subsp. plantarum FZB42 (GenBank登录号:CP000560)聚在同一分支,且分支支持率为91%,同时与解淀粉芽胞杆菌的另外3株标准菌株亲缘关系较近。综合菌株形态学特征、生理生化特性及16S rRNA基因序列分析,将菌株PC2鉴定为解淀粉芽胞杆菌(Bacillus amyloliquefaciens)。
|
| 图 4 基于16S rRNA基因序列的PC2菌株系统发育树 Figure 4 Phylogenetic tree based on the partial 16S rRNA gene sequence of PC2 and type strains 注:分支处数值表示Bootstrap 值;括号内数字表示序列GenBank登录号;标尺为进化距离. Note:Numbers at branch nodes present bootstrap value; The GenBank accession number of aligned sequences are shown in the brackets; Bar: Nucleotide divergence. |
|
|
2.5.1 热稳定性:由图 5可知,菌株PC2无菌发酵液分别在经不同温度处理后对番茄绵腐病菌仍具有较强的抑菌活性,其抑菌活性随着热处理时间的延长和处理温度的升高而下降,经121 ℃处理 30 min其抑菌圈直径仍有13.54 mm,是未处理发酵液抑菌圈直径的71.19%,表明菌株PC2发酵液中抑菌物质成分具有较强的热稳定性。

|
| 图 5 不同温度处理无菌发酵液对番茄绵腐病菌的抑菌活性 Figure 5 Inhibitory activity of cell-free fermentation broth of strain PC2 treated with different temperature against Pythium aphanidermatum 注:图中不同小写字母表示0.05水平上差异显著. 下同. Note:The different letter means significant difference (P<0.05). the same below. |
|
|
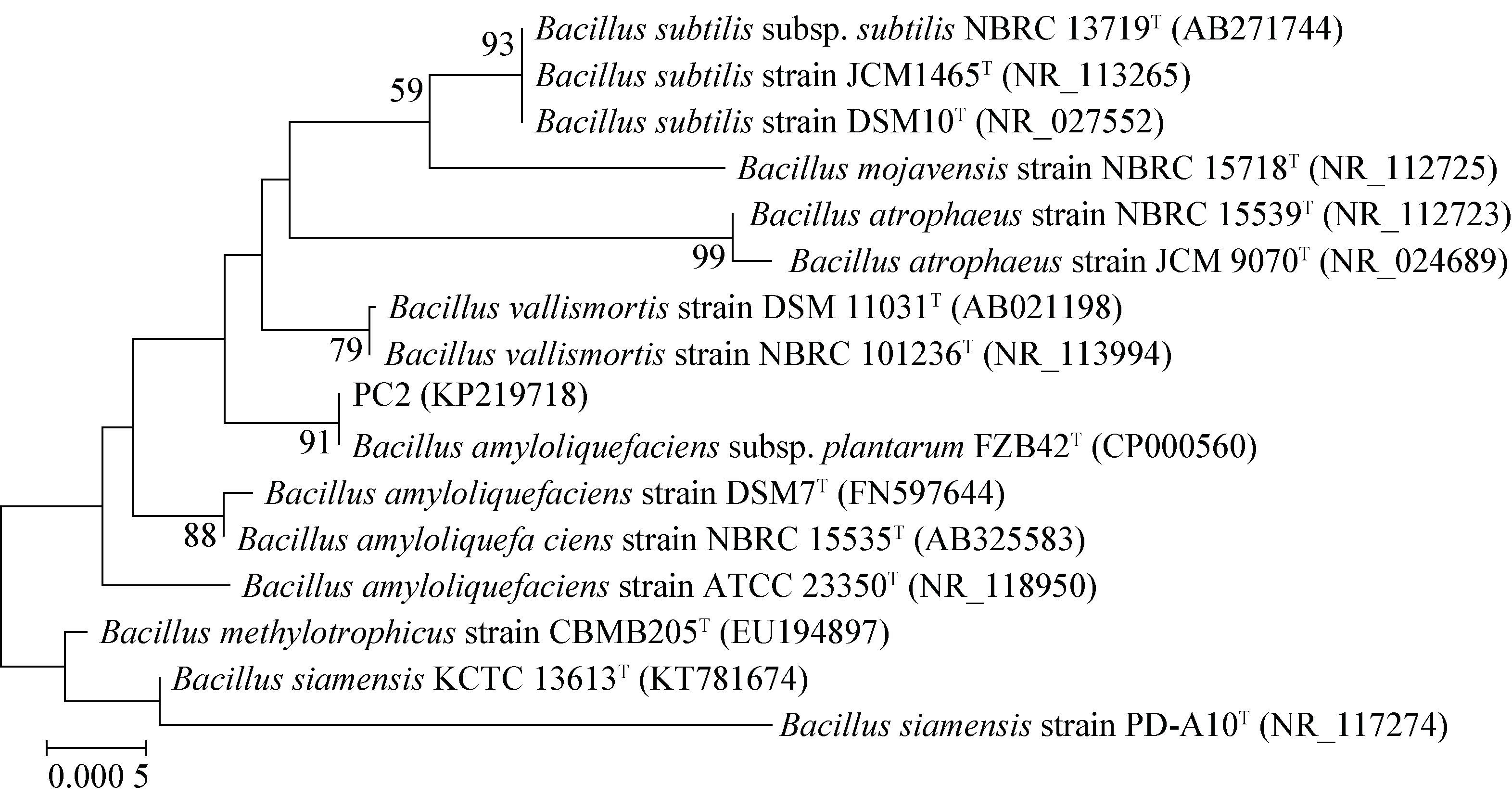
2.5.2 酸碱稳定性:由图 6可知,菌株PC2发酵液在pH 1.0-7.0范围内,对番茄绵腐病菌的抑菌圈直径在21.19 mm左右,抑菌活性与对照相比无显著性差异(P>0.05),表明其对酸稳定性好;随着pH增大,其抑菌活性快速显著下降(P<0.01),当pH≥12.0时,抑菌活性完全丧失,可能是碱性环境改变了发酵液中活性物质结构导致抑菌活性下降。表明菌株PC2发酵液抑菌物质成分对碱性环境比较敏感,但能适应较强的酸性环境。
|
| 图 6 酸碱处理无菌发酵液对番茄绵腐病菌的抑菌活性 Figure 6 Inhibitory activity of cell-free fermentation broth of strain PC2 treated with different pH against Pythium aphanidermatum |
|
|
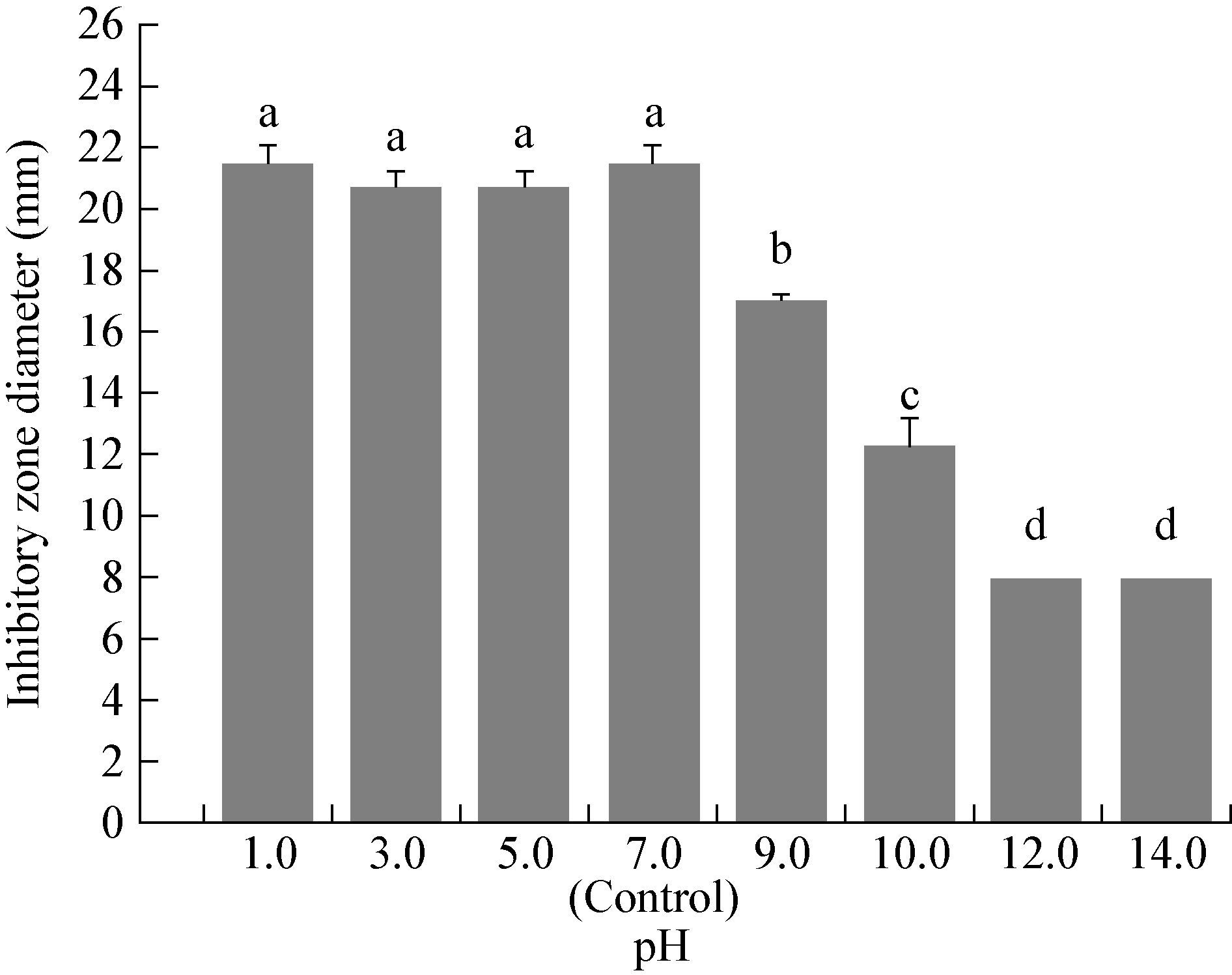
2.5.3 紫外线稳定性:由图 7可知,与对照样品相比,菌株发酵液在紫外光下照射10 min内对番茄绵腐病菌的抑菌活性无显著差异,照射20-60 min抑菌圈直径明显降低(P<0.01),但仍有19.13 mm,是未处理发酵液抑菌圈直径的88.89%,表明菌株PC2发酵液抑菌物质成分具有较好的紫外线照射稳定性。
|
| 图 7 紫外照射处理无菌发酵液对番茄绵腐病菌的抑菌活性 Figure 7 Inhibitory activity of cell-free fermentation broth of strain PC2 treated with ultraviolet irradiation against Pythium aphanidermatum |
|
|
2.5.4 蛋白酶稳定性:试验结果发现,对照组的抑菌圈直径为19.02 mm,而经蛋白酶处理后的无菌发酵液对番茄绵腐病菌无明显的抑菌圈,表明PC2发酵液抑菌活性物质对蛋白酶K、胃蛋白酶、碱性蛋白酶敏感,初步判断抑菌物质可能为抑菌蛋白质成分。
2.6 无菌发酵液抑菌活性粗提取物抑菌活性2.6.1 抑菌粗蛋白抑菌活性:对菌株发酵液不同饱和度硫酸铵获得的沉淀粗蛋白及上清液的抑菌活性进行检测。由表 3可见,50%-70%饱和度硫酸铵沉淀蛋白对大肠杆菌、金黄色葡萄球菌及酿酒酵母均有较强的抑菌活性,其中饱和度为60%对金黄色葡萄球菌和酿酒酵母的抑菌圈直径最大,分别为32.45 mm和35.14 mm;而70%饱和度对大肠杆菌抑菌活性最强,抑菌圈达26.82 mm,但与60%饱和度差异不大。表明60%硫酸铵饱和度可较完全沉淀抑菌蛋白,为最佳的饱和度。
| 指示菌株 Tested strains | 硫酸铵饱和度 Ammonium sulfate saturation (%) | ||||||
| 30 | 40 | 50 | 60 | 70 | 80 | 90 | |
| Staphyloccocus aureus | 22.31±0.90 | 25.56±0.89 | 28.91±0.72 | 32.45±0.86 | 20.08±0.47 | - | - |
| Escherichia coli | - | - | 23.87±0.64 | 25.12±0.85 | 26.82±1.03 | 20.43±0.80 | - |
| Saccharomyces cerevisiae | 36.33±0.95 | 41.54±0.76 | 43.53±0.91 | 35.14±0.73 | 26.70±0.65 | - | - |
为了更加全面地了解菌株发酵液抑菌活性物质的组成,对硫酸铵沉淀后的上清液抑菌活性进行检测。由表 4可知,30%-70%饱和度硫酸铵处理后上清液仍有一定的抑菌活性,饱和度30%-50%硫酸铵处理后上清液对大肠杆菌、金黄色葡萄球菌和酿酒酵母均有抑菌活性,但其抑菌活性较未处理无菌发酵液(表 1)的抑菌活性弱,同时也低于粗蛋白的抑菌活性。表明菌株PC2抑菌活性成分较为复杂,抑菌蛋白是菌株发酵液中主要的抑菌活性成分,还存在其他类型抑菌成分。
| 指示菌株 Tested strains | 硫酸铵饱和度 Ammonium sulfate saturation (%) | ||||||
| 30 | 40 | 50 | 60 | 70 | 80 | 90 | |
| Staphyloccocus aureus | 16.50±1.01 | 15.44±0.94 | 12.56±0.59 | 18.53±0.84 | 16.78±0.69 | - | - |
| Escherichia coli | 18.23±0.96 | 16.80±0.82 | 10.45±0.93 | - | - | - | - |
| Saccharomyces cerevisiae | 18.18±0.57 | 12.63±0.84 | 12.82±0.77 | 19.33±0.64 | 10.21±0.88 | - | - |
2.6.2 抑菌粗脂肽抑菌活性:芽胞杆菌抑菌活性物质种类丰富,脂肽类化合物是芽胞杆菌中一类重要的抑菌活性成分,实验采用盐酸沉淀有机溶剂提取法获得抑菌脂肽的粗提物,并检测其抑菌活性。由表 5可知,甲醇、乙醇、丙酮和乙酸乙酯提取物对3株指示菌均有抑菌活性,其中甲醇和乙醇提取物抑菌活性较强,对发酵液抑菌脂肽提取作用最强。同时发现,盐酸沉淀后的上清液仍具有较强的抑菌活性,且高于有机溶剂提取物的抑菌活性。表明菌株发酵液抑菌活性物质中存在脂肽类化合物,可能还存在其他抑菌化合物,进一步表明了该菌株抑菌活性物质组成的复杂性。
| 指示菌株 Tested strains | 有机溶剂 Organic solvent | 盐酸上清液Supernatant | |||||
| 甲醇Methanol | 乙醇 Ethanol | 正丁醇 N-butyl alcohol | 丙酮Acetone | 乙酸乙酯 Ethyl acetate | 石油醚 Petroleum ether | ||
| Staphyloccocus aureus | 18.59±0.73 | 20.33±0.68 | - | 16.28±0.90 | 12.88±0.84 | - | 20.58±0.59 |
| Escherichia coli | 12.51±0.87 | 10.76±0.74 | - | 9.22±0.94 | 16.78±0.72 | - | 16.47±0.76 |
| Saccharomyces cerevisiae | 23.54±0.55 | 26.38±0.83 | - | 18.19±0.73 | 16.23±0.80 | - | 35.20±0.81 |
蜂粮是蜂花粉的发酵产物,较蜂花粉具有良好的耐储藏性。已有研究表明,蜂粮耐储藏性主要与其中的乳酸菌发酵成熟后蜂粮呈现较强的酸性有关[10-11]。此外,贺春玲等[12]发现从长木蜂蜂粮中分离的68株菌株中有12株具有较强抑菌活性。本实验从3种蜂粮中也分离获得了17株抑菌活性菌株。
因此,蜂粮的防腐能力与其中的抑菌活性微生物也有一定关系,本研究结果也为蜂粮中拮抗功能菌株资源的筛选利用提供了依据。
芽胞杆菌是植物病害生物防治研究中较多的一大类细菌,其中解淀粉芽胞杆菌具有较强次生代谢能力,能产生种类繁多的抑菌活性物质,且繁殖速度快、抗逆性强、易保存、有利于工业化生产、且对人畜无害、不污染环境,是近年来生物拮抗菌研究利用的热点[13-16]。蜂粮作为蜂花粉自然发酵产物,含有丰富的微生物。目前对其研究较多的是其中的乳酸细菌[4, 12],而对其中的拮抗细菌资源研究较少。本实验从荷花蜂粮中筛选获得1株广谱拮抗解淀粉芽胞杆菌PC2菌株,其无菌发酵液对常见的金黄色葡萄球菌、大肠杆菌、酿酒酵母及番茄采后腐败真菌也表现出较强的抑菌活性,在生物防治和食品抑菌保鲜方面具有潜在的开发利用价值。
解淀粉芽胞杆菌在自然界中分布广泛,代谢产物种类丰富,不同来源的菌株发酵培养条件各异。发酵培养基一定程度上限制了不同来源分离株在生产中的应用推广。本实验分离的解淀粉芽胞杆菌PC2菌株产抑菌活性物质培养基比较特殊,其在马铃薯葡萄糖液体培养发酵24 h即可产生较强的胞外抑菌活性代谢产物,而利用已报道的拮抗解淀粉芽胞杆菌发酵培养基[6-7, 15]获得的发酵液抑菌活性较低,甚至无抑菌活性代谢产物产生。这可能与本菌株独特的抑菌物质合成代谢途径及其所需底物有关,有待进一步研究。实验筛选获得的PC2菌株产抑菌活性物质速度快,营养要求简单,可利用马铃薯废弃渣、液一类成本低廉的原料,在规模化工业生产上具有潜在的成本优势。而本研究仅选用了6种发酵培养基进行初步筛选,为进一步提高发酵液抑菌物质的活性和产量,还需在马铃薯葡萄糖液体培养基的基础上对PC2菌株的最适发酵培养基及发酵条件进一步优化。
解淀粉芽胞杆菌代谢产物具有广泛的抑菌活性,包括对革兰氏阳性细菌、革兰氏阴性细菌、酵母菌和植物病原真菌。抑菌蛋白[15, 17-19]和抑菌多肽[20-22]是芽胞杆菌代谢产物中很重要的抑菌活性物质。本研究通过对发酵液抑菌物质的高温、强酸(碱)及蛋白酶敏感性实验及抑菌活性物质初步分离实验结果,推测菌株发酵液可能存在抑菌蛋白和抑菌脂肽类化合物。对于这两类化合物的进一步分离纯化及抑菌机理有待进一步研究。
本实验所获菌株PC2发酵液抑菌物质具有较强的热稳定性,经121 ℃处理30 min仍保持71.19%的抑菌活性;发酵液酸稳定性很好,在pH 1.0-7.0范围内抑菌活性基本不变;紫外照射稳定性较好,紫外照射时间1 h后抑菌活性仍保持原来的88.89%。上述结果表明,该菌株发酵代谢产物稳定性好,具有很好的应用潜力,同时该结果也为发酵液抑菌活性代谢物质的进一步分离、纯化鉴定及在生产中选择适宜的应用方式提供了依据。
| [1] | Nagai T, Nagashima T, Myoda T, et al. Preparation and functional properties of extracts from bee bread[J]. Food/Nahrung , 2004, 48 (3) : 226–229. DOI:10.1002/(ISSN)1521-3803 |
| [2] | Baltrušaitytė V, Venskutonis PR, Čeksterytė V. Radical scavenging activity of different floral origin honey and bee bread phenolic extracts[J]. Food Chemistry , 2007, 101 (2) : 502–514. DOI:10.1016/j.foodchem.2006.02.007 |
| [3] | Gilliam M. Microbiology of pollen and bee bread: the genus bacillus[J]. Apidologie , 1979, 10 (3) : 269–274. DOI:10.1051/apido:19790304 |
| [4] | Duan CR, Bao JF, Shi YS, et al. Isolation and identification of microbe in loquat flower and rape flower bee bread[J]. Science and Technology of Food Industry , 2015, 36 (5) : 175–180. (in chinese) 段传人, 暴佳芳, 石轶松, 等. 枇杷花和油菜花蜂粮中微生物的分离与鉴定[J]. 食品工业科技 , 2015, 36 (5) : 175–180. |
| [5] | Li PL, He ZF. Experimental Principles and Techniques of Food Microbiology[M].2nd edition. Beijing: China Agriculture Press, 2011: 222 -224. (in chinese) 李平兰, 贺稚非. 食品微生物学实验原理与技术[M].第2版. 北京: 中国农业出版社, 2011: 222 -224. |
| [6] | Lü Z, Zhang LP, Cheng HC, et al. Optimization of fermentation for production conditions of antibiotic by Bacillus amylolique faciens D1[J]. Northern Horticulture , 2013 (5) : 94–97. (in chinese) 吕钊, 张丽萍, 程辉彩, 等. 响应面法优化解淀粉芽孢杆菌D1产抗菌素培养基研究[J]. 北方园艺 , 2013 (5) : 94–97. |
| [7] | Zhang XH, Wang K, Zhu TH, et al. Optimization of medium and fermentation conditions for the production of antifungal substance by Bacillus amyloliquefaciens BW-13[J]. Journal of Zhejiang University of Technology , 2013, 41 (1) : 35–39. (in chinese) 章小洪, 汪琨, 朱廷恒, 等. 解淀粉芽孢杆菌BW-13培养基和培养条件优化[J]. 浙江工业大学学报 , 2013, 41 (1) : 35–39. |
| [8] | Dong XZ, Cai MY. Manual of Systematic Determinative General Bacteriology[M]. Beijing: Science Press, 2001: 9 -42. (in chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 9 -42. |
| [9] | Zhang YQ, Lai HX, Wei XM, et al. Screening and identification and antagonism research of two biocontrol bacillus strains[J]. Microbiology China , 2014, 41 (2) : 281–289. (in chinese) 张艳群, 来航线, 韦小敏, 等. 两株生防芽孢细菌筛选、鉴定及拮抗研究[J]. 微生物学通报 , 2014, 41 (2) : 281–289. |
| [10] | He CL, Ji BZ, Liu SW. Determination of pH and the pollen germination ability during the process from pollen to bee bread of Xylocopa tranquebarorum (Swederus)[J]. Journal of Environmental Entomology , 2010, 32 (1) : 78–84. (in chinese) 贺春玲, 嵇保中, 刘曙雯. 长木蜂蜂粮酿制过程中pH值和花粉活力的测定[J]. 环境昆虫学报 , 2010, 32 (1) : 78–84. |
| [11] | de Grandi-Hoffman G, Eckholm BJ, Huang MH. A comparison of bee bread made by Africanized and European honey bees (Apis mellifera) and its effects on hemolymph protein titers[J]. Apidologie , 2013, 44 (1) : 52–63. DOI:10.1007/s13592-012-0154-9 |
| [12] | He CL, Zhang SX, Ji BZ, et al. Screening on the abundance and antibacterial activity of microbial strains in the bee bread of Xylocopa tranquebarorum[J]. Journal of Environmental Entomology , 2012, 34 (3) : 302–309. (in chinese) 贺春玲, 张淑霞, 嵇保中, 等. 长木蜂蜂粮中微生物丰度及抑菌活性菌株的筛选[J]. 环境昆虫学报 , 2012, 34 (3) : 302–309. |
| [13] | Li B, Wei XJ, Li YN, et al. Primary analysis of antifungal proteins produced by Bacillus amylolique faciens X-278 against Verticillium dahlia[J]. Journal of Henan Agricultural Sciences , 2013, 42 (7) : 68–71. (in chinese) 黎波, 魏学军, 李亚宁, 等. 解淀粉芽孢杆菌X-278菌株抗菌蛋白初步分析[J]. 河南农业科学 , 2013, 42 (7) : 68–71. |
| [14] | Qiu BS. Endophytic Bacillus amyloliquefaciens CC09[J]. Microbiology China , 2015, 42 (7) : 1418. (in chinese) 邱并生. 内生解淀粉芽孢杆菌CC09[J]. 微生物学通报 , 2015, 42 (7) : 1418. |
| [15] | Qin N, Hao L, Li X. Isolation, purification and inhibitive effect of antifungal protein of Bacillus amyloliquefaciens HRH317[J]. Journal of Plant Protection , 2015, 42 (5) : 813–819. (in chinese) 秦楠, 郝林, 李鑫. 解淀粉芽胞杆菌HRH317抗菌蛋白的分离纯化及其抗菌作用[J]. 植物保护学报 , 2015, 42 (5) : 813–819. |
| [16] | Kaewklom S, Lumlert S, Kraikul W, et al. Control of Listeria monocytogenes on sliced bologna sausage using a novel bacteriocin, amysin, produced by Bacillus amyloliquefaciens isolated from Thai shrimp paste (Kapi)[J]. Food Control , 2013, 32 (2) : 552–557. DOI:10.1016/j.foodcont.2013.01.012 |
| [17] | Meng LQ, Li J, Zhao XY, et al. Isolation, purification and characterization of antifungal protein from antagonistic bacterium TF28 strain[J]. Journal of Northeast Agricultural University , 2014, 45 (2) : 83–88. (in chinese) 孟利强, 李晶, 赵晓宇, 等. 生防细菌TF28抗菌蛋白的分离纯化及理化特性[J]. 东北农业大学学报 , 2014, 45 (2) : 83–88. |
| [18] | Yang LR, Wang ZJ, Xue BG, et al. Clonging of antagonistic protein TasA gene in Bacillus amyloliquefaciens YN-1 and its prokaryotic expression[J]. Genomics and Applied Biology , 2010, 29 (5) : 823–828. (in chinese) 杨丽荣, 王正军, 薛保国, 等. 解淀粉芽孢杆菌YN-1抑菌蛋白TasA基因的克隆及原核表达[J]. 基因组学与应用生物学 , 2010, 29 (5) : 823–828. |
| [19] | Hu HQ, Li XS, He H. Characterization of an antimicrobial material from a newly isolated Bacillus amyloliquefaciens from mangrove for biocontrol of Capsicum bacterial wilt[J]. Biological Control , 2010, 54 (3) : 359–365. DOI:10.1016/j.biocontrol.2010.06.015 |
| [20] | Zhu XF, Zhang XX, Niu YC, et al. Isolation and identification of a Bacillus amyloliquefaciens YB-3 against Rhizoctonia solani[J]. Acta Microbiologica Sinica , 2011, 51 (8) : 1128–1133. (in chinese) 朱晓飞, 张晓霞, 牛永春, 等. 一株抗水稻纹枯病菌的解淀粉芽胞杆菌分离与鉴定[J]. 微生物学报 , 2011, 51 (8) : 1128–1133. |
| [21] | He H, Zhu YL, Chi LQ, et al. Screening and antibacterial function of Bacillus amyloliquefaciens X030[J]. Acta Microbiologica Sinica , 2015, 55 (9) : 1133–1143. (in chinese) 何浩, 朱颖龄, 迟立庆, 等. 解淀粉芽胞杆菌BaX030的分离鉴定及抗菌功能[J]. 微生物学报 , 2015, 55 (9) : 1133–1143. |
| [22] | Yang RX, Ji JH, Wang ZH, et al. Isolation, indentification and inhibitory activity of lipopeptides of endophytic bacteria from the root of Paeonia suffruticosa[J]. Microbiology China , 2015, 42 (6) : 1081–1088. (in chinese) 杨瑞先, 姬俊华, 王祖华, 等. 牡丹根部内生细菌的分离鉴定及脂肽类物质的拮抗活性研究[J]. 微生物学通报 , 2015, 42 (6) : 1081–1088. |
 2016, Vol. 43
2016, Vol. 43