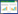扩展功能
文章信息
- 谢越盛, 许泉, 王大成, 王宁, 王超, 蒋春号, 郭坚华
- XIE Yue-Sheng, XU Quan, WANG Da-Cheng, WANG Ning, WANG Chao, JIANG Chun-Hao, GUO Jian-Hua
- 植物根际促生枯草芽孢杆菌JC01筛选
- Screening of plant growth-promoting Bacillus subtilis JC01 producing vola
- 微生物学通报, 2016, 43(10): 2187-2196
- Microbiology China, 2016, 43(10): 2187-2196
- DOI: 10.13344/j.microbiol.china.150839
-
文章历史
- 收稿日期: 2015-10-28
- 接受日期: 2016-05-04
- 优先数字出版日期(www.cnki.net): 2016-06-08
2. 环境保护部南京环境科学研究所 江苏 南京 210042 ;
3. 环境保护部有机食品发展中心 江苏 南京 210042
2. Nanjing Institute of Environmental Sciences of the Ministry of Environmental Protection of PR China, Nanjing, Jiangsu 210042, China ;
3. Organic Food Development Center of the Ministry of Environmental Protection of PR China, Nanjing, Jiangsu 210042, China
氮和磷是作物生长所需的大量元素,而自然界中的氮元素大多以氮气存在于空气中,磷元素在土壤中则大多以难溶解状态存在,极难被作物所利用[1-3]。铁元素是大多生物所必需的,铁元素含量是作物生长及土壤细菌生长的重要影响因 素[4]。土壤中存在各种各样的细菌,其中植物根际促生细菌(Plant growth-promoting rhizobacteria,PGPR)是一类在植物根围定殖,可促进植物生长、增产以及抗病的有益菌群[5-6]。目前,国内外关于PGPR的报道较多,主要包括肠杆菌属(Enterobacter spp.)、克雷伯氏菌属(Klebsiella spp.)、假单胞菌属(Pseudomonas spp.)、固氮菌属(Azotobacter spp.)、芽孢杆菌属(Bacillus spp.)、不动杆菌属(Acinetobacter spp.)等[5-11]。PGPR的促生机制主要包括将土壤中的难溶解的含磷化合物转化成植物可吸收的形态,将空气中的N2固定还原成植物可利用的NH4+,分泌生长素(IAA)等植物激素直接调控植物生长等[10-13]。另外还有间接作用,如跟病原菌竞争生存空间和营养,减少病原菌定殖,或产生嗜铁素清除植物根围可被病原物利用的铁元素,抑制病原物生长,达到促生目 的[4-5]。有研究表明植物内源激素吲哚乙酸(IAA)、乙烯(Ethylene,ETH)和脱落酸(Abscisic acid,ABA)与植物的生长发育相关,IAA能够促进植物的生长,而ETH与ABA一般被认为是一种胁迫激素、生长抑制剂[14-15]。而目前发现部分PGPR能够产生一些挥发性有机化合物(Volatile organic compound,VOC),此挥发物可以作为植物的营养物质被植物吸收利用,提升植物内源IAA水平或者降低ETH水平,具有显著的促生 效果[15-18]。
目前,对解磷、溶磷、固氮及产IAA、嗜铁素PGPR的筛选非常广泛,但完整且充分的筛选较少,对PGPR促生机理的探究也不够全面[19]。本实验通过筛选评价体系从838株细菌中筛选出高效促生细菌,并初步探究该体系的可行性,进一步阐明细菌的促生机制,为后续植物根际促生菌筛选提供理论依据。
1 材料与方法 1.1 供试材料供试细菌:实验室前期从植物根际分离并保存的838株细菌。
供试作物:玉米(Zea mays):美豫5号;小麦(Triticum aestivum):矮抗958;水稻(Oryza sativa):两优培九;棉花(Gossypium hirsutum L.):中棉所46;空心菜(Ipomoea aquatica Forsk.):泰国空心菜;番茄(Lycopersicon esculentum):Micro-Tom。
培养基:LB (Luria-Bertani)培养基、固氮培养基(NFb)、蒙金娜无机磷培养基(NPA)、蒙金娜有机磷培养基(OPA)、嗜铁素培养基(CAS培养基)、MS (Murashige-Skoog)培养基、埃利希氏反应显色试剂[19-22]。
1.2 主要试剂和仪器细菌基因组DNA提取试剂盒及所用引物合成,上海赛百盛基因技术有限公司;DNA凝胶回收试剂盒,爱思进生物技术(杭州)有限公司;PCR扩增反应相关试剂及限制酶等,宝生物工程(大连)有限公司;植物RNA提取试剂盒(Tiangen RNA simple,DP419),天根生化科技(北京)有限公司;荧光染料SYBR Green及参比染料ROX Reference Dye,美国英杰生命技术有限公司。
荧光定量PCR仪ABI 7500,购于美国应用生物系统公司。
1.3 细菌发酵液的制备将供试细菌接入LB培养液中培养(培养条件:28 ℃,180 r/min,24 h),然后将菌液稀释至约为5.0×107 CFU/mL备用。
1.4 细菌活性测定与赋值评估采用点板法将细菌接种在NFb、OPA、NPA、CAS平板上,置于培养箱培养(培养条件:28 ℃,96 h)。若NPA平板上有透明圈,表明该细菌具有溶解无机磷的活性;OPA平板上有透明圈,表明该细菌具有分解有机磷的活性;细菌能在NFb培养基上生长,并且菌落周围能够变蓝,表明其有固氮能力;CAS平板上菌落周围有黄色透明圈,表明其具有分泌嗜铁素能力;反之则 无[20-23]。挑取细菌单菌落于1%的胰蛋白胨水溶液中,28 ℃、180 r/min培养48 h,再加入3 mL埃利希氏反应显色试剂,若出现红色则说明该细菌有分泌IAA活性,反之则无[19, 24]。
根据Faltin等在细菌生防潜力上进行赋值评估的方法,对细菌解(溶)磷、固氮和嗜铁素分泌活性进行赋值评价[24]。其中平板活性赋值:活性圈半径大于0 mm且小于或等于3 mm则赋值 1分,大于3 mm且小于或等于6 mm则赋值2分,大于6 mm则赋值3分。分泌IAA赋值:与埃利希氏反应显色试剂混合后显淡红色则赋值1分,显红色则赋值2分,显红紫色则赋值3分。没有活性圈,或者不显色则赋值0分。
1.5 指纹图谱聚类分析利用基因组试剂盒提取细菌的DNA后,进行扩增核糖体DNA限制性酶切分析(aamplified ribosomal DNA restriction analysis,ARDRA)。
采用引物U8-27(F) [5′-AGAGTTTGATC(AC) TGGCTCAG-3′]和L1494-1514(R) [5′-CTACGG (AG)TACCTTGTTACGAC-3′]扩增细菌基因组DNA中的16S rRNA基因片段[25]。扩增条件为:94 ℃ 5 min;94 ℃ 1 min,56 ℃ 2 min,72 ℃ 2 min,35个循环;72 ℃ 10 min,4 ℃保存[26]。取10 μL细菌的16S rRNA基因扩增产物,Msp I酶切(37 ℃,3 h)后,将酶切产物进行电泳检测(1.5%琼脂糖+1.5% Synergel,1.0×TAE,80 V,3 h),最后用GelCompar® Ⅱ version 4.5进行图谱的聚类分析。
1.6 潜力细菌温室促生实验作物种子用3% NaClO溶液浸种5 min,最后用无菌水清洗5遍。将种子在准备好的潜力细菌稀释液中浸泡5 min,然后播于盆钵(直径9 cm,高13 cm,基质:草炭土:蛭石=3:1)中,每个盆钵播种4颗种子,置于温室中培养(温室条件:温度26-28 ℃,光照时长12 h)。共20个处理,以无菌水处理作为对照组,每个处理24株苗,3次重复。30 d后统计作物(其中玉米的统计间隔为10 d)的生物量。并分析细菌平板活性与温室促生效果之间的相关性。
1.7 菌株JC01产VOC测定通过实验对低赋值的JC01进行检测是否能够产生具有促生作用的VOC成分,并以相同赋值且促生效果较低的菌株2JW2及空白处理作为对照。将番茄经3% NaClO溶液消毒5 min后,在MS培养基上催芽后,将出芽一致的幼苗转移至组培瓶中,每瓶放置1颗。将已灭菌的含有MS培养基的10 mL小烧杯放在组培瓶中,在小烧杯中分别接种2JW2、JC0 1菌液(浓度约为 5.0×107 CFU/mL) 10 μL。小烧杯使接种的细菌菌液与番茄植株之间产生物理隔离,只能进行气体交换,以探究细菌分泌的VOC对作物的影响[16]。将组培瓶置于光照培养箱中培养(条件:光照时间12 h,温度28 ℃,相对湿度50%)。以接种LB液作为空白对照,每个处理12株苗,3次重复。 28 d后统计番茄的株高、茎粗、叶片数、鲜重。
1.8 通过16S rRNA基因对产VOC菌株JC01鉴定采用对16S rRNA基因序列测序鉴定的方法。使用细菌基因组DNA提取试剂盒提取细菌JC01的DNA,采用引物U8-27(F)和L1494-1514(R)扩增细菌基因组DNA中的16S rRNA基因片段[25]。扩增条件见1.5。琼脂糖凝胶电泳检测PCR产物,采用DNA凝胶回收试剂盒法回收所需条带后,将目标片段连接至pMD-19T载体,转入大肠杆菌Top-10感受态中,挑取阳性单菌落培养后测序。将获得JC01的16S rRNA基因序列在Basic Local Alignment Search Tool (BLAST)上进行比对,获得鉴定结果[25, 26]。
1.9 Real-time PCR分析VOC处理后番茄激素信号通路关键基因的表达变化按照1.5的方法,于菌株JC01、2JW2处理后第14天用总RNA提取试剂盒提取对照组及处理组番茄叶片的总RNA,反转录为cDNA,以适量的cDNA为模板进行荧光定量PCR反应[27]。在荧光定量PCR仪ABI 7500上分析测定基因(IAA信号通路应答关键基因ctd1、ABA信号通路应答关键基因SlABF4、ETH信号通路应答关键基因ERF2)的表达情况。以真核生物内保守表达的EF1α作为对照,采用ΔΔCT方法[27, 28]进行试验数据处理,每个处理重复3次。
1.10 统计与分析实验数据均使用DPS 7.05版软件以及Excel软件进行分析,并进行Duncan多重比较分析差 异性(P<0.05)。
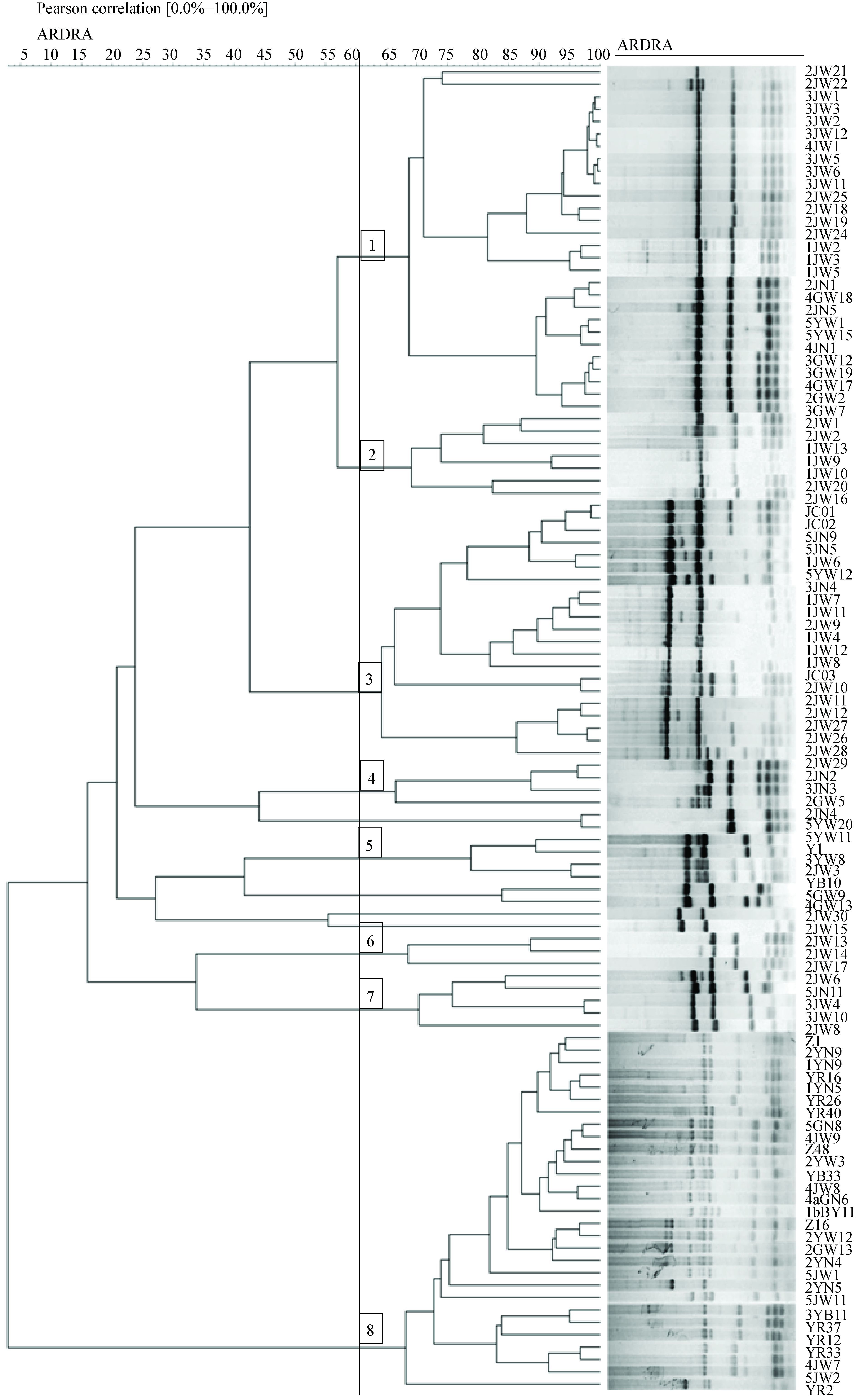
2 结果与分析 2.1 细菌活性与促生潜力评估选取的838细菌中有715株细菌具备多种平板活性,占供试细菌的85.32%。各项活性检测结果表明,具有溶磷活性的细菌占65.91%,所占比例最大;其次是具有固氮活性的细菌,占65.16%;具有解磷活性的细菌占48.30%;而具有分泌IAA或者嗜铁素活性的细菌所占比例最少,分别占8.05%、6.92%。对所筛选细菌的活性进行赋值评估结果分析,发现细菌的总分均在0-10分之间。超过3分的有107株,占12.77%,其中最高赋值10分的有5株(表 1)。
2.2 聚类图谱分析为探究促生潜力细菌的种群分布,采用ARDRA图谱分析方法对细菌活性赋值总分3分以上的 107株细菌进行聚类分析(数据未显示),从ARDRA图谱聚类分析结果可以看出,在相似系数为60%时,107株细菌共划分为8个簇(图 1)。簇8有29株细菌,占27.10%,比例最大,而组6最少,只有3株。根据细菌的平板活性赋值与ARDRA图谱分析的结果,从不同组中选取赋值在5分以上的细菌进行温室实验,最终选择了其中7个簇(簇1、簇2、簇3、簇4、簇5、簇7、簇8)中的20株细菌。
|
| 图 1 ARDRA指纹图谱分析 Figure 1 Analysis of the ARDRA fingerprint 注:图中刻度线数值表示采用皮尔逊相关系数分析,在菌株的属水平上的相似度;在刻度“60”的竖线表示在相似系数为60%的条件下,将菌株分为8个簇,用“1-8”表示;筛选的进一步实验的20株促生潜力菌株选自于不同的簇. Note:The analysis was performed using Pearson correlation applied to the densitometric curves formed by the fingerprints. The strains were grouped into 8 clusters with 60% similarity as the cut-off line for ARDRA fingerprinting. And number ‘1-8’ indicates 8 big clusters which 20 PGPR strains selected from. |
|
|
所筛选的20细菌中4株促生细菌3YB11、YB33、Y1、JC01分别在5种作物上具有较好的促生效果(表 1)。在空心菜、棉花上,促生效果最佳的细菌3BY11处理组的生物量分别增加了35.87%、19.76%;对水稻促生效果最好的细菌是YB33,生物量增加量达13.97%;对小麦促生效果最好的细菌为Y1,生物量增加量达18.35%;在玉米上JC01为最佳促生细菌,生物量增加量达13.52%。对实验结果分析发现,大多数平板活性赋值高的细菌在作物上的促生效果优于赋值低的细菌,但赋值最低的细菌JC01对5种作物的生物量的增加量均在10%以上,促生效果优于其他赋值较高的细菌。因此,对JC01 进一步实验以探究其促生机理。
 |
将细菌的平板活性赋值与空心菜的生物量增加量的相关性进行相关性分析,发现其相关系数 r为0.76 (P<0.05) (图 2)。同样对棉花、水稻、小麦、玉米进行分析其相关系数r分别为0.63、0.76、0.63、0.74 (P<0.05)。表明细菌的固氮、解磷、溶磷、产IAA、产嗜铁素活性与其温室促生效果呈高度正相关。

|
| 图 2 菌株对空心菜的促生作用与赋值之间的相关性(相关系数r为0.76) Figure 2 The correlation between the plant growth promoting effect of strains on water spinach and the assessment points (the correlation coefficiency was 0.76) |
|
|
菌株2JW2处理组与对照组差异不显著,而JC01处理组的各项生长指标显著高于对照组以及2JW2处理组(表 2)。因此,JC01能够产生VOC成分,且VOC成分能够显著促进番茄生长,而2JW2不产生(图 3)。
| 细菌 strains | 株高 Height (cm) | 茎粗 Stem diameter (mm) | 叶片数 Leaf number | 地上部重 Shoot weight (mg) | 地下部重 Root weight (mg) |
| JC01 | 5.23±0.62a | 2.07±0.10a | 10.67±0.94a | 547.00±106.86a | 140.33±24.79a |
| 2JW2 | 3.30±0.38b | 1.64±0.18b | 6.50±1.12b | 112.33±12.10b | 47.33±2.65b |
| CK | 3.43±0.67b | 1.62±0.14b | 5.75±0.43b | 83.33±8.50b | 40.50±10.72b |
| 注:不同小写字母表示处理在P<0.05的显著水平下差异显著(Duncan’s test). | |||||
| Note: Values with different letters within the same column differ significantly according to Duncan’s test (P<0.05). | |||||

|
| 图 3 细菌产生的VOC对番茄的促生效果 Figure 3 Plant growth-promoting effect of VOC produced by bacteria on tomato (28 d) |
|
|
为了揭示所筛选出来产VOC的菌株JC01的种属情况,采用对16S rRNA基因序列测序鉴定的方法,将测序结果与NCBI数据库进行BLAST比对。产VOC菌株JC01经鉴定为枯草芽孢杆菌(Bacillus subtilis,Genbank登录号:KX096714)。
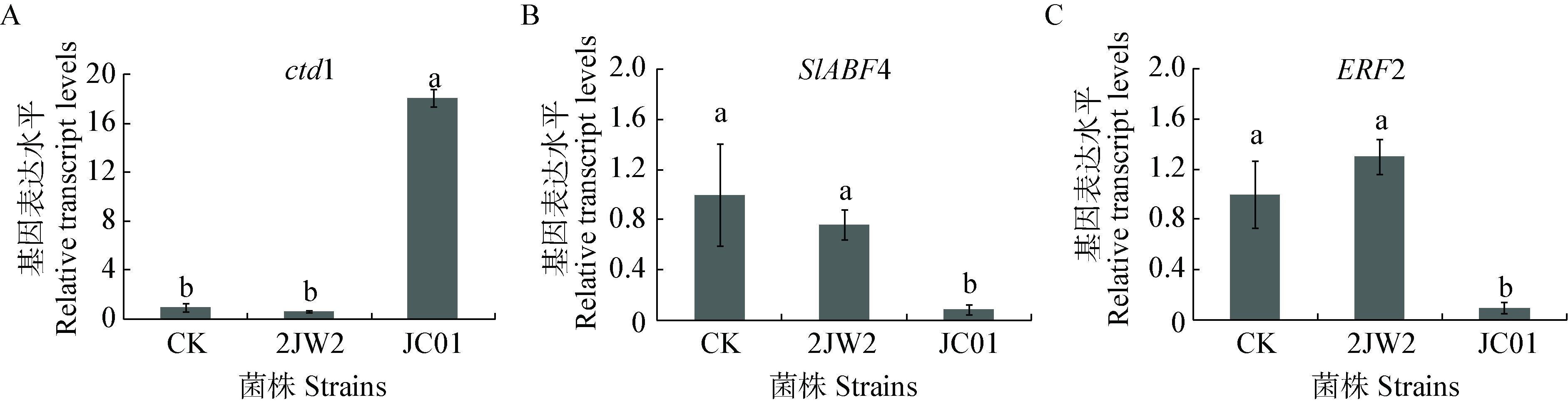
2.7 JC01产生的VOC对植物激素信号通路关键基因表达的影响采用表 3中的引物,Real-time PCR分析VOC处理后番茄激素信号通路关键基因(ctd1、SlABF4、ERF2)的表达变化。JC01处理后番茄的IAA信号通路关键基因ctd1与对照相比,表达量上调了约16倍;但ABA以及ETH信号通路关键基因SlABF4、ERF2均出现下调现象。而不产生具有促生作用VOC的2JW2与对照没有显著差异(图 4)。因此,JC01可能通过产生VOC调控植物激素IAA、ABA、ETH信号通路,从而促进植物生长。
| 引物序列 Primer sequence (5′→3′) | 基因号 Gene ID | 基因名称 Gene name | 基因功能 Gene description |
| Up: CTGCTACAAAGGCACAGGTTG Down: ATAGGGAGCACCATCCATGC | 543750 | ctd1 | 与IAA应答相关 |
| Up: AAGGGATCGGAAGCAGGCAT Down: ACTACCAAGGTCCCGTCACT | 100820704 | SlABF4 | 与ABA应答相关 |
| Up: GTCATCCACCGACCTATGGC Down: CTTCATCTGCTCACCACCTGT | 543866 | ERF2 | 与ETH应答相关 |
| Up: GGATTTGCTGGTGATGATGCT Down: GCATCCTTCTGTCCCATTCC | 544055 | EF1α | 内参基因 |
|
| 图 4 番茄激素信号通路关键基因ctd1 (A)、SlABF4 (B)、ERF2 (C)表达情况 Figure 4 Transcript expression analysis of hormone signaling pathways related genes ctd1 (A),SlABF4 (B) and ERF2 (C) in bacteria-treated and control (CK) tomato 注:每个基因独立重复测定3次,数值为平均值;显著性分析,P<0.05. Note:Data are presented as mean of three independent biological replicates. Asterisks indicate statistically significant differences between different treatments. P<0.05,LSD test. |
|
|
研究通过对细菌的功能进行赋值,结合ARDRA聚类分析及温室实验,分析建立了一个高效、准确、快速的PGPR多赋值筛选体系。从838株细菌中筛选出4株PGPR,并进一步阐述了产VOC菌株JC01可能通过调控植物生长关键基因的表达从而促进番茄植株生长的机理,为有益细菌的筛选及微生物肥料的研发提供理论基础。
恰当的评估筛选体系对PGPR的筛选是非常重要的,本研究所用的赋值评估体系在其他生防细菌筛选中已得到广泛应用。Berg等建立了内生细菌筛选评估系统并筛选出马铃薯病害生防 菌[29],Yang等利用生防菌筛选评估系统筛选出针对生姜病害的高效生防菌[30]。本研究将赋值法应用于植物促生细菌筛选体系,以细菌的平板活性为评价指标进行赋值,结合ARDRA聚类分析,选择20株具有植物促生潜力的细菌进行温室实验,最终筛选出了4株PGPR,并验证了平板活性与促生效果之间存在正相关,其相关系数r均大于0.6 (P<0.05),表明本研究建立的筛选体系具有一定的可行性。
此外,本研究同时发现平板活性较低的JC01菌株对多种作物的促生效果优于其它平板活性较高的细菌。因此,我们分析JC01可能存在其他促生途径。前人研究表明,植株根围直接接种PGPR后,对植物IAA、ABA、ETH等激素信号通路具有调控作用[15, 18, 31]。其中,IAA能够促进植物生长发育,而ABA、ETH对植物根系等的生长发育具有一定的抑制作用[13-14]。Ryu等的研究发现Bacillus subtilis GB03可以分泌具有促生作用及诱导植物产生抗病性的VOC,且其促生功能与细胞分裂素(Cytokinin)信号途径有关[16]。本研究发现Bacillus subtilis JC01能够产生具有促生效应的VOC成分,通过检测番茄内源激素IAA、ABA以及ETH信号通路关键基因的表达水平发现,JC01所产生的VOC能够增强IAA关键基因的表达,提高IAA信号水平,进而促进番茄生长;同时下调ABA及ETH关键基因的表达,降低ABA、ETH信号水平,减弱其对番茄生长的抑制作用,从而同样达到促生目的。
本研究共筛选到了4株促生效果较好的PGPR,其田间应用效果尚需进一步试验验证。在常规细菌制剂中,单一菌剂的促生效果弱于复合菌剂[32]。因此,我们将进一步探究上述4株PGPR复配菌剂的促生作用,以期筛选出对多种作物均具有较好促生效果的复合菌剂。
| [1] | Feng YH, Yao T, Long RJ. Research progress of phosphate-dissolving microorganisms in plant rhizosphere[J]. Grassland and Turf , 2003 (1) : 3–5. (in chinese) 冯月红, 姚拓, 龙瑞军. 土壤解磷菌研究进展[J]. 草原与草坪 , 2003 (1) : 3–5. |
| [2] | Meng Y, Xu FH, Meng QY, et al. Current application status and prospect of microbiological fertilizer in China[J]. Chinese Agricultural Science Bulletin , 2008, 24 (6) : 276–283. (in chinese) 孟瑶, 徐凤花, 孟庆有, 等. 中国微生物肥料研究及应用进展[J]. 中国农学通报 , 2008, 24 (6) : 276–283. |
| [3] | Jiang CL, Xu LH. Microbial Resources[M]. Beijing: Science Press, 1997: 151 . (in chinese) 姜成林, 徐丽华. 微生物资源学[M]. 北京: 科学出版社, 1997: 151 . |
| [4] | Lindsay WL, Schwab AP. The chemistry of iron in soils and its availability to plants[J]. Journal of Plant Nutrition , 1982, 5 (4/7) : 821–840. |
| [5] | Kloepper JW, Leong J, Teintze M, et al. Enhanced plant growth by siderophores produced by plant growth-promoting rhizobacteria[J]. Nature , 1980, 286 (5776) : 885–886. DOI:10.1038/286885a0 |
| [6] | Bhattacharyya PN, Jha DK. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture[J]. World Journal of Microbiology and Biotechnology , 2012, 28 (4) : 1327–1350. DOI:10.1007/s11274-011-0979-9 |
| [7] | Haiyambo DH, Chimwamurombe PM, Reinhold-Hurek B. Isolation and screening of rhizosphere bacteria from grasses in east Kavango Region of Namibia for plant growth promoting characteristics[J]. Current Microbiology , 2015, 71 (5) : 566–571. DOI:10.1007/s00284-015-0886-7 |
| [8] | Ahmad F, Ahmad I, Khan MS. Screening of free-living rhizospheric bacteria for their multiple plant growth promoting activities[J]. Microbiological Research , 2008, 163 (2) : 173–181. DOI:10.1016/j.micres.2006.04.001 |
| [9] | Thokchom E, Kalita MC, Talukdar NC. Isolation, screening, characterization, and selection of superior rhizobacterial strains as bioinoculants for seedling emergence and growth promotion of Mandarin orange (Citrus reticulata Blanco)[J]. Canadian Journal of Microbiology , 2014, 60 (2) : 85–92. DOI:10.1139/cjm-2013-0573 |
| [10] | Kuklinsky-Sobral J, Araújo WL, Mendes R, et al. Isolation and characterization of soybean-associated bacteria and their potential for plant growth promotion[J]. Environmental Microbiology , 2004, 6 (12) : 1244–1251. DOI:10.1111/emi.2004.6.issue-12 |
| [11] | Rodríguez H, Fraga R. Phosphate solubilizing bacteria and their role in plant growth promotion[J]. Biotechnology Advances , 1999, 17 (4/5) : 319–339. |
| [12] | Yu XM, Zheng FC. The development and utilization of siderophore on plant growth promotion and plant disease control[J]. Chinese Agricultural Science Bulletin , 2007, 23 (8) : 507–510. (in chinese) 余贤美, 郑服丛. 嗜铁素在促进植物生长及病害防治等方面的应用[J]. 中国农学通报 , 2007, 23 (8) : 507–510. |
| [13] | Bal HB, Das S, Dangar TK, et al. ACC deaminase and IAA producing growth promoting bacteria from the rhizosphere soil of tropical rice plants[J]. Journal of Basic Microbiology , 2013, 53 (12) : 972–984. DOI:10.1002/jobm.v53.12 |
| [14] | Wei JF, Zhao X, Zhang X. Analysis on ABA regulation of pant roots compensative growth[J]. Journal of Anhui Agricultural Sciences , 2009, 37 (26) : 12403–12405. (in chinese) 魏金凤, 赵翔, 张骁. 脱落酸调节植物根系补偿生长机制分析[J]. 安徽农业科学 , 2009, 37 (26) : 12403–12405. |
| [15] | Huang XF, Zhou D, Guo J, et al. Bacillus spp. from rainforest soil promote plant growth under limited nitrogen conditions[J]. Journal of Applied Microbiology , 2015, 118 (3) : 672–684. DOI:10.1111/jam.2015.118.issue-3 |
| [16] | Ryu CM, Farag MA, Hu CH, et al. Bacterial volatiles promote growth in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America , 2003, 100 (8) : 4927–4932. DOI:10.1073/pnas.0730845100 |
| [17] | Meldau DG, Stefan M, Long HH, et al. Dimethyl disulfide produced by the naturally associated bacterium Bacillus sp. B55 promotes Nicotiana attenuata growth by enhancing sulfur nutrition[J]. The Plant Cell , 2013, 25 (7) : 2731–2747. DOI:10.1105/tpc.113.114744 |
| [18] | Zhang HM, Kim MS, Krishnamachari V, et al. Rhizobacterial volatile emissions regulate auxin homeostasis and cell expansion in Arabidopsis[J]. Planta , 2007, 226 (4) : 839–851. DOI:10.1007/s00425-007-0530-2 |
| [19] | Wang KP, Zheng Y, Chu GY, et al. Screening of bacterial strains for phosphate solubilization, nitrogen fixation and IAA production and their promotive effects on plant growth[J]. Jiangsu Journal of Agricultural Sciences , 2013, 29 (6) : 1352–1359. (in chinese) 王奎萍, 郑颖, 褚光耀, 等. 解磷、固氮、产吲哚乙酸微生物菌株的筛选及其对植物的促生效果[J]. 江苏农业学报 , 2013, 29 (6) : 1352–1359. |
| [20] | Liu XY, Fu DQ, Chen LQ, et al. Screening and identification of phosphate solubilizing bacteria in the rhizosphere of camellia[J]. Guangdong Agricultural Sciences , 2015, 42 (3) : 47–50. (in chinese) 刘小玉, 付登强, 陈良秋, 等. 油茶根际溶磷菌3-Y-08的筛选与鉴定[J]. 广东农业科学 , 2015, 42 (3) : 47–50. |
| [21] | Zheng Y, Xue QY, Xu LL, et al. A screening strategy of fungal biocontrol agents towards Verticillium wilt of cotton[J]. Biological Control , 2011, 56 (3) : 209–216. DOI:10.1016/j.biocontrol.2010.11.010 |
| [22] | Shin SH, Lim Y, Lee SE, et al. CAS agar diffusion assay for the measurement of siderophores in biological fluids[J]. Journal of Microbiological Methods , 2001, 44 (1) : 89–95. DOI:10.1016/S0167-7012(00)00229-3 |
| [23] | Li QK. Routine Analysis Method of Soil Agricultural Chemistry[M]. Beijing: Science Press, 1984: 272 -278. (in chinese) 李酋开. 土壤农业化学常规分析方法[M]. 北京: 科学出版社, 1984: 272 -278. |
| [24] | Faltin F, Lottmann J, Grosch R, et al. Strategy to select and assess antagonistic bacteria for biological control of Rhizoctonia solani[J]. Canadian Journal of Microbiology , 2004, 50 (10) : 811–820. DOI:10.1139/w04-063 |
| [25] | Wang C, Shen CM, Zheng L, et al. Isolation and screening of antagonistic bacterial strains and their biocontrol efficiency against bacterial wilt[J]. Plant Protection , 2014, 40 (2) : 43–47. (in chinese) 王超, 申成美, 郑丽, 等. 烟草青枯病生防细菌的筛选与生防效果研究[J]. 植物保护 , 2014, 40 (2) : 43–47. |
| [26] | Wu F. The study of biological control against bacterial fruit blotch by Acidovorax avenae subsp. citrulli[D]. Nanjing: Master’s Thesis of Nanjing Agricultural University, 2013(in Chinese). 武芳. 瓜类细菌性果斑病的生物防治研究[D]. 南京: 南京农业大学硕士学位论文, 2013 http://cdmd.cnki.com.cn/article/cdmd-10307-1014216768.htm |
| [27] | Wang C, Wang C, Gao YL, et al. A consortium of three plant growth-promoting rhizobacterium strains acclimates Lycopersicon esculentum and confers a better tolerance to chilling stress[J]. Journal of Plant Growth Regulation , 2016, 35 (1) : 54–64. DOI:10.1007/s00344-015-9506-9 |
| [28] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the method[J]. Methods , 2001, 25 (4) : 402–408. DOI:10.1006/meth.2001.1262 |
| [29] | Berg G, Krechel A, Ditz1 M, et al. Endophytic and ectophytic potato-associated bacterial communities differ in structure and antagonistic function against plant pathogenic fungi[J]. FEMS Microbiology Ecology , 2005, 51 (2) : 215–229. DOI:10.1016/j.femsec.2004.08.006 |
| [30] | Yang W, Xu QY, Liu HX, et al. Evaluation of biological control agents against Ralstonia wilt on ginger[J]. Biological Control , 2012, 62 (3) : 144–151. DOI:10.1016/j.biocontrol.2012.05.001 |
| [31] | Spaepen S, Vanderleyden J, Remans R. Indole-3-acetic acid in microbial and microorganism-plant signaling[J]. FEMS Microbiology Reviews , 2007, 31 (4) : 425–448. DOI:10.1111/j.1574-6976.2007.00072.x |
| [32] | Li SM. Biological control of soilborn phythophthogens including Ralstonia solanacearun, Phythophthora capsici, and Meloidogyne incognita on pepper and tomato[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University, 2008(in Chinese). 李师默. 辣椒和番茄青枯病等土传病害的生物防治研究[D]. 南京: 南京农业大学博士学位论文, 2008 http://cdmd.cnki.com.cn/article/cdmd-10307-1012478744.htm |
 2016, Vol. 43
2016, Vol. 43