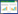扩展功能
文章信息
- 王明轩, 陈海琴, 顾震南, 陈卫, 陈永泉
- WANG Ming-Xuan, CHEN Hai-Qin, GU Zhen-Nan, CHEN Wei, CHEN Yong-Quan
- 高山被孢霉ATCC 32222中细胞色素b5还原酶Ⅰ的克隆、表达和功能鉴定
- Expression, purification and characterization of cytochrome b5 reductase I from Mortierella alpina ATCC 32222
- 微生物学通报, 2016, 43(10): 2172-2178
- Microbiology China, 2016, 43(10): 2172-2178
- DOI: 10.13344/j.microbiol.china.160116
-
文章历史
- 收稿日期: 2016-01-30
- 接受日期: 2016-05-23
- 优先数字出版日期(www.cnki.net): 2016-06-06
细胞色素b5还原酶是内质网上一种以黄素腺嘌呤二核苷酸(FAD)为辅酶的黄素蛋白,它在脂肪酸脱饱和反应电子传递链中将电子从NADH传递到细胞色素b5(图 1)。在20世纪70年代,Strittmatter等分离纯化了哺乳动物体内的细胞色素b5还原酶,在体外构建了脂肪酸脱饱和反应的电子传递链[1-3]。在植物拟南芥体内,细胞色素b5还原酶不仅参与到油酸和亚油酸的脱饱和反应中,也在花粉的形成和种子的成熟中起到重要作用[4]。而酵母中的细胞色素b5还原酶则被发现可以在固醇类物质的合成中作为P450酶类的电子供体[5-6]。
|
| 图 1 脂肪酸脱饱和反应电子传递链 Figure 1 Fatty acid desaturation electron transportation chain |
|
|
高山被孢霉(Mortierella alpina)是一种高产脂质的真菌,其既可以通过ω6脂肪酸脱饱和途径生产花生四烯酸(ARA),又可以通过ω3脂肪酸脱饱和途径生产二十碳五烯酸(EPA),是脂质生物化学基础研究的重要模式菌[7-9]。目前,针对高山被孢霉中各种脂肪酸脱饱和酶的研究已经很广泛,但对于脂肪酸脱饱和反应机理的研究国际上鲜有报道[10-12]。细胞色素b5还原酶是脂肪酸脱饱和电子传递链中第一个电子接受体,在脂肪酸脱饱和反应中起着重要作用。Sakuradani等克隆和鉴定了高山被孢霉1S-4中的细胞色素b5还原酶,但其与细胞色素b5相互作用的机制尚不清楚[13]。在本课题组已完成测序的高山被孢霉ATCC 32222基因组中发现存在4个潜在的细胞色素b5还原酶编码基因 (命名为细胞色素b5还原酶Ⅰ-Ⅳ)[14]。因此,本文选择高山被孢霉ATCC 32222中细胞色素b5还原酶基因Ⅰ进行表达纯化和活性测定,并将表达纯化人源的细胞色素b5与其进行相互作用。该菌株中细胞色素b5还原酶的功能鉴定和细胞色素b5的相互作用将为产油真菌高山被孢霉中脂肪酸脱饱和反应的机理研究奠定基础。
1 材料与方法 1.1 菌株和质粒、培养基大肠杆菌(Escherichia coli) BL21(DE3)为实验室菌种库提供;高山被孢霉(M. alpina ATCC 32222)购于美国标准生物品收藏中心,由本实验室菌种库保藏,并已对其完成基因组测序[14]。表达载体pET-15b购自Novagen。LB培养基(g/L):蛋白胨10.0,酵母抽提物5.0,NaCl 10.0,pH 7.5,琼脂粉15.0 (固体培养基)。需要时加入氨苄青霉素 10 mg/L。
1.2 主要试剂和仪器钴离子亲和柱,阴、阳离子交换柱,链霉亲和素琼脂糖,分子排阻柱HiLoad 16/60 Superdex 200,Vivaspin浓缩管均购自GE Healthcare公司;SanPrep柱式质粒DNA小量抽提试剂盒购自生工生物工程(上海)股份有限公司;2,6-二氯靛酚钠(DCIP)、还原型烟酰胺腺嘌呤二核苷酸(NADH)、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH),黄素腺嘌呤二核苷酸(FAD)等其它试剂均购自Sigma;细胞破碎仪EmulsiFlex-C3购自Avestin 公司。
1.3 实验方法1.3.1 表达载体的构建:高山被孢霉细胞色素b5还原酶Ⅰ和人可溶性细胞色素b5基因均由Genscript公司合成,密码子优化后连接至表达载体pET-15b,目的基因N端连有6个组氨酸作为纯化标签。
1.3.2 细胞色素b5还原酶Ⅰ和细胞色素b5在大肠杆菌中的表达和纯化:表达质粒的转化和转化子的筛选均按照《分子克隆实验指南》进行。筛选的转化子接种于50 mL (250 mL摇瓶)含有氨苄青霉素的LB液体培养基中,37 ℃、220 r/min振荡培养 15 h,使用此种子液按1%的接种量接种于1 L (2.8 L摇瓶)含有氨苄青霉素的LB液体培养基中继续培养。当OD600到达0.6-0.8时,置于4 ℃冷 却,加入1 mmol/L异丙基硫代半乳糖苷(IPTG) 24 ℃诱导4 h。收集的菌体于-80 ℃冻藏。菌体被重悬于150 mL缓冲液(20 mmol/L pH 7.9 Hepes,500 mmol/L KCl,5 mmol/L咪唑,0.1% Triton X-100,10%甘油,蛋白酶抑制剂苯甲基磺酰氟(PMSF)和benzamidine各0.1 mmol/L,1 mmol/L MgCl2,40 mg/L DNase Ⅰ)。在重悬细胞色素b5还原酶Ⅰ细胞时加入0.2 mmol/L FAD。重悬后的细胞用 EmulsiFlex-C3细胞破碎仪破碎,破碎液上清结合于10 mL钴离子柱子,然后用3倍柱体积的无甘油缓冲液(20 mmol/L pH 7.9 Hepes,500 mmol/L KCl,5 mmol/L咪唑,0.1% Triton X-100)洗涤。目的蛋白用5-500 mmol/L浓度的咪唑梯度洗脱。洗脱后的样品放入20 mmol/L pH 7.5 Tris缓冲液过夜透 析,其中细胞色素b5还原酶Ⅰ样品中加入0.2 U/mg的凝血酶,凝血酶利用链霉亲和素琼脂糖去除。随后,细胞色素b5还原酶Ⅰ样品、细胞色素b5样品分别结合于阴、阳离子交换柱,用0-1 mmol/L NaCl洗脱。最后通过20 mmol/L pH 7.5 Hepes,100 mmol/L NaCl预平衡的分子排阻柱子HiLoad 16/60 Superdex 200进一步纯化。对于细胞色素 b5,在分子排阻前加入3倍分子量的氯化血红素。含有目的蛋白的流出组分用Vivaspin浓缩管进行浓缩。
1.3.3 细胞色素b5还原酶Ⅰ的活性测定:纯化的高山被孢霉细胞色素b5还原酶Ⅰ的活性测定在 100 mmol/L pH 7.5的磷酸钾缓冲液24 ℃下进行。反应体系体积为800 μL,其中含有50 nmol/L纯化后的蛋白质,40 μmol/L DCIP,1 mmol/L NADH。反应检测DCIP在600 nm处的吸光值变化。酶活单位(1 U)定义为每摩尔蛋白质每分钟消耗DCIP的摩尔量。
1.3.4 细胞色素b5还原酶Ⅰ与细胞色素b5的相互作用:纯化的高山被孢霉细胞色素b5还原酶Ⅰ与纯化的细胞色素b5的相互作用在100 mmol/L Hepes pH 7.5、150 mmol/L NaCl的缓冲液,室温下进行。 200 mL缓冲液中含有0.25 μmol/L纯化的细胞色素b5还原酶Ⅰ和5 μmol/L纯化的细胞色素b5,加入 5 μmol/L NADH开始反应。使用贝克曼DU800对反应前和反应后的样品进行波长扫描。
2 结果与分析 2.1 膜结合细胞色素b5还原酶Ⅰ穿膜区域的确定高山被孢霉中细胞色素b5还原酶Ⅰ全长298个氨基酸,其在N端有一个穿膜区域,属于膜结合类型蛋白质。Kurian等将人源的细胞色素b5还原酶成功在大肠杆菌中表达为可溶性蛋白质[15]。为了避免膜蛋白质纯化中筛选去垢剂等步骤,研究中可溶性表达方法同样被应用于膜蛋白质的表 达。如图 2所示,将高山被孢霉ATCC 32222中细胞色素b5还原酶Ⅰ的氨基酸序列与人细胞色素b5还原酶可溶性片段进行比对,结果显示,在目的蛋白质N端鉴定出长度为42个氨基酸的片段,推测为该蛋白质穿膜区域。因此将从第43个氨基酸Phe开始对应的DNA序列克隆至含有6xHis标签的pET-15b载体,转入大肠杆菌BL21(DE3)中进行表达试验。

|
| 图 2 高山被孢霉ATCC 32222膜结合细胞色素b5还原酶Ⅰ (MaCytb5R)与人可溶性细胞色素b5还原酶(hCytb5R)的氨基酸序列比对结果 Figure 2 Sequence alignment of M. alpina ATCC 32222 membrane-bound cytochrome b5 reductase and human soluble cytochrome b5 reductase |
|
|
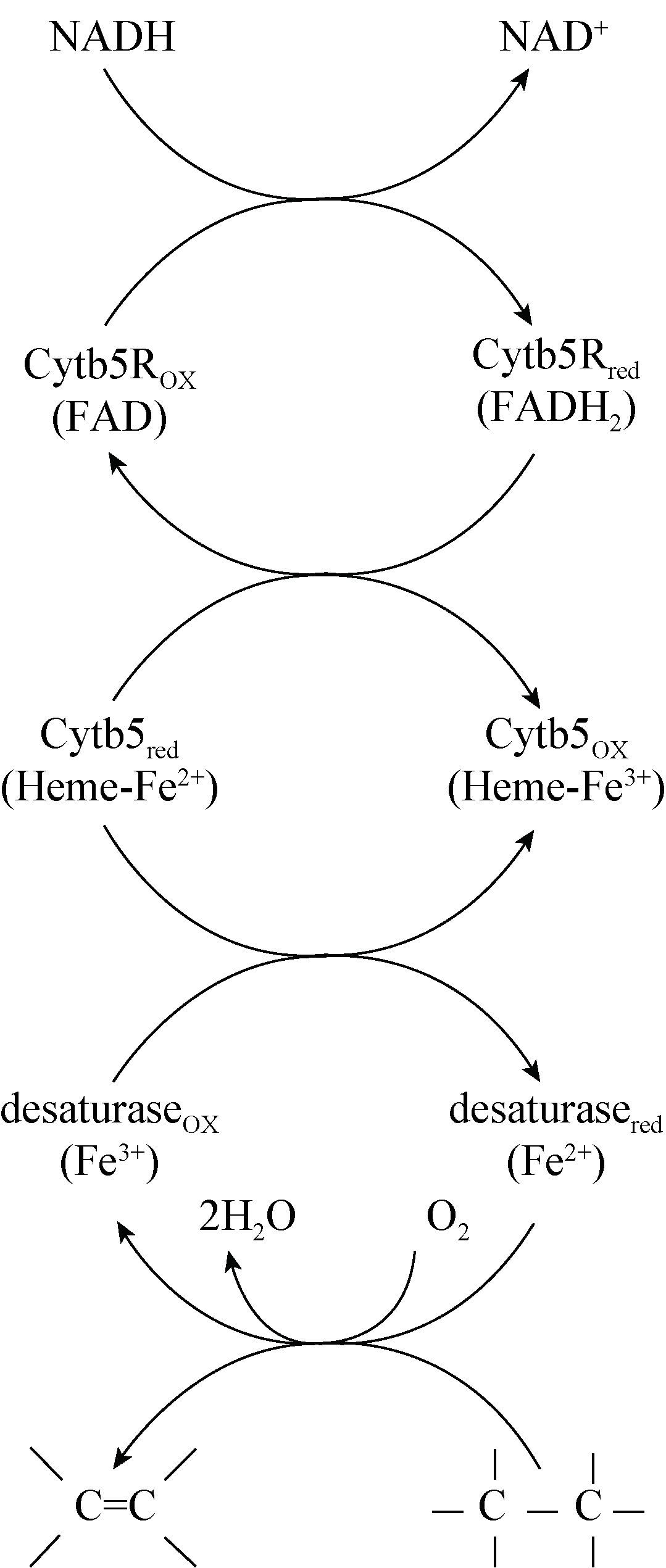
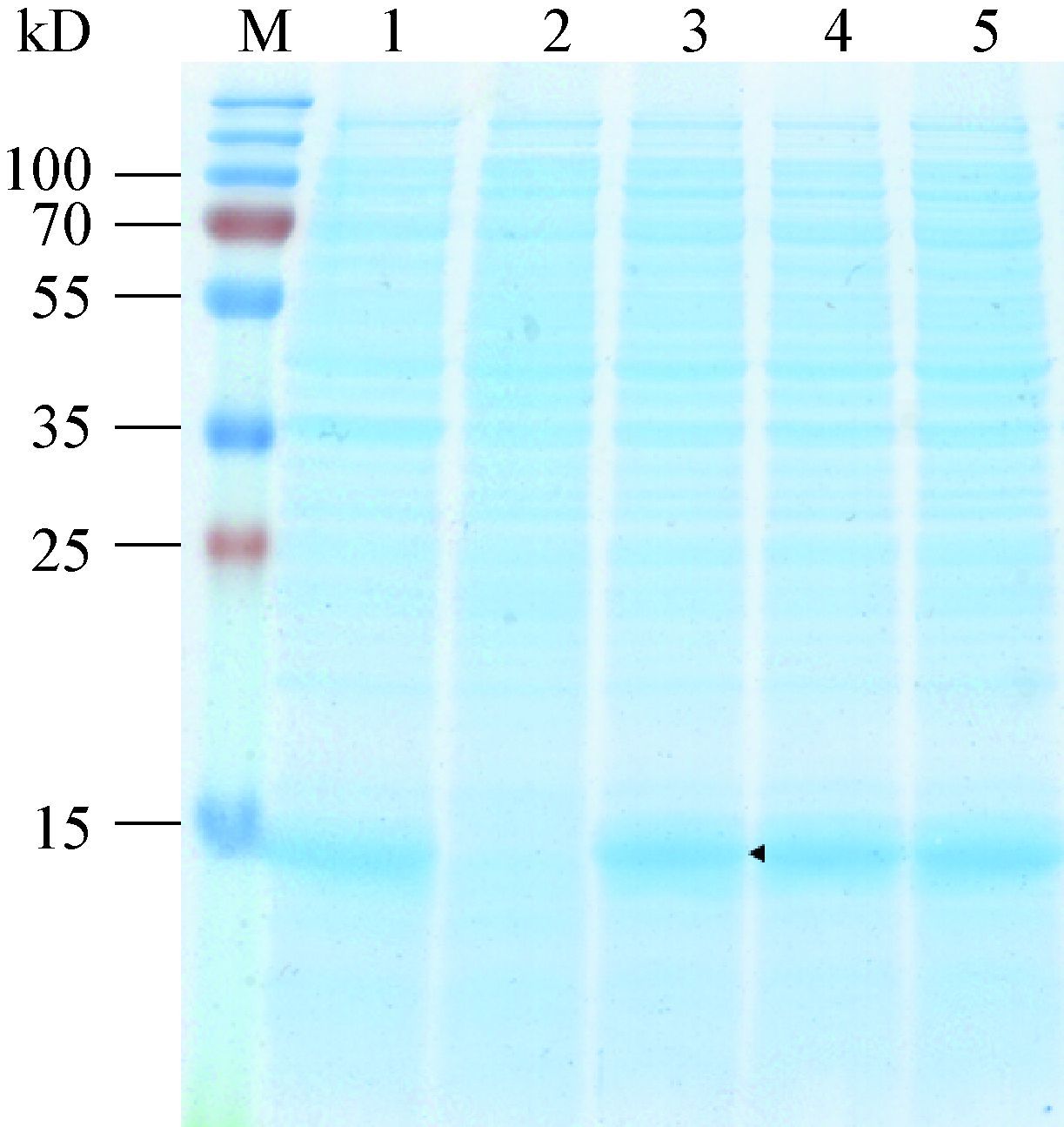
表达试验中,通过分析转化子诱导后的细胞破碎液上清对蛋白质可溶性进行判断。如图 3所 示,结果表明,与诱导前阴性对照相比,诱导后样品在30 kD处有明显条带,其大小与目的蛋白理论分子量接近,判断为细胞色素b5还原酶Ⅰ可溶性片段。因此高山被孢霉ATCC 32222细胞色素b5还原酶Ⅰ被成功表达为可溶性蛋白质,且挑取的5个转化子表达量无显著差异。
|
| 图 3 细胞色素b5还原酶Ⅰ的SDS-PAGE分析 Figure 3 SDS-PAGE analysis of the cytochrome b5 reductase Ⅰ 注:M:Marker;1:诱导前的转化子1;2-6:诱导后的转化子1-5. Note:M: Marker; 1: transformant 1 before induction; 2-6: transformant 1-5 after induction. |
|
|
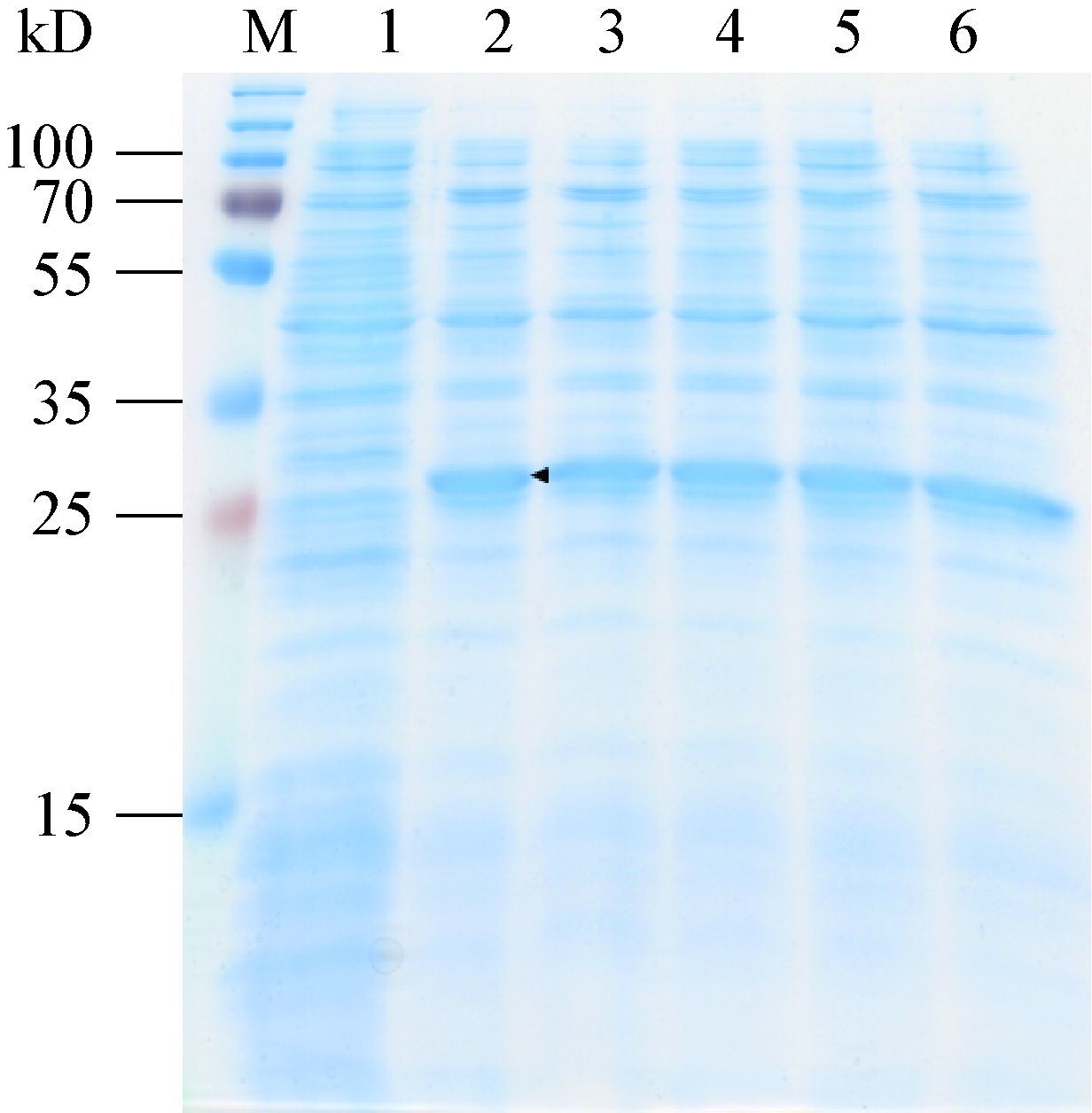
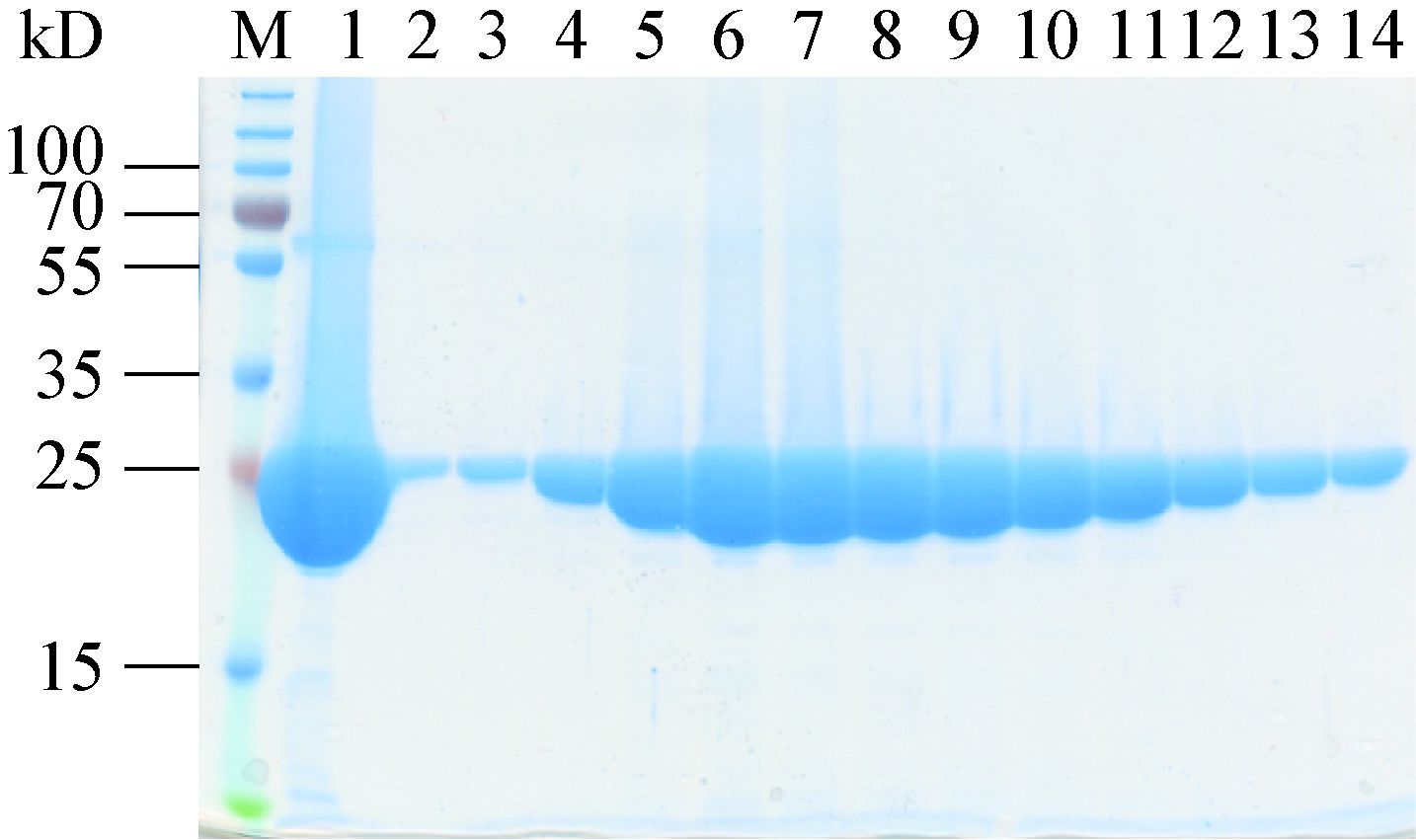
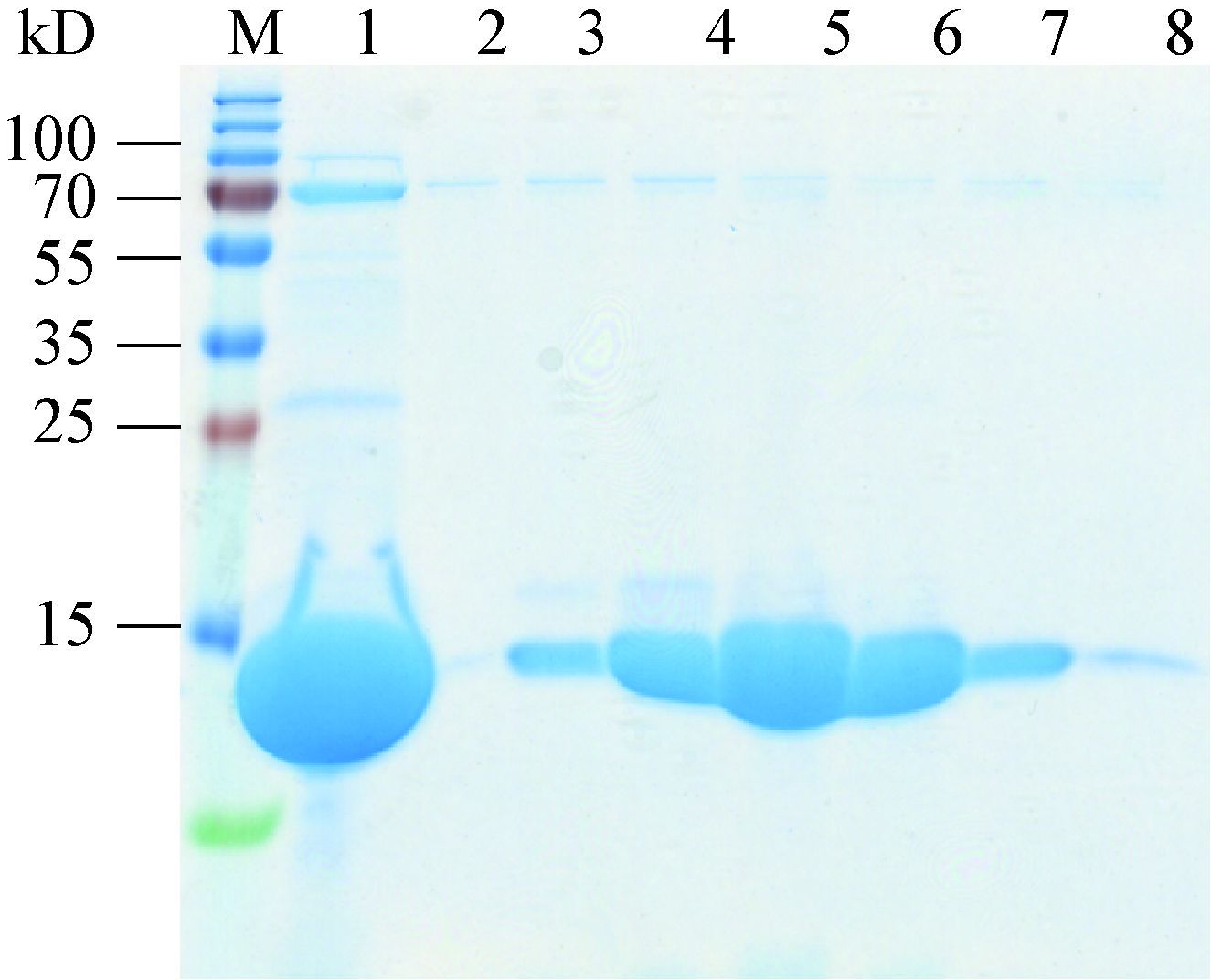
细胞色素b5还原酶是一种以FAD为辅酶的黄素蛋白,为了保证纯化后的蛋白质含有足够的辅酶,在细胞破碎时加入两倍蛋白质摩尔量的 FAD。利用His标签将蛋白质结合于钴离子柱子进行亲和层析,样品透析时通过加入凝血酶对his标签进行切除。根据目的蛋白理论pI值8.90,使用阳离子交换进一步纯化。最终将样品通过分子排阻色谱进一步提高蛋白质纯度和检验纯化产物均一性。纯化结果如图 4所示,分子排阻色谱将样品中55-70 kD的杂蛋白质去除,由于目的蛋白分子量较小,于杂蛋白质后流出,被收集于 第B28−52号组分收集管。目的蛋白纯度>99%,且产物均一。浓缩后产物浓度为46.5 g/L,蛋白质呈亮黄色,表明纯化后蛋白质含有足量辅助因子FAD。
|
| 图 4 细胞色素b5还原酶Ⅰ的分子排阻色谱组分SDS-PAGE分析 Figure 4 SDS-PAGE analysis of gel filtration fractions of the cytochrome b5reductase Ⅰ 注:M:Marker;1:分子排阻色谱前样品;2-14:流出组分B28-52. Note:M: Marker; 1: sample loaded; 2-14: fractions B28-52. |
|
|
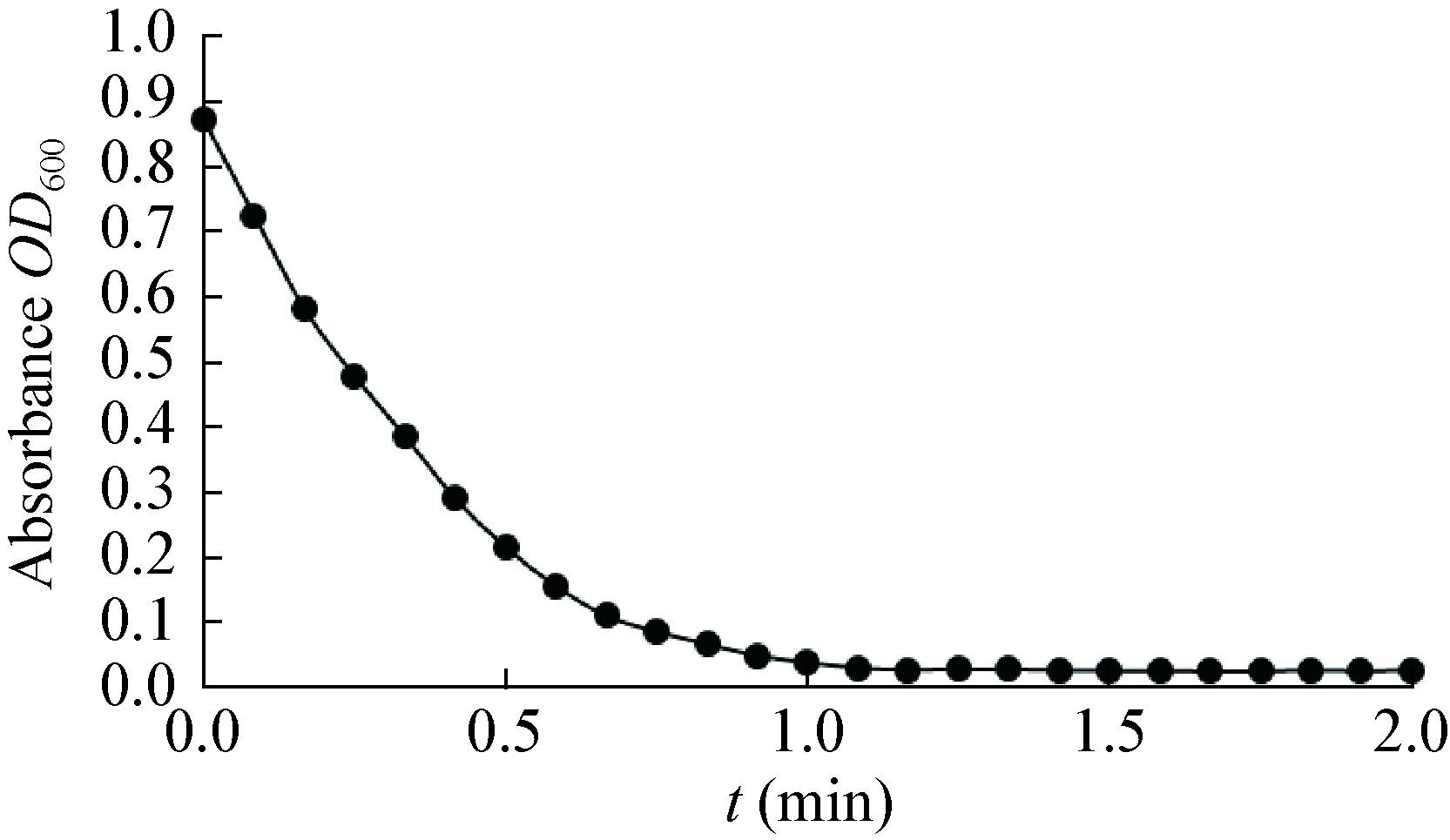
在NADH或NADPH存在条件下,细胞色素b5还原酶在体外可以还原底物DCIP[13, 16]。为了研究高山被孢霉ATCC 32222细胞色素b5还原酶Ⅰ对NADH和NADPH的偏好性,分别使用NADH和NADPH为还原力,测定细胞色素b5还原酶Ⅰ的活性。测定结果如图 5所示,NADH为足量时,细胞色素b5还原酶中的辅助因子FAD被还原为 FADH2。当底物浓度为40 μmol/L时,DCIP被还 原,其在600 nm处的吸光值快速下降,在2 min内降为0。经计算,其活性为564.57 U。另一方 面,结果表明N端穿膜区域去除后,蛋白质具有活性。
|
| 图 5 细胞色素b5还原酶Ⅰ在NADH条件下的活性 Figure 5 Activity of the cytochrome b5 reductase Ⅰ using NADH as reductant |
|
|
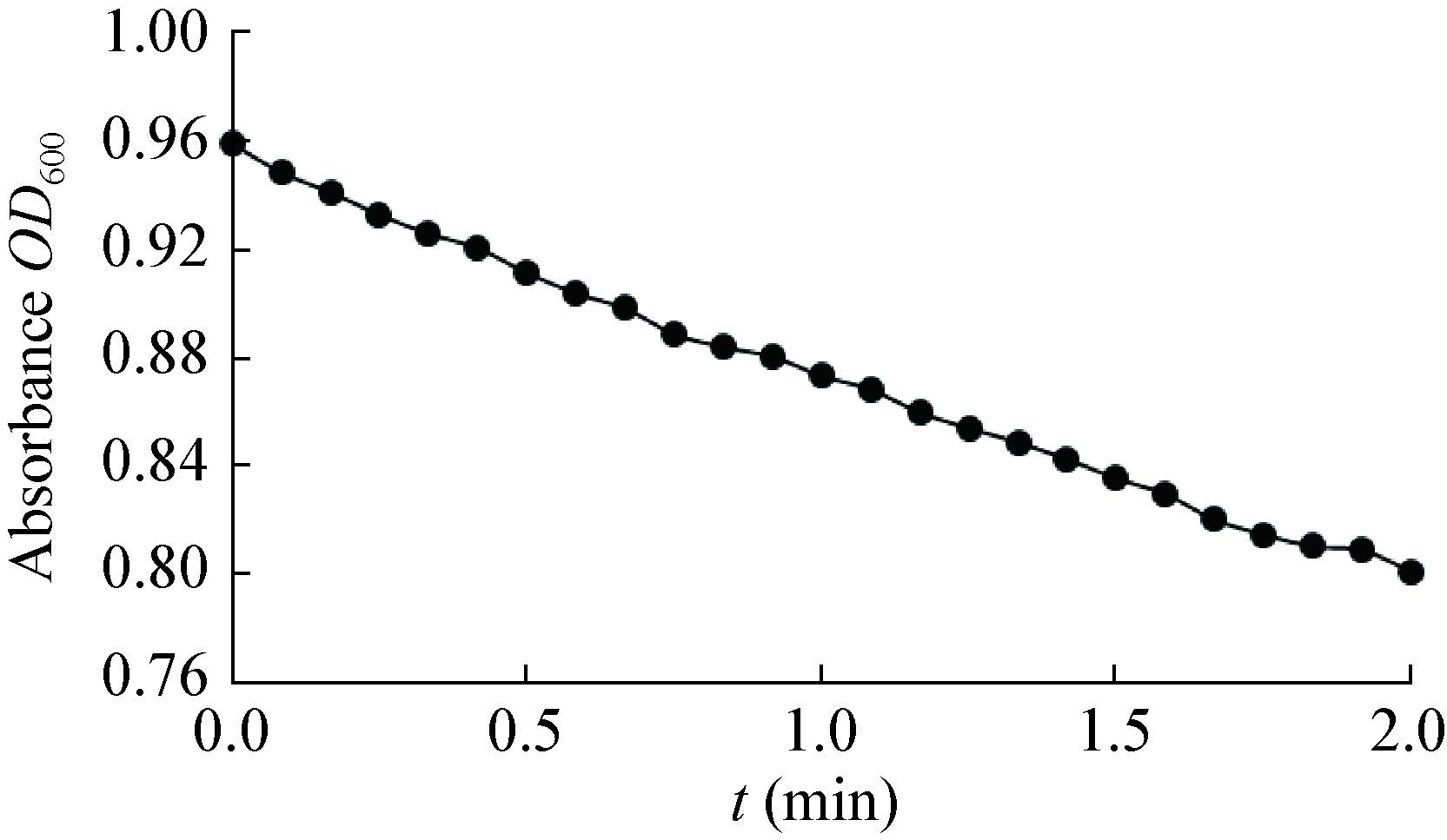
为了比较高山被孢霉ATCC 32222细胞色素b5还原酶Ⅰ在不同还原力条件下的活性,在同样浓度的NADPH和底物DCIP条件下对细胞色素b5还原酶Ⅰ的活性进行测定。测定结果如图 6所示,DCIP在2 min内不能被完全还原,且反应速率显著下 降。经计算,NADPH条件下的活性为51.97 U,反应速率为NADH条件下的十分之一,该细胞色素b5还原酶显示出了对还原力来源的偏好性。因此,纯化后的高山被孢霉ATCC 32222细胞色素b5还原酶Ⅰ偏好NADH为电子供体。
|
| 图 6 细胞色素b5还原酶Ⅰ在NADPH条件下的活性 Figure 6 Activity of the cytochrome b5 reductase Ⅰ using NADPH as reductant |
|
|
人来源的可溶性细胞色素b5同样在大肠杆菌中表达和纯化,用来考察纯化后的高山被孢霉ATCC 32222细胞色素b5还原酶Ⅰ的功能。该细胞色素b5的DNA序列由Novagen公司合成并连接至pET-15b载体,转入大肠杆菌BL21(DE3)中进行表达实验。表达结果如图 7所示,通过与诱导前阴性对照比较发现,诱导后样品在14 kD处有明显条 带,其大小与目的蛋白质理论分子量接近,因此细胞色素b5被成功表达。
|
| 图 7 人细胞色素b5的SDS-PAGE分析 Figure 7 SDS-PAGE analysis of human cytochrome b5 注:M:Marker;1:转化子1全细胞样品;2:诱导前转化子1;3-5:诱导后转化子1-3. Note:M: Marker; 1: whole cell sample of transformant 1; 2: transformant 1 before induction; 3-5: transformant 1-3 after induction. |
|
|
细胞色素b5的纯化同样利用his标签与钴离子柱的亲和作用和离子交换进行纯化,而与细胞色素b5还原酶Ⅰ相比,此蛋白质有较低的理论pI值5.81,因此采用阴离子交换方法。流出组分最终通过分子排阻色谱进一步提高纯度和检验产物均一 性。细胞色素b5是一种以血红素为辅酶的血红素蛋白,辅酶对纯化后蛋白质的活性至关重要,因此在通过分子排阻色谱前加入氯化血红素孵育,并通过分子排阻色谱将未结合的游离血红素分 离。纯化结果如图 8显示,分子排阻色谱将 25-35 kD的杂蛋白质分离,由于目的蛋白质分子量较小,于杂蛋白质后流出,被收集于第B57-82号组分管。目的蛋白质纯度>99%,且产物均一。浓缩后产物浓度为5.3 g/L,蛋白质呈深红色,表明细胞色素b5含有足量辅酶。
|
| 图 8 细胞色素b5的分子排阻色谱组分SDS-PAGE分析 Figure 8 SDS-PAGE analysis of gel filtration fractions of the cytochrome b5 注:M: Marker;1:分子排阻色谱前样品;2-8:流出组分B57-82. Note:M: Marker; 1: sample loaded; 2-8: fractions B57-82. |
|
|
纯化后细胞色素b5的辅酶血红素卟啉环中含有正三价铁离子,蛋白质处于氧化态。如图 9波长扫描结果显示,氧化态的细胞色素b5在412 nm处有较强吸收。当加入NADH和细胞色素b5还原酶Ⅰ后,还原态的细胞色素b5还原酶Ⅰ将电子传递给细胞色素b5,细胞色素b5血红素中的三价铁离子被还原成二价,蛋白质变成还原态。波长扫描显示血红素在412 nm的吸收峰偏移至422 nm处,并且在521 nm和554 nm处吸收增加。这与文献报道的现象一致[17-18],因此该实验证实纯化的高山被孢霉ATCC 32222细胞色素b5还原酶Ⅰ在体外能与人细胞色素b5相互作用。

|
| 图 9 高山被孢霉ATCC 32222细胞色素b5还原酶Ⅰ与细胞色素b5的相互作用 Figure 9 Interactions between M. alpina ATCC 32222 cytochrome b5 reductuase Ⅰ and human cytochrome b5 |
|
|
经实验验证产脂真菌高山被孢霉ATCC 32222中的细胞色素b5还原酶Ⅰ基因编码的是一种NADH-细胞色素b5还原酶,体外实验证实该细胞色素b5还原酶能够与细胞色素b5相互作用,将其辅助因子血红素还原为亚铁血红素。高山被孢霉ATCC 32222中的细 胞色素b5还原酶Ⅰ能够将电子传递给细胞色素b5,有能力为脂肪酸脱饱和反应提供还原力。这为产脂真菌高山被孢霉ATCC 32222中脂肪酸脱饱和反应的机理研究奠定了基础。
| [1] | Enoch HG, Catala A, Strittmatter P. Mechanism of rat liver microsomal stearyl-CoA desaturase[J]. The Journal of Biological Chemistry , 1976, 251 (16) : 5095–5103. |
| [2] | Strittmatter P, Rogers MJ, Spatz L. The binding of cytochrome b5 to liver microsomes[J]. The Journal of Biological Chemistry , 1972, 247 (22) : 7188–7194. |
| [3] | Strittmatter P, Spatz L, Corcoran D, et al. Purification and properties of rat liver microsomal stearyl coenzyme A desaturase[J]. Proceedings of the National Academy of Sciences of the United States of America , 1974, 71 (11) : 4565–4569. DOI:10.1073/pnas.71.11.4565 |
| [4] | Wayne LL, Wallis JG, Kumar R, et al. Cytochrome b5 reductase encoded by CBR1 is essential for a functional male gametophyte in Arabidopsis[J]. The Plant Cell , 2013, 25 (8) : 3052–3066. DOI:10.1105/tpc.113.113324 |
| [5] | Gutiérrez MS, Rojas MC, Sepúlveda D, et al. Molecular characterization and functional analysis of cytochrome b5 reductase (CBR) encoding genes from the carotenogenic yeast Xanthophyllomyces dendrorhous[J]. PLoS One , 2015, 10 (10) : e0140424. DOI:10.1371/journal.pone.0140424 |
| [6] | Lamb DC, Kelly DE, Manning NJ, et al. Biodiversity of the P450 catalytic cycle: yeast cytochrome b5/NADH cytochrome b5 reductase complex efficiently drives the entire sterol 14-demethylation (CYP51) reaction[J]. FEBS Letters , 1999, 462 (3) : 283–288. DOI:10.1016/S0014-5793(99)01548-3 |
| [7] | Shinmen Y, Shimizu S, Akimoto K, et al. Production of arachidonic acid by Mortierella fungi[J]. Applied Microbiology and Biotechnology , 1989, 31 (1) : 11–16. |
| [8] | Shimiziu S, Kawashima H, Shinmen Y, et al. Production of eicosapentaenoic acid by Mortierella fungi[J]. Journal of the American Oil Chemists' Society , 1988, 65 (9) : 1455–1459. DOI:10.1007/BF02898307 |
| [9] | Sakuradani E, Ando A, Shimizu S, et al. Metabolic engineering for the production of polyunsaturated fatty acids by oleaginous fungus Mortierella alpina 1S-4[J]. Journal of Bioscience and Bioengineering , 2013, 116 (4) : 417–422. DOI:10.1016/j.jbiosc.2013.04.008 |
| [10] | Sakuradani E, Abe T, Iguchi K, et al. A novel fungal ω3-desaturase with wide substrate specificity from arachidonic acid-producing Mortierella alpina 1S-4[J]. Applied Microbiology and Biotechnology , 2005, 66 (6) : 648–654. DOI:10.1007/s00253-004-1760-x |
| [11] | Huang YS, Chaudhary S, Thurmond JM, et al. Cloning of Δ12- and Δ6-desaturases from Mortierella alpina and recombinant production of γ-linolenic acid in Saccharomyces cerevisiae[J]. Lipids , 1999, 34 (7) : 649–659. DOI:10.1007/s11745-999-0410-8 |
| [12] | Wongwathanarat P, Michaelson LV, Carter AT, et al. Two fatty acid Δ9-desaturase genes, ole1 and ole2, from Mortierella alpina complement the yeast ole1 mutation[J]. Microbiology , 1999, 145 (10) : 2939–2946. DOI:10.1099/00221287-145-10-2939 |
| [13] | Sakuradani E, Kobayashi M, Shimizu S. Identification of an NADH-cytochrome b5 reductase gene from an arachidonic acid-producing fungus, Mortierella alpina 1S-4, by sequencing of the encoding cDNA and heterologous expression in a fungus, Aspergillus oryzae[J]. Applied and Environmental Microbiology , 1999, 65 (9) : 3873–3879. |
| [14] | Wang L, Chen W, Feng Y, et al. Genome characterization of the oleaginous fungus Mortierella alpina[J]. PLoS One , 2011, 6 (12) : e28319. DOI:10.1371/journal.pone.0028319 |
| [15] | Kurian JR, Bajad SU, Miller JK, et al. NADH cytochrome b5 reductase and cytochrome b5 catalyze the microsomal reduction of xenobiotic hydroxylamines and amidoximes in humans[J]. Journal of Pharmacology and Experimental Therapeutics , 2004, 311 (3) : 1171–1178. DOI:10.1124/jpet.104.072389 |
| [16] | Wang Y, Wu YS, Lan FH, et al. Expression and purification of wild and mutant type NADH cytochrome b5 reductase in E. coli[J]. Chinese Journal of Biochemistry and Molecular Biology , 2000, 16 (4) : 452–457. (in chinese) 王瑶, 吴玉水, 兰风华, 等. NADH-细胞色素b5还原酶在大肠杆菌中的表达及其产物的纯化[J]. 中国生物化学与分子生物学报 , 2000, 16 (4) : 452–457. |
| [17] | Holmans PL, Shet MS, Martin-Wixtrom CA, et al. The high-level expression in Escherichia coli of the membrane-bound form of human and rat cytochrome b5 and studies on their mechanism of function[J]. Archives of Biochemistry and Biophysics , 1994, 312 (2) : 554–565. DOI:10.1006/abbi.1994.1345 |
| [18] | Mulrooney SB, Waskell L. High-level expression in Escherichia coli and purification of the membrane-bound form of cytochrome b5[J]. Protein Expression and Purification , 2000, 19 (1) : 173–178. DOI:10.1006/prep.2000.1228 |
 2016, Vol. 43
2016, Vol. 43