扩展功能
文章信息
- 杨雅琳, 赵翀, 廖萍, 张瀚能, 张琴, 李艳宾, 张利莉, 赵珂
- YANG Ya-Lin, ZHAO Chong, LIAO Ping, ZHANG Han-Neng, ZHANG Qin, LI Yan-Bin, ZHANG Li-Li, ZHAO Ke
- 塔里木盆地胀果甘草内生放线菌多样性及抗菌活性分析
- Diversity and antimicrobial activity of endophyti actinobacteria from Glycyrrhizain flata Bat.
- 微生物学通报, 2016, 43(10): 2138-2147
- Microbiology China, 2016, 43(10): 2138-2147
- DOI: 10.13344/j.microbiol.china.150914
-
文章历史
- 收稿日期: 2015-11-13
- 接受日期: 2016-02-04
- 优先数字出版日期(www.cnki.net): 2016-03-07
2. 新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室 新疆 阿拉尔 843300
2. Xinjiang Production Construction Corps Key Laboratory of Protection and Utilization of Biological Resourses in Tarim Basin, Alar, Xinjiang 843300, China
植物内生菌是指在其生活史的某个阶段或全部阶段侵染健康植物并以寄生、共生等生活方式生活于植物各种组织和器官的细胞内、细胞间,其存在不会引起宿主植物外在病症的微生物[1]。放线菌作为植物内生菌的重要组成部分,是一类数量大、种类多、具有重要实用价值和开发潜力的微生物资源,迄今从微生物发现的大约12 000多种生理活性物质中,有近2/3是放线菌产生的[2],而处于特殊生境中的放线菌资源产生活性天然产物的可能性要高于一般环境[3]。
甘草为豆科(Leguminosae)甘草属(Glycyrrhiza Linn.)多年生草本植物,种类丰富、喜干燥气候、耐寒,广泛分布于新疆荒漠地区[4]。胀果甘草(Glycyrrhizain flata Bat.)是新疆塔里木盆地最具代表性的甘草种类之一,主要成分为黄酮类化合物,具有抗氧化、抗炎、抗菌、保肝、降糖、降脂、抗癌、解痉、抗抑郁、抑制艾滋病毒等多种药理作用[5]。目前国内外已对甘草的化学成分和药理作用开展了广泛的研究[6-7],但对胀果甘草内生放线菌多样性及其抗菌活性却鲜有报道。因此,本文以采集自新疆塔里木盆地野生胀果甘草为研究对象,分离内生放线菌资源并研究物种多样性,结合抗菌活性检测及功能基因筛选等方法获得具有应用前景的菌株,为寻找活性天然产物提供菌种资源。
1 材料与方法 1.1 材料1.1.1 样品采集:从塔里木盆地以棋盘式采样法采集20份野生胀果甘草,将植物样品装入无菌塑料袋,立即带回实验室。
1.1.2 主要试剂和仪器:溶菌酶、蛋白酶K、MIX、SDS、Tris、EDTA均购自上海生工生物工程有限公司;Marker、pMD19-T载体等购自宝生物工程(大连)有限公司;其余试剂均为国产分析纯试剂;聚酮类Ⅰ (PKS Ⅰ)、Ⅱ型(PKS Ⅱ)、非核糖体多肽类(NRPS)和卤代酶(Halo) 4类化合物合成基因的引物由深圳华大基因科技服务有限公司合成。PCR仪、凝胶成像系统、电泳仪购自Bio-Rad公司。
1.1.3 培养基:(1) 分离培养基:选择LNMS培养基(E1)[8]、胰蛋白胨-棉子糖培养基(E2)[9]、SCN培养基(E3)[10]、葡萄糖-天冬酰胺培养基(E4)[11]、高氏Ⅰ号培养基(E5)[12] 5种分离培养基用于甘草属植物内生放线菌的分离。为了抑制土壤中细菌和真菌的生长,每种培养基中加入胺苄青霉素(Benzylpenicillin)、K2Cr2O7作为抑菌剂,终浓度均为50 mg/L;(2) 菌株纯化、活化、保藏培养基:ISP4培养基[13];(3)拮抗指示菌培养基:LB培养基、马铃薯培养基(PDA)[12]。
1.1.4 指示菌株:黄瓜炭疽菌(Colletotrichum orbiculare)、黄瓜枯萎病菌(Cucumber fusarium)、蕃茄早疫菌(Alternaria solani)、大肠杆菌(Escherichia coli)、赤霉菌(Gibberella fujikuro)、西瓜枯萎菌(Fusarium oxyspirum)、玉米纹枯菌(Rhizoctonia solani)、枯草芽孢杆菌(Bacillus subtilis)、玉米弯孢菌(Curvularis lunata)、金黄色葡萄球菌(Staphylococcus aureus),由四川农业大学植物病理实验室提供。
1.2 胀果甘草内生放线菌分离、纯化将胀果甘草植株清洗干净,经严格的表面消毒及消毒效果检测后[13],置于无菌研钵中,加入无菌石英砂捣碎后转移至离心管中,加入5 mL磷酸缓冲液混匀,从离心管中吸取1 mL溶液到装有9 mL无菌水的试管之中,依次稀释为10-1、10-2、10-3等3个浓度梯度的组织悬液。采用热处理[14]、苯酚处理[15]、无处理[16]等3种预处理方式对稀释液进行处理,分别取预处理后的3个浓度梯度组织悬液各80 μL,涂布于分离培养基上。将涂布好的平板,放入28 ℃隔水式培养箱内培养15-30 d。待放线菌长出后,进行放线菌菌落的观察和菌落计数。ISP4培养基用于菌种的纯化,纯菌株分别保存在ISP4斜面培养基上和30%甘油水溶液中,各放置于4 ℃ 和-80 ℃保存。
1.3 菌种初步鉴定采用ISP4培养基埋片培养法,显微观察菌丝、孢子形态,肉眼观察培养特征,如气丝、基丝、产色素以及孢子丝吸水等情况[17],对分离菌株进行初步分类。
1.4 抗菌活性检测结合形态观察结果,选取36株代表菌株作为研究材料,接种于ISP4固体培养基于28 ℃培养7 d;指示真菌接种PDA培养基于28 ℃培养4 d待用;指示细菌接种于LB液体培养基,37 ℃、160 r/min培养1 d待用。
1.4.1 细菌指示菌的检测:接种细菌指示菌于装有无菌水的试管中,涡旋振荡成悬液,取80 μL菌悬液均匀涂布于LB培养基上,再用直径为5 mm的打孔器将生长良好的放线菌制成圆形琼脂块,将有菌面朝下置于距离平板中央3 cm的四个方向,于37 ℃培养1 d后,测定供试菌的抑菌圈大小,每个处理重复3次。
1.4.2 真菌指示菌的检测:采用对峙生长法对代表菌株的抗菌活性进行筛选。用5 mm的打孔器将培养好的指示真菌打制成带菌落的琼脂块,将植物病原真菌菌饼接种于PDA培养基平皿中央。之后用无菌牙签挑取同等大小的放线菌菌饼,分别放在各病原菌四个方向等距的3 cm处,做好标记,并做空白对照,重复3次。在28 ℃培养箱中培养5-7 d,测定抑菌圈大小。
1.5 几类活性物质合成相关基因的扩增采用20 μL反应体系[18],分别用PKS ⅠA (5′-TSAAGTCSAACATCGGBCA-3′)和PKS ⅠB (5′-CGCAGGTTSCSGTACCAGTA-3′)[18]、PKS ⅡA (5′-TSGCSTGCTTCGAYGCSATC-3′)和PKS ⅡB (5′-TGGAANCCGCCGAABCCGCT-3′)[19]、NRPSA (5′-GCSTACSYSATSTACACSTCSGG-3′)和NRPSB (5′-SASGTCVCCSGTSCGGTAS-3′)[20]以及HaloA (5′-TTCCCSCGSTACCA SATCGGSGAG-3′)和HaloB (5′-GSGGGATSWMCCAGWACCASCC-3′)[21] 4对引物分别对代表菌株的PKS Ⅰ、PKS Ⅱ、NRPS和卤化酶基因进行扩增。PCR条件:PKS Ⅰ:95 ℃ 5 min;95 ℃ 0.5 min,55 ℃ 2 min,72 ℃ 4 min;PKS Ⅱ:96 ℃ 2 min;96 ℃ 1 min,60 ℃ 2 min,73 ℃ 1.5 min;NRPS:95 ℃ 5 min;95 ℃ 1 min,59 ℃ 1.5 min,72 ℃ 2 min;Halo:95 ℃ 5 min; 95 ℃ 1 min,60 ℃ 1 min,72 ℃ 2 min,均35个循环。扩增产物用1%的琼脂糖凝胶电泳检测。
1.6 代表菌株DNA的提取及PCR扩增提取代表菌株DNA[22],选用细菌16S rRNA基因通用引物(8F-27F/1504R-1523R)[16],对甘草内生放线菌的16S rRNA基因进行扩增。
1.7 系统发育研究代表菌株16S rRNA基因扩增片段送往上海生工生物工程股份有限公司进行测序,测序结果在NCBI数据库中进行BLAST比对,在GenBank中寻找相似性最大的序列,用ClustalX进行比对,采用MEGA 5.0软件中Neighbor-Joining法构建系统发育树[23]。
2 结果与分析 2.1 胀果甘草内生放线菌的分离结果采用不同的预处理方法与不同的培养基,从胀果甘草中共分离获得80株放线菌。不同预处理方法对胀果甘草内生土壤放线菌的分离效果有明显影响,样品经3种方法处理后,分离到的放线菌数量由多到少依次是热处理(HX)>空白(CK)>苯酚处理(PX) (图 1A)。热处理以及空白处理的出菌率较好,苯酚处理的杂菌少,但出菌率低(图 1B)。

|
| 图 1 不同前处理下胀果甘草内生放线菌的分离 Figure 1 Isolation of endophytic actinobacteria from Glycyrrhizain flata Bat. under different pre-treatments 注:A:不同前处理下胀果甘草内生放线菌的出菌率;B:不同前处理下胀果甘草内生放线菌分菌图. 培养基:E1:LNMS;E2:胰蛋白胨-棉子糖;E3:SCN;E4:葡萄糖-天冬酰胺;E5:高氏Ⅰ号. 前处理:HX:热处理;PX:苯酚处理;CK:空白对照. Note:A: The number of endophytic actinobacteria from Glycyrrhizain flata Bat. under different pre-treatments; B: The isolating pictures of endophytic actinobacteria from Glycyrrhizain flata Bat. under different pre-treatments. Medium: E1: LNMS; E2: Tryptone-raffinose; E3: SCN; E4: Glucose-asparaginate; E5: Gause I medium. Pretreatment: HX: dry heat treatment; PX: Phenol treatment; CK: blank control. |
|
|
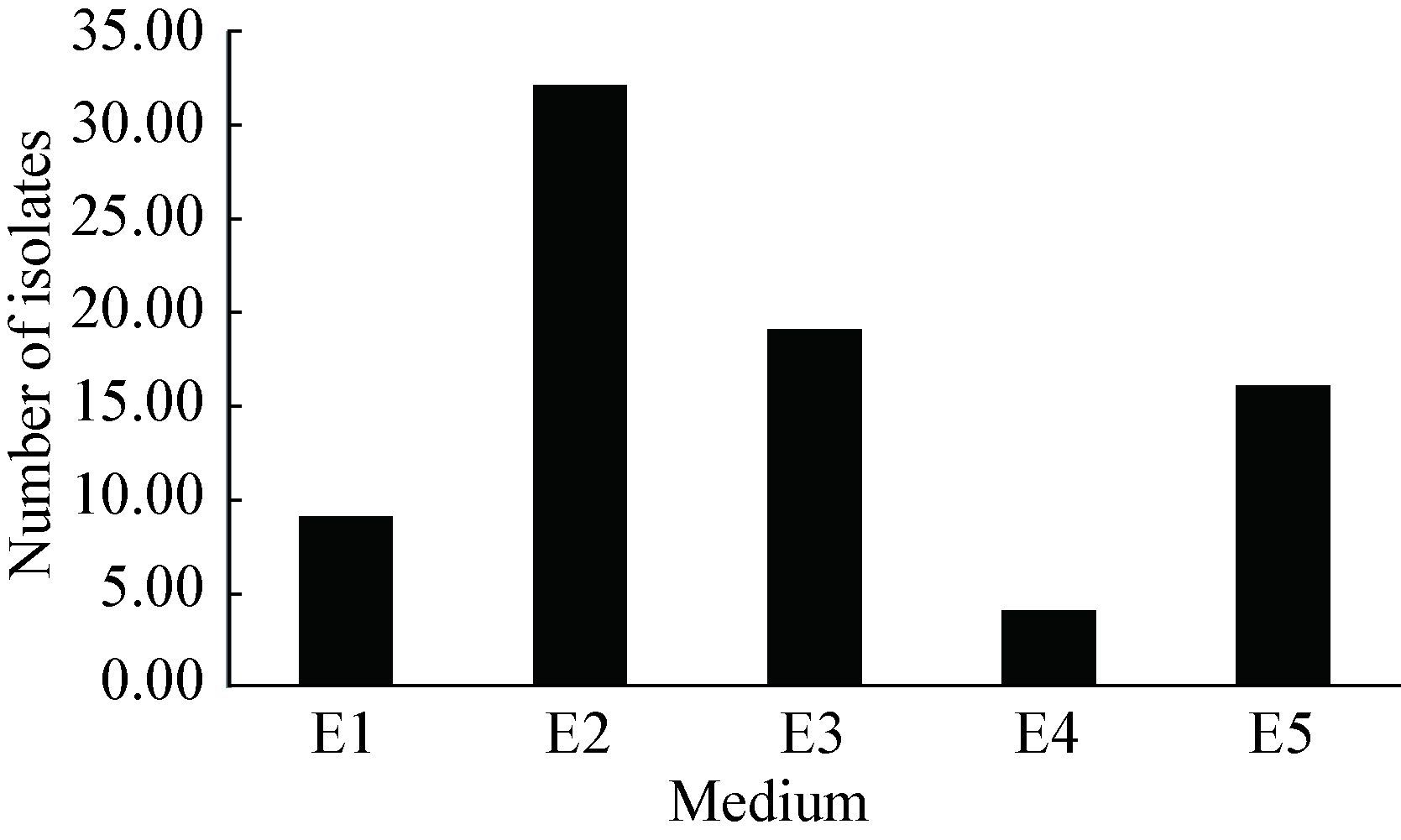
分离得到的80株内生放线菌在5种分离培养基中的分布也有明显的差异(图 2),其中E2培养基分离获得的放线菌最多,共32株;E3其次,分离获得20株;E4最少,只分离得到4株。
|
| 图 2 不同培养基分离获得的胀果甘草内生放线菌数量 Figure 2 The number of endophytic actinobacteria isolated from Glycyrrhizain flate Bat. on different media 注:E1:LNMS;E2:胰蛋白胨-棉子糖;E3:SCN;E4:葡萄糖-天冬酰胺;E5:高氏Ⅰ号. Note:E1: LNMS; E2: Tryptone-raffinose; E3: SCN; E4: Glucose-asparaginate; E5:Gause Ⅰ medium. |
|
|
根据气丝、基丝、色素颜色、孢子、吐水情况,从分离获得的80株菌株中初步选取36株代表菌株,显微观察菌株,有28株菌具有柔曲、螺旋、顶端卷曲呈球状的孢子链,呈现明显的链霉菌特征;其余8株菌气丝弱或无,与典型的链霉菌存在明显的区别。
2.3 胀果甘草内生放线菌抗菌活性筛选对胀果甘草内生放线菌抗菌活性筛选结果表明,36株供试菌中有86.1%的内生放线菌对供试的细菌与病原真菌具有不同程度的抗性,表现出广谱的抗菌活性(表 1)。其中有17株菌对大肠杆菌、枯草芽孢杆菌具有抑菌活性,15株菌对西瓜枯萎菌具有抑菌活性,13株菌对赤霉菌、玉米纹枯菌具有抑菌活性。抑菌圈大小表明,分离自胀果甘草的内生放线菌对不同供试病原菌株的拮抗效果存在差异,如菌株SCAU7014对黄瓜炭疽病菌、赤霉菌、玉米纹枯菌、黄瓜枯萎病菌、西瓜枯萎病菌、玉米弯孢菌的抑菌圈都大于6 mm,但对大肠杆菌、枯草芽孢杆菌的抑菌圈小于3 mm,对金黄色葡萄球菌没有表现出任何抑菌效果;SCAU7002、SCAU7005、SCAU7009、SCAU7010、SCAU7015、SCAU7016、SCAU7023、SCAU7029、SCAU7030、SCAU7032等表现出对4种以上的指示菌有抗性;而菌株SCAU7011对所有的指示菌均表现出了抗性,揭示了其代谢产物类型的多样性,为进一步寻找抗菌活性物质提供了良好的研究材料。
| 菌株编号 Isolates No. | 指示菌 Indicator organism | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| SCAU7001 | + | ++ | ++ | + | - | - | - | - | - | - |
| SCAU7002 | - | - | - | - | ++ | + | + | ++ | + | - |
| SCAU7003 | - | - | - | + | - | - | + | - | + | + |
| SCAU7004 | - | - | - | ++ | - | - | - | ++ | + | + |
| SCAU7005 | ++ | ++ | ++ | - | +++ | + | +++ | ++ | + | - |
| SCAU7006 | + | + | - | - | - | - | - | + | - | - |
| SCAU7007 | + | + | - | - | - | - | - | - | - | - |
| SCAU7008 | + | + | - | - | - | - | - | - | - | - |
| SCAU7009 | ++ | + | ++ | - | - | ++++ | - | - | ++ | ++ |
| SCAU7010 | + | + | + | ++ | ++ | ++ | ++ | - | - | - |
| SCAU7011 | ++ | ++ | + | ++++ | + | ++ | ++ | +++ | +++ | +++ |
| SCAU7012 | - | - | - | - | - | - | + | - | ++ | - |
| SCAU7013 | +++ | ++ | - | - | - | - | - | - | + | +++ |
| SCAU7014 | + | + | - | ++ | +++ | ++++ | +++ | +++ | +++ | +++ |
| SCAU7015 | + | + | - | + | + | + | + | + | - | - |
| SCAU7016 | + | - | - | ++ | - | - | - | ++ | + | + |
| SCAU7017 | - | - | - | - | - | - | - | - | - | - |
| SCAU7018 | - | - | - | - | - | - | - | - | - | - |
| SCAU7019 | - | - | - | - | - | - | + | - | - | - |
| SCAU7020 | - | - | - | - | - | - | - | - | - | - |
| SCAU7021 | - | - | - | - | - | - | - | - | + | - |
| SCAU7022 | - | - | - | - | - | + | - | - | - | - |
| SCAU7023 | + | ++ | ++ | - | - | + | - | - | ++ | ++ |
| SCAU7024 | - | - | - | - | - | - | - | - | - | - |
| SCAU7025 | - | + | + | - | - | + | - | - | - | + |
| SCAU7026 | + | + | - | - | + | - | + | - | - | - |
| SCAU7027 | - | - | - | - | - | - | + | - | - | - |
| SCAU7028 | - | - | - | + | - | + | - | - | - | - |
| SCAU7029 | + | + | + | ++ | ++ | ++ | ++ | - | - | - |
| SCAU7030 | + | + | ++ | + | - | - | + | - | + | ++ |
| SCAU7031 | - | - | - | - | - | - | - | - | + | + |
| SCAU7032 | + | ++ | + | - | + | + | - | - | ++ | + |
| SCAU7033 | + | + | ++ | + | - | - | + | - | + | ++ |
| SCAU7034 | - | - | - | - | - | - | - | - | - | - |
| SCAU7035 | - | - | - | - | - | - | + | - | - | - |
| SCAU7036 | - | - | - | - | - | - | - | - | - | - |
| 注:指示菌:1:大肠杆菌;2:枯草芽孢杆菌;3:金黄色葡萄球菌;4:蕃茄早疫病菌;5:黄瓜炭疽病菌;6:赤霉菌;7:玉米纹枯菌;8:黄瓜枯萎病菌;9:西瓜枯萎病菌;10:玉米弯孢菌. 抑菌活性:+:0-3 mm;++:4-6 mm;+++:7-9 mm;++++:10-12 mm;-:无抑菌效果. | ||||||||||
| Note: Indicator bacteria: 1: Escherichia coli; 2: Bacillus subtilis; 3:Staphylococcus aureus; 4: Alternaria solani; 5: Colletotrichum orbiculare; 6: Gibberella fujikuro; 7: Rhizoctonia solani; 8: Cucumber fusarium; 9: Fusarium oxyspirum; 10:Curvularia lunata. Inhibiting activity: +: 0-3 mm; ++: 4-6 mm; +++: 7-9 mm; ++++: 10-12 mm; -: No inhibiting activity. | ||||||||||
分别利用PKS Ⅰ、PKS Ⅱ、NRPS及卤代酶基因扩增引物,对36株代表菌株的聚酮合酶、非核糖体多肽合成酶及卤代酶相关基因进行检测。图 3结果表明,大部分菌的扩增片段长度符合各基因的预期值。将4种不同基因扩增的情况统计于表 2。从基因检测结果来看,36株供试菌株中有27株菌至少扩增出了一种合成酶基因,PKS Ⅰ、PKS Ⅱ、NRPS及卤代酶基因阳性菌株检出率分别是16.7%、72.2%、25.0%和11.1%,其中PKS Ⅱ基因数量最多,表明该基因广泛分布于胀果甘草内生放线菌中。同时,将菌株的功能基因检测与菌株抗菌活性测定结果进行比较分析发现(表 2),二者的分布存在一定的对应关系,即有抗菌活性的菌株大多都能扩出来至少一种合成酶基因。但也有例外,如菌株SCAU7029、SCAU7030和SCAU7032均对6种以上的指示菌株表现了抗菌活性,但并没有从中检测到PKS Ⅰ、PKS Ⅱ、NRPS及卤代酶基因的条带;而与之相反的是菌株SCAU7032、SCAU7032的 PKS Ⅱ及NRPS两种合成酶基因均能被扩增出来,但对10株指示菌株均无抗菌活性。

|
| 图 3 四种基因筛选部分扩增产物的电泳图谱 Figure 3 PCR amplification of PKS Ⅰ(A),PKS Ⅱ (B),NRPS (C) and Halo (D) genes from genomic DNA of isolates Note: M: Marker; 1-10: SCAU7001,SCAU7002,SCAU7003,SCAU7014,SCAU7015,SCAU7016,SCAU7008,SCAU7009,SCAU7010,SCAU7011. |
|
|
| 菌株编号 Isolates No. | 化合物合成基因 Synthetic genes | |||
| PKS Ⅰ | PKS Ⅱ | NRPS | Halogenase | |
| SCAU7001 | - | * | - | - |
| SCAU7002 | - | * | - | - |
| SCAU7003 | - | * | - | * |
| SCAU7004 | - | * | - | - |
| SCAU7005 | - | * | * | - |
| SCAU7006 | - | * | * | - |
| SCAU7007 | - | * | - | - |
| SCAU7008 | - | * | - | * |
| SCAU7009 | - | * | * | - |
| SCAU7010 | - | * | * | - |
| SCAU7011 | - | - | - | * |
| SCAU7012 | - | * | * | - |
| SCAU7013 | * | * | - | - |
| SCAU7014 | - | - | * | - |
| SCAU7015 | * | * | - | * |
| SCAU7016 | * | * | - | - |
| SCAU7017 | * | * | - | - |
| SCAU7018 | - | * | - | - |
| SCAU7019 | - | * | - | - |
| SCAU7020 | - | * | * | - |
| SCAU7021 | - | * | * | - |
| SCAU7022 | - | * | - | - |
| SCAU7023 | - | * | - | - |
| SCAU7024 | - | * | - | - |
| SCAU7025 | * | * | - | - |
| SCAU7026 | - | * | - | - |
| SCAU7027 | - | * | * | - |
| SCAU7028 | * | * | - | - |
| SCAU7029 | - | * | - | - |
| SCAU7030 | - | - | - | - |
| SCAU7031 | - | - | - | - |
| SCAU7032 | - | - | - | - |
| SCAU7033 | - | - | - | - |
| SCAU7034 | - | - | - | - |
| SCAU7035 | - | - | - | - |
| SCAU7036 | - | - | - | - |
| 注:*:有功能基因;-:无功能基因. | ||||
| Note: *: gene detected; -: gene not detected. | ||||
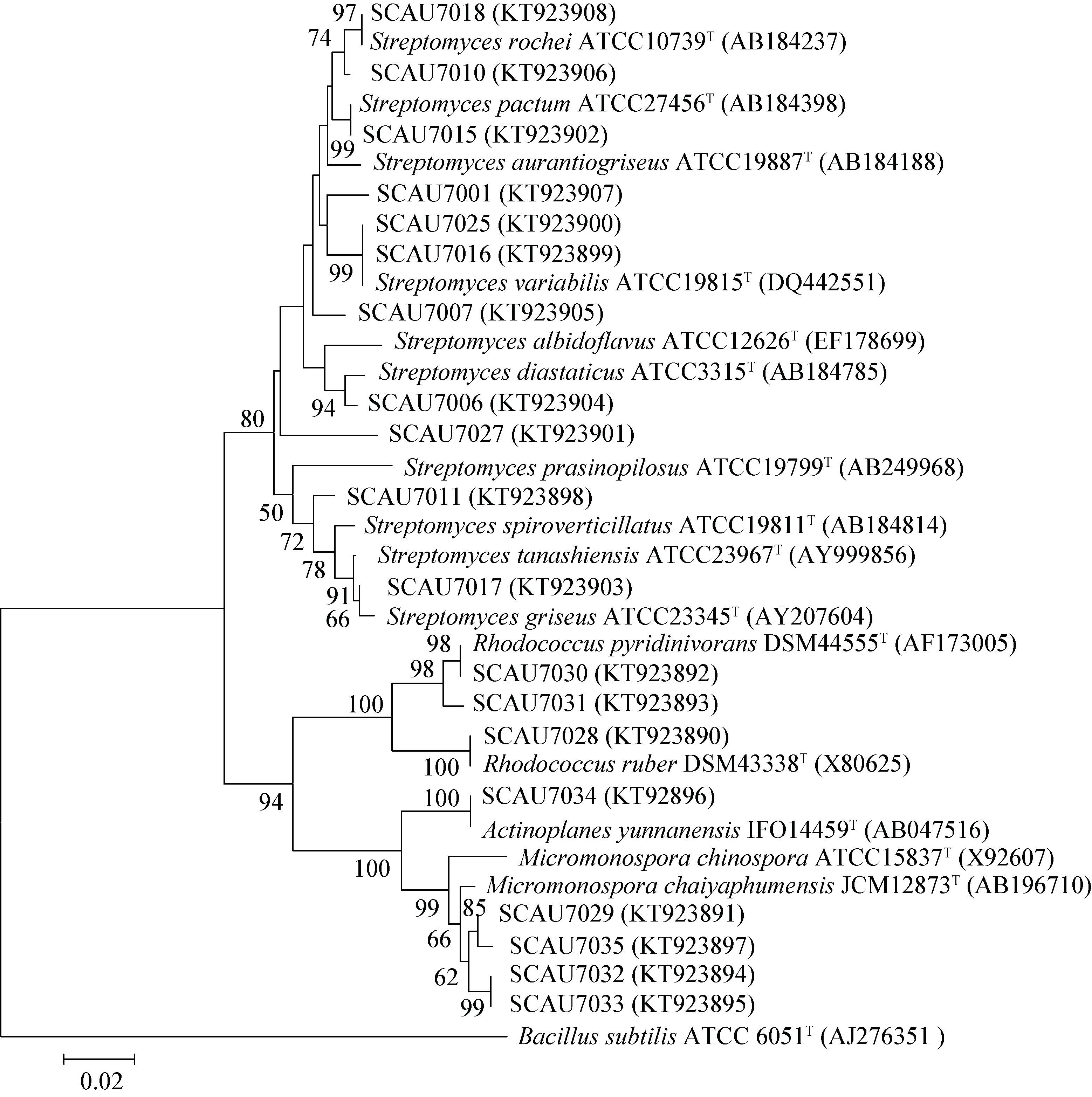
根据代表菌株的抗菌活性与功能基因筛选结果,选取20株菌株进行16S rRNA基因序列测定,序列结果在Genbank (http://www.ncbi.nlm.nih.gov/genbank)中用Blast进行检索和比对,找出相似性最高的序列,并构建系统发育树(图 4)。结果表明,序列与数据库中的模式菌株都具有一定的相似性,相似度在98%-100%。根据16S rRNA基因序列相似性大于97%的菌株归于同一个种的规则,20株菌分属于4个属:链霉菌属(Streptomyces)、小单孢菌属(Micromonospora)、红球菌属(Rhodococcus)、游动放线菌属(Actinoplanes),其中链霉菌属(Streptomyces)为胀果甘草的优势种群,占总菌数的60%。在不同的链霉菌属内,不同种间形成分支,表明胀果甘草内生放线菌在链霉菌属内的多样性很高,揭示了胀果甘草内生放线菌种群具有丰富的多样性。
|
| 图 4 胀果甘草内生放线菌16S rRNA基因序列系统发育树分析 Figure 4 Neighbor-joining phylogenetic tree analysis of 16S rRNA gene of endophytic actinobacteria isolated from Glycyrrhizain flata Bat. 注:括号里的数字为GenBank登录号;分支点上的数字为Bootsrap值,代表分类单位被聚在一起的几率;比例尺显示水平线的长度,代表碱基替换数. Note:Numbers in parentheses represent the sequesnces accession No. The numbers at the nodes indicate the level of bootstrap support (%) based on 1 000 resampled data sets,only values above 50% are given. The scale bar corresponds to 0.02 substitutions per nucleotide position. |
|
|
自链霉菌成为抗生素主要产生菌以来,放线菌作为一类重要的微生物资源逐渐被认识,并开创了抗生素的黄金时代[24]。目前尽管可以通过对菌株进行遗传修饰改造获得优良菌株,但从自然环境中筛选优良菌株仍然是主要方向。而分离方法和选择性培养基对发掘放线菌资源至关重要。司美茹等[25]报道在同样的处理时间下,随着预处理温度升高,放线菌数量和种类均明显增加,细菌数量有减少趋势。本研究同样发现植物样品经过热处理后,分离获得放线菌的数量显著增加,分离平板上杂菌污染较少,说明通过一定温度预处理有利于放线菌孢子萌发,同时可以抑制细菌的生长。Muscholl- Silberhorn等[15]报道,用一定浓度的苯酚处理样品后,将更有利于放线菌的分离,而我们发现植物样品经苯酚处理后,杂菌污染是3种处理中最少的,但分离出的放线菌也最少,这可能是因为不同环境中不同植物的内生微生物对于苯酚的耐受性各不相同而造成分离效果的差异[26]。其次,选择不同的培养基对胀果甘草内生放线菌的分离也有明显的影响,E2、E3、E4 3种寡营养培养基中分别使用了较难被细菌利用的棉子糖、干酪素及天冬酰胺酸作为碳、氮源,但不会影响放线菌的生长。因此,使用这 3种寡营养培养基可以有效地减少细菌在分离培养基上的生长,避免了因细菌生长过多过快抑制放线菌生长的情况,有利于一些生长缓慢的稀有放线菌的生长。本实验从新疆胀果甘草中分离出的放线菌分别属于链霉菌属、小单胞菌属、红球菌属和游动放线菌属,其中链霉菌为优势菌属。8株稀有放线菌均分离自3种寡营养培养基,表明放线菌偏好无机营养成分的培养基,寡营养培养基更适合稀有放线菌的分离[27]。有机物含量低的分离培养基,不仅有利于稀有放线菌的分离,同时还可以防止外界真菌污染[8]。因此,分离培养基选取不同的碳源、氮源及类型各异的营养成分,才能尽可能满足不同类型放线菌的生长需求,分离到更多放线菌资源。
放线菌的多数次生代谢产物是通过聚酮合酶和非核糖体多肽合成酶来合成主要结构骨架,而活化产物结构多样性则是由一类称为后修饰酶的蛋白决定的。放线菌的抗菌活性与其产生的次生代谢产物密不可分,因此通过对这些基因的检测,可以对菌株合成此类化合物的潜力以及它的抗菌活性进行预测和评价,提高发现新化合物的效率[28]。目前,次生代谢产物合成基因筛选作为一种发现新药先导化合物的方法已被广泛应用[21]。本实验中 36株代表菌株中PKS Ⅰ、PKS Ⅱ、NRPS基因和卤化酶基因阳性检出率分别为16.7%、72.2%、25.0%和11.1%,其中PKS Ⅱ基因的检出率尤为突出。已知的Ⅱ型PKS合成酶基因编码的天然产物主要有聚酮类抗生素、醌类物质、金霉酸、孢子色素等。Sun等[29]通过对珊瑚中可培养放线菌PKS Ⅱ基因的筛选,获得10株PKS Ⅱ基因筛选呈阳性的菌株,通过对各菌株发酵产物的进一步分析发现,其中的一株菌Micromonospora sp. A5-1具有产生聚酮类化合物jadomycin B类似物的能力,表明通过化合物合成基因的检测发现含有天然产物合成基因的放线菌资源是可行的。然而,有研究表明并非所有胀果甘草内生放线菌菌株功能基因的检出与抑菌活性之间存在一一对应关系[18]。例如,本研究获得的稀有放线菌均未检测到编码任何天然产物的相关基因,但其中小单孢菌属、红球菌属的部分菌株却对不同病原菌表现出了不同程度的抑制作用,而与之相反的是菌株SCAU7032,其PKS Ⅱ和NRPS两种合成酶基因均能被扩增出来,但对10株指示菌株均无抗菌活性。因此,我们在进行活性菌株筛选时,应将天然活性物质的基因筛选与抗菌活性实验相结合,这样筛选得到的菌株产生活性化合物的可能性更大,同时也可以很好地避免活性菌株的漏筛[30]。
综上所述,胀果甘草作为我国传统的药用植物,其内部蕴藏着丰富的放线菌资源,在塔里木盆地极端环境下的胀果甘草内生放线菌产生天然代谢产物的潜力巨大,具有进一步开发的价值。
| [1] | Stone JK, Bacon CW, White JF. An overview of endophytic microbes: endophytism defined[A]//Bacon CW, White JF. Microbial Endophytes[M]. New York: Dekker, 2000 . |
| [2] | Bérdy J. Bioactive microbial metabolites[J]. The Journal of Antibiotics , 2005, 58 (1) : 1–26. DOI:10.1038/ja.2005.1 |
| [3] | Zhao K, Penttinen P, Guan TW, et al. The diversity and anti-microbial activity of endophytic actinomycetes isolated from medicinal plants in Panxi plateau, China[J]. Current Microbiology , 2011, 62 (1) : 182–190. DOI:10.1007/s00284-010-9685-3 |
| [4] | Li XJ, Yang WD, Wen H. Brief analysis of resource of Xinjiang licorice[J]. Research and Information on Traditional Chinese Medicine , 2002, 4 (2) : 26–29. (in chinese) 李晓瑾, 杨卫东, 文浩. 简析新疆甘草资源现状[J]. 中药研究与信息 , 2002, 4 (2) : 26–29. |
| [5] | Asl MN, Hosseinzadeh H. Review of pharmacological effects of Glycyrrhiza sp. and its bioactive compounds[J]. Phytotherapy Research , 2008, 22 (6) : 709–724. DOI:10.1002/(ISSN)1099-1573 |
| [6] | Eu CHA, Lim WY, Ton SH, et al. Glycyrrhizic acid improved lipoprotein lipase expression, insulin sensitivity, serum lipid and lipid deposition in high-fat diet-induced obese rats[J]. Lipids in Health and Disease , 2010, 9 (1) : 81. DOI:10.1186/1476-511X-9-81 |
| [7] | Zhu S, Sugiyama R, Batkhuu J, et al. Survey of Glycyrrhizae radix resources in Mongolia: chemical assessment of the underground part of Glycyrrhiza uralensis and comparison with Chinese Glycyrrhizea Radix[J]. Journal of Natural Medicines , 2009, 63 (2) : 137–146. DOI:10.1007/s11418-008-0303-7 |
| [8] | Crawford DL, Lynch JM, Whipps JM, et al. Isolation and characterization of actinomycete antagonists of a fungal root pathogen[J]. Applied and Environmental Microbiology , 1993, 59 (11) : 3899–3905. |
| [9] | Vickers JC, Williams ST, Ross GW. Vickers JC, Williams ST, Ross GW. A taxonomic approach to selective isolation of streptomycetes from soil[A]//Ortiz-Ortiz L, Bojalil LF, Yakoleff V. Biological, Biochemical, and Biomedical Aspects of Actinomycetes[M]. Orlando: Academic Press,, 1984: 533 -561. |
| [10] | Davis KER, Joseph SJ, Janssen PH. Effects of growth medium, inoculum size, and incubation time on culturability and isolation of soil bacteria[J]. Applied and Environmental Microbiology , 2005, 71 (2) : 826–834. DOI:10.1128/AEM.71.2.826-834.2005 |
| [11] | Peng YX, Jiang Y, Duan SR, et al. Selective isolation methods of rare actinomycetes[J]. Journal of Yunnan University (Natural Sciences Edition) , 2007, 29 (1) : 86–89. (in chinese) 彭云霞, 姜怡, 段淑蓉, 等. 稀有放线菌的选择性分离方法[J]. 云南大学学报(自然科学版) , 2007, 29 (1) : 86–89. |
| [12] | Yuan HL, Wang HX. Agricultural microorganisms and experiment tutorial[M]. Beijing: China agricultural university press, 2008: 470 . (in chinese) 袁红莉, 王贺祥. 农业微生物及实验教程[M]. 北京: 中国农业大学出版社, 2008: 470 . |
| [13] | Chen HH, Yang Y, Jiang Y, et al. Method of endophytic actinomycetes separation from the plant[J]. Microbiology China , 2006, 33 (4) : 182–185. (in chinese) 陈华红, 杨颖, 姜怡, 等. 植物内生放线菌的分离方法[J]. 微生物学通报 , 2006, 33 (4) : 182–185. |
| [14] | Li J, Zhao GZ, Chen HH, et al. Antitumour and antimicrobial activities of endophytic Streptomycetes from pharmaceutical plants in rainforest[J]. Letters in Applied Microbiology , 2008, 47 (6) : 574–580. DOI:10.1111/lam.2008.47.issue-6 |
| [15] | Muscholl-Silberhorn A, Thiel V, Imhoff JF. Abundance and bioactivity of cultured sponge-associated bacteria from the Mediterranean sea[J]. Microbial Ecology , 2008, 55 (1) : 94–106. DOI:10.1007/s00248-007-9255-9 |
| [16] | 赵珂. 攀西地区药用植物内生及根际放线菌的多样性与抗菌活性研究[D]. 雅安: 四川农业大学博士学位论文, 2011 Zhao K. Diversity and antimicrobial activity of endophytic actinobacteria from the medicinal plants in Panxi region[D]. Ya’an: Doctoral Dissertation of Sichuan Agricultural University, 2011(in Chinese). http://cdmd.cnki.com.cn/Article/CDMD-10626-1011222371.htm |
| [17] | Ruan JS, Huang Y. The Rapid Identification and Classification of Actinobacteria[M]. Beijing: Science Press, 2011 . (in chinese) 阮继生, 黄英. 放线菌快速鉴定与系统分类[M]. 北京: 科学出版社, 2011 . |
| [18] | Ayuso A, Clark D, González I, et al. A novel actinomycete strain de-replication approach based on the diversity of polyketide synthase and nonribosomal peptide synthetase biosynthetic pathways[J]. Applied Microbiology and Biotechnology , 2005, 67 (6) : 795–806. DOI:10.1007/s00253-004-1828-7 |
| [19] | Ayuso-Sacido A, Genilloud O. New PCR primers for the screening of NRPS and PKS-Ⅰ systems inaction mycetes: detection and distribution of these biosynthetic gene sequences in major taxonomic groups[J]. Microbial Ecology , 2005, 49 (1) : 10–24. DOI:10.1007/s00248-004-0249-6 |
| [20] | Mets-Ketel M, Salo V, Halo L, et al. An efficient approach for screening minimal PKS genes from Streptomyces[J]. FEMS Microbiology Letters , 1999, 180 (1) : 1–6. DOI:10.1111/fml.1999.180.issue-1 |
| [21] | Hornung A, Bertazzo M, Dziarnowski A, et al. A genomic screening approach to the structure-guided identification of drug candidates from natural sources[J]. ChemBioChem , 2007, 8 (7) : 757–766. DOI:10.1002/(ISSN)1439-7633 |
| [22] | Nie M, Zhang XD, Wang JQ, et al. Rhizosphere effects on soil bacterial abundance and diversity in the Yellow River Deltaic ecosystem as influenced by petroleum contamination and soil salinization[J]. Soil Biology and Biochemistry , 2009, 41 (12) : 2535–2542. DOI:10.1016/j.soilbio.2009.09.012 |
| [23] | Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution , 2011, 28 (10) : 2731–2739. DOI:10.1093/molbev/msr121 |
| [24] | Bérdy J. Thoughts and facts about antibiotics: where we are now and where we are heading[J]. The Journal of Antibiotics , 2012, 65 (8) : 385–395. DOI:10.1038/ja.2012.27 |
| [25] | Si MR, Xue QH, Lai HX. Studies on selection of the isolation medium for actinomycetes and inhabition methods to miscellaneous microorganism[J]. Microbiology China , 2004, 31 (2) : 61–65. (in chinese) 司美茹, 薛泉宏, 来航线. 放线菌分离培养基筛选及杂菌抑制方法研究[J]. 微生物学通报 , 2004, 31 (2) : 61–65. |
| [26] | Chen XH, Wei G, Liu SY, et al. Growth kinetics and phenol degradation of highly efficient phenol-degrading Ochrobactrum sp. CH10[J]. Environmental Science , 2012, 33 (11) : 3956–3961. (in chinese) 陈晓华, 魏刚, 刘思远, 等. 高效降酚菌株Ochrobactrum sp. CH10生长动力学和苯酚降解特性的研究[J]. 环境科学 , 2012, 33 (11) : 3956–3961. |
| [27] | Jensen PR, Mincer TJ, Williams PG, et al. Marine actinomycete diversity and natural product discovery[J]. Antonie van Leeuwenhoek , 2005, 87 (1) : 43–48. DOI:10.1007/s10482-004-6540-1 |
| [28] | Xu P, Li WJ, Gao HY, et al. Study on biodiversity of typeⅠ&Ⅱpolyketide synthesis genes positive microorganisms[J]. Acta Microbiologica Sinica , 2005, 45 (6) : 821–827. (in chinese) 徐平, 李文均, 高慧英, 等. 聚酮类化合物生物合成途径基因阳性菌株生物多样性研究[J]. 微生物学报 , 2005, 45 (6) : 821–827. |
| [29] | Sun W, Peng CS, Zhao YY, et al. Functional gene-guided discovery of Type Ⅱ Polyketides from culturable actinomycetes associated with soft coral Scleronephthya sp.[J]. PLoS One , 2012, 7 (8) : e42847. DOI:10.1371/journal.pone.0042847 |
| [30] | Zheng YK, Liu K, Xiong ZJ, et al. Research progress on biodiversity of endophytic actinobacteria in medicinal plants and their bioactive substances Chinese[J]. Traditional and Herbal Drugs , 2014, 45 (14) : 2089–2096. (in chinese) 郑有坤, 刘凯, 熊子君, 等. 药用植物内生放线菌多样性及天然活性物质研究进展[J]. 中草药 , 2014, 45 (14) : 2089–2096. |
 2016, Vol. 43
2016, Vol. 43