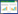扩展功能
文章信息
- 李晓艳, 于爽, 窦少华, 张庆芳, 迟乃玉, 王晓辉
- LI Xiao-Yan, YU Shuang, DOU Shao-Hua, ZHANG Qing-Fang, CHI Nai-Yu, WANG Xiao-Hui
- 植物乳杆菌CLP0279发酵生产低温SOD培养基的优化
- Optimization of fermentation medium for a cold-adapted superoxide dismutase (SOD) produced by Lactobacillus plantarum sp. CLP0279
- 微生物学通报, 2016, 43(10): 2129-2137
- Microbiology China, 2016, 43(10): 2129-2137
- DOI: 10.13344/j.microbiol.china.150688
-
文章历史
- 收稿日期: 2015-09-13
- 接受日期: 2016-05-09
- 优先数字出版日期(www.cnki.net): 2016-05-24
超氧化物歧化酶(superoxide dismutase,EC l.15.1.1,简称SOD)是催化超氧阴离子自由基(O2-·)和氢离子生成过氧化氢和分子氧,从而减轻或消除生物体内氧自由基的一类金属酶[1]。按所含金属离子的种类SOD分为四类:铁超氧化物歧化酶(Fe-SOD)、锰超氧化物歧化酶(Mn-SOD)、铜锌超氧化物歧化酶(Cu/Zn-SOD)和镍超氧化物歧化酶(Ni-SOD)[2]。SOD是生物体内自由基清除剂,具有抗炎症、抗病毒、抗辐射、抗衰老等作用,广泛应用在食品、医疗、保健等领域[3-5]。
SOD广泛存在于动物、植物及微生物中[6]。动植物体内提取SOD工艺复杂、安全性低,而微生物生产SOD具有生产周期短、发酵工艺简单、生产效率高、无毒且获得率高等特点受到广泛关注[7]。国内外学者主要研究生产中高温SOD微生物的选育、发酵工艺优化、基因的克隆表达与产品开发等方面[8-11],而低温酶具有低温下催化效率高,结构柔顺性和热不稳定性等生物学特性,使其在食品、农业等应用上更有优势[12-14]。海洋微生物为了适应极端的海洋环境,具有低温、耐压、嗜盐等特性,其分泌的SOD也进化出许多有价值的酶学特性,如对温度具有更高的抗性,在耐受理化方面也表现出较高的稳定性等[6, 15]。但关于低温SOD微生物研究较少,集中于假单胞菌属和弧菌属[1, 15-16],其产酶活力相对较低,不能满足工业化生产要求。
本文以实验室早期从海洋环境筛选到的一株高产低温SOD植物乳杆菌CLP0279为研究对象,在单因素实验的基础上,通过响应面优化策略对发酵培养基进行优化,进一步提高其SOD酶活性,为后期SOD的酶学特性及工业化应用研究奠定基础。
1 材料与方法 1.1 材料1.1.1 菌株:植物乳杆菌CLP0279 (Lactobacillus plantarum sp. CLP0279)筛选自中国辽宁大连黄海海水、海泥,保藏至辽宁省海洋微生物工程技术研究中心。
1.1.2 培养基:种子培养基(g/L):葡萄糖20.0,牛肉膏5.0,蛋白胨10.0,磷酸氢二钾2.0,磷酸二氢钾1.5,乙酸钠5.0,酵母粉5.0,硫酸铜0.017,硫酸锌0.015,pH 7.0,1.0x105 Pa灭菌20 min。
发酵培养基(g/L):玉米粉20.0,磷酸氢二钾2.0,磷酸二氢钾1.5,乙酸钠5.0,酵母粉5.0,硫酸铜0.010,硫酸锌0.005,pH 7.0,1.0x105 Pa灭菌20 min。
1.1.3 主要试剂和仪器:邻苯三酚、葡萄糖、蛋白胨、牛肉膏等购自Sigma公司;其它试剂均为国产分析纯级试剂。LRH系列培养箱、HWS24型电热恒温水浴锅,购自上海一恒科学仪器有限公司;HZP-256全温振荡培养箱,购自武汉建伟生物科技有限公司;Thermo Scientific Multiskan Ascent酶标仪,购自芬兰Labsystems公司。
1.2 培养方法1.2.1 菌株活化:用灭菌的牙签挑取保存菌株接种于固体种子培养基上,置于恒温培养箱中,20 ℃黑暗培养活化。
1.2.2 种子培养:挑取单菌落接种于5 mL液体种子培养基中,于20 ℃、160 r/min培养24 h。按1%接种量将一级种子液接入100 mL液体种子培养基,于20 ℃、160 r/min培养24 h。
1.2.3 发酵培养:按8%接种量将二级种子液接入发酵培养基中,于20 ℃、160 r/min培养48 h。
1.3 SOD酶活的测定方法发酵液于4 ℃、8 000 r/min离心20 min,用磷酸缓冲液(pH 7.0)将菌体清洗3次,4 ℃、5 000 r/min离心30 min,弃上清。将离心得到的湿菌体用磷酸缓冲液(pH 7.0)溶解,480 W超声波冰浴破碎 30 min,4 ℃、8 000 r/min离心20 min,弃沉淀,留上清,即为粗酶液。
采用Marklund等[17]报道的邻苯三酚自氧化法测定SOD酶活。酶活力定义:1 mL反应液每分钟抑制邻苯三酚自氧化速度50%所需酶量。
1.4 实验设计1.4.1 单因素实验:采用单因素实验考察培养温度、发酵培养基中玉米浆、磷酸氢二钾、磷酸二氢钾、硫酸铜和硫酸锌对Lactobacillus plantarum sp. CLP0279产SOD的影响。
1.4.2 Plackett-Burman (PB)因素水平及编码设计:根据前期单因素实验选择5个因素进行12次实验(n=12),并设计6项虚拟项(A、C、E、G、J、L)。因素水平及编码见表 1。
| Code | Parameters (g/L) | Levels | |
| Low (-1) | High (+1) | ||
| B | Corn meal powder | 20 | 25 |
| D | Potassium dihydrogen hosphate | 2.1 | 2.6 |
| F | Potassium phosphate dibasic | 1.2 | 1.6 |
| H | Copper sulfate pentahydrate | 0.006 | 0.010 |
| K | Zinc sulfate heptahydrate | 0.007 | 0.013 |
1.4.3 最陡爬坡实验:根据Plackett-Burman实验及其分析结果设计最陡爬坡实验,找出SOD酶活最高的区域。
1.4.4 Box-Behnken (BB)实验设计:根据Plackett-Burman实验得到的3个显著因素及最陡爬坡实验确定的中心点,设计n=15的3因素3水平实验。以磷酸氢二钾、硫酸铜、磷酸锌为自变量设计n=15组的Box-Behnken实验。见表 2。
| Factors (g/L) | Levels | ||
| -1 | 0 | +1 | |
| Potassium phosphate dibasic | 1.6 | 1.8 | 2.0 |
| Copper sulfate pentahydrate | 0.010 | 0.011 | 0.012 |
| Zinc sulfate heptahydrate | 0.013 | 0.014 | 0.015 |
1.4.5 数据分析:Plackett-Burman (PB)法是一种以不完全平衡块(balanced incomplete blocks)为原理的实验设计,它能从众多的过程变量中快速、有效地筛选出最效应因素[18]。响应面分析法(RSM)以回归方法作为函数估算的工具,用多项式近似把因素与实验结果关系函数化,依此研究因素与响应值之间、因素与因素之间的相互关系,并进行优化[19]。
2 结果与分析 2.1 菌体最适发酵温度与发酵培养基的单因素实验从大连黄海样品中分离得到产SOD活力较好的Lactobacillus plantarum sp. CLP0279。接种发酵培养基,分别在15-50 ℃、160 r/min培养48 h,检测酶活。由图 1A可知。菌株产酶最佳温度为20 ℃,随着培养温度升高,产酶能力迅速降低,表明菌株适合低温产酶,分泌低温SOD。发酵培养基的成分以及配比对菌体的生长、代谢产物的积累以及目的代谢产物的活性和质量都有较大的影响。通过单因素实验确定玉米粉浓度25.0 g/L、磷酸二氢钾2.6 g/L、磷酸氢二钾1.6 g/L、硫酸铜0.010 g/L、硫酸锌 0.013 g/L。
|
| 图 1 培养基单因素实验对产酶的影响 Figure 1 The results of single factor experiment in culture medium 注:A:温度;B:玉米粉;C:磷酸二氢钾;D:磷酸氢二钾;E:硫酸铜;F:硫酸锌. Note:A: temperature; B: corn meal powder; C:KH2PO4; D: K2HPO4; E:CuSO4·5H2O; F: ZnSO4·7H2O. |
|
|
由表 1和Minitab 17软件得到PB实验设计,每组配方做3个平行样,n=12的PB实验设计及3次酶活的平均值结果如表 3所示。由表 2得到PB设计的各因素水平及效应评价(表 4)。由表 4可知,磷酸氢二钾、硫酸铜、硫酸锌显著影响Lactobacillus plantarum sp. CLP0279产酶,可信度大于95%,达到显著水平。作为下一步响应面设计的主要影响因素。其余因素选值根据各自效应值的正负及大小来确定,正效应取其较大值,负效应取其较小值。后续实验玉米粉浓度为25.0 g/L,磷酸二氢钾浓度为2.6 g/L。
| Serial number | (A) | B | (C) | D | (E) | F | (G) | H | (J) | K | (L) | Enzyme activity (U/mL) |
| 1 | 1 | -1 | 1 | -1 | -1 | -1 | 1 | 1 | 1 | -1 | 1 | 146.31 |
| 2 | -1 | 1 | 1 | -1 | 1 | -1 | -1 | -1 | 1 | 1 | 1 | 139.39 |
| 3 | -1 | 1 | -1 | -1 | -1 | 1 | 1 | 1 | -1 | 1 | 1 | 190.27 |
| 4 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | 130.05 |
| 5 | -1 | -1 | -1 | 1 | 1 | 1 | -1 | 1 | 1 | -1 | 1 | 164.76 |
| 6 | - | 1 | 1 | 1 | -1 | 1 | 1 | -1 | 1 | -1 | -1 | 167.42 |
| 7 | 1 | 1 | -1 | 1 | -1 | -1 | -1 | 1 | 1 | 1 | -1 | 164.12 |
| 8 | 1 | -1 | -1 | -1 | 1 | 1 | 1 | -1 | 1 | 1 | -1 | 171.81 |
| 9 | 1 | -1 | 1 | 1 | -1 | 1 | -1 | -1 | -1 | 1 | 1 | 185.33 |
| 10 | 1 | 1 | 1 | -1 | 1 | 1 | -1 | 1 | -1 | -1 | -1 | 178.03 |
| 11 | 1 | -1 | -1 | 1 | 1 | -1 | 1 | -1 | -1 | -1 | 1 | 133.42 |
| 12 | -1 | -1 | 1 | 1 | 1 | -1 | 1 | 1 | -1 | 1 | -1 | 163.81 |
| Note: R2 = 93.52%; Adj R2= 88.12%. | ||||||||||||
| Code | Factors (g/L) | Levels | t value | Prob>t | Importance | |
| -1 | +1 | |||||
| B | Corn meal powder | 20.0 | 25.0 | 0.45 | 0.671 | 5 |
| D | Potassium dihydrogen hosphate | 2.1 | 2.6 | 0.97 | 0.369 | 4 |
| F | Potassium phosphate dibasic | 1.2 | 1.6 | 7.62 | 0.000 | 1 |
| H | Copper sulfate pentahydrate | 0.006 | 0.010 | 3.37 | 0.015 | 3 |
| K | Zinc sulfate heptahydrate | 0.007 | 0.013 | 4.00 | 0.007 | 2 |
针对磷酸氢二钾、硫酸铜、硫酸锌3个因素的浓度进行最陡爬坡实验,将3个因素的浓度逐步增加以寻找最大响应区域。实验设计和结果如表 5所示,第2组实验中,当磷酸氢二钾1.8 g,硫酸铜0.011 g,硫酸锌0.014 g时酶活达到最大值,此后浓度继续变化但酶活不断降低。所以第2组实验作为中心组合实验的中心点。
| Serial number | Potassium phosphate dibasic (g/L) | Copper sulfate pentahydrate (g/L) | Zinc sulfate heptahydrate (g/L) | Enzyme activity (U/mL) |
| 1 | 1.6 | 0.010 | 0.013 | 186.56 |
| 2 | 1.8 | 0.011 | 0.014 | 194.68 |
| 3 | 2.0 | 0.012 | 0.015 | 178.70 |
| 4 | 2.2 | 0.013 | 0.016 | 176.43 |
2.4.1 Box-Behnken (BB)中心组合实验设计:响应面分析设计3因素3水平共15个实验点,其中 12个实验点为析因点,3个为零点,零点实验重复 3次用于估计实验误差。因素和水平设计见表 2,结果见表 6。数据分析和模型建立由Minitab 17软件完成。
| Serial number | Potassium phosphate dibasic (g/L) | Copper sulfate pentahydrate (g/L) | Zinc sulfate heptahydrate (g/L) | Enzyme activity (U/mL) | |||
| X1 | Code X1 | X2 | Code X2 | X3 | Code X3 | ||
| 1 | 1.8 | 0 | 0.011 | 0 | 0.014 | 0 | 195.90 |
| 2 | 1.8 | 0 | 0.012 | 1 | 0.015 | 1 | 157.28 |
| 3 | 1.6 | -1 | 0.010 | -1 | 0.015 | 0 | 146.29 |
| 4 | 1.8 | 0 | 0.010 | -1 | 0.013 | -1 | 179.45 |
| 5 | 1.8 | 0 | 0.011 | 0 | 0.014 | 0 | 193.96 |
| 6 | 1.6 | -1 | 0.011 | 0 | 0.013 | -1 | 175.85 |
| 7 | 1.8 | 0 | 0.010 | -1 | 0.015 | 1 | 133.67 |
| 8 | 2.0 | 1 | 0.011 | 0 | 0.013 | -1 | 175.98 |
| 9 | 1.6 | -1 | 0.011 | 0 | 0.015 | 1 | 149.29 |
| 10 | 1.8 | 0 | 0.012 | 1 | 0.013 | -1 | 151.72 |
| 11 | 2.0 | 1 | 0.010 | -1 | 0.014 | 0 | 173.59 |
| 12 | 2.0 | 1 | 0.012 | 1 | 0.014 | 0 | 152.31 |
| 13 | 1.8 | 0 | 0.011 | 0 | 0.014 | 0 | 189.92 |
| 14 | 1.6 | -1 | 0.012 | 1 | 0.014 | 0 | 180.95 |
| 15 | 2.0 | 1 | 0.011 | 0 | 0.015 | 1 | 169.34 |
2.4.2 二次回归拟合与方差分析:20 ℃、pH 7.0、160 r/min发酵2 d,运用Minitab 17软件对实验数据进行回归分析,得出回归方程:
Y=193.26+2.355X1+1.158X2-9.178X3-8.945X12-21.03X22-16.7X32-13.985X1X2+4.98X1X3+12.835X2X3。
进行显著性检验和方差分析见表 7和表 8。从表 7显著性检验结果可以看出硫酸铜因子的平方、硫酸锌因子的平方对酶活的影响都极显著;硫酸锌因子、磷酸氢二钾因子的平方、磷酸氢二钾与硫酸铜的交互因子、硫酸铜与硫酸锌的交互因子对酶活的影响显著,说明响应值的变化相当复杂,实验因子对响应值的影响不是简单的线性关系,三因素之间交互效应较大;回归方程的相关系数R2=97.59%,表明该模型拟和程度良好,实验设计可靠;从表 8中的方差分析结果可以看出,方程的失拟项为0.222>0.05,表明失拟不显著,模型稳定,能很好地进行预测。
| Variable coefficient | Coefficient estimation | Standard error | t value | Prob>t |
| X1 | 2.355 | 1.739 | 1.354 | 0.234 |
| X2 | 1.158 | 1.739 | 0.666 | 0.535 |
| X3 | -9.178 | 1.739 | -5.278 | 0.003 |
| X1 X1 | -8.945 | 2.560 | -3.495 | 0.017 |
| X2 X2 | -21.030 | 2.560 | -8.216 | 0.000 |
| X3 X3 | -16.700 | 2.560 | -6.525 | 0.001 |
| X1 X2 | -13.985 | 2.459 | -5.687 | 0.002 |
| X1 X3 | 4.980 | 2.459 | 2.025 | 0.099 |
| X2 X3 | 12.835 | 2.459 | 5.219 | 0.003 |
| Note: R2= 97.59%; Adj R2= 88.12%. | ||||
| Variance source | Degrees of freedom | Adjustment sum of squares | Adjustment mean square | F value | Prob>F |
| Regression | 9 | 4 893.08 | 543.675 | 22.48 | 0.002 |
| Linear | 3 | 728.90 | 242.966 | 10.04 | 0.015 |
| Square | 3 | 2 623.71 | 874.469 | 36.16 | 0.001 |
| Interaction | 3 | 1 540.47 | 513.490 | 21.23 | 0.003 |
| Residual error | 5 | 120.95 | 24.189 | ||
| Loss of quasi | 3 | 102.33 | 34.110 | 3.66 | 0.222 |
| Pure error | 2 | 18.62 | 9.308 | ||
| Total | 14 | 5 014.02 |
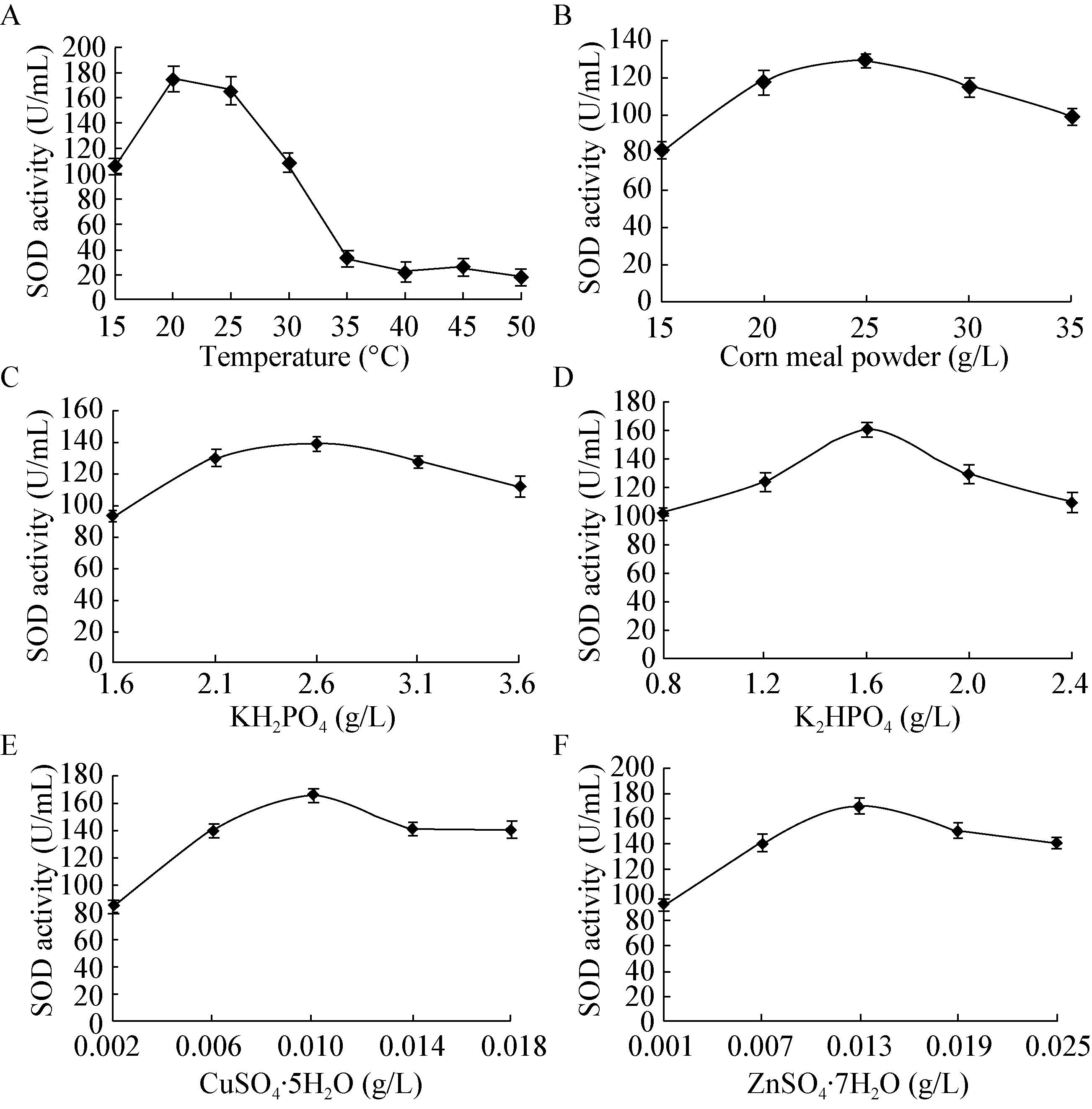
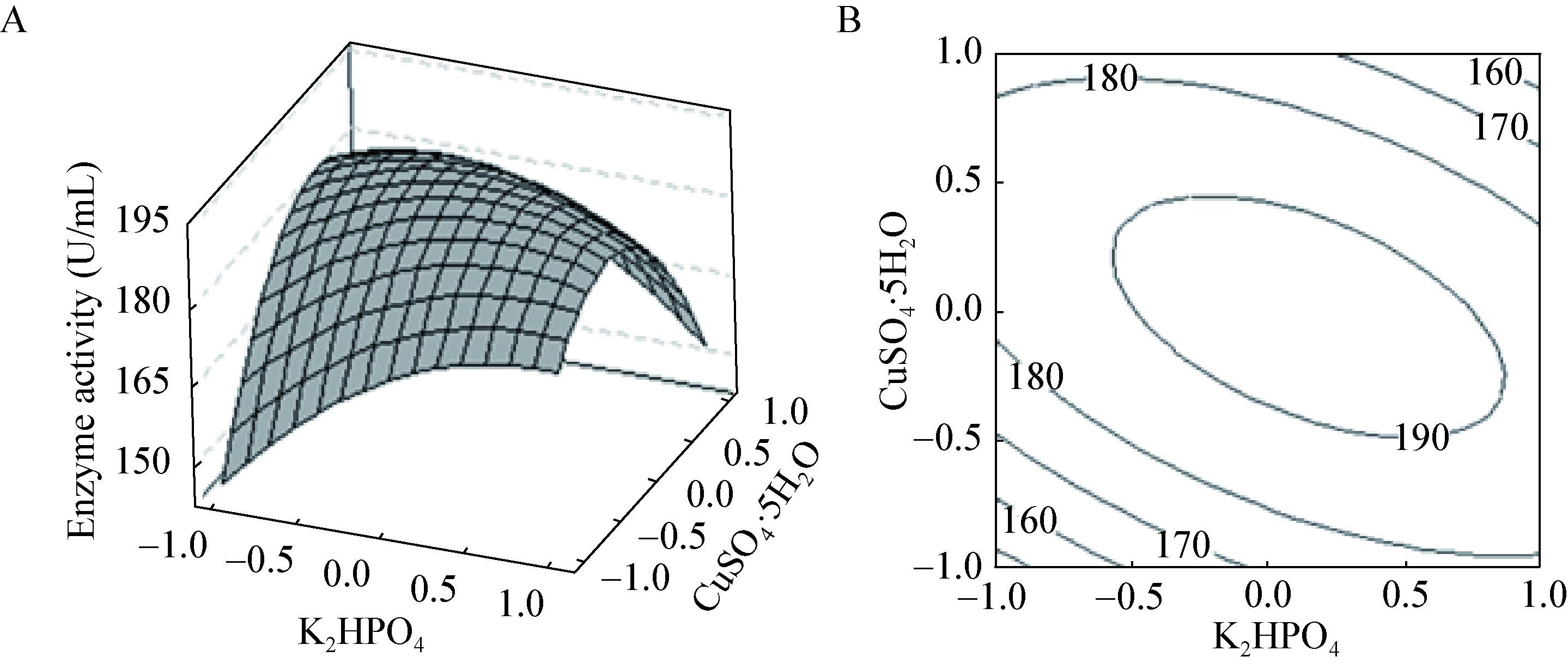
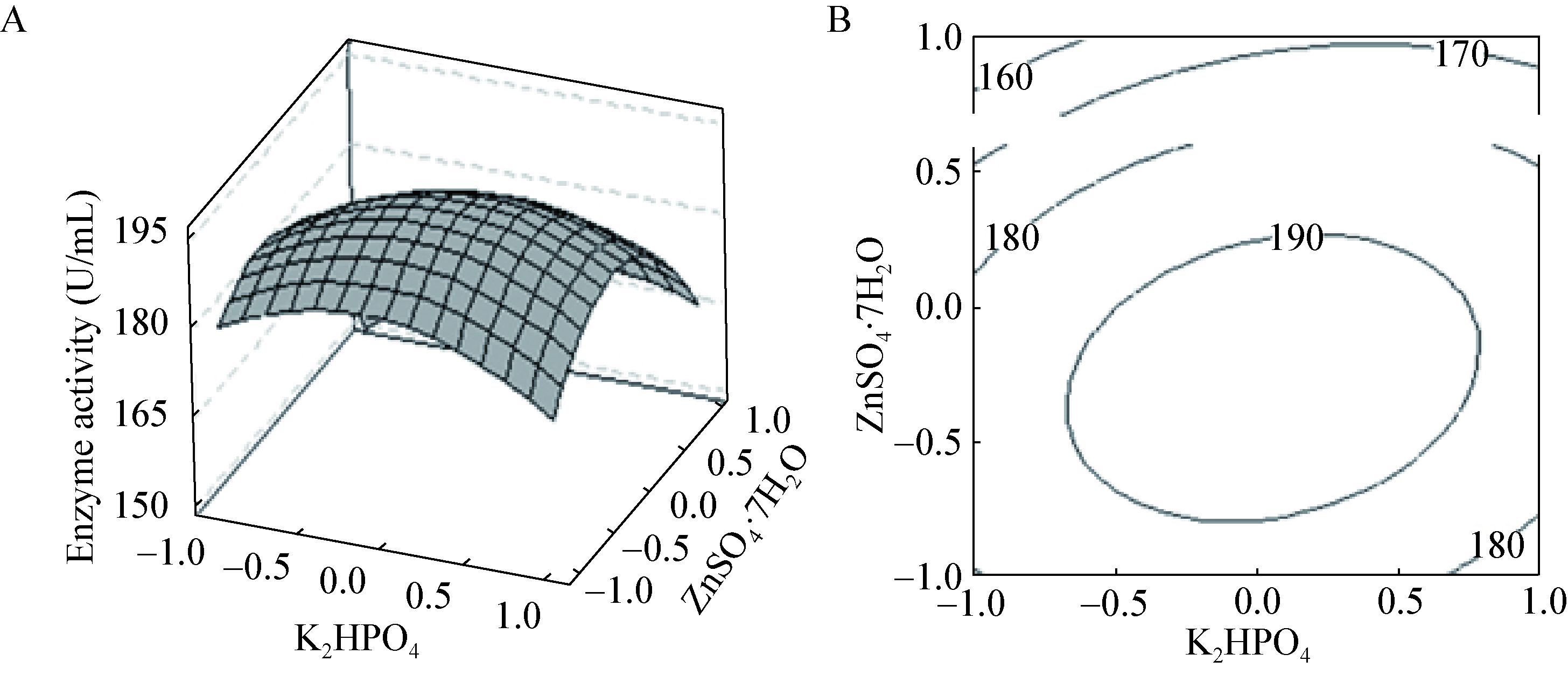
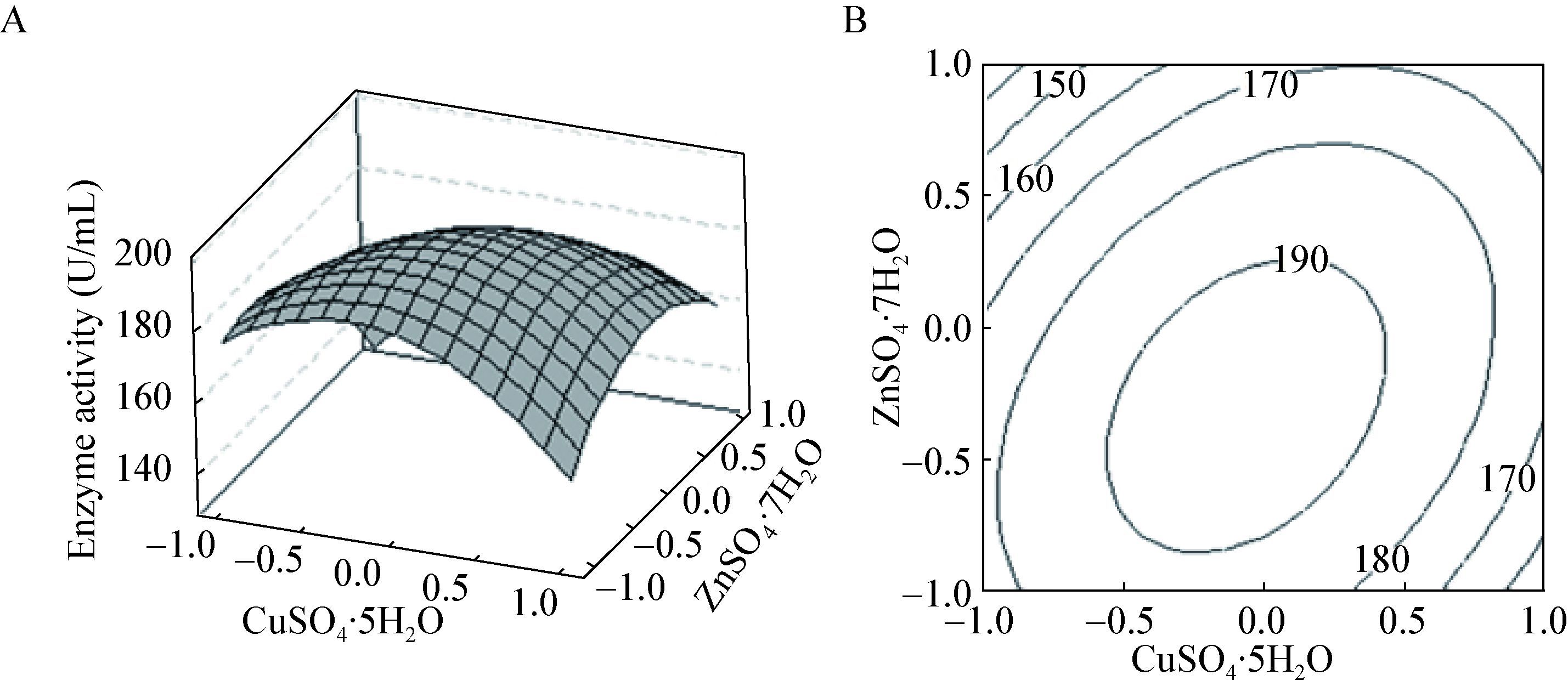
2.4.3 响应面分析:根据响应面法分析数据绘出响应面及其等高线图,图 2-4直观反应出磷酸氢二钾、硫酸铜和硫酸锌及其交互作用对酶活的影响。在等高线图中圆形等高线表示参数之间交互作用不显著,椭圆型或马鞍型等高线表示参数之间交互作用显著。
|
| 图 2 磷酸氢二钾与硫酸铜交互影响酶活曲线图(A)与等高线图(B) Figure 2 The response surface (A) and corresponding contour plot (B) for CuSO4·5H2O and K2HPO4 on the SOD activity |
|
|
|
| 图 3 磷酸氢二钾与硫酸锌交互影响酶活曲线图(A)与等高线图(B) Figure 3 The response surface (A) and corresponding contour plot (B) for ZnSO4·7H2O and K2HPO4 on the SOD activity |
|
|
|
| 图 4 硫酸铜与硫酸锌交互影响酶活曲线图(A)与等高线图(B) Figure 4 The response surface (A) and corresponding contour plot (B) for ZnSO4·7H2O and CuSO4·5H2O on the SOD activity |
|
|
由磷酸氢二钾、硫酸铜和硫酸锌交互影响的曲面图和等高线图可以看出磷酸氢二钾与硫酸铜、硫酸铜与硫酸锌交互作用与酶产量都存在显著的相关性,而且磷酸氢二钾、硫酸铜的交互作用最显著。
由图 2B可看出,当硫酸铜和硫酸锌浓度固定在一般水平时,磷酸氢二钾在1.6-1.8 g/L范围内,酶活性随着磷酸氢二钾浓度的增大而提高,当高于1.8 g/L时,SOD活性开始下降。其原因可能是磷酸氢氢二钾的浓度过高导致环境pH变化缓慢,或由于离子浓度过高,从而影响酶活。由图 3B可看出,当磷酸氢二钾和硫酸铜浓度固定在一般水平时,硫酸锌在0.013-0.014 g/L范围内,酶活性则随之提高,当浓度高于0.014 g/L时,SOD活性开始下降。其原因可能是金属离子浓度的过高或过低会对酶活产生一定影响。由图 4B可看出,当磷酸氢二钾和硫酸锌浓度固定在一般水平时,硫酸铜在0.010-0.011 g/L范围内,酶活性随着硫酸铜浓度的增大而提高,当高于0.011 g/L时,SOD活性基本不变。
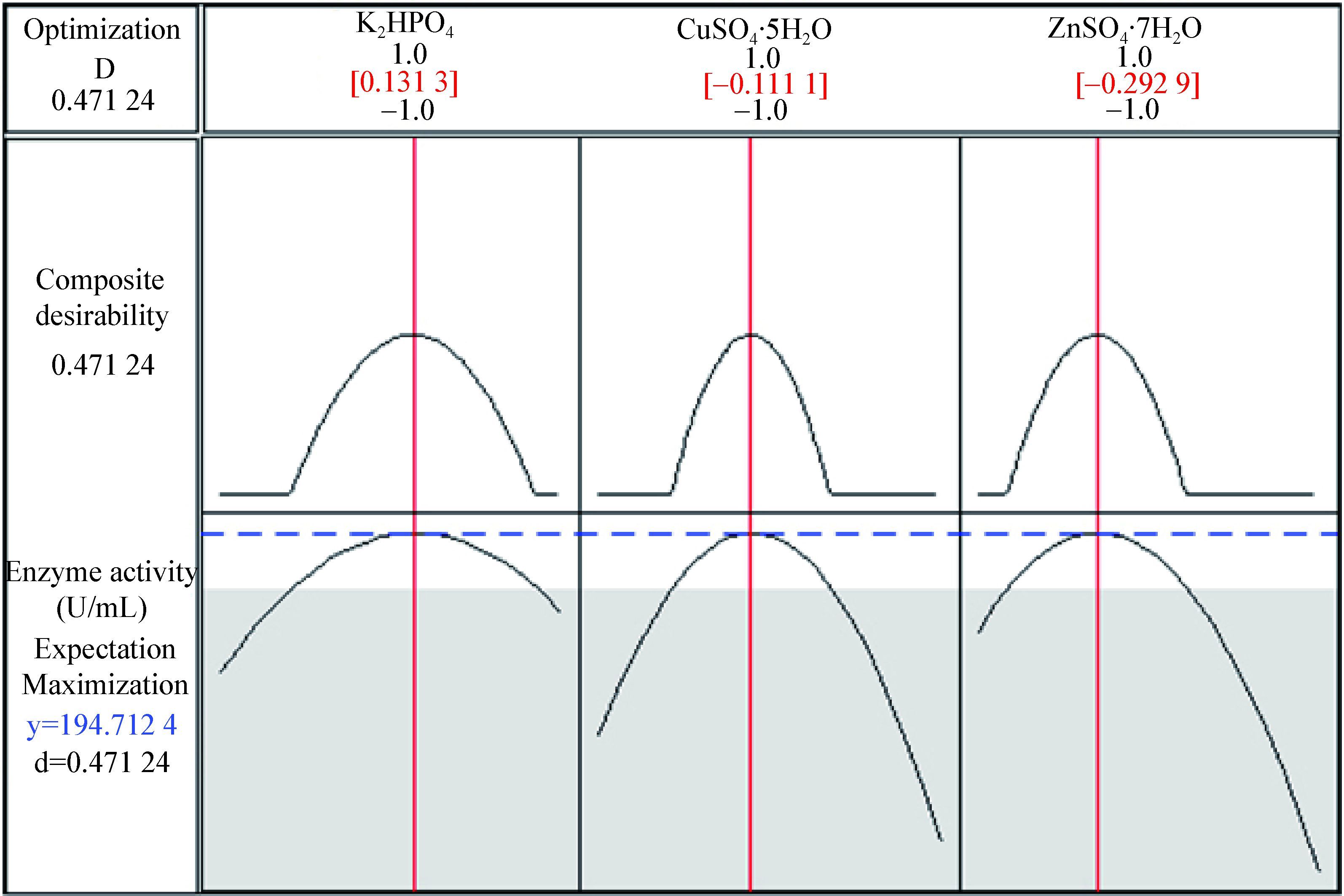
2.4.4 最优条件的确定与验证:用Minitab 17软件进行优化(图 5),由图 5可以得到最大酶活对应的各因素参数值,预测最大酶活为194.71 U/mL时所对应的磷酸氢二钾、硫酸铜、硫酸锌浓度的编码值分别为0.131 3、-0.111 1、-0.292 9,根据编码值与实际值关系,可得到最佳的浓度为磷酸氢二钾 1.83 g/L,硫酸铜0.011 g/L,硫酸锌0.014 g/L。实测3次平均酶活为194.82 U/mL,与理论预测吻合良好,表明采用响应面法优化得到的最佳条件准确可靠。
|
| 图 5 磷酸氢二钾、硫酸铜和硫酸锌的优化图 Figure 5 Optimal graph about K2HPO4 and CuSO4·5H2O and ZnSO4·7H2O |
|
|
通过发酵培养基单因素实验,确定了考察因素的基本范围,为后续响应面实验提供参考。通过PB实验设计筛选出磷酸氢二钾、硫酸铜、硫酸锌的浓度显著影响菌株产酶活性,且3个因素均为正效应。进一步对发酵培养基进行优化,得到Lactobacillus plantarum sp. CLP0279产SOD的最适发酵培养 基(g/L):玉米粉25.0,磷酸二氢钾2.6,磷酸氢二钾1.83,硫酸铜0.011,硫酸锌0.014,其最高酶活力达194.82 U/mL,是优化前的1.36倍。这一结论为植物乳杆菌Lactobacillus plantarum sp. CLP0279后期的发酵放大与潜在的工业化生产提供了理论参考。
| [1] | Castellano I, Di Maro A, Ruocco MR, et al. Psychrophilic superoxide dismutase from Pseudoalteromonas haloplanktis: biochemical characterization and identification of a highly reactive cysteine residue[J]. Biochimie , 2006, 88 : 1377–1389. DOI:10.1016/j.biochi.2006.04.005 |
| [2] | Bafana A, Dutt S, Kumar A, et al. The basic and applied aspects of superoxide dismutase[J]. Journal of Molecular Catalysis B: Enzymatic , 2006, 68 (2) : 129–138. |
| [3] | Dong L, He YZ, Wang YL, et al. Research progress on application of superoxide dismutase (SOD)[J]. Journal of Agricultural Science and Technology , 2013, 15 (5) : 53–58. (in chinese) 董亮, 何永志, 王远亮, 等. 超氧化物歧化酶(SOD)的应用研究进展[J]. 中国农业科技导报 , 2013, 15 (5) : 53–58. |
| [4] | Chen RX. Research and application in marine fishery industry of superoxide dismutase[J]. Chinese Fisheries Economics , 2014, 32 (5) : 85–91. (in chinese) 陈瑞曦. 超氧化物歧化酶研究及在海洋渔业中的应用[J]. 中国渔业经济 , 2014, 32 (5) : 85–91. |
| [5] | Yi JF, Li YM, Liu T, et al. Mn-SOD and CuZn-SOD polymorphisms and interactions with risk factors in gastric cancer[J]. World Journal of Gastroenterology , 2002, 16 (37) : 4738–4746. |
| [6] | Zeinali F, Homaei A, Kamrani E. Sources of marine superoxide dismutases: characteristics and applications[J]. International Journal of Biological Macromolecules , 2015, 79 : 627–637. DOI:10.1016/j.ijbiomac.2015.05.053 |
| [7] | Hu B, Wang CL, Lu MF. Optimization of fermentation conditions to superoxide dismutase by Escherichia coli[J]. Food Research and Development , 2008, 29 (9) : 64–67. (in chinese) 胡滨, 王昌禄, 鲁梅芳. 超氧化物歧化酶发酵条件的优化[J]. 食品研究与开发 , 2008, 29 (9) : 64–67. |
| [8] | Ma HD, Zhang LY, Zhao HD, et al. Cloning and expression of manganese superoxide dismutase gene by food-grade vector in Lactococcus lactis[J]. Food Science , 2015, 36 (1) : 135–139. (in chinese) 马红丹, 张丽媛, 赵邯郸, 等. 大豆锰超氧化物歧化酶基因在乳酸乳球菌中的分泌表达[J]. 食品科学 , 2015, 36 (1) : 135–139. |
| [9] | Liu JL, Lu XL, Cao XY, et al. Identification and fermentation condition optimization of a SOD-producing strain isolated from soil[J]. Food Science , 2011, 32 (9) : 146–150. (in chinese) 刘剑利, 芦秀丽, 曹向宇, 等. 一株SOD生产菌的分离、鉴定和产酶条件优化[J]. 食品科学 , 2011, 32 (9) : 146–150. |
| [10] | Uchihara Y, Tanaka K, Asano T, et al. Superoxide dismutase overexpression protects against glucocorticoid-induced depressive-like behavioral phenotypes in mice[J]. Biochemical and Biophysical Research Communications , 2016, 469 (4) : 873–877. DOI:10.1016/j.bbrc.2015.12.085 |
| [11] | Rujito L, Mulatsih S, Sofro ASM. Status of Superoxide dismutase in transfusion dependent thalassaemia[J]. North American Journal of Medical Sciences , 2015, 7 (5) : 194–198. DOI:10.4103/1947-2714.157480 |
| [12] | de Vendittis E, Castellano I, Cotugno R, et al. Adaptation of model proteins from cold to hot environments involves continuous and small adjustments of average parameters related to amino acid composition[J]. Journal of Theoretical Biology , 2008, 250 (1) : 156–171. DOI:10.1016/j.jtbi.2007.09.006 |
| [13] | Karan R, Capes MD, Dassarma S. Function and biotechnology of extremophilic enzymes in low water activity[J]. Aquatic Biosystems , 2012, 8 : 4. DOI:10.1186/2046-9063-8-4 |
| [14] | Merlino A, Krauss IR, Castellano I, et al. Structural and denaturation studies of two mutants of a cold adapted superoxide dismutase point to the importance of electrostatic interactions in protein stability[J]. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics , 2014, 1844 (3) : 632–640. DOI:10.1016/j.bbapap.2014.01.007 |
| [15] | Abrashev R, Feller G, Kostadinova N, et al. Production, purification, and characterization of a novel cold-active superoxide dismutase from the Antarctic strain Aspergillus glaucus 363[J]. Fungal Biology , 2016 . DOI:10.1016/j.funbio.2016.03.002 |
| [16] | Wang QF, Wang YF, Hou YH, et al. Cloning, expression and biochemical characterization of recombinant superoxide dismutase from Antarctic psychrophilic bacterium Pseudoalteromonas sp[J]. Journal of Basic Microbiology , 2015 . DOI:10.1002/jobm.201500444 |
| [17] | Marklund S, Marklund G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase[J]. European Journal of Biochemistry , 1974, 47 (3) : 469–474. DOI:10.1111/ejb.1974.47.issue-3 |
| [18] | Ma L, Wang L, Tang J, et al. Optimization of arsenic extraction in rice samples by Plackett-Burman design and response surface methodology[J]. Food Chemistry , 2016, 204 : 283–288. DOI:10.1016/j.foodchem.2016.02.126 |
| [19] | Jiang Z, Wang H, Wu QN. Optimization of polysaccharide extraction from spirodela polyrrhiza by plackett-burman design combined with box-behnken response surface methodology[J]. Journal of Chinese Medicinal Materials , 2015, 38 (6) : 1283–1286. (in chinese) 蒋征, 王红, 吴启南. PB试验结合BBD响应面法优化浮萍多糖的提取工艺研究[J]. 中药材 , 2015, 38 (6) : 1283–1286. |
 2016, Vol. 43
2016, Vol. 43