扩展功能
文章信息
- 吉文汇, 孙亮, 黄庆庆, 王恒安, 严亚贤, 孙建和
- JI Wen-Hui, SUN Liang, HUANG Qing-Qing, WANG Heng-An, YAN Ya-Xian, SUNJian-He
- 猪链球菌7 型噬菌体裂解酶Ly7917 催化域的裂菌活性
- Catalytic domain of endolysin Ly7917 harbored in lysogenic phage of Streptococcus suis 7
- 微生物学通报, 2016, 43(1): 156-163
- Microbiology China, 2016, 43(1): 156-163
- 10.13344/j.microbiol.china.150230
-
文章历史
- 收稿日期: 2015-03-20
- 接受日期: 2015-10-21
- 优先数字出版日期(www.cnki.net): 2015-11-06
2. 甘肃农业大学动物医学院 甘肃 兰州 730070
2. School of Veterinary medicine, Gansu AgriculturalUniversity, Lanzhou, Gansu 730070, China
猪链球菌(Streptococcus suis,S. suis) 2型、7型等是临床常见的引起猪群发病、死亡的病原菌,然而由于滥用抗生素等原因,临床上耐药菌株不断出现,猪链球菌病的治疗面临挑战[1]。噬菌体裂解酶具有裂菌效率高、裂菌谱广、不易产生抗性、易于批量生产等优势,作为一种新型抗菌分子备受关注[2]。Ly7917是猪链球菌7型溶原性噬菌体编码的裂解酶[3],全长含有245个氨基酸(aa),由氨基端(N端)的半胱氨酸-组氨酸依赖型氨肽酶(CHAP)催化结构域和羧基端(C端)的SH3b结合结构域组成[4],研究发现该酶热稳定性好、裂菌谱广、裂菌活性强,对S. suis 2型强毒株HA9801感染小鼠的保护率高,具有开发应用潜力。
虽然Ly7917的裂菌活性已经确认,但其裂菌机制及活性相关功能域尚不清楚。因此本文拟通过分段和截短表达Ly7917全酶和催化功能域LyCHAP,通过比较分段或截短后蛋白的活性,确定Ly7917的核心功能域和活性片段。鉴于Ca2+可以有效提高Ly7917的裂菌活性,拟通过揭示Ly7917蛋白的Ca2+结合区域,为进一步改造裂解酶提供基础数据。
1 材料与方法 1.1 实验材料表达质粒:pSJ2,由pET21a(+)改造构建,携带氨苄青霉素(Amp+)抗性和N端His6纯化标签,由中国科学院上海有机化学研究所周佳海研究员惠赠。
感受态细胞:Trans5α、BL21(DE3)均购自北京全式金生物技术有限公司。
细菌菌株:HA9801,为S. suis 2型猪源强毒分离株,本实验室保存。
LB培养基(g/L):氯化钠10,蛋白胨10,酵母浸出粉5。1×105 Pa灭菌15 min,冷却至室温并加入氨苄青霉素(Amp+)至终浓度100 mg/L。酶类及其他试剂:TransStart® FastPfu DNA聚合酶试剂盒,购自北京全式金生物技术有限公司;快速限制性内切酶BamH I、Xho I、T4快速连接试剂盒(Thermo FisherScientific Inc.)、Omega胶回收试剂盒,购自上海前尘生物技术有限公司;BCA蛋白浓度测定试剂盒,购自碧云天生物技术有限公司。HistrapFast flow镍离子亲和纯化填料、DEAE Sepharose fast flow弱阴离子交换纯化填料,GE公司,国药集团化学试剂有限公司代购。
1.2 实验方法 1.2.1 目的片段克隆及鉴定:裂解酶Ly7917的基因全长738 bp,编码245 aa。经Pfam在线分析,Ly7917由两个结构域构成,N端1−146 aa为CHAP催化结构域,C端163−227 aa为SH3b结合结构域。为了揭示CHAP的活性及活性区域,按照图 1所示,从CHAP的N端及C端分别截短CHAP结构域,通过与Ly7917全长及LyCHAP全长(1−150 aa)进行活性比较,寻找活性中心。

|
|
图 1
Ly7917结构域分析及蛋白质截短方案
Figure 1
Domains prediction ofLy7917 and serial truncated peptide
注:结构域预测基于http://pfam.xfam.org/相关软件. Note: Domains predicted at websitehttp://pfam.xfam.org/. |
通过分析,选择从Ly7917的N端分别截短16 aa (Ly791717−245)、25 aa (Ly791726−245)、52aa (Ly791753−245)、78 aa (Ly791779−245);从LyCHAP的C端分别截短10 aa (LyCHAP1−140)、20 aa (LyCHAP1−130)、32aa (LyCHAP1−118)、50 aa (LyCHAP1−100)。
根据相应序列设计引物(表 1),使用TranStart® FastPfu DNA聚合酶试剂盒扩增裂解酶蛋白Ly7917全长及片段Ly791717−245、Ly791726−245、Ly791753−245和Ly791779−245;扩增催化结构域蛋白LyCHAP全长及片段LyCHAP1−100、LyCHAP1−118、LyCHAP1−130和LyCHAP1−140。50 μLPCR反应体系组成:1 μL TranStart® FastPfu DNA聚合酶,10 μL 5×TranStart®FastPfu Buffer,5 μL 2.5 mmol/L dNTPs,2 μL10 mmol/LLy7917 Forward Primer (F),2 μL10 mmol/L Ly7917 Reverse Primer (R),1 μL phi7917基因组,29 μL双蒸水。PCR体系反应条件为:95 °C 2 min;95 °C 20 s,50 °C (最低引物Tm值−5 °C) 20 s,72 °C 25 s,共30个循环;72 °C 5 min。用1%琼脂糖凝胶电泳检测PCR产物,胶回收试剂盒回收目的片段,并将目的片段、pSJ2载体分别用快切酶BamH I和Xho I于37 °C恒温酶切30 min。双酶切产物用快速连接酶试剂盒于22 °C水浴条件下连接30 min。将连接产物转化100 μL全式金Trans5α感受态细胞,涂布Amp+ LB平板后,置于37 °C恒温培养过夜。
| 引物名称 Primer name | 引物序列 Primer sequence (5′→3′) | 限制性酶切位点 Restriction enzyme |
| Ly7917 F | cgGGATCCatgacaacagtaaatg | BamH I |
| Ly791717−245 F | cgGGATCCtccggtgtgtctgttggcaatg | BamH I |
| Ly791726−245 F | cgGGATCCtgctatgctttggccagttg | BamH I |
| Ly791753−245 F | cgGGATCCagtggtgccactggtgatac | BamH I |
| Ly791779−245 F | cgGGATCCtccacatctgggccatttcaag | BamH I |
| Ly7917 R | gCTCGAGttatttaaaagtaccccaggc | Xho I |
| LyCHAP R | ccgCTCGAGttacgttccaggcggtgtgatgt | Xho I |
| LyCHAP1−100 R | CgCTCGAGttaataggggttgcctgatg | Xho I |
| LyCHAP1−118 R | ccgCTCGAGttactccagaatggtcaatc | Xho I |
| LyCHAP1−130 R | cgCTCGAGttagttgcgggtagggtac | Xho I |
| LyCHAP1−140 R | cgCTCGAGttactgttgacggtagctag | Xho I |
| pSJ2 F | gtgagccggataacaattc | |
| pSJ2 R | agcttcctttcgggctttg |
Note:*: The reverse complementarysequences of a termination codon tta added in reverse primer.
从每个LB平板中挑取3个单克隆,用载体引物pSJ2F、pSJ2R进行菌落PCR鉴定。扩增程序同上。对PCR鉴定阳性的菌液进行测序。
1.2.2 蛋白诱导表达及活性初筛:从测序正确的菌液中提取质粒并转化感受态细胞BL21(DE3),挑取阳性单克隆菌落小量培养,然后按1%转接到含5mL Amp+ LB液体培养基试管中,37 °C、200 r/min培养至OD600=0.6,加入IPTG至终浓度为1 mmol/L,于27 °C、120 r/min培养4 h诱导蛋白表达。设pSJ2-BL21为空白对照,未诱导的菌株为阴性对照。蛋白表达水平采用SDS-PAGE (分离胶12%,浓缩胶4%)进行检测。将表达每种蛋白的对应菌种转接入含1 L Amp+ LB液体培养基的三角摇瓶中进行大量表达,培养与诱导方法同上。收集菌体,重悬于30 mL Binding Buffer A (0.02 mol/L Na3PO4,0.3 mol/L NaCl,pH7.4)中,采取冰浴-超声波裂解细胞。8 000 r/min离心后收集上清液(蛋白粗提液),并经0.22 μm滤器(Millipore)过滤,参照Bustamante等[5]采用平板裂解法,以HA9801为指示菌,通过观察裂菌圈大小来确定蛋白粗提液的活性,并以pSJ2-BL21诱导的粗提物为阴性对照,Ly7917为阳性对照。对可以产生裂菌圈的表达蛋白进行进一步蛋白纯化。没有产生裂菌圈的蛋白,则视为无裂解能力。
1.2.3 蛋白纯化及活性比较:按照产品说明书,使用Histrap fast flow镍离子亲和层析技术纯化His标签融合蛋白,并进一步采用DEAE Sepharose fast flow进行弱阴离子交换亲和层析纯化。用BCA蛋白浓度测定试剂盒测定纯化蛋白浓度,并将定量后的蛋白质溶液按照其蛋白质分子量大小调整到相同摩尔浓度后进行下一步的裂菌活性比较研究。参照Nelson等[6]建立的96孔板-浊度递减法,检测纯化蛋白的活性。用灭菌PBS将HA9801重悬至OD650=0.6,加入96孔板,100 μL/孔。将各种蛋白溶液作2倍稀释为3个梯度20、21、22,加入到96孔板,100 μL/孔,每个浓度设置3个重复孔。阴性对照只加入对应的缓冲液。37 °C恒温孵育15 min,酶标仪测定OD650的吸光度值(细菌浊度)。
为了揭示Ca2+对裂解酶活性的影响,按照上述方法,先将蛋白溶液稀释后依次加入96孔板,每个稀释度重复6孔,其中3孔加入1μL 1 mol/L CaCl2溶液至终浓度为1 mmol/L,另3孔不加CaCl2,阴性对照为PBS+buffer A。37 °C感作15 min后每孔加入100 μL HA9801悬液,再于37 °C放置15 min后读取OD650吸光度值。分析Ca2+对截短蛋白的酶活性的影响[7]。
2 结果与分析设计的10个Ly7917全长或截短片段:Ly7917、Ly791717−245、Ly791726−245、Ly791753−245、Ly791779−245、LyCHAP、LyCHAP1−140、LyCHAP1−130、LyCHAP1−118和LyCHAP1−100,经PCR成功扩增(图 2)后测序分析显示序列完全正确。
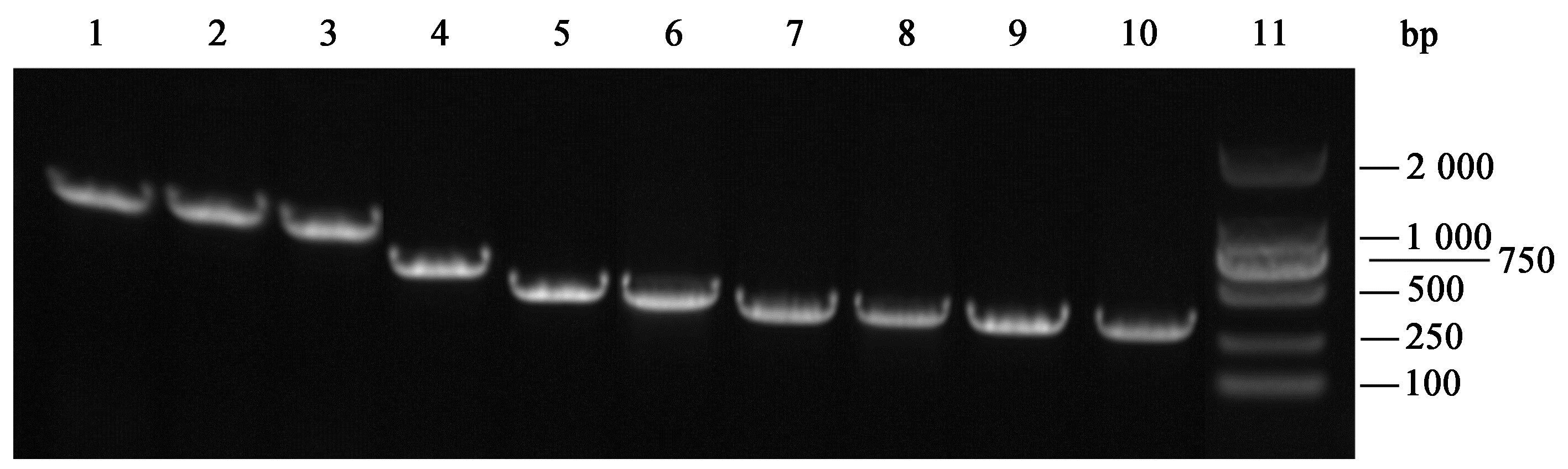
|
| 图 2 2PCR产物电泳图 Figure 2 Electrophoretogram of PCR products Note:1: Ly7917; 2: Ly791717−245; 3: Ly791726−245; 4: Ly791753−245; 5: Ly791779−245; 6: LyCHAP; 7: LyCHAP1−140; 8: LyCHAP1−130; 9: LyCHAP1−118; 10: LyCHAP1−100; 11: Marker 2000. |
构建了10个Ly7917全长或截短片段的重组质粒(表 2),重组菌经诱导后呈可溶性表达。采用目标蛋白粗提物进行的平板裂解实验显示(图 3),Ly7917和LyCHAP粗提物的裂菌圈非常明显,直径均约为13 mm左右。LyCHAP1−140、LyCHAP1−130、LyCHAP1−118、LyCHAP1−100粗提物形成的裂菌圈相对较小且依次减小,裂菌圈直径介于9−11 mm之间,其中,LyCHAP1−140的裂菌圈直径为11 mm,LyCHAP1−100的为9 mm。而Ly791717−245、Ly791726−245、Ly791753−245和Ly791779−245粗提物均未形成可见裂菌圈,将视为无裂解活性。将Ly7917、LyCHAP、LyCHAP1−140、LyCHAP1−130、LyCHAP1−118和LyCHAP1−100进一步采用镍柱纯化,并对LyCHAP进行离子交换层析纯化。

|
|
图 3
平板裂解试验
Figure 3
Plate lysis assay
注:1:Ly7917;2:LyCHAP;3:LyCHAP1−140;4:LyCHAP1−130;5:LyCHAP1−118;6:LyCHAP1−100;7:Ly791717−245;8:Ly791726−245;9:Ly791753−245;10:Ly791779−245;11:阴性对照(pSJ2-BL21).琼脂打孔孔径为8 mm,以上各孔中加入的均为表达后的蛋白质粗提液. Note: 1: Ly7917; 2: LyCHAP; 3: LyCHAP1−140; 4: LyCHAP1−130; 5: LyCHAP1−118; 6: LyCHAP1−100; 7: Ly791717−245; 8: Ly791726−245; 9: Ly791753−245; 10: Ly791779−245; 11: Negative control(pSJ2-BL21). Crude extracts of each peptide were added into the wells with a diameter of 8 mm. |
| 蛋白名称 Protein name | 核算序列长度 Nucleotide length (bp) | 重组质粒名称 Recombinant plasmid | 融合蛋白大小 Fusion protein (kD) | 预测pI值* pI value |
| Ly7917 | 738 | Ly7917−pSJ2 | 26.1+3.3 | 6.79 |
| Ly791717−245 | 690 | Ly791717−245−pSJ2 | 24.2+3.3 | 6.79 |
| Ly791726−245 | 663 | Ly791726−245−pSJ2 | 23.6+3.3 | 7.16 |
| Ly791753−245 | 582 | Ly791753−245−pSJ2 | 20.7+3.3 | 7.96 |
| Ly791779−245 | 504 | Ly791779−245−pSJ2 | 18.1+3.3 | 7.98 |
| LyCHAP | 453 | LyCHAP−pSJ2 | 15.8+3.3 | 6.16 |
| LyCHAP1−140 | 423 | LyCHAP1−140−pSJ2 | 14.7+3.3 | 6.09 |
| LyCHAP1−130 | 393 | LyCHAP1−130−pSJ2 | 13.5+3.3 | 5.92 |
| LyCHAP1−118 | 357 | LyCHAP1−118−pSJ2 | 12.1+3.3 | 5.40 |
| LyCHAP1−100 | 303 | LyCHAP1−100−pSJ2 | 10.2+3.3 | 5.80 |
Note: *pI values of eachpeptide were predicted on http://web.expasy.org/compute_pi/. Fusion proteinswere consists of target protein and 26 aa (3.3kD) on plasmid.
经过Ni-NTA镍柱层析,获得纯化的Ly7917、LyCHAP、LyCHAP1−140、LyCHAP1−130、LyCHAP1−118和LyCHAP1−100 6个蛋白,均洗脱于含200 mmol/L咪唑的Binding buffer A (200-A);LyCHAP经镍柱纯化后,进一步采用DEAE弱阴离子纯化,洗脱于含100 mmol/L NaCl的Binding buffer B (100-B)中(图 4)。将纯化后的各蛋白浓度均调整到1.5 μmol/L, 进行活性测试,比较各蛋白与细菌作用后的相对浊度(反应孔细菌浊度/阴性对照孔细菌浊度)大小。
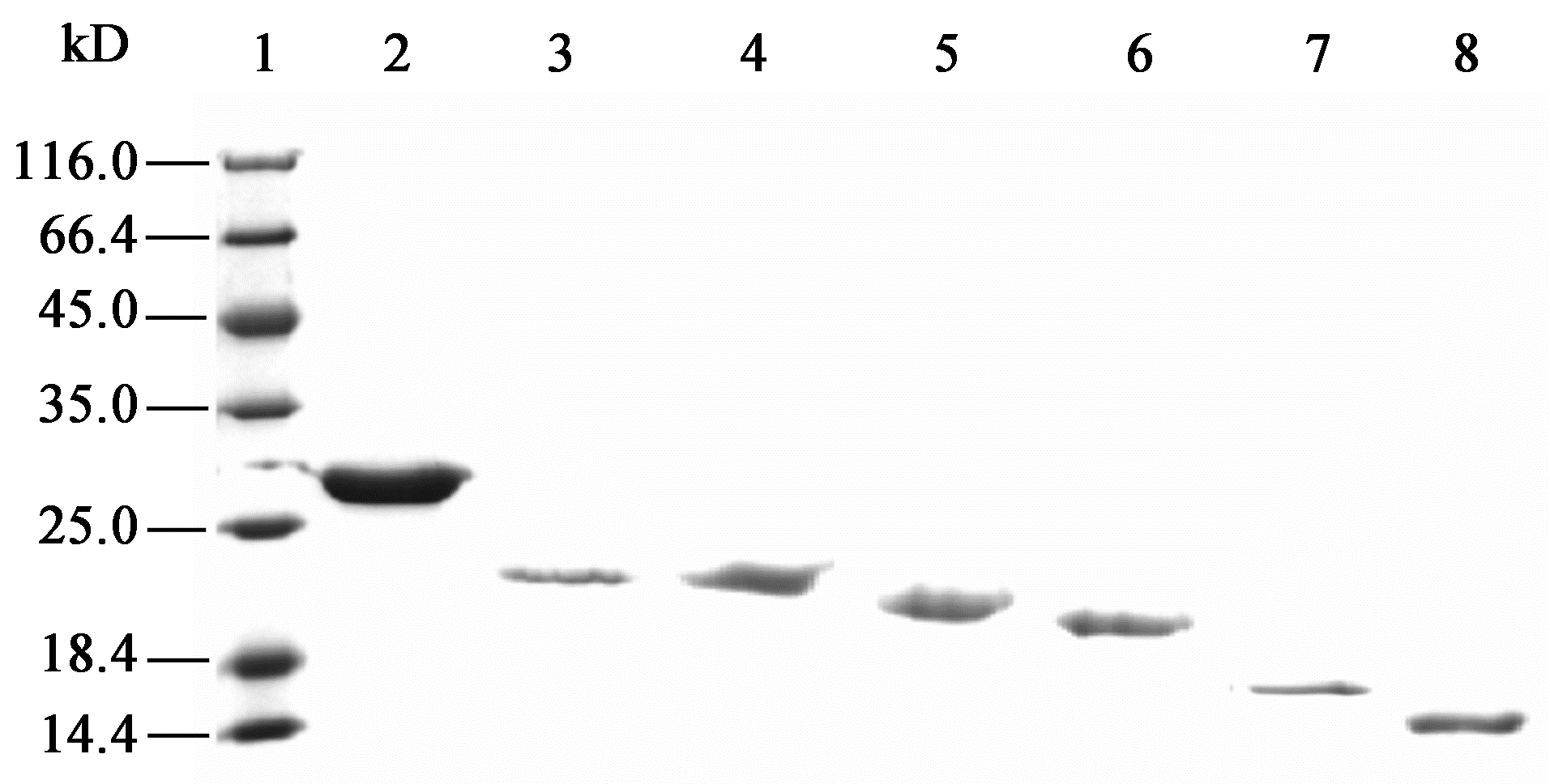
|
|
图 4
纯化蛋白SDS-PAGE图
Figure 4
SDS-PAGE of purified protein ofLy7917 and C-terminal truncated LyCHAP
注:1:蛋白Marker;2:Ly7917;3:LyCHAP (离子纯化);4:LyCHAP;5:LyCHAP1−140;6:LyCHAP1−130;7:LyCHAP1−118;8:LyCHAP1−100. Note: 1: Protein marker; 2: Ly7917; 3: LyCHAP (DEAE); 4:LyCHAP; 5: LyCHAP1−140; 6: LyCHAP1−130; 7: LyCHAP1−118;8: LyCHAP1−100. |
结果显示(图 5),用200-A洗脱液作22稀释,摩尔数相同的各蛋白中,Ly7917全酶的活性最强,其对应的相对细菌浊度最低,约为47%;其次是LyCHAP约50%。LyCHAP1−140的活性较LyCHAP略低,其对应的相对细菌浊度约52%。LyCHAP随着aa数量的逐渐减少,对应的细菌浊度比值也相应增高,裂解活性随之降低。Ly79171−118与LyCHAP1−100的裂解活性均相对较低,二者之间无显著差异。活性最低的LyCHAP1−100对应的相对细菌浊度较LyCHAP的高约22%,较Ly7917全酶的高约25%。溶解于不同缓冲溶液的LyCHAP表现出明显的活性差异,用100-B洗脱液作22稀释的LyCHAP对应的相对细菌浊度低于用200-A洗脱液稀释的LyCHAP近10%。
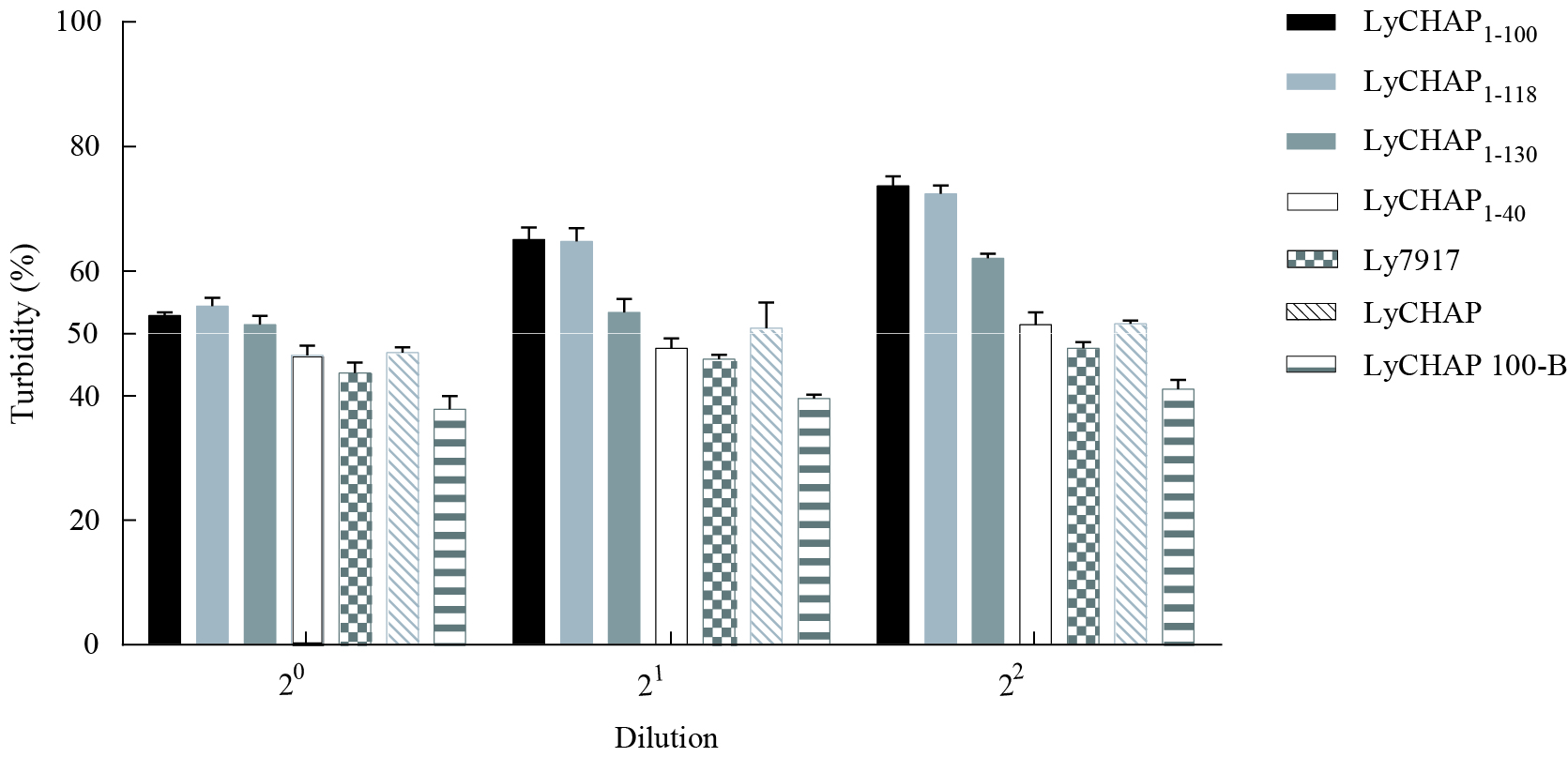
|
|
图 5
蛋白质分段表达后相对活性比较
Figure 5
Catalytic activity analysis of partial and full length of Ly7917
注:溶解于200 mmol/L咪唑的Binding Buffer A (200-A)中的Ly7917、LyCHAP、LyCHAP1−140、LyCHAP1−130、LyCHAP1−118和LyCHAP1−100 6个蛋白没有特别标注出溶解溶液,进一步离子纯化后的LyCHAP溶解于100 mmol/L NaCl BindingBuffer B中,标注为LyCHAP100-B. Note:Ly7917, LyCHAP, LyCHAP1−140, LyCHAP1−130, LyCHAP1−118and LyCHAP1−100 were purified by Histrap fast flow resin and LyCHAP100-B was purified by DEAE iron exchange resin. |
图 6中,未加Ca2+的5个蛋白在两个浓度梯度上,所对应的相对细菌浊度大小依次为LyCHAP1−100>LyCHAP1−118>LyCHAP1−130>LyCHAP1−140>LyCHAP,与图 4结果一致。23稀释度下各蛋白对应的相对细菌浊度均高于22稀释度下对应的相对细菌浊度。添加1 mmol/L Ca2+后,LyCHAP1−100、LyCHAP1−118、LyCHAP1−130所对应的相对细菌浊度大小依次为LyCHAP1−100>LyCHAP1−118>LyCHAP1−130,且各蛋白对应的相对细菌浊度明显比未添加Ca2+的低。LyCHAP1−140对应的相对细菌浊度在添加Ca2+后并无明显降低,而LyCHAP在添加Ca2+后相对细菌浊度较未添加组明显增高。
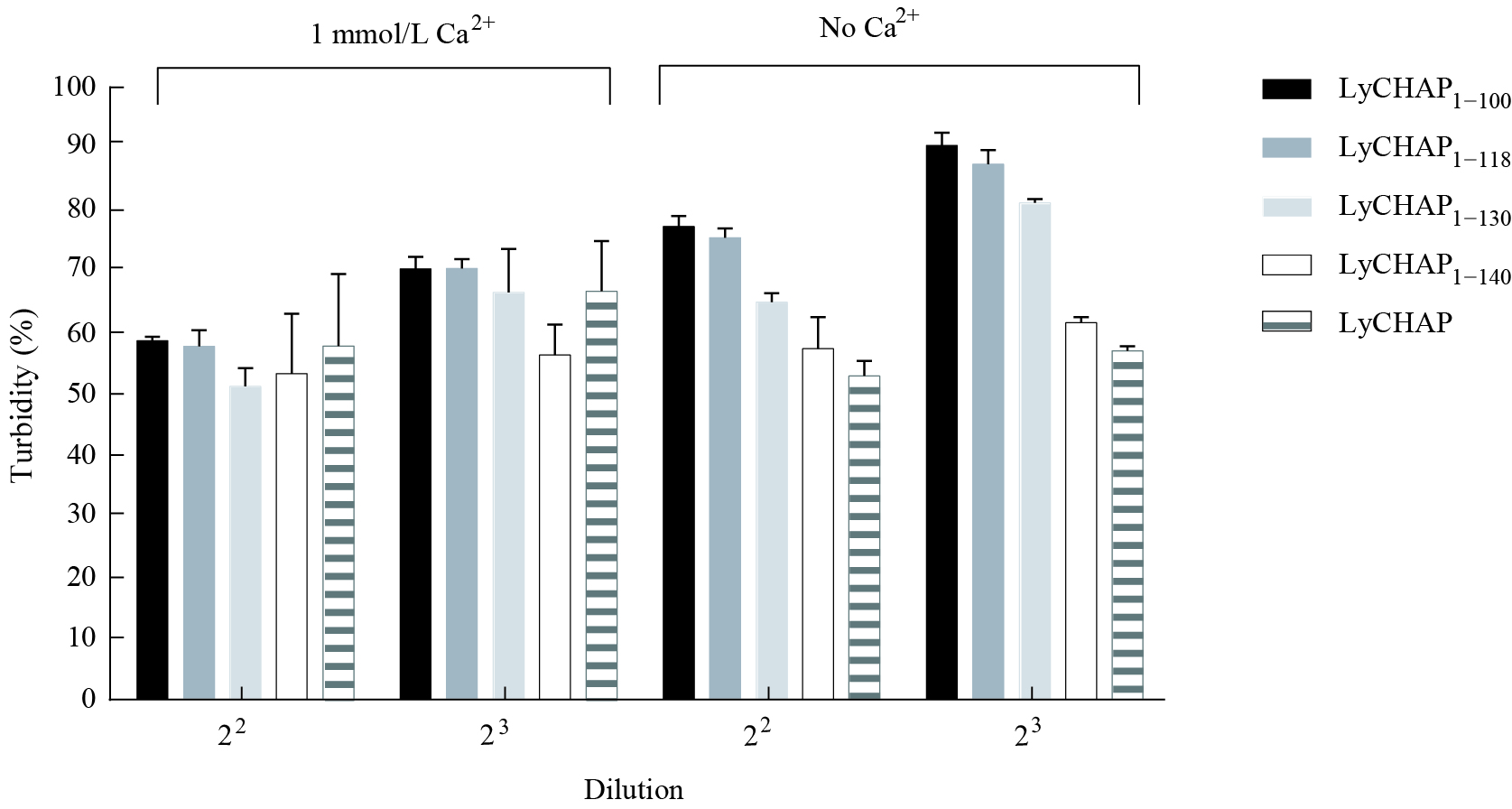
|
| 图 6 Ca2+对含不同长度裂解结构域的LyCHAP蛋白活性影响 Figure 6 Effect of Ca2+ on serial peptieds of LyCHAP |
S. suis 7型菌株溶原性噬菌体phi7917编码的裂解酶Ly7917的生物活性已在本实验室前期工作中得到证实。Ly7917是一个热稳定性高、裂菌谱广、裂解活性强的新型裂解酶。CHAP为Ly7917裂解酶的催化结构域,决定着Ly7917的裂菌能力。本实验通过构建、表达Ly7917的10个截短或分段表达的蛋白并通过比较蛋白的裂菌活性,定位了CHAP的活性区域。同时,发现Ca2+对Ly7917全酶的裂解活性具有明显的增强作用。
研究结果显示,LyCHAP及其4个C端截短的蛋白LyCHAP1−140,LyCHAP1−130、LyCHAP1−118和LyCHAP1−100均有裂解活性。摩尔数相同条件下,经镍柱纯化的蛋白裂解活性由高到低依次为Ly7917>LyCHAP>LyCHAP1−140>LyCHAP1−130>LyCHAP1−118>LyCHAP1−100。经离子交换纯化的LyCHAP (100-B)的裂解活性明显高于相同摩尔数的LyCHAP (200-A)。究其原因,可能是因为LyCHAP融合蛋白的等电点pI为6.16,100-B溶液的pH值较200-A更高,更适宜LyCHAP解离为离子态而更好地保持活性。Ly791717−245、Ly791726−245、Ly791753−245和Ly791779−245 4个N端依次截短的蛋白质在平板裂解实验中均未表现出裂菌活性,说明N端1−16 aa参与酶活性部位组成或其空间结构构成,对整个CHAP裂解结构域的活性有很大的影响。
在添加Ca2+后,LyCHAP1−100、LyCHAP1−118和LyCHAP1−130对HA9801的裂解活性均有明显提高,其活性强弱依次为LyCHAP1−130>LyCHAP1−118>LyCHAP1−100,与其未添加Ca2+时的裂解活性强弱排序一致,说明Ly7917 的1−100 aa内存在Ca2+结合位点。Ca2+的添加对LyCHAP1−140的裂解活性未表现出明显的增强效果,对LyCHAP的作用反而是抑制。从理论上分析应该是LyCHAP越完整,Ca2+所体现出的促活性增强作用越明显。在Ca2+存在的情况下,各蛋白的裂解活性强弱顺序与未添加Ca2+时的活性强弱顺序一致:LyCHAP>LyCHAP1−140>LyCHAP1−130>LyCHAP1−118>LyCHAP1−100。推测LyCHAP的130−146 aa之间的序列有可能会在Ca2+存在的条件下使得Ca2+与LyCHAP截短蛋白形成络合物或者复合物,其本身就会使得反应孔内的浊度增高。其次,形成复合物有可能会影响酶的裂解作用,使裂解细菌能力减弱,这将在今后的试验中进一步验证。此外,LyCHAP1−130比相同摩尔浓度未添加Ca2+的LyCHAP裂解能力还强。因此,在添加1 mmol/L Ca2+的条件下,分子量更小的LyCHAP1−130代替LyCHAP甚至Ly7917应用于临床治疗,会有更大的优势。
总之,Ly7917的裂解能力略高于LyCHAP。但是LyCHAP分子量小,在表达纯化方面更有优势。在添加Ca2+至终浓度为1 mmol/L条件下,LyCHAP1−130活性显著增强且活性最高,比相同摩尔浓度添加及未添加Ca2+的LyCHAP裂解能力还强,可媲美Ly7917全酶,为裂解酶的进一步改造及临床应用奠定了理论基础。
| [1] | Meng XP, Shi YB, Ji WH, et al. Application of a bacteriophage lysin to disrupt biofilms formed by the animal pathogen Streptococcus suis[J]. Applied and Environmental Microbiology, 2011, 77(23): 8272-8279 |
| [2] | Fischetti VA. Bacteriophage endolysins: A novel anti-infective to control Gram-positive pathogens[J]. International Journal of Medical Microbiology, 2010, 300(6): 357-362 |
| [3] | Tang F, Bossers A, Harders F, et al. Comparative genomic analysis of twelve Streptococcus suis (pro)phages[J]. Genomics, 2013, 101(6): 336-344 |
| [4] | Huang QQ, Ji WH, Du B, et al. Mining and evaluating the high-effectiveness and broad-spectrum endolysin encoded by prophage harbored in Streptococcus suis serotype 7[J]. Microbiology China, 2015, 42(6): 1052-1059 (in Chinese) 黄庆庆, 吉文汇, 杜斌, 等. 高效广谱猪链球菌7型前噬菌体裂解酶的挖掘及活性研究[J]. 微生物学通报, 2015, 42(6): 1052-1059 |
| [5] | Bustamante N, Rico-Lastres P, García E, et al. Thermal stability of Cpl-7 endolysin from the streptococcus pneumoniae bacteriophage Cp-7; cell wall-targeting of its CW_7 motifs[J]. PLoS One, 2012, 7(10): e46654 |
| [6] | Nelson D, Loomis L, Fischetti VA. Prevention and elimination of upper respiratory colonization of mice by group A streptococci by using a bacteriophage lytic enzyme[J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(7): 4107-4112 |
| [7] | Gu JM, Feng YG, Feng X, et al. Structural and biochemical characterization reveals LysGH15 as an unprecedented “EF-Hand-Like’’ calciumbinding phage lysin[J]. PLoS Pathogens, 2014, 10(5): e1004109 |
 2016, Vol. 43
2016, Vol. 43




