扩展功能
文章信息
- 吉晋波, 陆震鸣, 龚劲松, 余永建, 李国权, 陆茂林, 史劲松, 许正宏
- JI Jin-Bo, LU Zhen-Ming, GONG Jin-Song, YU Yong-Jian, LI Guo-Quan, LU Mao-Lin, SHI Jin-Song, XU Zheng-Hong
- 镇江香醋醋醅抑菌活性及机理的初步分析
- Antibacterial activity of fermentation culture of Zhenjiang aromatic vinegar
- 微生物学通报, 2016, 43(1): 116-122
- Microbiology China, 2016, 43(1): 116-122
- 10.13344/j.microbiol.china.150208
-
文章历史
- 收稿日期: 2015-03-16
- 接受日期: 2015-05-11
- 优先数字出版日期(www.cnki.net): 2015-05-13
2. 国家固态酿造工程技术研究中心 四川 泸州 646000;
3. 江苏恒顺醋业股份有限公司 江苏 镇江 214043;
4. 江苏省微生物研究所 江苏 无锡 214063
2. National Engineering Research Center of Solid-State Brewing, Luzhou, Sichuan 646000, China;
3. Jiangsu Hengshun Vinegar Industry Co., Ltd., Zhenjiang, Jiangsu 214043, China;
4. Jiangsu Institute of Microbiology, Wuxi, Jiangsu 214063, China
LU Mao-Lin: E-mail: lumaolin@jsim.cn;
镇江香醋是我国传统固态酿造食醋的典型代表,具有醇香浓厚、回味悠长的特点[1]。镇江香醋的生产过程分为酒精发酵、醋酸发酵及后期陈酿3个阶段,其中醋酸发酵阶段是食醋中典型风味物质合成的重要阶段[2]。近年来多项研究结果表明,醋酸发酵过程中参与的微生物呈现丰富的多样性[3, 4],其中醋酸杆菌和乳酸杆菌是主要的酿醋功能微生物(两者数量占菌群生物量的80%以上)[5, 6]。
另一方面,由于醋酸发酵过程的半开放发酵模式,来源于酿造原料、生产环境和操作器械的大量微生物会进入醋醅中,与酿醋功能微生物进行竞争性的生长。目前对于醋酸发酵系统如何抵御系统外环境微生物的竞争、酿醋功能菌群如何实现“自我净化”等问题尚缺少深刻的认识。本研究采用琼脂扩散法评价了不同发酵时间醋醅的水提取液及醋醅中分离获得的4种酿醋功能微生物(Acetobacter pasteurianus,A. pomorum,Lactobacillus helveticus,L. plantarum)发酵上清液对4种指示菌的生长抑制效果,并初步研究了抑菌活性物质的种类和特性。
1 材料与方法 1.1 实验材料 1.1.1 菌株及培养基: 所用的4株酿醋功能微生物(A. pasteurianus,A. pomorum,L. helveticus,L. plantarum)和4株指示微生物(Escherichia coli, Staphylococcus aureus,Aspergillus niger,Penicillium chrysogenum)均由本研究室保藏。所用的MRS培养基、肉汤培养基和PDA培养基,购自国药集团化学试剂有限公司;改良肉汤培养基添加3%乙醇。 1.1.2 醋醅样品: 醋酸发酵过程的醋醅样品取样于江苏恒顺醋业股份有限公司,每天取样1次。 1.1.3 主要试剂及器材: 木瓜蛋白酶(比活> 3 500 U/mg)、胰蛋白酶(比活≥2 500 U/mg)、溶菌酶(比活>22 800 U/mg)、蛋白酶K (比活>600 U/mg),生工生物工程(上海)股份有限公司;其他试剂,分析纯,国药集团化学试剂有限公司。牛津杯,上海江星仪器有限公司;SPX-250B-Z型生化培养箱,上海博讯实业有限公司医疗设备厂;HYL-C组合式摇床,太仓市强乐实验设备有限公司;台式高速冷冻离心机,德国Sigma公司;Mettler Toledo pH计,上海Mettler Toledo仪器有限公司;Bio-Rad 电泳仪、Bio-Rad Mini-PROTEAN® Tetra电泳槽,美国Bio-Rad公司;戴安Ultimate 3000 HPLC分析仪,戴安中国有限公司。
1.2 预处理 1.2.1 醋醅水提取液的制备: 取发酵不同时间的醋醅样品5 g置于具塞三角瓶中,加入15 mL超纯水,室温下振荡提取3 h后采用双层滤纸和0.22 μm无菌滤膜过滤除菌,得到醋醅水提取液。 1.2.2 酿醋功能微生物发酵上清液制备: 活化不同酿醋功能微生物,培养至48 h;菌液离心(8 000 r/min,5 min)后取上清液,经0.22 μm无菌滤膜过滤后待用。未接种的空白培养基进行相同处理后作为阴性对照,5%苯酚为阳性对照[7]。 1.2.3 指示微生物的培养: 活化E. coli和S. aureus 两株细菌指示微生物,转接至肉汤培养基,于37 °C、220 r/min培养12 h;发酵液梯度稀释后涂布平板,培养过夜后计数[8]。活化A. niger,P. chrysogenum两株霉菌指示微生物,转接至PDA培养基,于28 °C、120 r/min培养3 d,过滤掉菌丝体,利用血球计数板计算霉菌孢子个数。 1.3 实验方法 1.3.1 琼脂扩散方法: 将10 mL含2%琼脂的肉汤培养基倾注无菌平板;待凝固,置无菌牛津杯嵌于培养基中;将温度降至50 °C、含0.75%琼脂糖的肉汤培养基与细菌指示微生物混匀(控制添加细菌指示微生物的体积,稀释细菌指示微生物的浓度为107 CFU/mL[9]),迅速倾注于平板中;待培养基凝固,取出牛津杯,于每孔中注入150 μL待测样品;于37 °C培养过夜,测定抑菌圈大小。对霉菌指示微生物的抑制实验使用PDA培养基,控制微生物的浓度为104个孢子/mL,其他步骤同上述琼脂扩散方法,再于28 °C恒温培养箱中培养3 d,测定抑菌圈大小。实验过程中设置3个平行。以未接种微生物的发酵培养基作为阴性对照组,以5%苯酚溶液为阳性对照组。
1.3.2 不同酿醋功能微生物发酵上清液潜在抑菌物质特性分析[10]: (1) 热处理: 取发酵上清液沸水浴30 min,0.22 μm无菌滤膜过滤除菌,进行抑菌活性评价。(2) 蛋白酶处理: 取发酵上清液用2 mol/L氢氧化钠调pH至6.5,分别加入0.5 g/L的木瓜蛋白酶、胰蛋白酶、溶菌酶或蛋白酶K,摇匀后37 °C酶解2 h,再用乳酸调节pH至原值,0.22 μm无菌滤膜过滤除菌后进行抑菌活性评价。(3) 抑菌活性物质分子量分析: 将发酵上清液用大小为8 kD的透析袋透析,分别浓缩透析外液及内液,0.22 μm无菌滤膜过滤除菌后进行抑菌活性评价。取浓缩样品40 μL及上样缓冲液10 μL,混匀,于沸水浴中加热10 min,离心,取上清液30 μL进行SDS-PAGE电泳,以观察透析对酿醋微生物发酵上清液中蛋白类物质的影响。(4) 发酵上清液酸类物质分析: 用酸碱滴定法测定总酸[11],用HPLC方法测定有机酸[12]。配制同样含量的有机酸样品,0.22 μm无菌滤膜过滤除菌,进行抑菌实验。 1.4 数据分析使用Excel 2013 (Microsofe office,Windows) 对实验数据进行统计分析,采用t检验进行显著性差异分析。利用Origin 8.0 (OriginLab)软件按均值±标准差( $\bar x$ ± s )方式作图。
2 结果与分析 2.1 醋酸发酵阶段不同时间醋醅水提取液抑菌活性的评价如图 1所示,随着醋酸发酵时间的增加,醋醅水提取液对4种指示菌的抑制效果逐渐增强。发酵0−2 d的醋醅水提取液未检测到抑菌效果,第3天对2种细菌指示微生物出现显著抑菌效果,抑制直径均为9.3±0.3 mm;第4天对A. niger出现显著抑菌效果,第5天对P. chrysogenum出现显著抑菌效果,抑制直径均为8.7±0.2 mm;随后抑菌效果逐渐增强,醋酸发酵结束时(第20天)达到最大,对E. coli、S. aureus、P. chrysogenum、A. niger的抑制圈直径分别达到21.2±0.3 mm、21.5±0.9 mm、21.2±0.3 mm、13.6±0.2 mm。

|
| 图 1 不同发酵时间醋醅对指示微生物生长的抑制作用(与第0天醋醅进行比较) Figure 1 Effect of fermentation cultures from different fermentation time on the growth of indicator strains (compared with fermentation culture on day 0) Note: *: P≤0.05; **: P≤0.01. |
主要酿醋功能微生物的发酵上清液对指示菌生长的影响如图 2和表 1所示。与阴性对照相比,4种酿醋功能微生物均具有抑菌效果,与阳性对照比,不同微生物的抑菌效果各有差异。

|
| 图 2 4种酿醋功能微生物发酵上清液对指示微生物生长抑制作用 Figure 2 Inhibitory effect of culture supernatants from different microbes on the growth of indicator strains Note: A: E. coli; B: S. aureus; C: P. chrysogenum; D: A. niger. 0: Negative control; 1: L. helveticus; 2: L. plantarum; 3: A. pasteurianus; 4: A. pomorum. |
| 菌株 Strains | 上清液pH pH of culture supernatant | 对指示菌抑制直径 Inhibition halos diameter to indicator strains (mm) | |||
| E. coli | S. aureus | A. niger | P. chrysogenum | ||
| A. pasteurianus | 25.9±1.1** | 27.3±1.0** | 15.2±0.3** | 28.3±1.5** | |
| A. pomorum | 3.75 | 23.8±0.3** | 23.6±0.5** | 13.8±0.3** | 25.3±0.6** |
| L. helveticus | 3.71 | 19.7±0.6** | 16.5±0.5** | 7.9±0.1 | 12.0±1.0** |
| L. plantarum | 4.13 | 22.0±0.4** | 23.0±0.8** | 12.7±0.3** | 21.3±0.6** |
| negative control | 6.00 | 7.8±0.1 (ND) | 7.8±0.1 (ND) | 7.8±0.1 (ND) | 7.8±0.1 (ND) |
| positive control | 5%苯酚 | 22.5±1.8 | 22.0±0.0 | 16.7±0.3 | 19.1±0.8 |
Note: ND: None antibacterial activitiy. Compared with the negative sample, **: P≤0.01.
其中,A. pasteurianus发酵上清液对E. coli、S. aureus、A. niger、P. chrysogenum的抑制圈直径分别为25.9±1.1 mm、27.3±1.0 mm、15.2±0.3 mm、28.3±1.5 mm,均高于其他3种醋醅功能微生物的抑制效果。酿醋功能微生物发酵上清液均为酸性,然而发酵上清液的pH值高低和抑制作用大小没有相关性。
2.3 不同酿醋功能微生物发酵上清液潜在抑菌活性物质的研究酿醋功能微生物发酵液的代谢物质种类复杂,其中有机酸是主要的酸类代谢物质,也是促使醋酸发酵阶段醋醅呈酸性的主要骨架物质。实验结果表明,酿醋功能微生物发酵上清液等量有机酸类物质的抑菌活性只占到发酵上清液的70%-80% (详细数据未给出)。当有机酸类物质以未解离的形式透过细胞膜进入细胞,且在中性细胞质内解离时,细胞中的功能性大分子很容易受到破坏,使微生物失去活力[13]。也有报道称,乳酸可以直接破坏细胞膜,致使细胞内大量蛋白泄露,从而抑制大量病原微生物的生长代谢[14]。可见酸类物质的抑菌效果明显,是发酵上清液中主要的抑菌活性物质。然而,除有机酸以外,不同微生物发酵液还可能存在其他抑菌活性物质。本实验进一步考察加热、蛋白酶解、透析等不同条件对发酵液抑制细菌活性的影响。
2.3.1 热处理对不同酿醋功能微生物发酵上清液抑菌活性的影响: 如表 2所示,与发酵上清液相比,热处理之后抑菌效果均显著变小,尤其以A. pasteurianus对S. aureus抑制效果及L. plantarum对E. coli抑制效果下降最明显,抑菌圈直径均减小了8.0 mm左右,说明4种微生物发酵液中均存在热敏感的抑菌活性物质。与阴性对照组相比,热处理后的发酵液仍具有明显的抑菌圈,也说明耐热性物质的存在。热敏感性及耐热性说明了发酵上清液抑菌活性物质成分多样,其中可能存在耐热性的细菌素[15, 16]。| 菌株 Strains | 上清液pH pH of culture supernatant | 对E. coli抑制直径 Inhibition halos diameter to E. coli (mm) | 对S. aureus抑制直径 Inhibition halos diameter to S. aureus (mm) | ||||
| A | B | C | A | B | C | ||
| A. pasteurianus | 3.76 | 21.7±1.2** | ND | 14.0±0.8** | 18.7±0.3** | ND | 13.6±0.7** |
| A. pomorum | 3.75 | 20.0±1.7 | ND | 13.3±0.3** | 20.0±0.0** | ND | 12.3±0.5** |
| L. helveticus | 3.71 | 16.0±0.6** | ND | 13.7±0.6** | 15.5±0.7 | ND | 10.5±0.5** |
| L. plantarum | 4.13 | 15.7±0.6** | ND | 14.5±0.5** | 21.7±0.4 | ND | 15.7±0.3** |
Note: ND: None antibacterial activitiy; A: The heated culture supernatant; B: The sample in dialysis bag after the culture supernatant dialyzed; C: The sample out of dialysis bag after the culture supernatant dialyzed. Compared with the fermentation culture (Table 1), : P≤0.05; **: P≤0.01.
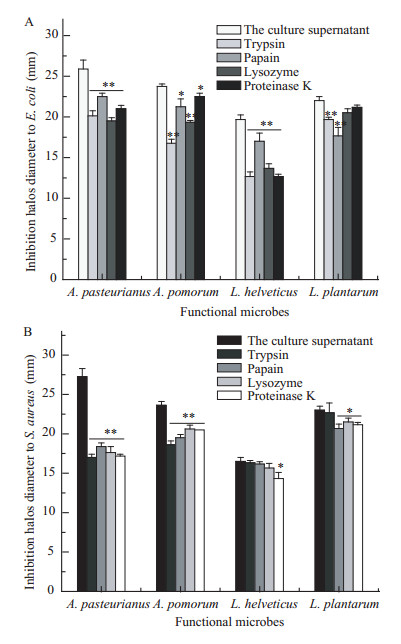
|
|
图 3 蛋白酶解对4种酿醋功能微生物发酵上清液抑菌活性影响
Figure 3 Inhibitory effect of the culture supernatant digested by proteases to indicator strains
注: A: E. coli; B: S. aureus. 与未进行蛋白酶处理的对照组相比,*: P≤0.05,**: P≤0.01.
Note: A: E. coli; B: S. aureus. Compared with the unhydrolyzed culture supernatant, *: P≤0.05, **: P≤0.01. |

|
|
图 4 酿醋微生物发酵上清液透析前后样品SDS-PAGE电泳图
Figure 4 The SDS-PAGE electrophoretogram of samples from the culture supernatant by dialysis treatment
注: M: 标准蛋白;1、5: A. pasteurianus、L. helveticus发酵上清液;2、3、4: 分子量≥8 kD、8 kD≥分子量≥3 kD、分子量≤ 3 kD的A. pasteurianus发酵上清液;6、7、8: 分子量≥8 kD、8 kD≥分子量≥3 kD、分子量≤3 kD的L. helveticus发酵上清液.
Note: M: Standard protein; 1, 5: the culture supernatant of A. pasteurianus and L. helveticus; 2, 3, 4: the different culture supernatant of A. pasteurianus distinguish by molecular weight (MW) ≥8 kD, 8 kD≥MW≥3 kD, MW≤3 kD; 6, 7, 8: the different culture supernatant of L. helveticus distinguish by MW≥8 kD, 8 kD≥MW≥3 kD, MW≤3 kD. |
综上,不同酿醋功能微生物发酵上清液对指示菌的抑制效果并非由一种物质起作用。推断酸类物质、蛋白短肽类物质及其他小分子代谢物共同构成了发酵上清液中潜在的抑菌活性物质。
3 结论与讨论醋酸发酵阶段作为镇江香醋酿造的重要阶段,其醋醅水提取液对4种指示菌具有良好的抑制效果,且醋醅发酵越久其水提液的抑制效果越强;4种主要酿醋功能微生物的发酵上清液对指示菌的生长也具有显著的抑制作用。分析4种主要酿醋功能微生物的发酵上清液,发现抑菌活性物质以酸类物质为主,可能存在包括细菌素在内的蛋白类物质及分子量小于8 kD的其他抑菌物质,这些物质在醋酸发酵阶段产生并持续积累,产生强的抑菌效果[20]。由此可见,主要酿醋功能微生物的生长及代谢对环境微生物的定殖及繁殖起到了抑制作用。酿醋微生物群落通过自身的生长及代谢,维护自身结构及功能的稳定,维持“自我净化”,保证醋酸发酵的正常进行[21]。
食品来源的细菌素在食品防腐及贮存更有利用优势,因此醋醅环境中存在的细菌素存在巨大的应用及开发潜力[22]。本次实验还发现醋酸杆菌具有不亚于乳酸杆菌的抑菌活性。已有报道A. xylinum产生的细菌纤维素在抑制环境微生物、治疗伤口中的应用[23, 24],但是未见A. pasteurianus和A. pomorum存在抑菌活性的报道。
| [1] | Yu MC. Analysis on flavor components and ligustrazine in Hengshun Vinegar[D]. Wuxi: Master’s Thesis of Jiangnan University, 2006 (in Chinese) 余鸣春. 镇江恒顺香醋风味物质及川芎嗪的分析研究[D]. 无 锡: 江南大学硕士学位论文, 2006 |
| [2] | Zhang LJ. The variation of the flavor substances in aerobic solid-fermentation cultures of Hengshun Vinegar[D]. Wuxi: Master’s Thesis of Jiangnan University, 2008 (in Chinese) 张丽娟. 恒顺香醋醋酸发酵过程中风味物质的变化分析[D]. 无锡: 江南大学硕士学位论文, 2008 |
| [3] | Xu W, Zhang XJ, Xu HY, et al. Analysis of bacterial communities in aerobic solid-fermentation culture of Zhenjiang Hengshun vinegar[J]. Microbiology China, 2007, 34(4): 646-649 (in Chinese) 许伟, 张晓君, 许泓瑜, 等. 镇江香醋醋酸发酵过程中细菌 群落组成分析[J]. 微生物学通报, 2007, 34(4): 646-649 |
| [4] | Su JX. Biodiversity of acetic acid bacteria in the vinegar Pei of Zhenjiang aromatic vinegar and the properties of Gluconacetobacter intermedius[D]. Wuxi: Master’s Thesis of Jiangnan University, 2014: 1-54 (in Chinese) 苏俊霞. 镇江香醋醋醅中醋酸菌多样性及 Gluconacetobacter intermedius 特性的研究[D]. 无锡: 江南大学硕士学位论文, 2014: 1-54 |
| [5] | Tao JL, Lu ZM, Wang ZM, et al. Detection of the variation of microorganisms in acetic acid fermentation of Zhenjiang aromatic vinegar through real-time quantitative PCR[J]. Food and Fermentation Industries, 2013, 39(2): 156-160 (in Chinese) 陶京兰, 陆震鸣, 王宗敏, 等. 实时荧光定量 PCR 监测镇江 香醋醋酸发酵过程中微生物变化[J]. 食品与发酵工业, 2013, 39(2): 156-160 |
| [6] | Zhu QH. Isolation of microbes and their acid-producing characteristics in the solid-cultures of Zhenjiang Vinegar[D]. Wuxi: Master’s Thesis of Jiangnan University, 2008: 1-50 (in Chinese) 朱其瀚. 镇江香醋发酵过程中微生物分离及其产酸特性[D]. 无锡: 江南大学硕士学位论文, 2008: 1-50 |
| [7] | Li CJ, Shuang Q, Li YL, et al. Research antifungal activity on bacteriocin produced by lactic acid bacteria from traditional sour cabbage[J]. The Food Industry, 2012(12): 128-131 (in Chinese) 李传娟, 双全, 栗永乐, 等. 传统酸菜中具有抗真菌特性乳 酸菌素的研究[J]. 食品工业, 2012(12): 128-131 |
| [8] | Tajkarimi MM, Ibrahim SA, Cliver DO. Antimicrobial herb and spice compounds in food[J]. Food Control, 2010, 21(9): 1199-1218 |
| [9] | Yu N, Chen ZJ. Screening of lactic acid bacteria for bacteriostatic activity and characteristics of antibacterial compounds[J]. Food Science and Technology, 2011, 36(5): 13-17 (in Chinese) 于娜, 陈忠军. 具有抑菌作用乳酸菌的筛选及其抑菌物质特 性的研究[J]. 食品科技, 2011, 36(5): 13-17 |
| [10] | Schillinger U, Lücke FK. Antibacterial activity of Lactobacillus sake isolated from meat[J]. Applied and Environmental Microbiology, 1989, 55(8): 1901-1906 |
| [11] | Zhang L, Lu ZY, Li SQ, et al. GB 18187-2000 Fermented vinegar[S]. Beijing: China Standard Publishing House (in Chinese) 张林, 鲁肇元, 李栓勤, 等. GB 18187-2000 酿造食醋[S]. 北 京: 中国标准出版社 |
| [12] | Zhang LJ, Xu W, Xu HY, et al. Analysis of organic acids in aerobic solid-fermentation culture of Hengshun Vinegar[J]. China Condiment, 2009, 34(2): 106-109 (in Chinese) 张丽娟, 许伟, 许泓瑜, 等. 恒顺香醋固态发酵过程中有机 酸的变化分析[J]. 中国调味品, 2009, 34(2): 106-109 |
| [13] | Kent RM, Fitzgerald GF, Hill C, et al. Novel approaches to improve the intrinsic microbiological safety of powdered infant milk formula[J]. Nutrients, 2015, 7(2): 1217-1244 |
| [14] | Wang CJ, Chang T, Yang H, et al. Antibacterial mechanism of lactic acid on physiological and morphological properties of Salmonella Enteritidis, Escherichia coli and Listeria monocytogenes[J]. Food Control, 2015, 47: 231-236 |
| [15] | Enan G, Abdel-Shafi S, Ouda S, et al. Novel antibacterial activity of Lactococcus lactis subspecies lactis z11 isolated from zabady[J]. International Journal of Biomedical Science, 2013, 9(3): 174-180 |
| [16] | Du LH, Somkuti GA, Renye JA Jr, et al. Properties of durancin gl, a new antilisterial bacteriocin produced by Enterococcus durans 41D[J]. Journal of Food Safety, 2012, 32(1): 74-83 |
| [17] | Sip A, Więckowicz M, Olejnik-Schmidt A, et al. Anti-Listeria activity of lactic acid bacteria isolated from golka, a regional cheese produced in Poland[J]. Food Control, 2012, 26(1): 117-124 |
| [18] | Iranmanesh M, Ezzatpanah H, Mojgani N. Antibacterial activity and cholesterol assimilation of lactic acid bacteria isolated from traditional Iranian dairy products[J]. LWT-Food Science and Technology, 2014, 58(2): 355-359 |
| [19] | Složilová I, Purkrtová S, Kosová M, et al. Antilisterial activity of lactic acid bacteria against Listeria monocytogenes strains originating from different sources[J]. Czech Journal of Food Sciences, 2014, 32(2): 145-151 |
| [20] | O’Shea EF, Cotter PD, Ross RP, et al. Strategies to improve the bacteriocin protection provided by lactic acid bacteria[J]. Current Opinion in Biotechnology, 2013, 24(2): 130-134 |
| [21] | Xu W. Analysis of the microbial diversity and function during acetic acid fermentation process of Zhenjiang aromatic vinegar[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2011: 1-146 (in Chinese) 许伟. 镇江香醋醋酸发酵过程微生物群落及其功能分析[D]. 无锡: 江南大学博士学位论文, 2011: 1-146 |
| [22] | da Silva Sabo S, Vitolo M, Domínguez González JM, et al. Overview of Lactobacillus plantarum as a promising bacteriocin producer among lactic acid bacteria[J]. Food Research International, 2014, 64: 527-536 |
| [23] | Laçin NT. Development of biodegradable antibacterial cellulose based hydrogel membranes for wound healing[J]. International Journal of Biological Macromolecules, 2014, 67: 22-27 |
| [24] | Lin WC, Lien CC, Yeh HJ, et al. Bacterial cellulose and bacterial cellulose-chitosan membranes for wound dressing applications[J]. Carbohydrate Polymers, 2013, 94(1): 603-611 |
 2016, Vol. 43
2016, Vol. 43




