扩展功能
文章信息
- 王淑芳, 马桂珍, 孙漫红, 李世东, 暴增海
- WANG Shu-Fang, MA Gui-Zhen, SUN Man-Hong, LI Shi-Dong, BAO Zeng-Hai
- 粘帚霉几丁质酶GcCHI1的结构鉴定及其抑菌作用
- Identification of chitinase GcCHI1 of Gliocladium catenulatum HL-1-1and the antibacterial characters
- 微生物学通报, 2016, 43(1): 107-115
- Microbiology China, 2016, 43(1): 107-115
- 10.13344/j.microbiol.china.150062
-
文章历史
- 收稿日期: 2015-01-20
- 接受日期: 2015-07-03
- 优先数字出版日期(www.cnki.net): 2015-11-03
2. 江苏省海洋资源开发研究院 江苏 连云港 222000;
3. 中国农业科学院植物保护研究所 北京 100081
2. Jiangsu Marine Resources Development Research Institute, Lianyungang, Jiangsu 222000, China;
3. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing, 100081, China
粘帚霉(Gliocladium spp.)是一类广泛存在于土壤中、近似于木霉的植物病原真菌的寄生菌,可寄生于多种植物病原真菌的菌丝和菌核,具有较好的生防潜力,已经引起国内外学者的重视。国外成功开发出了分别以粉红粘帚霉(Gliocladium roseum)和链孢粘帚霉(Gliocladium catenulatum)为有效成分的生物农药SoilGard和Primastop[1, 2],用于多种植物病害的防治[3, 4]。
我们在研究大豆菌核病菌菌核重寄生菌时,经大量筛选获得一株对菌核有强寄生能力的链孢粘帚霉菌株(G. catenulatum) HL-1-1。研究表明该菌株室内对菌核的寄生率达100%,使90%以上的菌核腐烂。温室盆栽实验表明该菌株对核盘菌引起的大豆菌核病、立枯丝核菌引起的茄科蔬菜猝倒病、水稻纹枯病防效均达80%以上,并对多种植物病原真菌具有抑制作用[5, 6]。该菌株经诱导能够产生较强的几丁质酶活性,实验表明该几丁质酶对核盘菌有明显的抑制作用[7],有必要对该几丁质酶进行分离纯化、结构鉴定和抗菌作用研究。本课题组以核盘菌菌核粉为诱导培养基进行发酵,从发酵液中分离纯化出一种分子量为51 kd左右的几丁质酶,命名为GcCHI1,并研究了其酶学性质。本文采用纳升电喷雾-四极杆-飞行时间串联质谱(Nano-ESI-Q-TOF-MS/MS)技术,对几丁质酶GcCHI1进行鉴定,并系统测定该几丁质酶的抗菌作用,旨在为该几丁质酶的基因克隆和功能分析提供理论依据。
1 材料与方法 1.1 实验材料和仪器设备胰蛋白酶为德国Roche公司经修饰的测序级的酶(产品编号1418025);色谱纯乙腈为美国Fisher Scientific产品;其他试剂均为国产分析纯。实验用水为Milli2Q纯水器制备的去离子水。
鉴定GcCHI1几丁质酶采用纳升电喷雾-四极杆-飞行时间串联质谱(nano-ESI-Q-TOF2),实验在军事医学科学院完成。实验所用植物病原菌,如油菜菌核病菌(Sclerotinia sclerotiorum)、番茄灰霉病菌(Botuytis cinerea),辣椒疫霉病菌(Phytophora capsici)等,均来自中国农业科学院生物防治研究所,由本实验室保存。
PDA培养基(g/L): 马铃薯200、葡萄糖20、琼脂15−20,pH自然。
1.2 实验方法 1.2.1 几丁质酶GcCHI1的制备及其SDS-PAGE电泳: 将粗酶液置于冰水浴中,加入硫酸铵[(NH4)2SO4)]使溶液分别达到35%、45%、55%、65%、75%、85%的盐饱和度,冰浴中继续缓慢搅拌2 h,4 °C、7 000 r/min离心30 min。沉淀复溶于0.05 mol/L pH 8.0的Tris-HCl缓冲液中,用Sephadex G-25凝胶过滤层析脱盐,上样量为15 ml,流速为6 ml/min,洗脱液为0.05 mol/L pH 8.0的Tris-HCl缓冲液。按吸收峰收集,每管0.5 ml,测定不同吸收峰的所有收集管的几丁质酶活性。合并有酶活性吸收峰处的不同收集管的收集液,用于进一步纯化。将脱盐后收集得到的具有几丁质酶活性的蛋白质溶液用截留分子量为30 kD的YM-30超滤离心管进行超滤浓缩,分别测定超滤管膜上、下溶液的几丁质酶活性,保留有酶活性部分。将超滤浓缩后有酶活性部分的样品进行离子交换层析。采用安玛西亚生物技术(上海)有限公司AKTA explorer System层析系统(阴离子预装柱,型号: source TM 15Q 4.6/100 PE),柱体积1.7 ml,填料的平均粒直径为15 μm,每毫升载量为45 mg BSA。上柱样品的体积约为3 ml,流速为2 ml/min,梯度洗脱。层析缓冲系统: A液为0.05 mol/L pH 8.0的Tris-HCl缓冲液,B液为1 mol/L的NaCl溶液,上样前用A液5倍柱体积洗脱系统。B液洗脱浓度梯度及洗脱体积为16% 2倍柱体积,20% 2倍柱体积,100% 2倍柱体积,按洗脱蛋白峰(280 nm吸收峰)收集洗脱液,上样即收,每管收集2 ml,洗脱结束后,将峰收集液在磷酸缓冲液(0.02 mol/L pH 5.8)中进行透析脱盐,分别测定各个蛋白吸收峰的几丁质酶活性和蛋白含量。电泳检测几丁质酶纯度。阴离子层析收集液,浓缩后使用非变性电泳继续纯化,回收电泳凝胶上的不同条带,分别检测几丁质酶活性,纯化出几丁质酶GcCHI1。将经过纯度检验达到电泳纯的几丁质酶样品进行SDS-PAGE电泳,分离胶浓度为12%,150−200 V电泳1 h。以SDS-PAGE低分子量标准蛋白为标准蛋白,以确定酶的分子量大小。
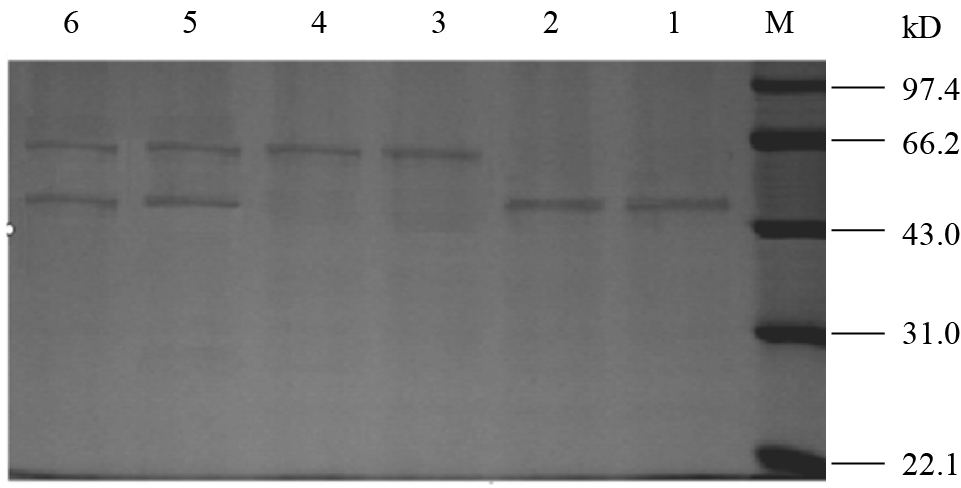
1.2.2 质谱样品的制备: 将从SDS-PAGE上分离后经考马斯亮蓝染色的几丁质酶Gc-chitinase斑点用刀片切下并切成1 mm2的胶块,置于Eppendorf管中,用100 μl 50%乙腈-100 mmol/L 碳酸氢铵洗2−3次,每次20 min至胶片完全脱色。脱色后的胶片置于真空干燥器SpeedVac (Savant Instruments,USA)中干燥20 min,然后加入10 mg/L的胰蛋白酶液(25 mmol/L碳酸氢铵溶液,pH 8.0) 5−10 μl,于4 °C放置40 min,使胶片完全吸收酶液,再补加25 mmol/L碳酸氢铵缓冲液10 μl,于37 °C温育过夜。用5% TFA 50−100 μl于40 °C提取酶切肽段,1 h一次;再用相同体积的50% ACN-2.5%TFA溶液于30 °C提取,1 h一次;最后用50 μl ACN超声提取一次;合并3次提取液,用真空干燥器SpeedVac进行干燥。干燥后的样品用3−5 μl 0.5%的TFA溶液溶解,备用。 1.2.3 质谱鉴定: Nano-ESI-MS/MS为英国Micromass公司的正交加速电喷雾串联质谱仪Q-TOF2。配备纳升喷雾源。所有测定均在正离子方式下进行。质谱仪的校正是用Glu-fib的串联质谱碎片校正的,质量准确度小于0.1 Da。雾化气为氮气,碰撞气体为氩气。离子源温度80 °C,锥孔电压50 V左右。TOF加速电压为9.1 kV。MCP检测器电压为2 200 V。进行Nano-ESI-MS/MS分析时,毛细管电压为800−1 000 V。首先进行一级质谱扫描,得到ESI-MS图。从ESI-MS图中随机选择几个强度比较高的峰进行MS/MS分析。采用Mcromass的专用软件MaxEnt3对MS/MS图进行处理后,利用Micromass公司的专用软件MasSeq,直接推导出肽段序列,得到的肽段序列与Mascot数据库中的多肽理论MS/MS裂解图进行序列比对分析,得到匹配分值较高的肽段。进一步通过NCBI BLAST数据库查询几丁质酶的相关信息,得到几丁质酶的氨基酸组成数目以及测定的序列在整个序列中所处的位置。 1.2.4 几丁质酶对病原真菌菌丝生长的抑制作用: 采用牛津杯法进行测定。将供试的不同病原真菌接种于PDA平板上,培养1周后用灭菌的打孔器打直径6 mm的菌苔,重新接种于新的PDA平板中间。当菌落生长到3−4 cm时,从菌落边缘1 cm处放置无菌的牛津杯,向杯中分别加入浓度为10 mg/L的粗酶液、纯酶液200 μL,12 h后观察结果。以pH 8.0 Tris缓冲液为对照,每种病菌接种3皿为3次平行。重复3次取平均值并计算标准差。 1.2.5 几丁质酶对病原菌孢子萌发的抑制作用: 将培养7 d的供试的病原菌孢子用浓度为10 mg/L的粗酶液、纯酶液配成浓度为106 CFU/mL左右的孢子悬浮液,取0.2 mL涂布于PDA平板上,28 °C保温培养,2 h后调查孢子萌发率,以缓冲液为对照,每一处理接种3皿为3次平行。重复3次取平均值并计算标准差。 1.2.6 几丁质酶对两种病原菌菌核萌发的抑制作用: 将立枯丝核菌和核盘菌的菌核表面消毒后,酶液中28 °C保温24 h,用无菌滤纸将表面吸干放置于PDA平板上,2 d后调查菌核的萌发率,每种病菌处理50粒菌核。 2 结果与分析 2.1 几丁质酶GcCHI1的制备及SDS-PAGE电泳分析结果粗酶液经硫酸铵分级沉淀、SourceTM 15Q 4.6/100 PE离子交换柱层析、非变性凝胶电泳等方法进行纯化,SDS-PAGE检测几丁质酶纯度,谱带单一,与标准蛋白比较,分子量约为51 kD (图 1)。纯化数据见表 1。
|
|
图 1 非变性凝胶电泳回收后蛋白样品的电泳图谱
Figure 1 SDS-PAGE profile of protein samples collected via non-denatured electrophoresis
注: M: 标准蛋白;1−2: 无活性蛋白;3−4: 纯化的几丁质酶;5−6: SourceTM 15Q 4.6/100 PE柱层析活性组分.
Note: M: Protein marker; 1−2: No activity protein; 3−4: Purified Chitinase; 5−6: SourceTM 15Q 4.6/100 PE column chromatography of active components. |
| 步骤 Step | 总蛋白量 Total protein (mg) | 酶比活 Specific activity (U/mg) | 酶总量 Total activity (U) | 酶产率 Yield (%) | 纯化倍数 Purification factor (fold) |
| Crude extract | 190.4 | 1.21 | 230.84 | 100.0 | 1.00 |
| 85% (NH4)2SO 4 | 50.3 | 3.24 | 162.83 | 70.5 | 2.68 |
| SourceTM 15Q 4.6/100 PE | 12.4 | 5.50 | 68.20 | 29.5 | 4.55 |
| 0.6 | 12.17 | 7.30 | 3.2 | 10.06 |
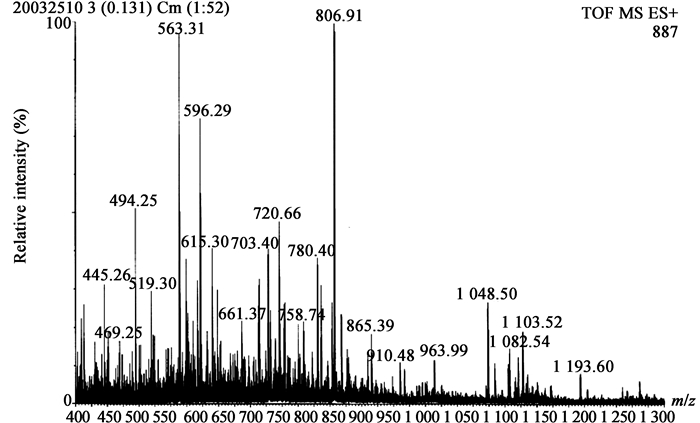
首先对几丁质酶GcCHI1经胰蛋白酶酶解后的肽段进行一级质谱鉴定。胰蛋白酶酶切后的肽段,在一级质谱中产生了较清晰的不同m/z值峰,得到几丁质酶GcCHI1的肽质量指纹图谱,图谱见图 2,可进一步进行MS/MS分析。
|
| 图 2 几丁质酶GcCHI1的胰蛋白酶酶切肽质量指纹谱 Figure 2 Tryptic peptide mapping of GcCHI1 chitinase (ESI-MS) |
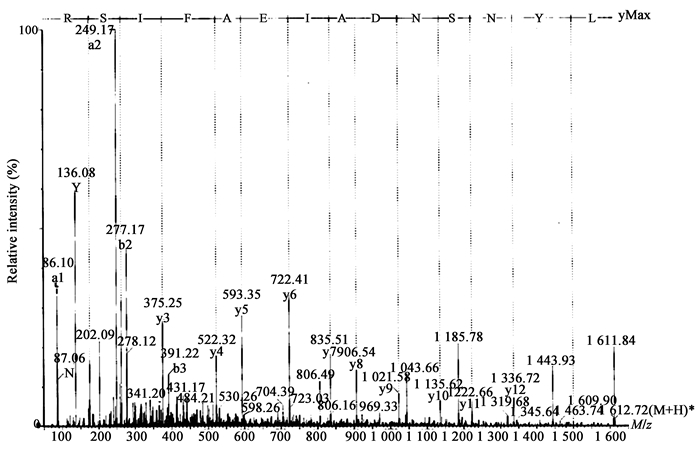
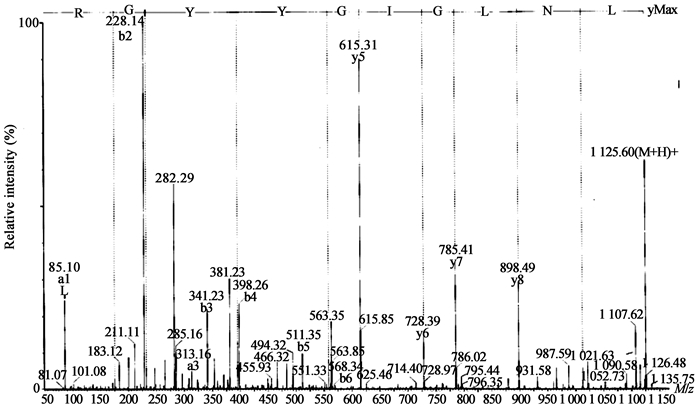
随机选择m/z值分别为806.89、780.40、563.31的3个多肽片段进行Nano-ESI-MS/MS分析,图 3−5是m/z值分别为806.89、780.40、563.31的MS/MS图谱。
|
| 图 3 m/z值为806.89的MS/MS图谱 Figure 3 ESI-MS/MS spectrum of m/z equal 806.89 |

|
| 图 4 m/z值为780.40的MS/MS图谱 Figure 4 ESI-MS/MS spectrum of m/z equal 780.40 |
|
| 图 5 m/z值为563.31的MS/MS图谱 Figure 5 ESI-MS/MS spectrumof m/z equal 563.31 |
用Micromass公司MasSeq软件对测定出的所有y离子进行序列分析,推导出了3个肽段的氨基酸序列,分别为LYNSNDAIEAFISR、VIGYFTQWGIYGR、LNLGIGYYGR。3个肽段的分子量理论值与实验测定值误差很小,结果见表 2。
| 肽段号 Peptide No. | 质荷比 m/z | 电荷 Charge | 分子量(实测值/理论值) Mass Da (Measured/Theory) | 氨基酸序列 Amino acid sequence |
| 1 | 563.31 | 1 | 1 124.61/1 124.60 | LNLGIGYYGR |
| 2 | 780.40 | 1 | 1 558.79/1 558.79 | VIGYFTQWGIYGR |
| 3 | 806.89 | 1 | 1 611.76/1 611.79 | LYNSNDAIEAFISR |
将ESI-MS/MS所得到的肽段序列,经Mascot数据库[8]查询,得到5个查询结果,登录号分别为Gi/19526711、Gi/2429326、Gi/7710068、Gi/15605167、Gi/15966318。其中Gi/19526711和Gi/2429326均有2个肽段相匹配,分值分别为128和110,鉴定结果分别为Chitinase和Chitinase A。其余查询结果只有1个肽段匹配,且分值均较低,只有27。几丁质酶GcCHI1鉴定结果见表 3。
| 肽段名 Peptide name | 分值 Total score | 分子量 Mass (Da) | 匹配的肽段1 Peptides matched1 | 结论 Results | 来源 Source |
| Gi/19526711 | 128 | 15 144 | 2 (1,3) | Chitinase | Uncultured bacterium |
| Gi/2429326 | 110 | 72 339 | 2 (1,2) | Chitinase A | Stenotrophomonas maltophilial |
| Gi/7710068 | 27 | 46 816 | 1 (1) | Neuraminidase | Mus musculus |
| Gi/15605167 | 27 | 73 261 | 1 (1) | ||
| Gi/15966318 | 27 | 53 633 | 1 (1) |
Note: The number in bracket was the matched peptide.
分值(score)是一个参考值,通常与匹配肽段相互参照来确定鉴定蛋白质的可靠程度。软件规定得分大于44时为相同的种类或高度同源。从表 3可以看出,本实验查询结果中Gi/19526711和Gi/2429326中分别有2个肽段与之完全匹配,且分值分别为128和110,其他查询结果的分值低于44,因而鉴定结果认为本实验纯化得到的几丁质酶GcCHI1与来自Uncultured bacterium和Stenotrophomonas maltophilial的几丁质酶和几丁质酶A具有高度的同源性,而与来自于木霉等其他真菌所产生的几丁质酶没有同源性。进一步通过NCBI BLAST数据库查询Gi/19526711和Gi/2429326的相关信息,得到了2种几丁质酶的氨基酸组成数目以及测定的序列在整个序列中所处的位置,结果见表 4。
| 肽段名 Peptide name | 肽段序号 Peptide No. | 质量电荷比 m/z | 肽段位置 Start-End | 序列 Sequence |
| Gi/19526711 (Chitinase) | 1 | 563.31 | 125-134 | LNLGIGYYGR |
| 3 | 806.89 | 105-118 | LYNSNDAIEAFISR | |
| Gi/2429326 (Chitinase A) | 1 | 563.31 | 586-595 | LNLGIGYYGR |
| 2 | 780.40 | 300-312 | VIGYFTQWGIYGR |
Gi/19526711 (Chitinase)是一个具有139个氨基酸具有几丁质酶活性的蛋白质。分子量为15 144 Da。序列如下:
1 VDIDWEWPVA CGIACGTPED NANFTALMAE FRRQLDAVRP GLLLTVAVGA GIDKIRVTDP
61 AAYHPYLDYI NVMTYDFHGA WDAKTNHQSA LFDSPSDPST GDQKLYNSND AIEAFISRGV
121 PAAKLNLGIGYYGRGWTGV
Gi/2429326 (Chitinase A)是由chiA基因编码的具有700个氨基酸、具有几丁质酶活性的蛋白质,分子量为72 339 Da,序列如下:
1 MPDPMMRSAV TSISLQPAAR HKRWLLALAL AAAATPSLAL AANCTGAPEW NAAVIYLSGT
61 TLQKGGVLYR ANQDIWNAPP DHPAGAPYYT NLGACDGSGS NQPPTVSLTA PTAGASFTAG
121 SSITVSANAA DSDGSVSKVE FFRGGTSLGI DTSAPYSVTW ANASAGSHTF KAVATDNNNA
181 VTSSATVSVT VTASSNDTTP PSVPGGLASP SKTATTVNLV WSAATDNSGG SGVAGYDVYR
241 NGSLVGSPSA TQYTDGGLTA STAYTYTVRA RDNAGNASAQ SGSISVTTAA GGGGGGTKRV
301 IGYFTQWGIY GRNYRVKNID TSGSAAKLTH INYAFGNVRN NRCEVGVTQASDPNTGVGGD
361 AFADYTKAFG AGESVSGSAD TWDQPLRGNW QLKQLKAKH PNVKVLISLG GWTWSRGFSS
421 AAQPANRQAF VASCVDAYIK GNLPVTDGAG GVGAAAGVFD GIDIDWEYPVACGLSCGTPA
481 DNANYTALLA EFRRQLDAVR PGLLLTVAVG AGIDKIRVTD PAAYHPYLDFINVMTYDFHG
541 AWDPQTNHHSALFDSPADPS TGDQKLYNSN AMEAFLSRGVPASKLNLGIGYYGRGWTGV
601 ASGNNGLYKS AGGAAPGTYE GIEDWKVLKNLNWPVYTDT VAKATWISNGTTFWSVDTPA
661 MVTEKMGYVK AQGLGGAFFW EFSGDDPQGT LTKAISDGLN
比较Gi/19526711 (Chitinase)和Gi/2429326 (Chitinase A)的序列,Gi/2429326 (Chitinase A)的序列中含有Gi/19526711 (Chitinase)的序列。而本实验测定的几丁质酶GcCHI1分子量为51 kD,与Gi/2429326 (Chitinase A)近似,因而认为链孢粘帚霉(Gliocladium catenulatum) HL-1-1菌株产生的几丁质酶GcCHI1与来自Stenotrophomonas maltophilial 34S1菌株的Chitinase A[9]高度同源。肽段1处于586−595位,肽段2处于300−312位。
2.5 GcCHI1对病原菌菌丝生长的影响GcCHI1粗酶液和纯酶液对10种病原菌都表现出不同程度的抑制作用(表 5)。粗酶液对油菜菌核病菌、番茄灰霉病菌的抑制作用较大,对辣椒疫霉病的抑制作用最小。纯酶液对番茄灰霉病菌、立枯丝核菌的抑制作用较大,对辣椒疫霉病菌、番茄早疫病菌的生长抑制作用较小。
2.6 几丁质酶GcCHI1对病原真菌孢子萌发的影响几丁质酶GcCHI1对供试的小麦雪腐病菌、葡萄白腐病菌、玉米黄斑病病菌、番茄早疫病菌、斑点落叶病菌的分生孢子萌芽均有明显的抑制作用,酶液处理的孢子萌发率明显低于对照,除纯酶液处理番茄早疫病菌的孢子萌发率高于粗酶液外,其余均低于粗酶液。对辣椒疫霉病菌孢子萌发的抑制作用较小,其孢子萌发率与对照差异极小。
2.7 GcCHI1对两种病原菌菌核萌发的影响经GcCHI1粗酶液和纯酶液处理后的大豆菌核病菌菌核的萌发率分别为75%和63%,明显低于对照的94%。立枯丝核菌菌核经粗酶液和纯酶液处理后的萌发率分别为45%和21%,而对照的萌发率达95%。说明GcCHI1酶液对供试的2种病菌的菌核萌发具有明显的抑制作用,对立枯丝核菌菌核的萌发抑制作用大于对油菜菌核病病原菌菌核抑制作用,且纯酶液比粗酶液抑制萌发的作用强。
3 结论与讨论Kobayashi等从Stenotrophomonas maltophilial 34S1菌株的培养液中通过疏水层析纯化出了具有几丁质酶活性的51 kD的蛋白质,并通过一系列实验证实该蛋白质是由chiA基因编码的几丁质酶[9]。Kobayashi等的研究结果为几丁质酶在植物病害生防中的作用提供了直接证据。本实验获得的几丁质酶GcCHI1与Kobayashi等获得的Chitinase A蛋白质序列高度同源,因此可以用于植物病害的生物防治研究。
目前,几丁质酶在寄生菌的作用机制中所发挥的作用已得到普遍认可,国内外许多学者从菌寄生真菌的发酵液中分离纯化到多种几丁质酶,并系统 研究了几丁质酶的抗菌作用。Lorito等研究表明与菌寄生作用关系密切的是一种分子量为42 kD的内切几丁质酶,该酶对灰葡萄孢霉(Botrytis cinerea)分生孢子萌发的ED50为45−49 mg/l,几丁质二糖酶的ED50为112−121 mg/l,而哈茨木霉(Trichoderma hazianum)本身对上述几丁质酶具有抗性,ED50大于1 000 mg/l,他们从哈茨木霉P1菌株中克隆出内切几丁质酶基因ThEn42,该基因与细菌及其他丝状真菌的几丁质酶基因具有较高的相似性[10],该基因是目前抗病基因遗传和转化研究的常用材料。
| 病原菌 Pathogens | 粗酶抑菌带宽度 The inhibition zone width of crude enzyme | 纯酶抑菌带宽度 The inhibition zone width of pure enzyme |
| Fusarium oxysporum | 2.47±0.123 | 1.26±0.063 |
| Sclerotinia sclerotiorum | 3.08±0.154 | 2.74±0.137 |
| Phytophthora capsici | 0.59±0.030 | 0.47±0.023 |
| Coniella diplodiella | 3.28±0.164 | 1.99±0.096 |
| Fusarium graminicola | 2.38±0.119 | 2.77±0.136 |
| Botrytis cinerea | 3.34±0.167 | 3.74±0.187 |
| Curvularia lunata | 2.18±0.109 | 1.28±0.064 |
| Alternaria solani | 1.58±0.079 | 0.45±0.022 |
| Alternaria alternataf | 2.40±0.117 | 2.16±0.108 |
| Rhizoctonia solani | 2.41±0.114 | 3.60±0.132 |
陶刚等从木霉中分离纯化的几丁质酶对烟草赤星病菌孢子萌发具有明显的抑制作用[11]。郭润芳等从Thermomyces lanuginosus中分离纯化出分子量在48.0−49.8 kD之间、对供试病原菌有不同程度抑制作用的几丁质酶[12]。阎瑞香等研究了重组几丁质酶对引起果蔬采后腐烂的病原真菌灰霉和根霉的抑制效果,表明重组几丁质酶对果蔬采后病原真菌具有明显抑制效果,在果蔬采后病害的生物防治中具有应用开发前景[13]。惠有为等从重组工程菌GS115-pPIC9k-ChiA4.0发酵液中纯化出了可以通过酶解真菌细胞壁中的几丁质达到抑菌作用的几丁质酶,证明了几丁质酶的抑菌作用机制为降解真菌细胞壁中的几丁质[14]。
目前,质谱技术已成为现代蛋白质科学中最重要和不可缺少的组成部分。其中纳升电喷雾-四极杆-飞行时间串联质谱(Nano-ESI-MS/MS)已经发展成为分析从1D和2D上分离得到的微量蛋白质的有利工具[15]。有关质谱技术用于粘帚霉几丁质酶的鉴定研究上未见报道,本实验结果为粘帚霉几丁质酶基因化学合成和生物克隆及功能分析奠定了基础。
| [1] | Paulitz TC, Bélanger RR. Biological control in greenhouse systems[J]. Annual Review of Phytopathology, 2001, 39(1): 103-133 |
| [2] | McQuilken MP, Mohammadi O. Evaluation of a commercial formulation of Gliocladium catenulatum (J1446) for biocontrol of damping-off in bedding plants[J]. Meded Rijksfac Landbouwwet, Univ Gent, 1997, 62(3b): 987-992 |
| [3] | Sharma BK, Singh BM. Biological control of white rot of pea caused by Sclerotinia sclerotiorum (Lib.) de Bary[J]. Journal of Biological Control, 1990, 4(2): 132-134 |
| [4] | Wu WS. Control of Sclerotinia rot of sunflower and chrysanthemum[J]. Plant Protection Bulletin, 1991, 33(1): 45-55 |
| [5] | Ma GZ, Wu XR, Yang WL, et al. Inhibition of zymotic liquid from different isolates of Gliocladium spp. to three pathogenic fungi[J]. Journal of Huazhong Agricultural University, 2004, 23(1): 96-99 (in Chinese) 马桂珍, 吴学仁, 杨文兰, 等. 粘帚霉不同菌株发酵液对3种 病原真菌的抑制作用[J]. 华中农业大学学报, 2004, 23(1): 96-99 |
| [6] | Bao ZH, Yang WL, Wu XR, et al. Inhibition of different isolates of Gliocladium spp. to six pathogenic fungi[J]. Journal of Jilin Agricultural University, 2004, 26(4): 394-398 (in Chinese) 暴增海, 杨文兰, 吴学仁, 等. 粘帚霉(Gliocladium spp.)不同 菌株对几种病原菌的抑菌作用测定[J]. 吉林农业大学学报, 2004, 26(4): 394-398 |
| [7] | Ma GZ, Gao HL, Zhang YH, et al. Chitinases induced from Gliocladium catenulatum HL-1-1 and their antagonistic activity against plant pathogenic fungi[J]. Microbiology China, 2007, 34(5): 905-908 (in Chinese) 马桂珍, 高会兰, 张拥华, 等. 链孢粘帚霉几丁质酶的诱导 及其抗真菌活性研究[J]. 微生物学通报, 2007, 34(5): 905-908 |
| [8] | http://www.matrixscience.com |
| [9] | Kobayashi DY, Reedy RM, Bick J, et al. Characterization of a chitinase gene from Stenotrophomonas maltophilia strain 34S1 and its involvement in biological control[J]. Applied and Environmental Microbiology, 2002, 68(3): 1047-1054 |
| [10] | Lorito M, Harman GE, Hayes CK, et al. Chitinolytic enzymes produced by Trichoderma harzianum: antifungal activity of purified endochitinase and chitobiosidase[J]. Phytopathology, 1993, 83(3): 302-307 |
| [11] | Tao G, Liu XZ, Wang G, et al. Role of Chitinase produced by Trichoderma sp. in biocontrol of Tobacco Brown Spot caused by Alternaria alternata[J]. Chinese Journal of Biological Control, 2004, 20(4): 252-255 (in Chinese) 陶刚, 刘杏忠, 王革, 等. 木霉几丁质酶对烟草赤星病菌的 作用[J]. 中国生物防治, 2004, 20(4): 252-255 |
| [12] | Guo RF, Li DC, Wang R. Purification and properties of a thermostable chitinase from thermophilic fungus Thermomyces lanuginosus[J]. Acta Microbiologica Sinica, 2005, 45(2): 270-274 (in Chinese) 郭润芳, 李多川, 王荣. 疏绵状嗜热丝孢菌热稳定几丁质酶 的纯化及其性质研究[J]. 微生物学报, 2005, 45(2): 270-274 |
| [13] | Yan RX, Zhang N, Guan WQ, et al. Antifungal activity of Chitinase on the several pathogen from fruit & vegetable in vitro[J]. Acta Agriculturae Boreali-Sinica, 2014, 29(4): 155-159 (in Chinese) 阎瑞香, 张娜, 关文强, 等. 重组几丁质酶对不同果蔬病原真菌的抑菌效果研究[J]. 华北农学报, 2014, 29(4): 155-159 |
| [14] | Hui YW, Xia T, Zhao YL, et al. Purification and toxicological studies of HaSNPV chitinase[J]. China Biotechnology, 2011, 31(2): 43-49 (in Chinese) 惠有为, 夏天, 赵亚玲, 等. HaSNPV 几丁质酶的分离纯化与 毒理学研究[J]. 中国生物工程杂志, 2011, 31(2): 43-49 |
| [15] | Wang HX, Zhang XM, Yang SC, et al. Study on ono-covalent bond complex recombinant human FKBP12 and its small molecular ligands with nerves growth action by Biological Mass Spectrometry[J]. Science in China (Series C), 2002, 32(4): 355-360 (in Chinese) 王红霞, 张学敏, 杨松成, 等. 重组人受体蛋白 FKBP12与新 型神经生长促进剂非共价键复合物的电喷雾质谱[J]. 中国科 学: C 辑, 2002, 32(4): 355-360 |
 2016, Vol. 43
2016, Vol. 43




