扩展功能
文章信息
- 刘星, 王希东, 刘君
- LIU Xing, WANG Xi-Dong, LIU Jun
- 西瓜食酸菌RND蛋白家族外排转运体cusB基因抗铜功能研究
- Functional analysis of a RND family efflux transporter component-cusB gene associated with copper resistance in Acidovorax citrulli
- 微生物学通报, 2016, 43(1): 97-106
- Microbiology China, 2016, 43(1): 97-106
- 10.13344/j.microbiol.china.140917
-
文章历史
- 收稿日期: 2014-11-18
- 接受日期: 2015-08-14
- 优先数字出版日期(www.cnki.net): 2015-09-14
2. 新疆农业大学林学与园艺学院 新疆 乌鲁木齐 830052
2. College of Forestry and Horticulture, Xinjiang Agricultural University, Urumqi, Xinjiang 830052, China
LIU Jun: liujem@126.com
瓜类细菌性果斑病是由革兰氏阴性菌——西瓜食酸菌(Acidovorax citrulli)引起的一种严重危害西瓜、甜瓜等葫芦科植物的世界性的种传细菌性病害。在高温高湿环境下,病菌可快速传播而导致植株的叶片、茎发生萎蔫或果实腐烂[1]。目前人们对瓜类细菌性果斑病的研究多集中在致病性、病原菌鉴定等方面[2],对于因过度使用铜化合物作为杀菌剂而导致抗铜菌株产生的抗铜机理方面研究却很少。Nies对细菌抗重金属机制做了初步研究发现可能存在3种机制: (1) 通过外排系统将有毒离子排出体外;(2) 通过含巯基等分子将有毒离子形成络合物或螯合物;(3) 通过酶促或化学反应将有毒物质还原成无毒或低毒物质[3]。2010年,杨亮对铜绿假单胞菌(Pseudomonas aeruginosa)中RND外排泵所有成员基因表达调节及重金属对铜绿假单胞菌的抗性影响进行了系统研究,研究发现缺失了RND外排泵基因的铜绿假单胞菌在重金属锌的环境下生长受严重抑制[4]。到目前为止国内对于西瓜食酸菌抗铜性的研究仅有赵文龙报道了P型ATP酶基因缺失对于西瓜食酸菌两个亚群抗铜性的影响,结果表明: P型ATP酶在铜离子转运过程中发挥了重要作用[5]。
本研究利用Tn5转座子随机插入西瓜食酸菌FC440基因组中,构建突变体文库,通过筛选该突变体库的2 100个菌株,得到一株Tn5转座子插入到RND家族外排转运体(efflux transporter)膜融合蛋白(MFP)亚基基因cusB中的突变体,该突变体在含铜培养基上表现出生长受严重抑制,在胞外多糖分泌量和生物膜形成上与野生型相比均表现出明显下降,而通过双亲杂交得到的功能互补菌株在上述检测中功能上又得到部分恢复。
RND蛋白家族是一类以质子驱动力(即质子进入细胞质释放的自由能转化为RND把底物排出细胞所需要的动力)为能量的外排系统,由三部分组成,包括内膜外排蛋白(IMP)、外膜外排蛋白(OMP)和膜融合蛋白(MFP),这三组分对于RND外排系统的正常工作缺一不可。膜融合蛋白(MFP)具有β-桶状结构、酯域和一个α-螺旋发卡结构,这些结构最终组装成富含β片段的α-螺旋柱状结构,产生一个跨整个周质空间的通道,诱导或稳定了外膜蛋白开放状态,从而使得底物直接排到细胞外而不是周质空间内。
到目前为止还没有报道RND外排系统对西瓜食酸菌中的抗铜影响,细菌抗铜性可能由多种基因共同表达调控,但RND外排系统作为革兰氏阴性菌所特有的系统,如果缺失某个组分,必定受到影响,因此本研究组针对cusB构建了突变体,并对突变体性状进行了生物学分析,初步研究了cusB基因在西瓜食酸菌中的功能。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和引物: 黄瓜(Cucumis sativus)品种为长春密刺,烟草(Nicotiana benthamiana)品种为本氏烟草,菌株与质粒见表 1。| 菌株、质粒和引物 Strains, plasmid and primers | 特征 Characteristics | 来源 Source |
| 菌株 Strains | ||
| FC440 | AmpR; wild type | This lab |
| Escherichia coli DH10B | 80 lacZ M15, (lacZYA-argF), recA1, endA1 | This lab |
| ∆cusB | AmpR; KanR; FC440 mutant defective in cusB | This study |
| ∆cusB+cusB | AmpR; KanR; TetR; complement strain of ∆cusB | This study |
| 质粒 Plasmids | ||
| pMD19-T | AmpR; ColE1 origin, T-vector | TaKaRa |
| pHC60 | TetR; expression vector; low copy | This lab |
| 引物 Primers | ||
| MF | CGGGATCCACCGCAACTTCCGGACCCTT BamHⅠ | This study |
| MR | GCTCTAGAGGCGGGGGACAGCTTCTT XbaⅠ | This study |
| AAC-1 | GACCAGCCCACAACTGGGAC | This lab |
| AAC-2 | CTGCCGCACTCCAGCGA | This lab |
Note: The restriction sites are underlined.
PCR仪,德国Biometra公司;电子天平AL-204-IC,梅特勒-托利多仪器上海有限公司;分光光度计722型,上海仪电分析仪器总厂;凝胶成像系统FC2,美国Alpha Innotech公司。
1.1.3 培养基和培养条件: 西瓜食酸菌在28 °C培养于含30 mg/L Amp的KMB (King’s medium B)[6]固体或NB (nutrient broth,NB)液体培养基中。大肠杆菌(E. coli)在37 °C培养于Luria-Bertani液体固体培养基,或者SOB[7]液体培养基中。本研究中所使用的抗生素浓度,除特别说明外,均为Amp 30 mg/L,Kan 50 mg/L,Tet 10 mg/L。 1.2 方法 1.2.1 cusB基因突变体制备: 将含有Amp和Kan的NB培养基倒入灭菌后的培养皿盖(2个96孔板约40 mL),用排枪吸取混合液140 μL,注入96孔板相应孔中,按照编号用灭菌牙签挑取由本实验室提供的插入Tn5转座子的FC440适量的菌液于相应的孔中,用滤纸小心吸取表面的水分,封膜,28 °C培养48 h,再取2个96孔板,注入140 μL含Amp和Kan的NB培养基,用机械手将含有适当浓度菌液的96孔板转移到另外两个板上(简称转存板),转存板予以封膜,28 °C培养48 h。待培养完成时,在384孔板中注入60 μL含有Amp和Kan的NB培养基,用机械手将上述96孔板中全部菌液转移至384孔板,用滤纸小心吸取表面的水分,封膜,28 °C培养48 h,最后用机械手将384孔板中含有适当浓度的菌液转移至含有1.25 mmol/L和2.5 mmol/L CuSO4的KMB平板上,28 °C培养48 h,观察菌落生长情况。将铜敏感型菌株送往华大基因测序鉴定插入位点。 1.2.2 cusB基因的PCR扩增和克隆: 根据Genbank已公布的Acidovorax citrulli AAC00-1的全基因组序列设计引物MF、MR (表 1)扩增cusB片段。PCR扩增体系如下: 5×Primer STARTM buffer (Mg2+) 4 μL,2.5 mmol/L dNTPs 1.6 μL,MF (30 μmol/L) 1.0 μL,MR (30 μmol/L) 1.0 μL,FC440 DNA (0.03 mg/L) 1.0 μL,Primer STARTM HS DNA polymerase (2.5 U/L) 0.2 μL,ddH2O 11.2 μL。PCR扩增条件: 95 °C 5 min;98 °C 10 s,68 °C 2 min,共30个循环;72 °C 5 min。将PCR产物回收纯化后与pMD19-T连接,热激法转化入E. coli DH10B,在LB+Amp的平板上筛选重组子,提取质粒双酶切验证并测序。用BamH I和Xba I双酶切重组子和表达载体pHC60,将其连接形成pHC60-cusB,热激法转化E. coli S17-1感受态,构建载体pHC60-cusB,提取质粒,双酶切验证。 1.2.3 互补菌株的构建: 将得到的重组载体pHC60-cusB利用双亲杂交的方法将质粒转入突变体中,在KMB+Amp+Kan+Tet的平板上筛选,并双酶切及用西瓜食酸菌特异性引物AAC-1和AAC-2 (表 1)[8]验证。 1.2.4 抗铜性的生物测定: 待测菌株FC440、FC440-pHC60、∆cusB、∆cusB+cusB活化培养后,用NB制备菌悬液OD600为0.18,取菌悬液0.5 μL转接至含1.25 mmol/L或者2.5 mmol/L CuSO4的KMB平板上(含30 mg/L Amp),置于28 °C培养48 h。同样浓度的菌悬液于1.25 mmol/L和2.5 mmol/L的CuSO4的NB培养基,28 °C、220 r/min培养,培养前(0 h)于600 nm波长下检测吸光度,随后每2 h检测一次并记录吸光值。以不含菌的相应铜浓度的NB液体作为上述菌液浓度检测时的对照组。 1.2.5 胞外纤维素酶测定: 待测菌株FC440、FC440-pHC60、∆cusB、∆cusB+cusB过夜培养后,稀释至OD600=0.5,取2 μL接种于含有0.5%羧甲基纤维素(CMC)的KMB平板上,静置10 min,28 °C培养48 h,在平板上加入20 mL的0.1%刚果红染色30 min,水清洗2次,再通过比较菌落周围水解透明圈的有无或大小判断菌株间胞外纤维素酶产量的差异,1 mol/L的NaCl 20 mL脱色2次,每次20 min,能产生纤维素酶的菌株,在红色背景下其菌落生长处及周围形成一个透明圈。每个处理重复3次[9]。 1.2.6 生物膜测定: 将待测菌株FC440、FC440-pHC60、∆cusB、∆cusB+cusB用NB液体培养基28 °C、180 r/min振荡培养至吸光度为1.0,按1:100的比例吸取菌液加入5 mL新鲜的液体NB培养基中,室温静置7 d,加入0.1%结晶紫溶液染色500 μL,20 min后用蒸馏水缓慢冲洗,观察实验结果。用95%乙醇润洗生物膜,在575 nm波长下检测吸光度,每个处理重复3次[10]。 1.2.7 胞外蛋白酶测定: 待测菌株FC440、FC440-pHC60、∆cusB、∆cusB+cusB过夜培养后,稀释至OD600=0.5,取2 μL接种于含有1%脱脂乳KMB平板上,静置10 min,28 °C培养48 h,观察透明圈的大小。每个处理重复3次[11]。 1.2.8 胞外多糖测定: 将待测菌株FC440、FC440-pHC60、∆cusB、∆cusB+cusB用NB培养基28 °C、180 r/min振荡培养至OD600为1.0,吸取20 mL菌液,12 000 r/min离心10 min,将上清转移至记录重量的离心管中,边搅拌边缓慢加入40 mL冰乙醇,12 000 r/min离心2 min,37 °C烘干3−5 d,称量产生的EPS干重。每个处理重复3次[12]。 1.2.9 致病性及过敏性坏死反应: 待测菌株FC440、FC440-pHC60、∆cusB、∆cusB+cusB过夜培养后,用灭菌蒸馏水稀释至OD600=0.5,接种于培养在28 °C生长6 d的黄瓜子叶上,每个叶片20 μL,5 d后观察病斑大小。每个处理重复3次。同时用处理好的稀释至OD600为0.5菌液注射烟草叶片,接种12−48 h观察叶片有无HR反应产生。无菌水作空白对照[13]。 2 结果与分析 2.1 cusB基因突变体制备对FC440 Tn5转座子插入诱变突变体库的2 100个突变体进行了铜敏感性测试(表 2),其中有7个菌株对铜离子敏感,即不能在含1.25 mmol/L
| 菌株 Strains | 1.25 mmol/L CuSO4 | 2.5 mmol/L CuSO4 |
| FC440 | − | − |
| 08-3-12-40 | +++ | +++ |
| 08-4-15-5 | +++ | +++ |
| 08-4-16-20 | ++ | +++ |
| 08-3-12-27 | + | + |
| 08-4-16-48 | + | + |
| 08-9-8-15 | +++ | +++ |
| 08-10-13-11 | ++ | +++ |
| 08-10-13-27 | + | ++ |
| 08-9-7-56 | + | + |
| 08-10-13-94 | +++ | +++ |
| 08-5-23-224 | +++ | +++ |
| 08-11-18-1 | +++ | +++ |
| 08-11-8-16 | + | ++ |
| 10-7-29-64 | +++ | +++ |
| 08-9-10-2 | + | + |
| 08-4-16-47 | + | ++ |
| 08-3-19-12 | ++ | + |
| 08-10-13-10 | +++ | +++ |
| 08-10-13-43 | ++ | + |
| Other strains | − | − |
Note: −: not sensitive to copper; +: sensitive to copper slightly; ++: more sensitive to copper; +++: sensitive to copper seriously.
CuSO4的KMB平板上生长;另外有12个菌株表现不同程度抗铜性的减弱。经亚克隆鉴定发现: Tn5转座子插在cusB基因的129 bp位置处(图 1),由于转座子的插入,致使该基因功能失活,不能正确翻译出MFP蛋白,导致突变体比野生型FC440对铜的抗性明显降低,证明了cusB基因在西瓜食酸菌的RND外排泵中具有重要作用。
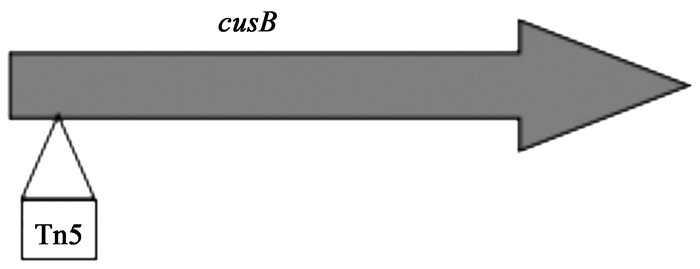
|
| 图 1 突变体插入基因的结构图 Figure 1 Organization of insertion gene of mutant |
以西瓜食酸菌野生型菌株FC440的基因组DNA为模板,通过PCR扩增出约1 231 bp的DNA片段(图 2),将其回收纯化后连接于pMD19-T,热激法转化入大肠杆菌感受态细胞DH10B,得到转化子,随机选取3个送北京华大基因公司测序,测序结果用DNAMAN进行比对,结果显示扩增片段与NCBI中西瓜食酸菌AAC00-1的同源基因相似性为99.66%,氨基酸序列相似性为99.75%,将其测序结果上传至NCBI,命名为cusB,获得GenBank登录号为KP334122。
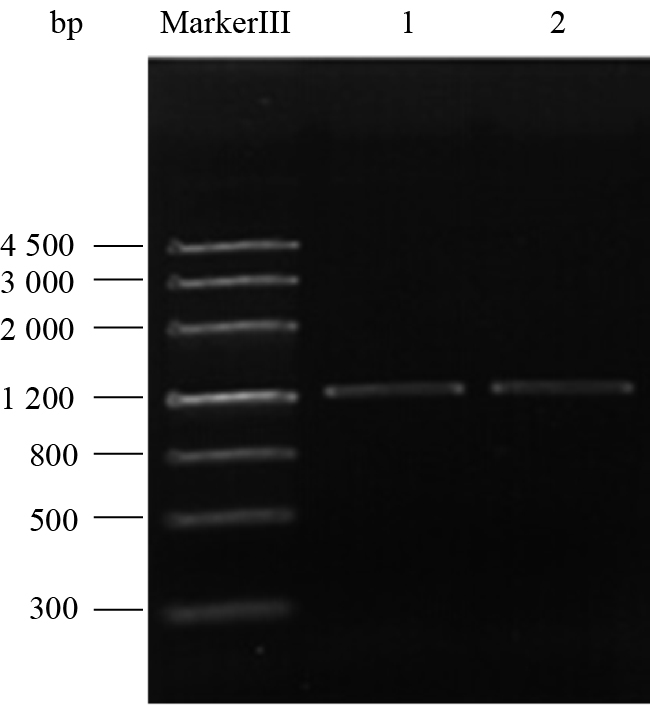
|
| 图 2 目的片段的扩增电泳图 Figure 2 Amplification of target fragments Note: 1, 2: cusB gene. |
提取互补菌株的质粒,通过双酶切验证重组质粒(图 3),通过双亲杂交得到的互补菌株利用西瓜食酸菌特异性引物AAC-1、AAC-2验证得到互补菌株 为西瓜食酸菌(图 4)。

|
| 图 3 双酶切验证重组质粒电泳图 Figure 3 Enzyme digestion of pHC60-cusB Note: 1, 2: pHC60-cusB. |

|
| 图 4 A. citrulli特异性引物PCR扩增结果 Figure 4 The PCR production of AAC-1/AAC-2 Note: 1: FC440; 2: FC440-pHC60; 3: ΔcusB 4: ΔcusB+cusB. |
对野生型菌株FC440、FC440-pHC60、突变体∆cusB以及功能互补菌株∆cusB+cusB的硫酸铜敏感性进行检测,从而对西瓜食酸菌抗铜性分子机理进行初步研究,实验结果表明: 在48 h后,突变体在含有1.25 mmol/L和2.5 mmol/L CuSO4的KMB上没有生长,说明突变体对于1.25 mmol/L和2.5 mmol/L CuSO4极度敏感。在含有1.25 mmol/L和2.5 mmol/L CuSO4的NB液体培养基中,每2 h检测一次在600 nm波长下的吸光值,与野生型相比,差异达到显著水平(P<0.05) (图 5)。
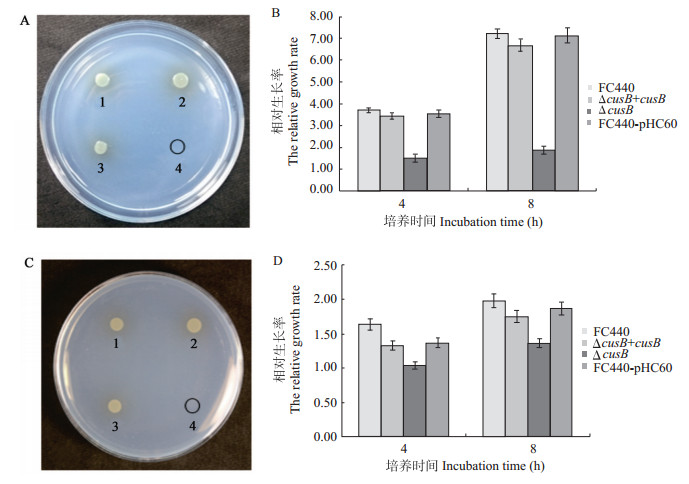
|
|
图 5 菌株在含不同浓度铜培养基的生长情况
Figure 5 The cupric sulphate sensitivity of strains
注: A,B: 1.25 mmol/L CuSO4浓度下菌落在KMB培养基和NB培养基的生长情况;C,D: 2.5 mmol/L CuSO4浓度下菌落在KMB培养基和NB培养基生长情况. 1−4: 依次是FC440、∆cusB、∆cusB+cusB、FC440-pHC60.
Note: A, B: The growth of colonies in 1.25 mmol/L CuSO4 concentration; C, D: The growth of colonies in 2.5 mmol/L CuSO4 concentration. 1−4: FC440, ∆cusB, ∆cusB+cusB, FC440-pHC60. |
如图 6a所示,在含有5% CMC的KMB平板上,突变体ΔcusB、野生型FC440、FC440-pHC60、互补菌株ΔcusB+cusB都能在菌落周围生成透明圈,测量透明圈的直径并且进行统计学分析后无显著差异(P>0.05),说明cusB基因的功能与胞外纤维素酶的活性无关。
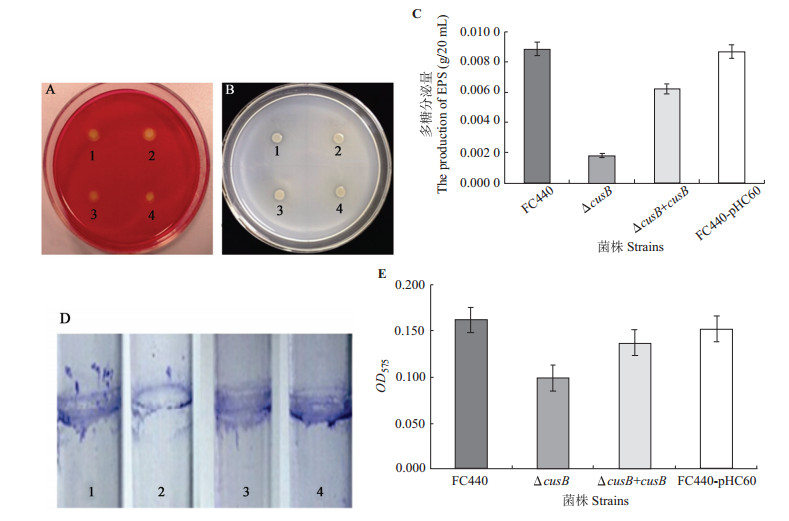
|
|
图 6 菌株胞外分泌物的检测
Figure 6 The examination of extracellular secretion
注: A: 胞外纤维素酶检测;B: 胞外蛋白酶检测;C: 胞外多糖的测定;D,E: 生物膜检测. 1−4: 依次是FC440、∆cusB、∆cusB+cusB、FC440-pHC60.
Note: A: extracellular cellulose test; B: extracellular protease test; C: extracellular polysaccharide production test; D, E: biofilm formation test. 1−4: FC440, ∆cusB, ∆cusB+cusB, FC440-pHC60. |
在含有脱脂乳的KMB平板上,突变体ΔcusB、野生型FC440、FC440-pHC60、互补菌株ΔcusB+cusB都能在菌落周围生成透明圈(图 6b),测量透明圈的直径并且进行统计学分析后无显著差异(P>0.05),说明突变体对于胞外蛋白酶的分泌没有影响。
2.7 胞外多糖的测定如图 6c所示,通过对待测菌株突变体ΔcusB、野生型FC440、FC440-pHC60、互补菌株ΔcusB+ cusB的胞外多糖检测,结果表明: 互补菌株的胞外多糖分泌量在突变体和野生型之间生物统计学分析具有显著性差异(P<0.05),说明cusB基因的缺失可能对胞外多糖分泌产生影响。
2.8 生物膜检测通过结晶紫染色,图 6E在菌液与空气接触面会出现一层紫色的圈,表明有生物膜的存在,如图6D、E所示,通过统计学分析得知突变体ΔcusB与野生型FC440之间差异显著(P<0.05),说明cusB基因的功能可能与西瓜食酸菌的生物膜形成有关。
2.9 致病性及过敏性反应将待测菌株通过针刺法接种于黄瓜子叶上,接种5 d后观察发病情况(图 7A),与野生型FC440相比,突变体的致病性无明显差异,表明cusB基因与致病性关系不密切。在非寄主植物烟草上的过敏性坏死反应测定结果表明(图 7B): 待测菌株均能发生过敏性坏死反应,野生型和突变体之间无明显差异。

|
|
图 7 黄瓜子叶上的的致病性及烟草叶上过敏性检测
Figure 7 Pathogenicity test in cucumber cotyledon and hypersensitive reaction test on tobacco
注: A: 1: 清水作为阴性对照;2: 野生型FC440作为阳性对照;3: FC440-pHC60;4: 突变体ΔcusB;5: 互补菌株ΔcusB+cusB. B: 1: 野生型FC440;2: FC440-pHC60;3: 突变体ΔcusB;4: 互补菌株ΔcusB+cusB.
Note: A: 1: Water sprayed (negative control); 2: Wild type FC440 (positive control); 3: FC440-pHC60; 4: Mutant strain ΔcusB; 5: Complementary strain ΔcusB+cusB. B: 1: Wild type FC440; 2: FC440-pHC60; 3: Mutant strain ΔcusB; 4: Complementary strain ΔcusB+cusB. |
西瓜食酸菌(Acidovorax citrulli)侵染葫芦科植物会使其发生一种危害极大的疾病——瓜类细菌性果斑病(bacterial fruit blotch,BFB),该病害已在世界各国迅速传播,对当地瓜农造成严重的经济损失。铜是细菌维持正常新陈代谢所必需的元素,但是当铜浓度过高时会对细菌产生毒害作用[14],根据这一特性,铜素类杀菌剂主要应用于瓜类细菌性病害的防治,但过度使用,使得西瓜食酸菌的铜敏感性日益降低,因此,研究该病菌的铜抗性机理显得尤为重要。
本文利用实验室保存的突变菌株ΔcusB,根据已公布的西瓜食酸菌全基因组序列设计引物,利用双亲杂交的方法得到了功能互补菌株ΔcusB+cusB,根据菌株间表型上的差异来验证其功能。通过不同CuSO4浓度条件下的检测发现: 在1.25 mmol/L和2.5 mmol/L CuSO4的KMB平板上,突变体的生长速率明显降低,不能正常生长,与野生型相比差异极显著,说明cusB基因的突变阻断了Cu2+的正常外排运输过程,进而影响其正常生长,在功能互补后,可恢复其生长。另外,植物病原菌通常在侵染寄主植物组织时会分泌多种致病因子,例如: 胞外纤维素酶[15]、胞外蛋白酶[16]、胞外多糖[17]、生物膜的形成[18]等,在胞外分泌物检测时发现: 突变体的多糖分泌量和生物膜形成与野生型相比差异显著,生物膜对菌体本身具有保护作用,其组分中包含了多糖等成分[19],进而随着多糖量的减少,检测发现生物膜在形成上也受到影响,说明西瓜食酸菌的RND外排系统与自身合成的多糖向外分泌有关,并且一定程度上能够影响生物膜的形成。胞外纤维素酶和胞外蛋白酶的检测中未发现与野生型有差异,说明它们的分泌途径与RND型外排转运体外排途径关系不密切,可能与细菌的其他分泌系统有关。致病性及过敏性坏死反应检测中发现: 突变体的致病性没有丧失,致病情况与野生型也没有差异,并且均能产生过敏性坏死反应。可见,RND外排转运体在西瓜食酸菌中与其致病性关系不密切。cusB基因的突变影响了西瓜食酸菌的正常铜离子外排转运,使其不能生长,这对于有效防治瓜类细菌性果
斑病具有一定的意义。本研究初步探索了cusB基因在A. citrulli中的功能,而其他未见报道的外排蛋白基因的突变是否也与抗铜性相关还有待进一步深入研究。
| [1] | Schaad NW, Postnikova E, Sechler A, et al. Reclassification of subspecies of Acidovorax avenae as A. avenae (Manns 1905) emend., A. cattleyae (Pavarino, 1911) comb. nov., A. citrulli (Schaad et al., 1978) comb. nov., and proposal of A. oryzae sp. nov.[J]. Systematic and Applied Microbiology, 2008, 31(6/8): 434-446 |
| [2] | Yan SS, Wang TL, Zhao TC. Advances in the bacterial fruit blotch of melons caused by Acidovorax citrulli[J]. Plant Quarantine, 2011, 25(3): 71-76 (in Chinese) 阎莎莎, 王铁霖, 赵廷昌. 瓜类细菌性果斑病研究进展[J]. 植物检疫, 2011, 25(3): 71-76 |
| [3] | Nies DH. Efflux-mediated heavy metal resistance in prokaryotes[J]. FEMS Microbiology Reviews, 2003, 27(2/3): 313-339 |
| [4] | Yang L. The regulation and functional characterization of the RND family in Pseudomonas aeruginosa PAO1[D]. Xi’an: Doctoral Dissertation of Northwest University, 2010 (in Chinese) 杨亮. 铜绿假单胞菌中 RND 外排泵基因表达调节和功能研 究[D]. 西安: 西北大学博士学位论文, 2010 |
| [5] | Zhao WL. Analysis of copper resistance in Acidovorax citrulli[D]. Beijing: Master’s Thesis of Chinese Academy of Agricultural Sciences, 2013 (in Chinese) 赵文龙. 瓜类细菌性果斑病菌抗铜性研究[D]. 北京: 中国农 业科学院硕士学位论文, 2013 |
| [6] | King EO, Ward MK, Raney DE. Two simple media for the demonstration of pyocyanin and fluorescin[J]. Journal of Laboratory and Clinical Medicine, 1954, 44(2): 301-307 |
| [7] | Cheng HP, Walker GC. Succinoglycan is required for initiation and elongation of infection threads during nodulation of alfalfa by Rhizobium meliloti[J]. Journal of Bacteriology, 1998, 180(19): 5183-5191 |
| [8] | Walcott RR, Gitaitis RD, Castro AC. Role of blossoms in watermelon seed infestation by Acidovorax avenae subsp. citrulli[J]. Phytopathology, 2003, 93(5): 528-534 |
| [9] | Chen L. Cloning and fuctional study of key genes of twin-arginine translocation system of Xanthomonas oryzae[D]. Nanjing: Master’s Thesis of Nanjing Agricultural University, 2008 (in Chinese) 陈磊. 水稻黄单胞菌双精氨酸运输(Tat)系统关键基因的克隆 与功能分析[D]. 南京: 南京农业大学硕士学位论文, 2008 |
| [10] | O’Toole GA, Kolter R. Flagellar and twitching motility are necessary for Pseudomonas aeruginosa biofilm development[J]. Molecular Microbiology, 1998, 30(2): 295-304 |
| [11] | Xu RQ. Identification of novel effectors depended on type Ⅲ secretion system in Xanthomonas campestris pv. campestris[D]. Nanning: Doctoral Dissertation of Guangxi University, 2006 (in Chinese) 徐荣旗. 野油菜黄单胞菌野油菜致病变种新的依赖于Ⅲ 型分 泌系统的效应物的鉴定[D]. 南宁: 广西大学博士学位论文, 2006 |
| [12] | He LY, Zhang YF, Ma HY, et al. Characterization of copper-resistant bacteria and assessment of bacterial communities in rhizosphere soils of copper-tolerant plants[J]. Applied Soil Ecology, 2010, 44(1): 49-55 |
| [13] | Ren ZG, Hou L, Song ZG, et al. Screening of the pathogenicitymutants of Acidovorax avenae subsp. citrulli and cloning of the hrcR gene[J]. Acta Phytopathologica Sinica, 2009, 39(5): 501-506 (in Chinese) 任争光, 侯磊, 宋治国, 等. 甜瓜细菌性果斑病菌致病性突 变体筛选与 hrcR 基因的克隆[J]. 植物病理学报, 2009, 39(5): 501-506 |
| [14] | Li Q, Yang YW, Sun BX, et al. Advances in copper resistant mechanisms of cucurbit and vegetable pathogenic bacteria[J]. China Cucurbits and Vegetables, 2014, 27(3): 5-9 (in Chinese) 李强, 杨玉文, 孙柏欣, 等. 瓜类及蔬菜等植物病原细菌抗 铜机制研究进展[J]. 中国瓜菜, 2014, 27(3): 5-9 |
| [15] | Li YS. Study on cellulase of Xanthomonas axonopodis pv. citri[D]. Chongqing: Master’s Thesis of Southwest University, 2011 (in Chinese) 李永胜. 柑桔溃疡病菌(Xanthomonas axonopodis pv. citri)纤 维素酶的分析[D]. 重庆: 西南大学硕士学位论文, 2011 |
| [16] | Fan WY, Wen JZ, Ma J, et al. Characterization of an extra-cellular protease produced by Rhizoctonia solani[J]. Plant Protection, 2010, 36(4): 55-59 (in Chinese) 范文艳, 文景芝, 马建, 等. 水稻纹枯病菌胞外蛋白酶特性 研 究[ J ] . 植物保护, 2010, 36(4): 55-59 |
| [17] | Zhou D, Zou LF, Zou HS, et al. Identification of extracellular polysaccharide-associated genes in Xanthomonas oryzae pv. oryzicola[J]. Acta Microbiologica Sinica, 2011, 51(10): 1334-1341 (in Chinese) 周丹, 邹丽芳, 邹华松, 等. 水稻条斑病菌胞外多糖相关基 因的鉴定[J]. 微生物学报, 2011, 51(10): 1334-1341 |
| [18] | Stewart PS, Costerton JW. Antibiotic resistance of bacteria in biofilms[J]. The Lancet, 2001, 358(9276): 135-138 |
| [19] | Høiby N, Bjarnsholt T, Givskov M, et al. Antibiotic resistance of bacterial biofilms[J]. International Journal of Antimicrobial Agents, 2010, 35(4): 322-332 |
 2016, Vol. 43
2016, Vol. 43




