扩展功能
文章信息
- 韩梅, 徐x致远, 钱和, 张伟国
- HAN Mei, XU Zhi-Yuan, QIAN He, ZHANG Wei-Guo
- 锁掷酵母油中营养成分的分离和鉴定
- Separation and identification of the main nutriments in Sporidiobolus pararoseus oil
- 微生物学通报, 2016, 43(1): 60-68
- Microbiology China, 2016, 43(1): 60-68
- 10.13344/j.microbiol.china.150296
-
文章历史
- 收稿日期: 2015-04-07
- 接受日期: 2015-07-09
- 优先数字出版日期(www.cnki.net): 2015-07-14
2. 光明乳业股份有限公司技术中心 乳业生物技术国家重点实验室 上海 200436
2. State Key Laboratory of Dairy Biotechnology, Technology Center Bright Dairy & Food Co., Ltd, Shanghai 200436, China
单细胞酵母和藻类被广泛应用于油脂的发酵研究。这些单细胞油脂不仅被应用于生物柴油的研究,还被应用于食品油脂的开发,例如微生物油脂可以提供花生四烯酸和二十二碳六烯酸(DHA)[1]。通过微生物发酵的方法获得油脂有不受环境的影响、不受土地的限制、发酵周期短等优点[2, 3, 4]。但是现在有关微生物油脂的报道主要集中在微生物油脂发酵条件的优化,很少有报道微生物油脂的营养成分组成的,因此研究微生物油脂的营养成分组成并建立营养组成的研究方法具有十分重要的意义。Zhao等[5]报道的Rhodosporidium toruloides Y4 138.5 h可以生产78.8 g/L的微生物油脂,Lin等[6]报道的Lipomyces starkeyi可以积累67.9 g/L的微生物油脂,但是他们只对微生物油脂中的脂肪酸组成进行了分析。
在我们以前的研究中[7, 8]发现锁掷酵母可以积累大量的油脂(20−25 g/L,45−50%干重),并且分析了锁掷酵母油中的主要类胡萝卜素的组成。但是随着研究的深入,酵母油中的其他有效成分不断被发现,例如角鲨烯、麦角固醇和麦角固醇酯。本研究详细介绍了酵母油中主要功效成分的分离纯化方法和其结构与含量的测定,并且测定了酵母油中三甘酯和麦角固醇酯的脂肪酸组成。通过研究证明锁掷酵母油是一种健康的油脂,含有丰富的功效成分,该油脂不仅可以应用于生物柴油的开发还可以作为营养补充剂用于功能食品中。本文所采用的分离纯化和鉴定方法同样可以被应用于其他微生物油脂中功能成分的研究。
1 材料与方法 1.1 菌种锁掷酵母(Sporidiobolus pararoseus JD-2)从自然界中筛选并保藏于中国典型菌种保藏中心,保藏号: CCTCCM2010326。
1.2 主要试剂和仪器β-胡萝卜素、麦角固醇、角鲨烯标准品购自Sigma公司;高效液相色谱仪购自美国安捷伦公司。
1.3 酵母油的获得锁掷酵母的培养方法和酵母油的提取方法见参考文献[5]。
1.4 酵母油的硅胶柱层析硅胶柱粗分: 酵母油溶于60−90 °C的石油醚中,然后上样60−90 °C石油醚装的硅胶柱(ID 32 mm× 25 mm,硅胶粒度200−300目)。洗脱条件为: 首先石油醚200 ml梯度添加20%丙酮的石油醚200 ml,然后洗脱体系换为300 ml 20%的石油醚丙酮溶液逐渐梯度添加300 ml乙酸乙酯,流速5 mL/min,每管收集2 min。
硅胶柱细分: 收集14−35管,50 °C蒸干然后溶于2 ml石油醚备用。细分柱为60−90 °C石油醚装的硅胶柱(ID 26 mm×40 mm,硅胶粒度200− 300目)。首先用200 ml石油醚洗脱,然后150 ml石油醚和150 ml的20%丙酮进行梯度洗脱,流速3.3 ml/min,每管收集3 min。
1.5 酵母油中各主要成分的鉴定薄层色谱法: 硅胶板10 cm×10 cm,以离薄板底端1.5 cm处为基线,准确吸取2 μl样品点于硅胶板上。基线端向下,放入展层剂中分离。待展层剂上升到距离最上沿0.5 cm处取出薄板,进行碘显色。
液相色谱法: 等度洗脱条件为: 乙腈:四氢呋喃=60:40 (体积比);梯度洗脱条件如文献[6]所述。
质谱分析: 将硅胶柱纯化后的样品进行质谱鉴定,质谱柱为C8柱,洗脱条件为纯甲醇溶液。
1.6 锁掷酵母油中三甘酯和麦角固醇酯的脂肪酸组成柱层析分纯后的三甘酯和麦角固醇酯进行甲基化,然后进行气相色谱测定。脂肪酸组成分析方法为国家标准GB/T 17377-2008。
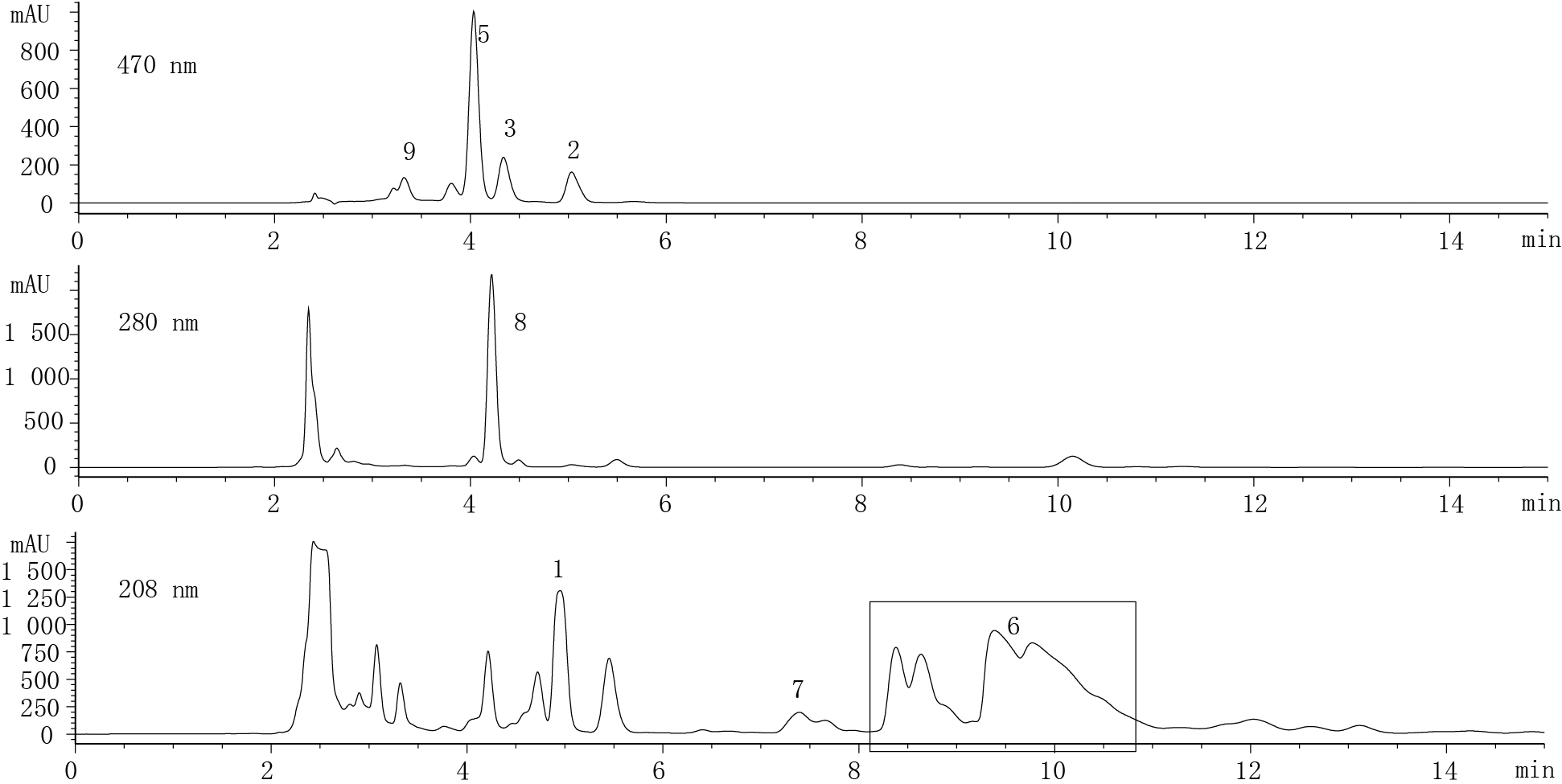
2 结果 2.1 酵母油中主要成分的分离鉴定通过硅胶柱粗分,从酵母油中分离出9个主要成分,命名为1−9。其中极性较强的成分分离较好,极性较弱的组分1−5之间仍然没有达到基线分离地效果,所以收集极性较弱的组分,进行细分。如图 1所示,通过硅胶柱细分后,1−5也可以较好地分开,同时对各个成分进行了质谱鉴定。1号物质其分子量为410,可能是角鲨烯,通过薄板层析与液相色谱进一步确定。1号物质的薄板层析Rf值(图 2)与液相色谱出峰时间(图 3)与角鲨烯标样一致。类胡萝卜素2、3、5和9在以前的文章中已经报道过其鉴定方法[8]。2号物质的分子量为536,是β-胡萝卜素;3号物质的分子量为536,是γ-胡萝卜素;5号物质分子量为534,是红酵母烯;9号物质的分子量为564,是红酵母红素。8号物质的分子量为396,可能是麦角固醇,通过其全波长图谱和薄板层析以及液相色谱进一步证明其确实为麦角固醇(图 3−5)。4号物质其质谱分子量为379,

|
|
图 1 酵母油中主要成分的硅胶层析色谱示意图
Figure 1 Seperation of the main compositions in Sporidiobolus pararoseus oil by silica gel chromatography
注: A: 洗脱条件: 首先石油醚和20%丙酮各200 ml,梯度洗脱,然后20%丙酮和乙酸乙酯各300 ml进行梯度洗脱;B: 洗脱条件: 首先200 ml石油醚进行洗脱,然后石油醚和20%丙酮各150 ml进行梯度洗脱. 1: 角鲨烯;2: β-胡萝卜素;3: γ-胡萝卜素;4: 麦角固醇酯;5: 红酵母烯;6: 甘油三酯;7: 游离脂肪酸;8: 麦角固醇;9: 红酵母红素.
Note: A: Elution conditions: Firstly, the extract was eluted with light-petroleum (200 ml ) gradually enriched with acetone (200 ml) and the final concentration of acetone was 20%. Secondly, the extract was eluted with 20% acetone in light-petroleum (300 ml) gradually enriched with ethyl acetate (300 ml) and the final concentration of ethyl acetate was 100%; B: Elution conditions: The extract was eluted with light-petroleum (200 ml); and then the elution was gradually enriched with acetone and the final concentration of acetone was 20% (150 ml). 1: Squalene; 2: β-Carotene; 3: γ-Carotene; 4: Ergosterol esters; 5: Torulene; 6: Triglyceride; 7: Free fatty acids; 8: Ergosterol; 9: Torularhodin. |

|
| 图 2 锁掷酵母油的薄板层析 Figure 2 Thin-layer chromatography of oil produced by Sporidiobolus pararoseus Note: Vhexane:VAcetone=50:1. |
|
|
图 3 锁掷酵母油的液相色谱等度洗脱结果
Figure 3 HPLC of the main compositions in Sporidiobolus pararoseus oil by isocratic elution
注: 1: 角鲨烯;2: β-胡萝卜素;3: γ-胡萝卜素;5: 红酵母烯;6: 甘油三酯;7: 游离脂肪酸;8: 麦角固醇;9: 红酵母红素. Note: 1: Squalene; 2: β-carotene; 3: γ-carotene; 5: Torulene; 6: Triglyceride; 7: Free fatty acids; 8: Ergosterol; 9: Torularhodin. |
|
|
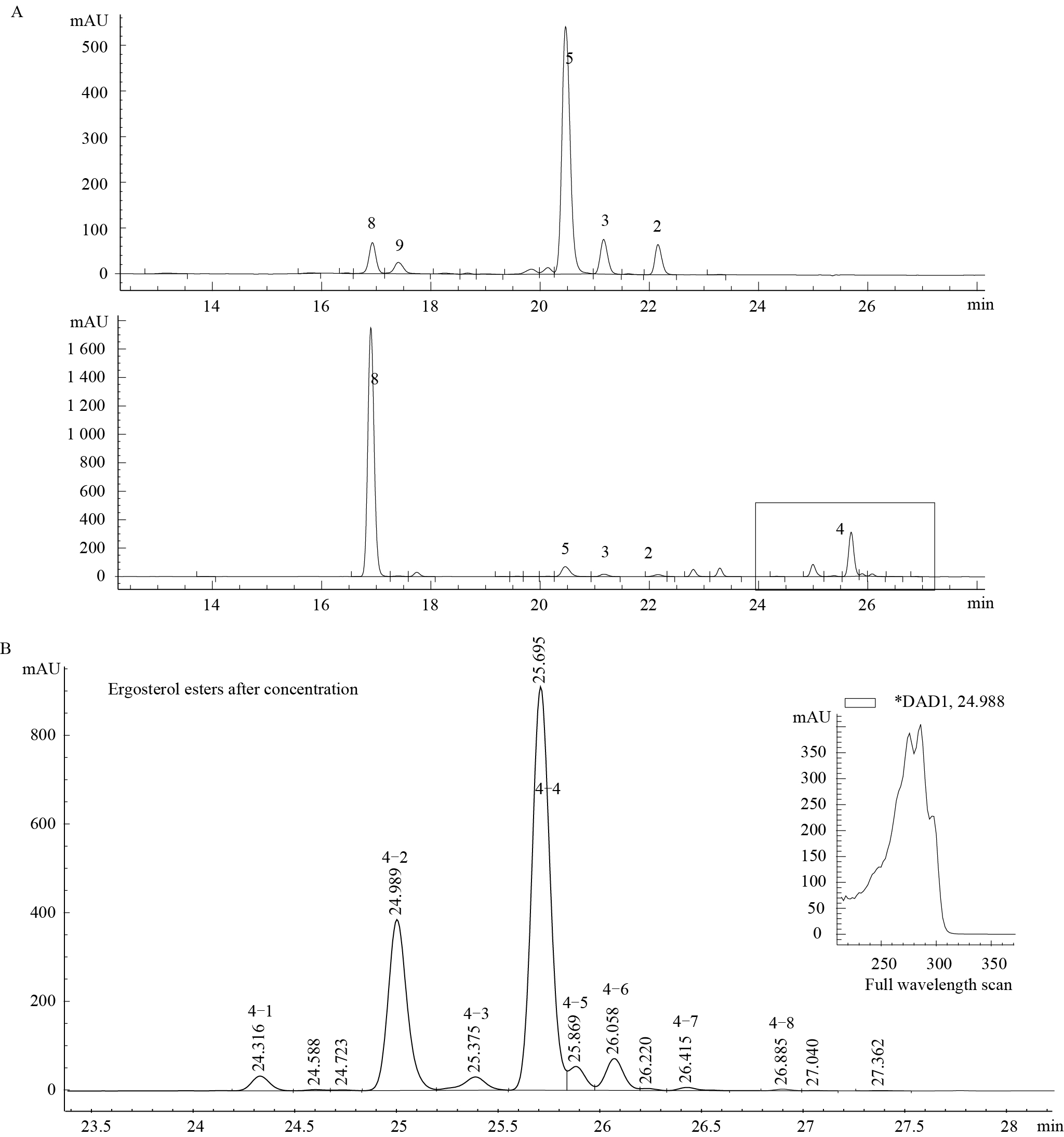
图 4 锁掷酵母油的主要成分的液相色谱梯度洗脱结果(A)和麦角固醇酯的液相色谱图(B)
Figure 4 HPLC of the main compositions in Sporidiobolus pararoseus oil by gradient elution (A) andHPLC of the different ergosterol esters (B)
注: 2: β-胡萝卜素;3: γ-胡萝卜素;4: 麦角固醇酯;5: 红酵母烯;8: 麦角固醇;9: 红酵母红素;4-1到4-8是麦角固醇与不同的脂肪酸酯化. Note: 2: β-carotene; 3: γ-Carotene; 4: Ergosterol esters; 5: Torulene; 8: Ergosterol; 9: Torularhodin; Ergosterol esterified with different fatty acids was shown From 4-1 to 4-8. |
该分子量为麦角固醇酯去掉酯基,并且其全波长扫描图形与麦角固醇相同(图 5),其皂化后可以得到麦角固醇。类胡萝卜素,角鲨烯和麦角固醇都是通过甲羟戊酸途径合成的,它们都属于萜类化合物,锁掷酵母甲羟戊酸代谢途径发达,以后的研究中可以将其作为母本用于其他甲羟戊酸途径合成物质的表达。

|
| 图 5 角鲨烯(A)、麦角固醇(B)和麦角固醇酯(C)的质谱图和全波长扫描 Figure 5 HPLC-MS and UV spectrum of squalene(A), ergosterol(B) and ergosterol esters(C) |
通过液相色谱法可以对酵母油中各物质进行定量分析,等度洗脱条件(图 3)主要可以用来对角鲨烯进行定量分析,对其他物质的含量进行快速分析,但是其分离效果没有梯度洗脱条件好。梯度洗脱(图 4)可以将酵母油中的各物质完全分开,分离效果好,但是由于所用试剂在208 nm有吸收,所以不能用来分析角鲨烯的含量。两种洗脱条件进行互补,最终可以得到酵母油中类胡萝卜素的含量为0.4±0.02 g/kg油。红酵母烯为主要的胡萝卜素成分其含量约为0.24 g/kg油,麦角固醇和麦角固醇酯分别为2.67 g/kg和0.53 g/kg油,角鲨烯含量为1.25 g/kg油(表 1)。
| Number | Name | Rf | λmax (nm) | Molecular weight | Content (g/kg oil) |
| 1 | 角鲨烯 | 0.94 (正己烷:丙酮=50:1) | 208 | 410 | 1.250 |
| 2 | β-胡萝卜素 | 0.82 (正己烷:丙酮=50:1) | 426,452,478 | 536 | 0.040 |
| 3 | γ-胡萝卜素 | 0.58 (正己烷:丙酮=50:1) | 434,461,490 | 536 | 0.032 |
| 4 | 麦角固醇酯 | 0.55 (正己烷:丙酮=50:1) | 283 | − | 2.470 |
| 5 | 红酵母烯 | 0.34 (正己烷:丙酮=50:1) | 462,484,516 | 534 | 0.240 |
| 8 | 麦角固醇 | 0.47 (正己烷:乙醚:甲酸=80:30:1) | 283 | 396 | 3.710 |
| 9 | 红酵母红素 | 0.64 (正己烷:丙酮=3:2) | 471,495,525 | 564 | 0.048 |
通过放大的图 4B可以看到麦角固醇酯由于连接的脂肪酸不同可以被分开,主要有8个峰,这与气相色谱中麦角固醇酯的脂肪酸主要有8种相对应。这8种麦角固醇酯的全波长扫描都与麦角固醇一致。
2.2 酵母油中三甘酯和麦角固醇酯中脂肪酸组成分析如表 2所示粗酵母油中不饱和脂肪酸占79.19%,不饱和脂肪酸主要为亚油酸。三甘酯和麦角固醇酯的脂肪酸组成有很大的区别。三甘酯中总的不饱和脂肪酸为79.15%,在麦角固醇酯中不饱和脂肪酸为92.15%,三甘酯中棕榈酸C16:0与棕榈油酸C16:1的比例为22:1,但是在麦角固醇酯中其两者的比例为4:1。三甘酯中亚油酸C18:2的比例仅为4.24%,但是在麦角固醇酯中亚油酸比例高达22.3%。 但是由于麦角固醇在酵母油中含量仅为0.53 g/kg油,所以粗油中的脂肪酸含量几乎与三甘酯的脂肪酸组成相同。
| Composition | Crude oil | Ergosterol esters | Triglycerides |
| C14:0 Tetradecanoic acid | 0.83 | 0.80 | 0.82 |
| C16:0 Hexadecanoic acid | 17.30 | 5.57 | 17.40 |
| C16:1 (Z)-9-hexadecanoic acid | 0.81 | 1.39 | 0.78 |
| C18:0 octadecanoic acid | 1.31 | 1.50 | 1.30 |
| C18:1 trans-9-Octadecenoic acid | 0.13 | − | 0.13 |
| C18:1 (Z)-9-octadecanoic acid | 73.20 | 65.80 | 74.00 |
| C18:2 (Z,Z)-9.12octadecanoic acid | 4.24 | 22.30 | 3.52 |
| C20:0 Eicosenoic acid | 0.36 | − | 0.37 |
| C20:1 11-eicosenoic acid | 0.52 | 1.72 | 0.52 |
| C18:3 α-linolenic acid | 0.29 | 0.94 | 0.20 |
| C22:0 behenic acid | 0.46 | − | 0.48 |
| C24:0 pyroligneous acid | 0.43 | − | 0.46 |
麦角固醇广泛存在于所有的真核细胞中。在酵母中的总麦角固醇通常以两种形式存在,一种是以麦角固醇的形式存在于细胞膜,另一种是以麦角固醇酯的形式存在于游离的细胞内油滴中[9]。麦角固醇是酵母中最主要的固醇类物质,它是重要的维生素D2和激素类药物的前体物质。另外近年来越来越多的报道集中在植物油中植物甾醇或植物甾醇酯对血浆胆固醇的降低作用。植物甾醇降低血浆胆固醇的机理主要是植物甾醇的结构与胆固醇的结构相似,因此植物甾醇可以抢占胆固醇的结合位点抑制胆固醇的吸收。而酵母油中的麦角固醇同样也与胆固醇结构类似,所以麦角固醇也同样具有降低血浆胆固醇的作用[10, 11, 12]。
酵母油的脂肪酸组成主要以单不饱和脂肪酸为主,其油酸的含量为73%,与橄榄油中油酸的含量(65%−75%)类似[13, 14]。橄榄油中因为含有丰富的单不饱和脂肪酸所以可以降低冠心病的发病率[15]。富含单不饱和脂肪酸的油脂可以降低氧化胆固醇在动脉的堆积,降低动脉粥状硬化[16, 17, 18, 19]。酵母油中既有麦角固醇又含有丰富的单不饱和脂肪酸,所以它可能有优于橄榄油的降血脂功能。
角鲨烯是一种含有6个异戊二烯结构的三萜化合物,被广泛应用于抗氧化剂、拮抗剂和化妆品中的润肤剂[20]。橄榄油中含有丰富的角鲨烯(约4 g/kg油)[19],但是在植物油中例如菜籽油,其角鲨烯的含量小于0.05 g/kg。锁掷酵母油中含有1.25 g/kg的角鲨烯,因此锁掷酵母油可以作为角鲨烯的优良来源。
类胡萝卜素是公认的自由基清除剂,并且还是重要的维生素A源,现在还有越来越多的报道表明类胡萝卜素具有显著的抗肿瘤活性[21]。所有的好氧微生物都需要有足够的抗氧化物质来帮助其抵御氧化损伤,但是动物和人又不能自身合成类胡萝卜素,所以补充适量的类胡萝卜素对人体的健康有十分重要的作用。锁掷酵母油中还含有大量的类胡萝卜素,约0.4 g/kg油,这远大于各种植物油中的类胡萝卜素含量。Parry等报道的南瓜籽油中类胡萝卜素含量约为5 481 µg/L[14],波森莓籽油中类胡萝卜素的含量为2.405 µg/g,覆盆子籽油中类胡萝卜素的含量为82 µg/kg,蓝莓籽油中类胡萝卜素的含量为1.352 µg/g,蔓越莓籽油中类胡萝卜素的含量为0.443 µg/g[22],Cabrini等报道的玉米油1 200 µg/L,花生油130 µg/L,大豆油280 µg/L[23]。这些数据表明酵母油可以提供更丰富的类胡萝卜素。
4 结语本实验研究了锁掷酵母油中的主要组成成分和含量,并且对其脂肪酸组成进行了分析,结果表明锁掷酵母油脂中含有麦角固醇、单不饱和脂肪酸、角鲨烯和类胡萝卜素,为锁掷酵母油作为功能性油脂的深入应用和功能性开发奠定了基础。后续的工作要对锁掷酵母油脂的功能性进行动物实验验证。
| [1] | Ratledge C. Fatty acid biosynthesis in microorganisms being used for single cell oil production[J]. Biochimie, 2004, 86(11): 807-815 |
| [2] | Li Q, Du W, Liu DH. Perspectives of microbial oils for biodiesel production[J]. Applied Microbiology and Biotechnology, 2008, 80(5): 749-756 |
| [3] | Meng X, Yang JM, Xu X, et al. Biodiesel production from oleaginous microorganisms[J]. Renewable Energy, 2009, 34(1): 1-5 |
| [4] | Vicente G, Martínez M, Aracil J. Integrated biodiesel production: a comparison of different homogeneous catalysts systems[J]. Bioresource Technology, 2004, 92(3): 297-305 |
| [5] | Zhao X, Hu CM, Wu SG, et al. Lipid production by Rhodosporidium toruloides Y4 using different substrate feeding strategies[J]. Journal of Industrial Microbiology & Biotechnology, 2011, 38(5): 627-632 |
| [6] | Lin JT, Shen HW, Tan HD, et al. Lipid production by Lipomyces starkeyi cells in glucose solution without auxiliary nutrients[J]. Journal of Biotechnology, 2011, 152(4): 184-188 |
| [7] | Han M, He Q, Zhang WG. Carotenoids production in different culture conditions by Sporidiobolus pararoseus[J]. Preparative Biochemistry and Biotechnology, 2012, 42(4): 293-303 |
| [8] | Shi QY, Wang HY, Du C, et al. Tentative identification of torulene Cis/trans geometrical isomers isolated from Sporidiobolus pararoseus by high-performance liquid chromatography-diode array detection-mass spectrometry and preparation by column chromatography[J]. Analytical Sciences, 2013, 29(10): 997-1002 |
| [9] | Shobayashi M, Mitsueda S, Ago M, et al. Effects of culture conditions on ergosterol biosynthesis by Saccharomyces cerevisiae[J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(12): 2381-2388 |
| [10] | Mussner MJ, Parhofer KG, von Bergmann K, et al. Effects of phytosterol ester-enriched margarine on plasma lipoproteins in mild to moderate hypercholesterolemia are related to basal cholesterol and fat intake[J]. Metabolism, 2002, 51(2): 189-194 |
| [11] | O’Neill FH, Brynes A, Mandeno R, et al. Comparison of the effects of dietary plant sterol and stanol esters on lipid metabolism[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2004, 14(3): 133-142 |
| [12] | Seki S, Hidaka I, Kojima K, et al. Effects of phytosterol ester-enriched vegetable oil on plasma lipoproteins in healthy men[J]. Asia Pacific Journal of Clinical Nutrition, 2003, 12(3): 282-291 |
| [13] | Okogeri O, Tasioula-Margari M. Changes occurring in phenolic compounds and α-tocopherol of virgin olive oil during storage[J]. Journal of Agricultural and Food Chemistry, 2002, 50(5): 1077-1080 |
| [14] | Parry J, Hao ZG, Luther M, et al. Characterization of cold-pressed onion, parsley, cardamom, mullein, roasted pumpkin, and milk thistle seed oils[J]. Journal of the American Oil Chemists’ Society, 2006, 83(10): 847-854 |
| [15] | Hu FB. The Mediterranean diet and mortality-olive oil and beyond[J]. The New England Journal of Medicine, 2003, 348(26): 2595-2596 |
| [16] | Khosla P, Hayes KC. Comparison between the effects of dietary saturated (16:0), monounsaturated (18:1), and polyunsaturated (18:2) fatty acids on plasma lipoprotein metabolism in cebus and rhesus monkeys fed cholesterol-free diets[J]. The American Journal of Clinical Nutrition, 1992, 55(1): 51-62 |
| [17] | Mattson FH, Grundy SM. Comparison of effects of dietary saturated, monounsaturated, and polyunsaturated fatty acids on plasma lipids and lipoproteins in man[J]. Journal of Lipid Research, 1985, 26(2): 194-202 |
| [18] | McLennan PL. Relative effects of dietary saturated, monounsaturated, and polyunsaturated fatty acids on cardiac arrhythmias in rats[J]. The American Journal of Clinical Nutrition, 1993, 57(2): 207-212 |
| [19] | Miettinen TA, Vanhanen H. Serum concentration and metabolism of cholesterol during rapeseed oil and squalene feeding[J]. The American Journal of Clinical Nutrition, 1994, 59(2): 356-363 |
| [20] | Huang ZR, Lin YK, Fang JY. Biological and pharmacological activities of squalene and related compounds: potential uses in cosmetic dermatology[J]. Molecules, 2009, 14(1): 540-554 |
| [21] | Frengova GI, Beshkova DM. Carotenoids from Rhodotorula and Phaffia: yeasts of biotechnological importance[J]. Journal of Industrial Microbiology and Biotechnology, 2009, 36(2): 163-180 |
| [22] | Parry J, Yu L. Fatty acid content and antioxidant properties of cold-pressed black raspberry seed oil and meal[J]. Journal of Food Science, 2004, 69(3): FCT189-FCT193 |
| [23] | Cabrini L, Barzanti V, Cipollone M, et al. Antioxidants and total peroxyl radical-trapping ability of olive and seed oils[J]. Journal of Agricultural and Food Chemistry, 2001, 49(12): 6026-6032 |
 2016, Vol. 43
2016, Vol. 43




