扩展功能
文章信息
- 谢萌, 熊子君, 赵立兴, 邓子新, 林双君
- XIE Meng, XIONG Zi-Jun, ZHAO Li-Xing, DENG Zi-Xin, LIN Shuang-Jun
- 雷公藤植物内生Micromonospora sp. M66生产的一组吲哚生物碱
- Indole alkaloids from endophytic Micromonospora sp. M66 of Tripterygium wilfordii Hook. f.
- 微生物学通报, 2016, 43(1): 51-59
- Microbiology China, 2016, 43(1): 51-59
- 10.13344/j.microbiol.china.150106
-
文章历史
- 收稿日期: 2015-01-30
- 接受日期: 2015-02-27
- 优先数字出版日期(www.cnki.net): 2015-06-12
2. 云南大学 云南省微生物研究所 云南 昆明 650091
2. Yunnan Institute of Microbiology, Yunnan University, Kunming, Yunnan 650091, China
微生物次级代谢产物作为天然产物的重要组成部分,在医药、抗生素和农用药物的研究与开发中发挥着重要作用。以链霉菌为主体的放线菌是微生物药物的主要生产者,然而,近年来从链霉菌中筛选和分离鉴定的新化合物越来越少,严重制约了微生物药物研究。因此,人们逐渐把目光投向了以小单孢菌为代表的稀有放线菌。小单孢菌科作为稀有放线菌中产生活性物质最多的一个科,产生的活性化合物占到稀有放线菌所产生化合物总量的约40%,至今已有750多个生物活性化合物成功地从小单孢菌中分离鉴定出来,这些次级代谢产物的生物活性十分多样,包括抗细菌活性、抗真菌活性和抗肿瘤活性等[1]。近二十年来,小单孢菌的次级代谢产物中新抗生素的发现数量已经超越链霉菌,使得其已然成为放线菌中最具生产力的活性天然产物产生菌[2]。
小单孢菌产生的生物活性化合物主要是抗生素,包含以下几种类型:氨基糖苷类、大环内酯类、安莎类、蒽环类、多环呫吨酮和醌类、烯二炔类等。(1) 氨基糖苷类:庆大霉素是从小单孢菌中鉴定的第一个氨基糖苷类抗生素,由此拉开了小单孢菌活性物质研究的序幕[3]。1970年,Weinstein等发现一株小单孢菌Micromonospora zionensis能够产生西索米星,它同样属于氨基糖苷类抗生素且化学结构和抗菌谱与庆大霉素类似,但对绿脓杆菌抗性相对更强[4]。(2) 大环内酯类:红霉素是临床上经常使用的大环内酯类抗生素,在小单孢菌Micromonospora megalomicea中分离得到红霉素B具有十分重要的意义,因为这是首次从链霉菌之外的微生物中分离得到该类抗生素,有力地证实了小单孢菌产生抗生素等生物活性物质的巨大潜力[5]。(3) 安莎类:安莎类抗生素分为卤霉素和利福霉素两个亚类,而能够产生这两类抗生素的小单孢菌菌株均已被报道[6]。(4) 蒽环类:Micromonomycin是从小单孢菌中分离得到的蒽环类抗生素,具备较强的抗金黄色葡萄球菌和抗肺炎链球菌活性,对真菌也有一定的杀灭作用[7]。另一种报道的蒽环类抗生素Dynemicins分离自茶新那小单孢菌(Micromonospora chersina),其抗肿瘤活性很强且毒性较小,具有较好的药物开发前景[8]。(5) 多环呫吨酮和醌类:从小单孢菌Micromonosporasp. Tü 6 368. I.分离得到的多环呫吨酮类抗生素Retymicin也具有很好的抗肿瘤活性,特别是对胃癌细胞和肝癌细胞的生长抑制作用比较明显[9]。而醌环类抗生素Kosinostatin分离自菌株Micromonospora sp. TP-A0 468,能够抑制21种人类癌细胞的生长[10]。(6) 烯二炔类:Calicheamicin是一种结构新颖的烯二炔类抗生素,最初由CYANAMID公司的科学家在1987年分离自棘孢小单孢菌亚种Micromonospora echinospora subsp. calichensis,其抗肿瘤活性大约是Doxorubicin的4 000倍,抗肿瘤疗效明显,经过多年的研究,已在2000年作为药物成功上市[11]。
为了获取更多的结构多样的次级代谢产物,本文选取一株稀有放线菌——小单孢菌M66,以HPLC-MS技术指导代谢产物的分离纯化过程,从中分离鉴定了7个吲哚生物碱类次级代谢产物,为新型微生物药物和农业生物制剂开发提供了有益信息。
1 材料与方法 1.1 菌株和培养基菌株M66分离自云南特有的药用植物雷公滕Tripterygium wilfordii Hook. f.的根,经16S rRNA基因和形态鉴定为Micromonospora sp.,编号为M66。Bennet培养基(g/L)[12];种子培养基(g/L):淀粉20.0,葡萄糖5.0,酵母提取物5.0,胰蛋白胨5.0,MgSO4-7H2O 0.5,CaCO3 0.5,pH 7.2;发酵培养基(g/L):糊精35.0,豆粉20.0,葡萄糖10.0,胰蛋白胨10.0,MgSO4-7H2O 0.5,CaCO3 1.0,pH 7.2。
1.2 主要试剂和仪器试剂:丙酮、氯仿、二氯甲烷,国药集团化学试剂公司;甲醇、石油醚、乙酸乙酯,上海凌峰试剂公司;氘代试剂,Cambridge Isotope Laboratory;HPLC级试剂,Hipure Chem;柱层析硅胶、硅胶GF254薄层层析高效板,青岛海洋化工厂;C18反相层析硅胶(50-75 μm),YMC*GEL;Sephadex LH-20,GE Healthcare。
仪器:旋转蒸发仪,Buchi (荷兰);Innova 44摇床,New Brunswick Scientific (美国);HPLC,LC-MS,Agilent 1260 Infinity (德国);分析色谱柱ZORBAX SB-C18 (5 μm, 4.6 mm×150 mm),Agilent,半制备色谱柱ZORBAX ODS (5 μm,9.4 mm×250 mm),Agilent;500M核磁共振仪,Bruker (德国)。
1.3 菌株的培养及发酵将菌种划线接种于Bennet平板,在30 °C培养3 d,刮取1 cm2的菌落,接种于50 mL种子培养基,30 °C、200 r/min摇床培养2 d。取种子液,5%接种量接种到500 mL发酵培养基中,30 °C、200 r/min摇床培养7 d。
1.4 次级代谢产物的提取对小单孢菌M66进行大批量发酵,共40 L。将收集到的发酵液先经过6 000 r/min离心20 min,合并上清液。随后用等体积乙酸乙酯反复萃取3次,将萃取后的有机相于30 °C减压蒸馏,除去有机溶剂,得到粗产物。
1.5 次级代谢产物分离及纯化使用正相硅胶柱对粗产物进行粗分。分离条件为石油醚:乙酸乙酯=10:1、石油醚:乙酸乙酯=5:1、石油醚:乙酸乙酯=2:1、石油醚:乙酸乙酯=1:2、乙酸乙酯、乙酸乙酯:甲醇=10:1、乙酸乙酯:甲醇=5:1、乙酸乙酯:甲醇=1:1、甲醇。收集洗脱液,采用薄层层析进行样品分析,最终合并为FR1-FR16 (FR:Fraction)共16个组分。
对组分FR7进行反相硅胶吸附柱色谱分离,用甲醇-水进行梯度洗脱,甲醇浓度依次为10%、30%、50%、70%和100%,收集洗脱液用HPLC检测,合并得到FR7A、FR7B和FR7C三个组分。再对FR7A组分用Sephadex LH-20柱色谱进行分离,甲醇作流动相,HPLC检测并合并,得到组分FR7A1和化合物6。之后,对FR7A1组分用半制备型HPLC进行分离制备,得到化合物1和化合物2。
对组分FR8用Sephadex LH-20柱色谱进行分离,甲醇作流动相,HPLC检测并合并得到组分FR8A、组分FR8B和化合物7。之后,对FR8B组分用半制备型HPLC进行分离制备,得到化合物3和化合物5。
对组分FR9用Sephadex LH-20柱色谱进行分离,甲醇作流动相,得到化合物4。
最终得到化合物1 (15 mg),化合物2 (10 mg),化合物3 (10 mg),化合物4 (25 mg),化合物5 (10 mg),化合物6 (20 mg),化合物7 (15 mg) (图 1、2)。

|
| 图 1 化合物1-7的化学结构 Figure 1 The chemical structures of compounds 1-7 |

|
|
图 2
化合物1-7的HPLC色谱图
Figure 2
HPLC chromatograms of compounds 1-7
注:HPLC分析条件:乙腈30%-100% (0-30 min).
Note: HPLC analysis condition: ACN 30%-100% (0-30 min). |
化合物1为淡黄色粉末,易溶于甲醇和二甲基亚砜,微溶于氯仿。紫外吸收如图 3所示。对化合物1进行液-质(LC-MS)分析,结果显示其准分子离子峰(m/z)为146.062 7 [M+H]+,其分子式为C9H8NO+,理论分子量为146.060 0。将化合物1溶解于0.6 mL的氘代甲醇中,进行核磁共振谱(NMR)分析,以TMS (Tetramethylsilane)为内标。根据其1H NMR谱图(图 4)和高分辨质谱,确定该化合物为已知化合物1H-Indole-3-carboxaldehyde,是重要的化学合成中间体。1H NMR (500 MHz, CD3OD):δ 9.89 (s,1H),8.16 (d,7.5 Hz,1H),8.09 (s,1H),7.47 (d,7.5 Hz,1H),7.27 (td,7.0,1.0 Hz,1H),7.23 (td,7.5,1.0 Hz,1H)。

|
| 图 3 代表性化合物1、5、6、7的紫外吸收光谱 Figure 3 UV absorbance spectra of compounds 1, 5, 6, 7 |

|
| 图 4 化合物1的核磁共振氢谱(500 MHz,CD3OD) Figure 4 The 1H NMR of compound 1 (500 MHz, CD3OD) |
化合物2是淡黄色粉末,易溶于甲醇和二甲基亚砜,微溶于氯仿。其与化合物1的紫外吸收相似,HPLC分析的出峰时间在6.5 min左右(图 2)。对化合物2进行液-质(LC-MS)分析,结果显示其准分子离子峰(m/z)为176.072 0 [M+H]+,其分子式为C10H10NO2+,理论分子量为176.070 6。将化合物2溶解于0.6 mL的氘代甲醇中,进行核磁共振谱(NMR)分析,以TMS为内标。其1H NMR图谱(图 5)和高分辨质谱表明,该化合物为已知化合物1H-Indole-3-acetic acid。1H NMR (500 MHz,CD3OD):δ 7.57 (d,8.0 Hz,1H),7.30 (d,8.5 Hz,1H),7.14 (s,1H),7.06 (td,8.0,1.0 Hz,1H),6.97 (td,8.0,1.0 Hz,1H),3.65 (s,2H)。

|
| 图 5 化合物2的核磁共振氢谱(500 MHz,CD3OD) Figure 5 The 1H NMR of compound 2 (500 MHz, CD3OD) |
化合物3是淡黄色粉末,易溶于甲醇和二甲基亚砜,微溶于氯仿。其与化合物1和2的紫外吸收相似,HPLC分析的出峰时间在15 min左右(图 2)。对化合物3进行液-质(LC-MS)分析,其准分子离子峰(m/z)为176.071 0 [M+H]+,其分子式为C10H10NO2+,理论分子量为176.070 6,与化合物2的分子量完全相同,那么它们属于同分异构体。将化合物3溶解于0.6 mL的氘代甲醇中,进行核磁共振谱(NMR)分析,以TMS为内标。比较化合物3的1H NMR谱图(图 6)与化合物2的1H NMR谱图,尽管芳香氢的化学位移不同,但是裂分方式是相同的,可见均是3-位取代的吲哚环;二者均含有一个CH2单元,而化合物3的CH2出现在δH 4.73 (s),表明这个CH2与氧相连。结合高分辨质谱,推测该化合物为已知化合物3-hydroxyacetyl-indole。1H NMR (500 MHz,CD3OD):δ 8.22 (dd,7.5,1.5 Hz,1H),8.19 (s,1H),7.45 (dd,7.0,1.5 Hz,1H),7.24 (td,7.5,1.0 Hz,1H),7.21 (td,7.5,1.5 Hz,1H),4.74 (s,2H)。

|
| 图 6 化合物3的核磁共振氢谱(500 MHz,CD3OD) Figure 6 The 1H NMR of compound 3 (500 MHz, CD3OD) |
化合物4是淡黄色粉末,微溶于甲醇,易溶于氯仿。与化合物1、2和3的紫外吸收相似,HPLC分析的出峰时间在14 min左右(图 2)。对化合物4进行液-质(LC-MS)分析,其准分子离子峰(m/z)为190.085 9 [M-H]-,其分子式为C11H12NO2-,理论分子量为190.087 4。将化合物4溶解于0.6 mL的氘代氯仿中,进行核磁共振谱(NMR)分析,以TMS为内标。利用核磁共振光谱数据如1H NMR (图 7)、13C NMR、HMBC、HMQC和COSY谱鉴定该化合物为已知化合物3-(2,3-Dihydroxypropyl) indole。1H NMR (500 MHz,CDCl3):δ 8.06 (brs,1H),7.62 (d,8.0 Hz,1H),7.38 (d,8.0 Hz,1H),7.22 (td,8.0,1.0 Hz,1H),7.14 (td,7.5,0.5 Hz,1H),7.10 (d,2.0 Hz,1H),4.07 (m,1H),3.76 (dd,11.0,3.5 Hz,1H),3.59 (dd,11.0,7.0 Hz,1H),3.00 (dd,9.5,5.0 Hz,1H),2.92 (dd,9.5,8.0 Hz,1H)。13C NMR (125 MHz,CDCl3):δ 136.6,127.7,123.0,122.5,119.8,119.0,111.7,111.4,72.0,66.5,29.5。

|
| 图 7 化合物4的核磁共振氢谱(500 MHz,CDCl3) Figure 7 The 1H NMR of compound 4 (500 MHz, CDCl3) |
化合物5是淡黄色粉末,易溶于甲醇和二甲基亚砜。紫外吸收略不同于以上4个化合物的紫外吸收图谱,如图 1所示。对化合物5进行液-质谱(LC-MS)分析,结果显示其准分子离子峰(m/z)为211.044 0 [M+Na]+,其分子式为C10H8N2NaO2+,理论分子量为211.047 8。将化合物5溶解于0.6 mL的氘代甲醇中,进行核磁共振谱(NMR)分析,以TMS为内标。根据其1H NMR (图 8)、13C NMR谱和高分辨质谱数据,确定该化合物为已知化合物N-(1H-Indol-3-yl)-2-oxo-acetamide。1H NMR (500 MHz,CD3OD):δ 8.72 (s,1H),8.30 (dd,7.0,1.0 Hz,1H),7.47 (dd,7.0,2.0 Hz,1H),7.27 (td,7.5,2.0 Hz,1H),7.24 (td,7.5,1.5 Hz,1H)。13C NMR (125 MHz,CD3OD):δ 183.4,168.6,139.8,138.3,128.2,125.1,124.1,123.3,114.3,113.4。
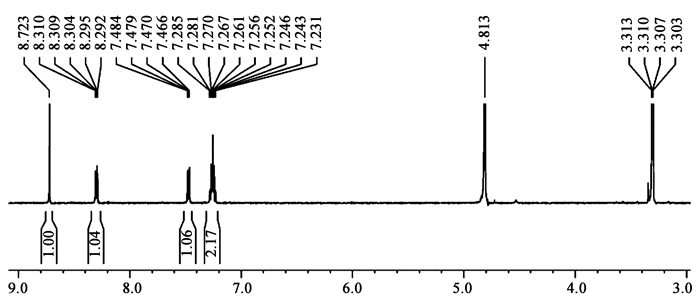
|
| 图 8 化合物5的核磁共振氢谱(500 MHz,CD3OD) Figure 8 The 1H NMR of compound 5 (500 MHz, CD3OD) |
化合物6是淡黄色粉末,易溶于氯仿和二甲基亚砜。紫外吸收图谱见图 1。对化合物6进行液-质(LC-MS)分析,结果显示其准分子离子峰(m/z)为224.122 6 [M+H]+,其分子式为C14H14N3+,理论分子量为224.118 2。将化合物6溶解于0.6 mL的氘代氯仿中,进行核磁共振光谱(NMR)分析,以TMS为内标。根据1H NMR (图 9)、13C NMR、HMBC、HMQC和COSY谱,鉴定该化合物为已知化合物1H-Indole,3-[(5-methyl-2-pyrazinyl)methyl],是2013年从一株深海稀有放线菌Serinicoccus profundi sp. nov.分离鉴定的[13]。1H NMR (500 MHz,CDCl3):δ 8.27 (d,3.5 Hz,2H),8.09 (brs,1H),7.56 (d,8.0 Hz,1H),7.36 (d,8.0 Hz,1H),7.19 (t,8.0 Hz,1H),7.09 (t,7.5 Hz,1H),7.07 (d,1.5 Hz,1H),4.28 (s,2H),2.56 (s,3H)。13C NMR (125 MHz,CDCl3):δ 155.6,152.9,142.0,141.6,136.6,127.4,122.7,122.4,119.8,119.2,113.1,111.3,32.2,21.7。此外,一些结构类似的化合物被报道从微生物中分离鉴定或通过化学合成方法合成出来[14, 15]。

|
| 图 9 化合物6的核磁共振氢谱(500 MHz,CDCl3) Figure 9 The 1H NMR of compound 6 (500 MHz, CDCl3) |
化合物7是淡黄色粉末,微溶于甲醇和氯仿,易溶于二甲基亚砜。紫外吸收如图 1所示。对化合物7进行液-质谱(LC-MS)分析,结果显示其准分子离子峰(m/z)为339.159 8 [M+H]+,其分子式为C22H15N4+,理论分子量为339.160 4。将化合物7溶解于0.6 mL的氘代二甲基亚砜中,进行核磁共振谱(NMR)分析,以TMS为内标。根据1H NMR (图 10)、13C NMR谱和高分辨质谱数据,确认该化合物为已知化合物1H-Indole,3,3'-[2,5-pyrazinediylbis(methylene)]bis-。1H NMR (500 MHz,DMSO-d6):δ 10.86 (brs,1H),8.45 (s,1H),7.45 (d,8.0 Hz,1H),7.32 (d,8.0 Hz,1H),7.18 (d,2.5 Hz,1H),7.04 (td,7.5,0.5 Hz,1H),6.92 (td,7.5,0.5 Hz,1H),4.16 (s,2H)。13C NMR (125 MHz,DMSO-d6):δ 153.7,142.9,136.2,126.8,123.4,121.0,118.4,118.4,111.6,111.4,30.8。

|
| 图 10 化合物7的核磁共振氢谱(500 MHz,DMSO-d6) Figure 10 The 1H NMR of compound 7 (500 MHz, DMSO-d6) |
通过上述结构鉴定可知,化合物1-7均为吲哚衍生物,其中化合物1-5都具有一个吲哚环和一个3位上取代的不同支链,化合物6和7是吲哚-吡嗪衍生物,从生源上推测这些化合物均可能来源于色氨酸的代谢途径产生的中间体或者色氨酸与其他化合物形成的衍生物。其中,化合物2是重要的植物生长调节剂,在植物体内,一般由色氨酸合成;在一些植物根际微生物中,也发现了能够产生此化合物的物种[16, 17]。化合物3也是一种重要的植物生长调节剂;Pettit等报道其对淋巴细胞性白血病细胞P388的增殖有抑制作用;Ashour等报道其对枯草芽孢杆菌和酿酒酵母生长有抑制作用[18, 19, 20]。化合物6由Zhang等2013年在深海放线菌Serinicoccus profundi sp. nov.中首次分离得到,具有一定的抗金黄色葡萄球菌的活性[13]。化合物3-7首次在小单孢菌中分离得到,体现了小单孢菌合成代谢产物结构多形性的能力。从我们鉴定的代谢产物的化学结构分析表明,此株小单孢菌合成这些吲哚类化合物可能通过吲哚或者色氨酸经一系列的修饰反应来完成的,预示着该菌株中蕴含着较丰富的吲哚或色氨酸的后修饰反应酶。因此,在将来的工作中或许可以通过喂养吲哚或者色氨酸,增强小单孢菌M66产生此类次级代谢产物的能力和效率,获得结构更加复杂、新颖的次级代谢产物。
| [1] | Cheng YR, Zheng W. Micromonospora spp. and their second metabolites[J]. Chinese Journal of Antibiotics, 2006(6): 321-327 (in Chinese)程元荣, 郑卫.小单孢菌及其产生的次级生物活性代谢产物 [J].中国抗生素杂志, 2006(6): 321-327 |
| [2] | Tiwari K, Gupta RK. Rare actinomycetes: a potential storehouse for novel antibiotics[J]. Critical Reviews in Biotechnology, 2012, 32(2): 108-132 |
| [3] | Weinstein MJ, Wagman GH, Marquez JA, et al. Verdamicin, a new broad spectrum aminoglycoside antibiotic produced by a new species of Micromonospora[C]. Abest Papers No.136, 13th intersci conf Antimicr Agents and Chemoth, Washington, Sept., 1973 |
| [4] | Weinstein MJ, Marquez JA, Testa RT, et al. Antibiotic 6640, a new Micromonospora-produced aminoglycoside antibiotic[J]. Journal of Antibiotics, 1970, 23(11): 551-554 |
| [5] | Asaka T, Manaka A, Sugiyama H. Recent developments in macrolide antimicrobial research[J]. Current Topics in Medicinal Chemistry, 2003, 3(9): 961-989 |
| [6] | Weinstein MJ, Luedemann GM, Oden EM, et al. Halomicin, a new Micromonospora-produced antibiotic[J]. Antimicrobial Agents and Chemotherapy, 1967, 7: 435-441 |
| [7] | Yang SW, Chan YM, Terracciano J, et al. A new anthracycline antibiotic micromonomycin from Micromonospora sp.[J]. Journal of Antibiotics, 2004, 5(8): 634-646 |
| [8] | Megumi M, Naoko M, Yoshiyuki T, et al. Pacile reductive rearrangement of dynemicin A to dynemicin H: the direct evidence for the phenylene diradical intermediate[J]. Tetrahedron Letters, 1991, 32(42): 224-230 |
| [9] | Bulaj G, Buczek O, Goodsell I, et al. Efficient oxidative folding of conotoxin sand the radiation of venomous cone snails[J]. Proceedings of the National Academy of Sciences USA, 2003, 100: 14562-14568 |
| [10] | Tamtsu F, Yasuhiro I, Hiroko H, et al. Kosinostatin, a quinocycline antibiotic with antitumor activity from Micromonospora sp. TP-A0468[J]. Antibiotics, 2002, 55(2): 128-130 |
| [11] | Cheng YR, Huang J. Antifungi immunosuppressives[J]. Chinese New Drugs Journal, 2005, 14(3): 268 (in Chinese)程元荣, 黄捷.抗真菌抗生素和免疫抑制剂[J].中国新药杂志, 2005, 14(3): 268 |
| [12] | Huang LZ, Hu ZN, Guo ZY, et al. Study on selective isolation and antibiotic activity of rare actinomycetes from soil[J]. Chinese Journal of Pesticide Science, 2007(1): 59-65 (in Chinese)黄路枝, 胡兆农, 郭正彦, 等.土壤稀有放线菌的选择性分离及其抗菌活性研究[J].农药学学报, 2007(1): 59-65 |
| [13] | Zhang GF, Yang XW, Ying JX, et al. Isolation, characterization, and bioactivity evaluation of 3-((6-methylpyrazin-2-yl)methyl)- 1H-indole, a new alkaloid from a deep-sea-derived actinomycete Serinicoccus profundi sp. nov.[J]. Marine Drugs, 2013, 11(1): 33-39 |
| [14] | Yin WB, Joshua B, Jin BK, et al. A nonribosomal peptide synthetase-derived iron(Ⅲ) complex from the pathogenic fungus Aspergillus fumigatus[J]. Journal of the American Society, 2013, 135(6): 2064-2067 |
| [15] | Anggi EP, Kei T, Hatsuki T, et al. Transition-metal-catalyzed regioselective alkylation of indoles with alcohols[J]. Eurpean Journal of Organic Chemistry, 2013(5): 6344-6354 |
| [16] | Wagman GH, Weinstein MJ. Antibiotic from Micromonospora[J]. Annual Review of Microbiology, 1980, 34: 537-557 |
| [17] | Fierro-Coronado RA, Quiroz-Figueroa FF, Garcia-Perez LM, et al. IAA-producing rhizobacteria from chickpea (Cicer arietinum L.) induce changes in root architecture and increase root biomass[J]. Canadin Journal of Microbiology, 2014, 60(10): 639-648 |
| [18] | Bernart M, Gerwick WH. 3-(Hydroxyacetyl) indole, a plant growth regulator from the oregon red alga Prionitis lanceolata[J]. Phytochemistry, 1990, 29(12): 3697-3698 |
| [19] | Ashour M. Indole alkaloid from the Red Sea sponge Hyrtios erectus[J]. Archive for Organic Chemistry, 2007(15): 225 |
| [20] | Du J, Pettit GR, Pettit RK, et al. The Manitoba bacterium Streptomyces sp.[J]. Journal of Natural Products, 2006, 69(5): 804-806 |
 2016, Vol. 43
2016, Vol. 43




