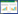扩展功能
文章信息
- 张燕飞, 庞欢瑛, 简纪常, 鲁义善, 吴灶和
- Zhang Yan-Fei, Pang Huan-Yingc, Jian Ji-Chang, Lu Yi-Shan, Wu Zao-He
- 溶藻弧菌kdpD 基因敲除突变株的构建及其表型特征
- Construction and characterization of the kdpD gene knock-out mutant of Vibrio alginolyticus
- 微生物学通报, 2015, 42(9): 1770-1778
- Microbiology China, 2015, 42(9): 1770-1778
- 10.13344/j.microbiol.china.140942
-
文章历史
- 收稿日期: 2014-11-24
- 接受日期: 2015-03-29
- 优先数字出版日期(www.cnki.net): 2015-04-24
2. 广东省水产经济动物病原生物学及流行病学重点实验室 广东 湛江 524088;
3. 广东省水产经济动物病害控制重点实验室 广东 湛江 524088;
4. 仲恺农业工程学院 广东 广州 510225
2. Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals,Zhanjiang,Guangdong 524088,China;
3. Guangdong Key Laboratory of Control for Disease of Aquatic Animals,Zhanjiang,Guangdong 524088,China;
4. Zhongkai University of Agriculture and Engineering,Guangzhou,Guangdong 510225,China
溶藻弧菌(Vibrio alginolyticus)为嗜盐嗜温性的革兰氏阴性菌[1,2],普遍存在于海洋环境和多种海洋动物中,是鱼、虾、贝等海水养殖动物的主要致病菌之一[3]。近年来对溶藻弧菌的研究主要集中在毒力因子(溶血素基因、外膜蛋白酶基因及摄铁系统相关基因)的鉴定和表达分析[4,5,6,7,8]。然而,溶藻弧菌是一种条件性致病菌,其毒力因子的表达受环境因素的调节,仅在某些特定的条件下才能表达。细菌致病的过程也是其不断适应宿主环境的过程,通过对外界信号的感应,调整不同毒力基因的表达,从而实现其在宿主体内的生存、繁殖及对抗宿主的免疫 系统[9]。
双组分调控系统(Two-component regulatory system)是广泛存在于细菌中的一种信号转导机制,在细菌捕捉外界信号的过程中起着极其重要的作用,它所操纵的信号转导包括病原菌对宿主的识别和侵袭,以及进一步的致病或共生[10,11]。KdpD作为一个感应蛋白,是双组分信号调控系统KdpD/KdpE的成员之一,能感知环境中K+缺少或高渗透压的压力从而调控下游基因的表达来适应环境压力[12,13]。kdpD基因参与多种致病菌的毒力调控过程,其调控的方式各有不同。鼠伤寒沙门氏菌(Salmonella typhimurium)中,kdpD缺失株在肠道线虫和巨噬细胞的生存能力显著下降,推测kdpD基因在抗渗透、抗氧化和抗菌等方面起重要作用[14]。结核分枝杆菌(Mycobacterium tuberculosis)中,kdpDE缺失株比野生株有更高的毒性,感染缺失株的小鼠与感染野生株的小鼠相比有更高的致死率[15]。溶藻弧菌HY9901中也存在kdpD同源基因,但其具体功能尚不清楚。为探究溶藻弧菌kdpD基因是否也具有调控毒力因子的功能,本研究通过同源重组技术,构建kdpD基因缺失株,比较其与野生株HY9901生物学特性的差异,为进一步探索溶藻弧菌的致病机制提供依据。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒和引物:实验所用菌株、质粒及引物见表1。| 菌株、质粒及引物 Strains, plasmids and primers |
基因型 Genotypes |
来源 Sources |
| 菌株 Strains | ||
| V. alginolyticus HY9901 | Wild type | [6] |
| ΔkdpD | HY9901 carrying an in-frame deletion of kdpD190-1212 | This study |
| E. coli MC1061 | lacY1galK2 ara-14xyl-5 supE44 λpir | [16] |
| E. coli S17-1 | Tpr,Smr,λpir | [17] |
| 质粒 plasmids | ||
| pRE112 | Suicide plasmid,sacB,Cmr | [18] |
| 引物 primers | 5′→3′ | |
| kdpD-for | GGGGTACC TGTGTAGCACCATAAATCGTT (划线部分为Kpn I酶切位点) | |
| kdpD-int-rev | ATTGACGAAGGTAAAATGGGAACGGATTACAACCCT (划线部分表示反向互补序列) | |
| kdpD-int-for | CATTTTACCTTCGTCAATCAC (划线部分表示反向互补序列) | |
| kdpD-rev | CGAGCTCACACTAATCCATCTTGCG (划线部分为Sac I酶切位点) | |
| kdpD-in1 | TAAATGACCAGCCTTTTCCTA | |
| kdpD-in2 | GCTTCTTTGCGTGCGGCGTCT | |
| 16S rRNA1 | TTGCGAGAGTGAGCGAATCC | |
| 16S rRNA2 | ATGGTGTGACGGGCGGTGTG |
Note: Nucleotides double underlined represent restriction enzyme site; Nucleotides underlined represent 18 bp reverse complement
|
| 图 1 kdpD敲除突变株构建示意图 Figure 1 Diagram for construction of kdpD in-frame deletion mutant of V. alginolyticus Note: A: For the construction of ΔkdpD, two PCR fragments were generated by using the HY9901 genomic DNA as template. The first fragment was amplified using primers kdpD-for and kdpD-int-rev, and the primers kdpD-int-for and kdpD-rev were used to amplify the second fragment. Both fragments contained an 18 bp overlapping sequence were used as templates for the subsequent PCR procedure using primers kdpD-for and kdpD-rev. B: The resulting PCR product was ligated into the suicide vector pRE112 (Cmr) to generate pRE-ΔkdpD. This recombinant suicide plasmid was then transformed into E. coli MC1061 and subsequently S17-1. Single crossover mutants were obtained by conjugal transfer of the resulting plasmid into V. alginolyticus HY9901. Deletion mutants were screened on 10% sucrose TSA plates, and then subsequently confirmed by PCR and sequencing using primers kdpD-in1 and kdpD-in2. |
提取测序正确的重组自杀质粒,转化至E. coli S17-1。分别培养含有pRE-ΔkdpD质粒的E. coli S17-1和溶藻弧菌HY9901至菌液OD600达到0.5,取160 μL E. coli S17-1和40 μL溶藻弧菌,4 000 r/min离心5 min后,去上清,重悬菌体,并将重悬液接种于TSA平板上(无抗生素),28 °C培养24 h,此时,发生第一次同源重组。用TSB液体培养基冲洗平板,将菌液涂布于含氯霉素的TSA平板,28 °C培养48 h。挑取单菌落,以kdpD-for和kdpD-rev为引物进行菌落PCR,筛选第一次同源重组突变体。
挑取上一步得到的阳性单菌落,接种于液体培养基,28 °C、200 r/min振荡培养48 h后,将菌液涂布于TSA平板上(含10%蔗糖),28 °C培养48 h。此时,利用pRE112质粒的蔗糖自杀基因(sacB),筛选发生第二次同源重组的溶藻弧菌。挑取单菌落,划线于含有氯霉素的TSA平板和没有抗性的TSA平板,28 °C培养48 h。选取仅在无抗性的平板上生长、而在含氯霉素的平板不生长的单菌落,以kdpD-for和kdpD-rev为引物进行菌落PCR检测,并送测序验证突变位点。根据测序结果碱基序列与融合片段碱基序列的一致性来判断该菌株是否为ΔkdpD缺失突变株。若测序结果碱基序列与野生型缺失kdpD内部190-1 212 bp片段后的碱基序列完全一致,可初步判断该菌株为ΔkdpD缺失突变株。
1.2.2 细菌的生长速率比较:取等量(OD600调至0.5)的野生株HY9901和kdpD缺失株菌液,以1:100的比例接种到TSB培养基中,28 °C、200 r/min振荡培养,每隔1 h测定OD600,每组3个重复,取平均值,绘制生长曲线。 1.2.3 生物被膜形成能力检测:参照文献[21]略改动,将野生株HY9901和kdpD缺失株(OD600调至0.5)转接至96孔板,每孔200 μL,每个样品设6个重复,同时设置阴性对照为TSB培养基,28 °C静置培养。在24、48和72 h取样,甲醇固定20 min后,结晶紫草酸铵染料染色15 min,用水冲洗至无染液流出,晾干。最后加入95%的酒精,室温放置30 min,测定溶液OD570。 1.2.4 细菌泳动实验:使用无菌牙签分别蘸取野生株HY9901和缺失株kdpD (OD600调至0.5),点接种于琼脂含量为0.35%的TSA平板上,每组设3个重复,28 °C静置培养24 h,测定泳动圈直径。 1.2.5 胞外蛋白酶活性检测:参照文献[22]略改动,将野生株HY9901和kdpD突变株分别涂布于铺有无菌玻璃纸的TSA平板上,28 °C培养24 h后,用液体培养基冲洗细菌,4 °C离心30 min,过滤上清,得到胞外产物。以煮沸10 min的灭活样品作为空白对照,取100 μL的样品,每个样品做3个重复,分别与100 μL偶氮酪蛋白溶液混匀,加入300 μL Tris-HCL缓冲液,37 °C温育30 min。加入10% (质量体积比)的三氯乙酸400 μL,室温静置30 min终止反应。离心5 min后,将上清转移至新的离心管,加入800 μL NaOH溶液(525 mmol/L)显色,测定溶液OD442。 1.2.6 半数致死率(LD50)检测:分别接种HY9901、ΔkdpD的单菌落至TSB液体培养基中,28 °C、200 r/min振荡培养18 h,以1:100比例倒转接到新鲜的TSB培养基中,培养至OD600为0.5,4 000 r/min离心5 min,收集菌体,使用生理盐水清洗并调节梯度浓度。实验用斑马鱼共220尾,随机分组,每组20尾。实验组以肌肉注射的方式每尾注射5 μL菌液。对照组以同样方式注射等量生理盐水。记录10 d内鱼体死亡数目直至死亡情况稳定。观察死鱼状态,并重新分离发病组织的细菌,用PCR鉴定。利用寇氏法[23]计算半数致死量:LogLD50= XK-d (ΣPi-0.5)。其中XK为最大对数剂量,d为相邻的两组对数剂量之差数,Pi为死亡率,i为组号。
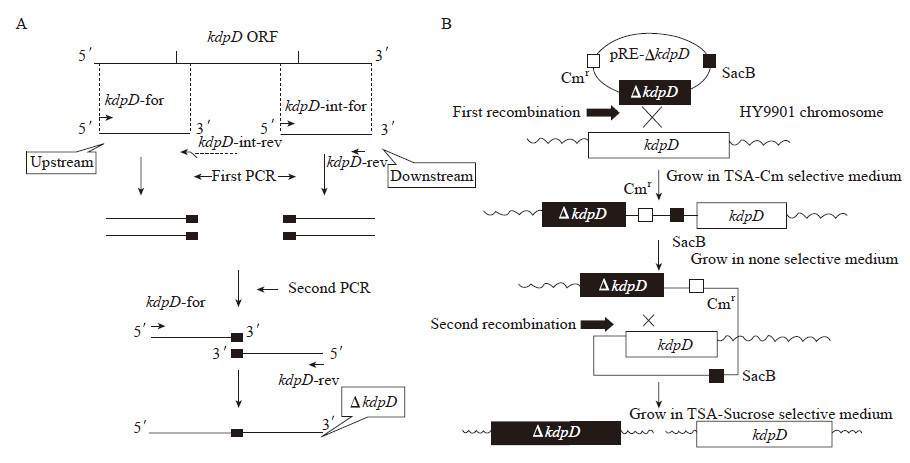
1.2.7 细菌在鱼体内的存活能力检测:实验用斑马鱼被随机分为3组,每组30尾鱼,用加热棒将水温调整至28 °C。取浓度为106 CFU/mL的野生株HY9901和突变株ΔkdpD,注射组1:每尾肌肉注射5 μL野生株HY9901菌液;注射组2:每尾肌肉注射5 μL ΔkdpD菌液;对照组:每尾肌肉注射5 μL生理盐水。注射后第12、24和48 h取样。斑马鱼较小,以组内随机3尾鱼为1个样本,在无菌条件下取肾脏和脾脏,分别称重后充分研磨,用生理盐水倍比稀释,涂布于TCBS平板上,每组设3个重复,28 °C静置培养24 h后进行菌落计数。通过判断菌落形态的一致性以及随机挑取板上的菌落进行PCR和DNA测序来确定板上菌是否为目的菌。 1.2.8 统计学处理:采用SPSS 17.0软件对所得的实验数据进行单因素方差分析,用邓肯氏进行多重比较,文中**表示与同期对照组相比差异极显著(P < 0.01),*表示与同期对照组相比差异显著(0.01 < P<0.05)。 2 结果与分析 2.1 缺失突变株的构建以溶藻弧菌HY9901基因组DNA为模板,分别扩增kdpD基因的上下游片段,得到415 bp的上游片段和505 bp的下游片段(图2,泳道1和2),上游片段3′和下游片段5′端包含18 bp的互补序列,并通过overlap PCR得到920 bp的融合片段(图2,泳道3)。在第一次同源重组筛选中,使用引物kdpD-for和kdpD-rev,重组菌扩增出野生型和缺失型2个片段,野生型是1 943 bp,源自HY9901,缺失型是920 bp,源自pRE112-ΔkdpD (图2,泳道5)。而野生株仅能扩增出1 943 bp单片段(图2,泳道4)。第二次同源重组筛选中,用引物kdpD-for/kdpD-rev对野生株和初筛得到的重组菌基因组进行PCR,HY9901得到1 943 bp的片段,ΔkdpD扩增出920 bp的片段(图2,泳道6和7),进一步对扩增产物进行DNA测序,与野生株相比,证明HY9901的kdpD基因缺失。使用kdpD内部引物,野生株能扩增出690 bp的目的片段,而突变株无法扩增出相应条带(图2,泳道8和9),再次验证突变株中kdpD基因已敲除。
|
|
图 2
kdpD敲除突变株的构建及验证
Figure 2
Construction and confirmation analysis of the knockout mutant strain ΔkdpD
注:M:DL2000 marker;1:kdpD-for/kdpD-int-rev PCR产物;2:kdpD-int-for/kdpD-rev PCR产物;3−7:kdpD-for/kdpD-rev PCR产物;8,9:kdpD-in1/kdpD-in2 PCR产物. 其中1、2、4、6、8为野生株扩增条带;3为融合片段条带;5为一次同源重组阳性菌扩增条带;7和9为突变株ΔkdpD扩增条带. Note: M: DL2000 marker; 1: PCR products with kdpD-for/kdpD-int-rev; 2: PCR products with kdpD-int-for/kdpD-rev; 3−7: PCR products with kdpD-for/kdpD-rev; 8−9: PCR products with kdpD-in1/kdpD-in2. Genomic DNAs from the wild-type strain (lanes 1, 2, 4, 6, 8), the overlap PCR product (lane 3), single crossover mutant (lane 5) and the mutant ΔkdpD (lane 7, 9), were used as templates. |
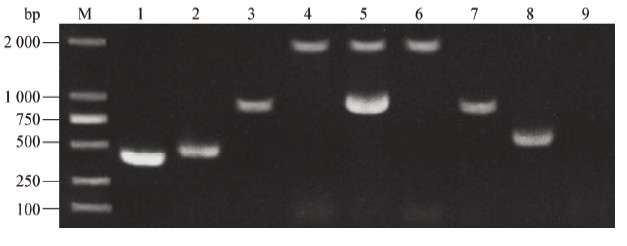
利用t检测方法比较两株菌在同一时间点的生长速率,发现野生株HY9901与kdpD缺失株的生长速率接近,无显著差异(P > 0.05),即kdpD基因的缺失对溶藻弧菌的生长没有影响,溶藻弧菌整个生长周期较短,生长迅速,在12 h后进入平台期,OD600约为2.7 (图3)。
|
| 图 3 溶藻弧菌HY9901和突变株ΔkdpD的生长曲线 Figure 3 Growth characteristics of the kdpD mutant and V. alginolyticus HY9901 |
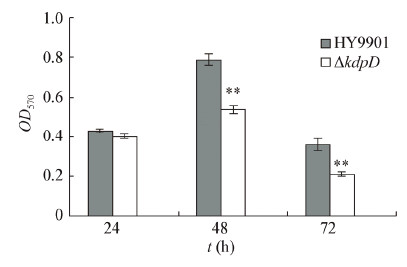
通过检测发现,溶藻弧菌野生株与突变株的生物膜形成能力如图4所示。在第48 h和72 h,野生株与突变株ΔkdpD的生物膜形成有显著差异(P < 0.01),说明kdpD的缺失可能会影响溶藻弧菌生物膜的形成。
|
| 图 4 藻弧菌HY9901和突变株ΔkdpD的生物膜形成能力 Figure 4 Biofilm formation of the kdpD mutant and V. alginolyticus HY9901 Note: **: P<0.01. |
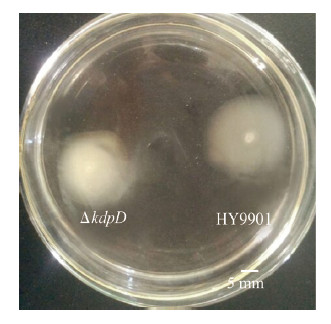
将野生溶藻弧菌HY9901与突变株ΔkdpD接种于泳动平板上,其泳动结果如下:野生株泳动圈为21.33±0.09 mm,突变株为16.83±0.07 mm (图5),根据泳动圈直径统计分析可知kdpD缺失后溶藻弧菌的泳动能力显著降低(0.01<P <0.05)。对两种菌的胞外蛋白酶进行检测,结果发现,溶藻弧菌缺失了kdpD基因后,其胞外蛋白酶的活性没有显著差异(P >0.05)。
|
| 图 5 藻弧菌HY9901和突变株ΔkdpD的泳动能力 Figure 5 Swarming ability of the kdpD mutant and V. alginolyticus HY9901 |
为了验证kdpD基因缺失后是否会使致病菌的毒力下降,采用斑马鱼模型进行感染实验。由实验结果(表2)可知,突变株ΔkdpD的半数致死量比野生株提高了8.84倍。该结果表明,kdpD基因影响了溶藻弧菌的致病性。
| 菌株 Bacterial strains |
攻毒浓度 Concentration (CFU/mL) |
累计结果 Cumulative results | 半数致死量 LD50 (CFU/fish) | ||
| 存活数 Survival number of fish |
死亡数 Death number of fish |
死亡率 Death rate (%) |
|||
| 野生株 | 1.08×108 | 0 | 20 | 100 | |
| Wild strain | 9.71×106 | 6 | 14 | 70 | |
| 1.10×106 | 8 | 12 | 60 | 2.42×104 | |
| 9.87×104 | 14 | 6 | 30 | ||
| 9.21×103 | 20 | 0 | 0 | ||
| kdpD缺失株 | 9.92×107 | 3 | 17 | 85 | |
| ΔkdpD | 1.07×107 | 12 | 8 | 40 | |
| 1.13×106 | 14 | 6 | 30 | 2.14×105 | |
| 9.56×104 | 16 | 4 | 20 | ||
| 9.33×103 | 20 | 0 | 0 | ||
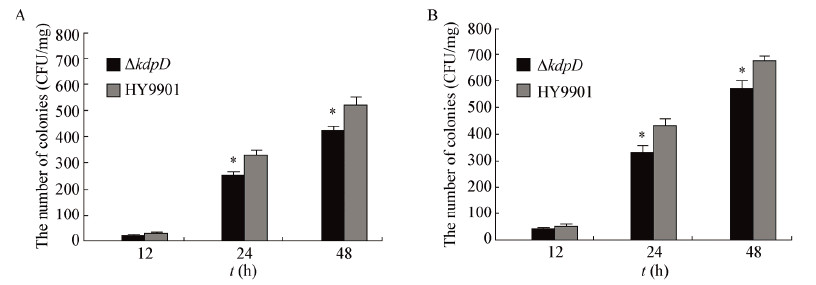
为了检测细菌在鱼体中的存活能力,以注射方式进行攻毒,在攻毒后第12、24和48 h分别取鱼消毒后,研磨倍比稀释涂平板。对照组菌落数量为0,对实验组TCBS板上菌落进行观察,发现其菌落形态一致,呈圆形黄色、凸起和边缘光滑的单落,从形态上可初步判断板上菌为溶藻弧菌。随机挑取板上单菌落,用引物16S rDNA 1/16S rDNA 2进行PCR扩增并测序。测序结果证实板上所长的菌为溶藻弧菌。菌落计数结果显示(图6),在第12 h,肾脏和脾脏中野生株和缺失株的数量接近(P>0.05);在第24 h和48 h,肾脏和脾脏中细菌数量均有上升,野生株明显多于缺失株(0.01<P<0.05)。
|
|
图 6
藻弧菌HY9901和突变株ΔkdpD在鱼体内的存活能力
Figure 6
Survival ability of the kdpD mutant and V. alginolyticus HY9901 in vivo
注:A:肾脏;B:脾脏;*:0.01<P<0.05. Note: A: Kidney; B: Spleen; *: 0.01<P<0.05. |
细菌在感染宿主过程中,由自然环境进入宿主体内,所处的环境(温度、渗透压和金属离子水平等)发生很大变化。因此,细菌需要一些调控蛋白密切感受和响应体内外各种微环境的变化,进而调节相关基因表达以完成其致病过程[11,24]。KdpD是双组分信号调控系统KdpD/KdpE的成员之一,维持胞内的K+水平和渗透压[12,13]。本研究以pRE 112自杀质粒为载体,通过Overlap PCR和同源重组筛选技术,成功构建溶藻弧菌kdpD基因缺失突变株,并比较分析缺失株和野生株的致病相关表型变化。
通过生物学特性比较,发现kdpD缺失后并不影响溶藻弧菌的生长特性和胞外蛋白酶活性,但泳动能力显著降低。近期的研究发现,金属离子浓度影响相关基因的表达,进而调节细菌的群体运动和蹭行运动[25]。我们推测,kdpD基因缺失后影响细菌对K+的吸收,对泳动力也有一定影响。生物被膜的形成是细菌为适应环境而吸附到宿主细胞膜表面,抵抗药物和宿主免疫应答的一种多细胞行为[26,27]。在本研究中,发现kdpD缺失株的生物被膜形成能力明显下降。该结果和鼠伤寒沙门氏菌(Salmonella typhimurium) kdpD缺失株生物被膜形成的实验结果一致[14]。金黄色葡萄球菌(Staphylococcus aureus)的AI-2群体感应通过对双组分调控系统KdpDE的调控来实现对荚膜多糖合成酶基因转录的调控[28]。此外,胞外荚膜多糖已经被确定参与弧菌生物膜的形成。弧菌生物膜形成的调控机制非常复杂,其涉及许多转录调控程序如双组分调控系统、群体感应和C-di-GMP信号[29]。那么,kdpD基因在溶藻弧菌生物膜形成调控过程中是担当何种角色,有待进一步研究。
细菌的毒力包括产毒力和侵染力,其感染与致病过程体现在与宿主细胞相互作用的复杂过程。它通过黏附、侵入、体内增殖、抵抗宿主免疫反应和产生代谢产物(毒素)等阶段最终达到侵染宿主的目的[11,24]。在细菌攻毒研究中,发现突变株△kdpD的半数致死量下降约一个数量级,这表明kdpD基因影响溶藻弧菌的毒力。金黄色葡萄球菌(S. aureus)在侵染过程中,由自然环境进入到高K+水平的宿主体内环境,KdpDE转录水平上调,从而引起外毒素基因表达水平上升[30]。而在本实验中,kdpD的缺失可能会导致双组分调控系统KdpDE的信号转导过程受到阻碍,不能完全地发挥其调控毒力因子表达的作用,以致出现溶藻弧菌毒力减弱的结果。细菌在鱼体内的存活能力实验的结果与细菌攻毒实验的结果一致。肾脏和脾脏是溶藻弧菌感染宿主的主要器官[31,32,33]。攻毒后的第24 h和48 h,突变株ΔkdpD在这两个器官的存活能力均明显低于野生株(0.01<P<0.05),提示kdpD基因可能参与溶藻弧菌在肾脏和脾脏的定殖及感染。
最近,Xue等[30]发现金黄色葡萄球菌(S. aureus)中的双组分调控系统KdpDE可以调控将近100个毒力基因。本研究中,kdpD基因在一定程度上影响了溶藻弧菌的毒力。那么,我们该深思,kdpD会调控哪些毒力基因的表达呢?因此下一步将以kdpD基因缺失的突变株为研究对象,进行全基因组表达谱芯片实验,通过比较野生株与突变株基因表达的差异,找出受kdpD调控的基因,并希望在其中发现可能的相关致病基因,为进一步研究kdpD基因参与溶藻弧菌致病过程和发现新的致病相关基因奠定基础。
| [1] | Robert-Pillot A, Guenole A, Fournier JM. Usefulness of R72H PCR assay for differentiation between Vibrio parahaemolyticus and Vibrio alginolyticus species:validation by DNA-DNA hybridization[J]. FEMS Microbiology Letters, 2002, 215(1):1-6 |
| [2] | Ramesh KP, Kalidas C, Tamilmani G, et al. Microbiological and histopathological investigations of Vibrio alginolyticus infection in cobia Rachycentron canadum (Linnaeus, 1766) cultured in sea cage[J]. Indian Journal of Fisheries, 2014, 61(1):124-127 |
| [3] | Balcázar JL, Gallo-Bueno A, Planas M, et al. Isolation of Vibrio alginolyticus and Vibrio splendidus from captive-bred seahorses with disease symptoms[J]. Antonie van Leeuwenhoek, 2010, 97(2):207-210 |
| [4] | He H, Wang Q, Sheng L, et al. Functional characterization of Vibrio alginolyticus twin-Arginine translocation system:its roles in biofilm formation, extracellular protease activity, and virulence towards fish[J]. Current Microbiology, 2011, 62(4):1193-1199 |
| [5] | González-Escalona N, Blackstone GM, DePaola A. Characterization of a Vibrio alginolyticus strain, isolated from Alaskan Oysters, carrying a hemolysin gene similar to the thermostable direct hemolysin-related hemolysin gene (trh) of Vibrio parahaemolyticus[J]. Applied and Environmental Microbiology, 2006, 72(12):7925-7929 |
| [6] | Cai SH, Wu ZH, Jian JC, et al. Cloning and expression of the gene encoding an extracellular alkaline serine protease from Vibrio alginolyticus strain HY9901, the causative agent of vibriosis in Lutjanus erythopterus (Bloch)[J]. Journal of Fish Diseases, 2007, 30(8):493-500 |
| [7] | Chen FR, Liu PC, Lee KK. Lethal attribute of serineprotease secreted by Vibrio alginolyticus strains in Kuruma prawn Penaeus japonicus[J]. Zeitschrift fur Naturforschung C, 2000, 55(1/2):94-99 |
| [8] | Wang Q, Liu Q, Cao X, et al. Characterization of two TonB systems in marine fish pathogen Vibrio alginolyticus:their roles in iron utilization and virulence[J]. Archives of Microbiology, 2008, 190(5):595-603 |
| [9] | Rasko DA, Sperandio V. Anti-virulence strategies to combat bacteria-mediated disease[J]. Nature Reviews Drug Discovery, 2010, 9(2):117-128 |
| [10] | Stock AM, Robinson VL, Goudreau PN. Two-component signal transduction[J]. Annual Review of Biochemistry, 2000, 69(1):183-215 |
| [11] | Mahajan-Miklos S, Tan MW, Rahme LG, et al. Molecular mechanisms of bacterial virulence elucidated using a Pseudomonas aeruginosa-Caenorhabditis elegans pathogenesis model[J]. Cell, 1999, 96(1):47-56 |
| [12] | Jung K, Veen M, Altendorf K. K+ and ionic strength directly influence the autophosphorylation activity of the putative turgor sensor KdpD of Escherichia coli[J]. Journal of Biological Chemistry, 2000, 275(51):40142-40147 |
| [13] | Walderhaug MO, Polarek JW, Voelkner P, et al. KdpD and KdpE, proteins that control expression of the kdpABC operon, are members of the two-component sensor-effector class of regulators[J]. Journal of Bacteriology, 1992, 174(7):2152-2159 |
| [14] | Alegado RA, Chin CY, Monack DM, et al. The two-component sensor kinase KdpD is required for Salmonella typhimurium colonization of Caenorhabditis elegans and survival in macrophages[J]. Cellular Microbiology, 2011, 13(10):1618-1637 |
| [15] | Parish T, Smith DA, Kendall S, et al. Deletion of two-component regulatory systems increases the virulence of Mycobacterium tuberculosis[J]. Infection and Immunity, 2003, 71(3):1134-1140 |
| [16] | Rubires X, Saigi F, Piqué N, et al. A gene (wbbL) from Serratia marcescens N28b (O4) complements the rfb-50 mutation of Escherichia coli K-12 derivatives[J]. Journal of Bacteriology, 1997, 179(23):7581-7586 |
| [17] | Simon R, Priefer U, Pühler A. A broad host range mobilization system for in vivo genetic engineering:transposon mutagenesis in gram negative bacteria[J]. Nature Biotechnology, 1983, 1(9):784-791 |
| [18] | Edwards RA, Keller LH, Schifferli DM. Improved allelic exchange vectors and their use to analyze 987P fimbria gene expression[J]. Gene, 1998, 207(2):149-157 |
| [19] | Shen P, Chen XD. Microbiology Experiment[M]. 4th Edition. Beijing:Higher Education Press, 2008:246-248 (in Chinese)沈萍, 陈向东.微生物学实验[M].第4版.北京:高等教育出版社, 2008:246-248 |
| [20] | Zhou Z, Pang H, Ding Y, et al. VscO, a putative T3SS chaperone escort ofVibrio alginolyticus, contributes to virulence in fish and is a target for vaccine development[J]. Fish & Shellfish Immunology, 2013, 35(5):1523-1531 |
| [21] | Di HL, Chen C, Shi L. Comparative study of biofilm formation and its associated factors in opaque and translucent colonies of Vibrio alginolyticus[J]. Modern Food Science and Technology, 2010, 26(11):1177-1180 |
| [22] | Windle HJ, Kelleher D. Identification and characterization of a metalloprotease activity from Helicobacter pylori[J]. Infection and Immunity, 1997, 65(8):3132-3137 |
| [23] | Reed LJ, Muench H. A simple method of estimating fifty percent endpoints[J]. American Journal of Epidemiology, 1938, 27(3):493-497 |
| [24] | Rutherford ST, Bassler BL. Bacterial quorum sensing:its role in virulence and possibilities for its control[J]. Cold Spring Harbor Perspectives in Medicine, 2012, 2(11):a012427 |
| [25] | Patriquin GM, Banin E, Gilmour C, et al. Influence of quorum sensing and iron on twitching motility and biofilm formation in Pseudomonas aeruginosa[J]. Journal of Bacteriology, 2008, 190(2):662-671 |
| [26] | Parsek MR, Singh PK. Bacterial biofilms:an emerging link to disease pathogenesis[J]. Annual Reviews in Microbiology, 2003, 57(1):677-701 |
| [27] | Verstraeten N, Braeken K, Debkumari B, et al. Living on a surface:swarming and biofilm formation[J]. Trends in Microbiology, 2008, 16(10):496-506 |
| [28] | Zhao L, Xue T, Shang F, et al. Staphylococcus aureus AI-2 quorum sensing associates with the KdpDE two-component system to regulate capsular polysaccharide synthesis and virulence[J]. Infection and Immunity, 2010, 78(8):3506-3515 |
| [29] | Yildiz FH, Visick KL. Biofilms:so much the same yet so different[J]. Trends in microbiology, 2009, 17(3):109-118 |
| [30] | Xue T, You Y, Hong D, et al. The Staphylococcus aureus KdpDE two-component system couples extracellular K+ sensing and Agr signaling to infection programming[J]. Infection and Immunity, 2011, 79(6):2154-2167 |
| [31] | Sangster CR, Smolowitz RM. Description of Vibrio alginolyticus infection in cultured Sepia officinalis, Sepia apama, and Sepia pharaonis[J]. The Biological Bulletin, 2003, 205(2):233-234 |
| [32] | Huang RF. Vibrio alginolyticus in the Grouper, Epinephelus coioides[J]. Fisheries Science, 2005, 24(6):1-3 (in Chinese)黄瑞芳.斜带石斑鱼溶藻弧菌病的研究[J].水产科学, 2005, 24(6):1-3 |
| [33] | Jin S, Cai WQ, Yu H, et al. Studied on cell pathology of Vibrio alginolyticus disease to large yellow croakers[J]. Marine Science, 2003, 27(2):59-62 (in Chinese)金珊, 蔡完其, 於宏, 等.大黄鱼溶藻弧菌病细胞病理变化的初步研究[J].海洋科学, 2003, 27(2):59-62 |
 2015, Vol. 42
2015, Vol. 42