扩展功能
文章信息
- 刘紫嫣, 周豪, 沈娥, 王经伟, 张照婧, 沈文丽, 马桥, 曲媛媛, 周集体
- LIU Zi-Yan, ZHOU Hao, SHEN E, WANG Jing-Wei, ZHANG Zhao-Jing, SHEN Wen-Li, MA Qiao, QU Yuan-Yuan, ZHOU Ji-Ti
- 微生物介导的金纳米颗粒合成
- Recent advances in microbes-mediated biosynthesis of gold nanoparticles
- 微生物学通报, 2015, 42(8): 1584-1592
- Microbiology China, 2015, 42(8): 1584-1592
- 10.13344/j.microbiol.china.140868
-
文章历史
- 收稿日期: 2014-11-03
- 接受日期: 2015-01-09
- 优先数字出版日期(www.cnki.net): 2015-01-23
2.大连理工大学 食品与环境学院 辽宁 盘锦 124221
2. School of Food and Environmental Science and Technology,Dalian University of Technology,Panjin,Liaoning 124221,China
与传统金属材料相比,纳米尺度的金属粒子具有量子尺寸效应、小尺寸效应、表面效应及宏观量子隧道效应,同时,还表现出量子耦合效应、协同效应等纳米结构组合引起的新效应[1]。其中,金纳米颗粒(AuNPs)具有高度的稳定性和独特的光、电、光热性能[2],在信息存储、化学传感、医学成像、药物传输以及生物标记等一系列领域得到广泛应用[3, 4]。传统的AuNPs合成方法包括物理法和化学法。其中物理合成方法需要复杂的仪器及高能耗的实验条件(如真空、激光烧蚀)[2],化学方法中使用的封端剂和有机溶剂则不利于AuNPs在生物医学领域的应用[5],并且对环境造成负面的影响[4, 5, 6]。近年来,研究者发现利用生物资源可以在相对温和的条件下合成AuNPs,其合成过程具有环境友好、绿色低毒等优点[3]。在众多生物资源中,微生物在自然界分布广泛、生长繁殖迅速、易分离培养,已被广泛应用于AuNPs的生物合成研究[3]。
微生物合成AuNPs的过程,由于其执行者——微生物具有种类多样性、代谢多样性、代谢条件可控性等特点,使得合成的AuNPs形貌各不相同,如球形、三角形、六边形、纳米线等。而这些形貌可以通过对反应过程的pH、温度、微生物的量、底物浓度等参数进行调控,从而实现不同形貌AuNPs的定向合成,并广泛应用于生物传感、生物制药、污染物催化降解等领域。迄今,微生物合成AuNPs的机制尚不明晰,需要结合先进的化学分析手段与比较基因组、蛋白组等多组学技术共同揭示合成机理。因此,本文主要从AuNPs合成的微生物资源、合成机制、微生物-AuNPs的表征及其应用等方面进行综述,并对未来该研究方向的发展进行展望。
1 AuNPs合成的微生物资源在长期自然进化过程中,微生物对金属离子产生了独特的脱毒机制,能够在细胞外部或胞内还原金属离子并合成纳米颗粒[6],因此微生物被称为“纳米材料加工厂”[2]。目前多种微生物,如细菌、放线菌、真菌、病毒等均已成功应用于AuNPs的合成。表1总结了近年来用于AuNPs合成的典型微生物资源和相应AuNPs的特性。
| 微生物分类 Microorganism |
尺寸 Size (nm) |
形状 Shape |
合成位点 Localization |
参考文献 Reference |
||||||
| 细菌 Bacteria | ||||||||||
| Spirulina platensis | 6-10 | - | Extracellular | [7] | ||||||
| Sulfate-reducing bacteria | <10 <25 |
- - |
Intracellular Extracellular |
[8] | ||||||
| Shewanella algae | 10-350 | Triangular, hexagonal | Periplasmic space, extracellular |
[9] | ||||||
| - | - | - | [10] | |||||||
| Bacillus licheniformis | 10-100 | Cubic | Extracellular | [11] | ||||||
| Escherichia coli K12 | Around 50 | Nanoplates | Extracellular | [6] | ||||||
| Rhodobacter capsulatus | - | - | Plasma membrane | [12] | ||||||
| Plectonema boryanum UTEX485 | <10-25 <10 |
Cubic Octahedral platelets |
Membrane vesicles Intracellular |
[13] | ||||||
| Rhodopseudomonas capsulata | 10-400 10-30, 50-60 |
Spherical, triangular, nanoplates Spherical, nanowire |
Extracellular - |
[14] [15] | ||||||
| Bacillus megatherium D01 | 1.9±0.8 | Spherical | Extracellular | [16] | ||||||
| 放线菌 Actinomyces | ||||||||||
| Thermonospora sp. | 7-12 | Spherical | Extracellular | [17] | ||||||
| Rhodococcus sp. | 5-15 | - | Cell wall, cytoplasmic membrane |
[18] | ||||||
| Arthrobacter sp. | 8-40 | Spherical | Extracellular | [19] | ||||||
| Streptomyces viridogens | 8-20 | Spherical, rod shaped | Intracellular | [20] | ||||||
| Saccharomonospora sp. | 40-100, 6-8 | Triangular, thick | - | [21] | ||||||
| 真菌 Fungi | ||||||||||
| Neurospora crassa | 3-100 | Mainly spherical | Intracellular Extracellular |
[22] | ||||||
| Colletotrichum sp. | 8-40 | Spherical | Extracellular | [23] | ||||||
| Schizosaccharomyces cerevisiae | >100 | - | Cell wall | [24] | ||||||
| Pichia jadinii | <100 | Spherical, triangular, hexagonal |
Cytoplasm | [25] | ||||||
| Yarrowia lipolytica NCIM 3589 | 15 | Triangular, hexagonal | Cell wall | [26] | ||||||
| Penicillium sp. | 30-50 50 |
Spherical Spherical |
Extracellular Intracellular |
[27] | ||||||
| Candida albicans | 20-40 60-80 |
Spherical Nonspherical |
- - |
[28] | ||||||
| 病毒 Virus | ||||||||||
| Cowpea chlorotic mottle viruses | 9.2±3.9, 23.8±14.5 |
Spheroidal | Viral surface | [29] | ||||||
Note: -: Not reported.
原核生物用于AuNPs合成已有诸多报道,其中细菌催化AuNPs形成的条件及还原位点是生物介导AuNPs合成的研究热点。早在1980年,Beveridge等就利用Bacillus subtilis168在细胞壁上合成AuNPs,并利用官能团特异性修饰的方法确定Au(III)还原位点为细胞壁上的羧基[10]。He等证实Rhodopseudomonas capsulata能够合成纳米球、纳米片以及纳米线[14, 15]。Lengke等利用蓝藻细菌Plectonema boryanumUTEX485分别与Au(S2O3)23-和AuCl4-水溶液反应,合成了具有立方体结构的AuNPs以及八面体纳米片,并且合成方法适用的温度范围较广,可在25-100 °C下进行[13]。进一步利用X射线吸收近边结构(X-ray absorption near edge structure,XANES)分析表明,反应过程中Au(III)-氯化物首先在细菌的代谢下形成Au(I)-硫化物,随后Au(I) -硫化物被进一步还原为AuNPs,这一研究首次从化学角度关注了AuNPs合成过程中金物种的变化情况[30]。本实验室前期从重金属污染土壤中筛选分离得到一株贪铜菌Cupriavidus sp. SHE,可还原氯金酸合成AuNPs[31]。
1.2 合成AuNPs的放线菌放线菌是一类具有丝状分支的细菌,相对于其他细菌而言,菌丝比表面积大,从菌体中分离纳米颗粒的下游处理过程更加简单[32]。但是目前关于放线菌合成AuNPs的报道相对较少。Ahmad等利用Thermomonospora sp.合成平均粒径在8 nm左右的AuNPs,这是最早利用原核微生物在胞外合成金属纳米颗粒的报道[17]。随后,该研究组还发现Rhodococcus sp.可以在细胞壁以及细胞质膜上合成粒度5-15 nm的AuNPs,并且在纳米颗粒形成之后细胞仍在继续繁殖[18]。Kalabegishvili等将Arthrobacter sp. 61B和Arthrobacter globiformis 151B培养36-48 h后观察到胞外形成球形AuNPs[19]。
1.3 合成AuNPs的真菌真菌是另一类重要的微生物资源,近年来被用于合成不同种类的纳米颗粒,而且相对细菌更具应用潜力。真菌可以分泌大量合成纳米颗粒相关的胞外酶、多肽类物质及次级代谢产物,纳米颗粒产量高且易与真菌分离[33, 34]。同时,真菌在实验室以及放大的工艺条件下都比较容易生长,具有更好的扩大化应用前景[35]。除此之外,真菌合成的AuNPs尺寸范围较小、单分散性较好。真菌Neurospora crassa能够还原Au3+,在细胞内外形成尺寸外形较为均一的AuNPs[22]。酵母菌Candida guilliermondii能够合成分散性良好的近球状AuNPs[25]。Penicillium sp.细胞滤出液在与氯金酸反应仅1 min就能在细胞外合成AuNPs,全细胞反应生成胞内AuNPs也仅需8 h,这说明真菌与细菌、放线菌相比,在AuNPs合成速度上具有很大优势[27]。与细菌类似,反应体系的pH也可以显著影响真菌合成AuNPs的形貌和尺寸。Yarrowia lipolytica NCIM 3589在pH 7.0和pH 9.0下合成的AuNPs约为15 nm且形状不规则,而在pH 2.0条件下颗粒尺寸增大并在胞外不断聚集,最终形成规则的三角形和六边形结构[26]。
1.4 合成AuNPs的病毒病毒属于非细胞生物,表面凹凸,具有一定极性和剩余电荷,这种独特的蛋白表面拓扑结构比较适合分子生物学操作[29]。病毒已被报道可以利用脂肪酸、氨基酸等生物小分子作为模板合成量子点材料[2, 36, 37],而近年来的研究表明病毒同样是一类新颖的合成AuNPs的生物资源。Slocik等利用Cowpea chlorotic mottle病毒的衣壳蛋白SubE作为模板合成AuNPs,Au3+的还原过程通过病毒衣壳蛋白表面酪氨酸残基介导的电子传递实现。由于衣壳蛋白的宿主不同,合成的纳米颗粒尺寸不一致,在酵母菌Pichia pastoris中表达的SubE和野生型SubE合成的AuNPs粒径分别为9.2±3.9 nm以及 23.8±14.5 nm[29]。
在合成AuNPs的微生物资源中,细菌及放线菌合成AuNPs的场所并不固定,若在胞内形成AuNPs还需要通过高温灭菌、差速离心等手段进行分离。而真菌合成AuNPs的尺寸比较均一、合成速度快,适合AuNPs的大规模生产并有利于其在生物医学等领域的应用。此外,病毒作为一类新颖的AuNPs生物合成资源尚未得到广泛的研究,值得研究者深入关注和探索。
2 AuNPs的微生物合成机制微生物合成金属纳米粒子是复杂的生物化学过程,其合成机理仍不明晰。通常认为,微生物为了抵抗外界金属离子的毒性,能够将金属离子还原成较低价态或形成不溶于水的复合物,以减轻金属离子对自身的影响[32]。在微生物与含金化合物相互作用的研究中,已有的研究主要针对还原产物AuNPs的合成场所、Au3+还原的分子基础,以及调控基因等方面对这种脱毒机制进行探讨和研究,相关的原理示意图见图1。
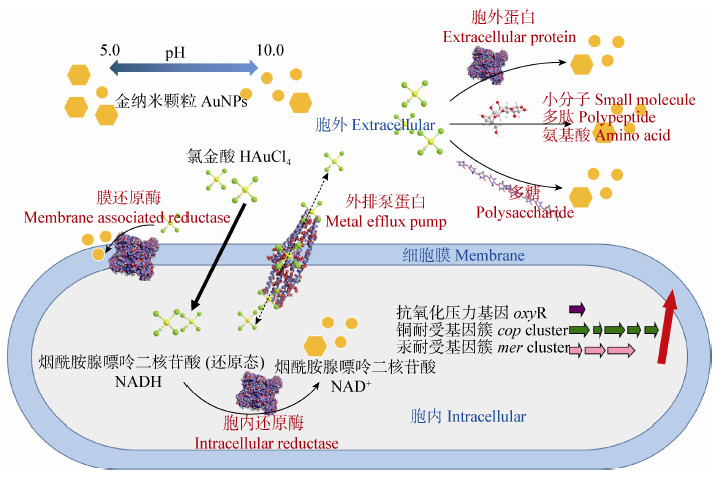
|
| 图 1 微生物合成AuNPs机制 Figure 1 Microbial synthesis mechanism of AuNPs |
微生物可以在胞内外或细胞膜上还原Au3+并形成AuNPs,合成位点可能取决于参与还原的酶的亚细胞定位。真菌Penicillium sp.可在胞外或胞内合成球形AuNPs[27]。放线菌Rhodococcus sp.合成的AuNPs则更多位于细胞膜上,研究者推测还原过程中涉及到的酶位于细胞壁内侧或位于细胞膜上[18]。除了还原Au3+过程中酶的亚细胞定位外,pH也是影响还原场所和合成位置的重要因素[9],可能是由于pH变化使得细胞膜通透性改变,从而影响Au3+进入细胞以及AuNPs外排的过程。
研究表明参与还原Au3+并稳定AuNPs的物质可以是蛋白质、多糖以及小分子物质。Sastry等发现放线菌Thermomonospora sp.与氯金酸反应120 h之后,菌体释放出4种分子量在10-80 kD的蛋白质,这些蛋白质可能是还原氯金酸或参与包被AuNPs的酶[32]。酵母菌Hansenula anomala利用乳酸进行厌氧发酵,产生的辅酶NADH可以调控Au3+的还原[5]。细胞壁肽聚糖层中多糖的水解产物,在酵母Saccharomyces cerevisiae还原Au3+过程中起到重要作用[24]。Feng等观察到光合细菌Rhodobacter capsulatus在还原Au3+的过程中细胞变为绿色,推测可能是细胞内的类胡萝卜素参与还原过程,使原来被掩蔽的叶绿素颜色显现出来。因此,利用类胡萝卜素参与还原Au3+并生成AuNPs的过程可能是光合细菌的自我保护机制[12]。
在微生物还原Au3+形成AuNPs的分子机制层面,Reith等首次对耐金属贪铜杆菌Cupriavidus metallidurans CH34的金矿化机制进行深入分析。除了采用同步辐射X射线荧光成像技术(Microfocused synchrotron based X-ray fluorescence,μXRF)和XANES研究Au元素的含量、位置、价态以及复合状态的变化,研究者还对菌株CH34的基因组和转录组进行分析。Au3+和菌体孵育一定时间后,基因簇中特定功能基因上调表达,如调控耐受氧化压力的基因oxyR、铜耐受基因簇cop、汞耐受基因簇mer等,表明菌体耐受Au3+受多种响应机制调控。同时,Au3+的矿化可能包含外排、还原和甲基化等多个过程[38]。Das等探究真菌Rhizopous oryzae的金耐受机制发现,Au(III)既可以通过静电相互作用与细胞壁结合,也可以进入胞内并通过共价作用与胞内蛋白结合,这两种情况下Au(III)在形成AuNPs之前均先被还原为Au(I)[39],这与菌株CH34还原Au3+的机制类似[38]。Pontel等发现菌株Salmonella sp.中存在Au3+特异性诱导的外排泵系统gesABC,这一外排泵系统属于典型的CBA外排泵系统。其中gesB编码的关键蛋白GesB (RND型蛋白)具有与Cu2+和Ag+转运蛋白完全不同的底物结合基序,控制胞内Au3+浓度不致于对菌株产生致命毒性。这一结果表明Au 3+可以通过菌株Salmonella sp.的分子通道进入和排出细胞[40]。然而,关于胞内合成的AuNPs是否可以通过外排泵系统排出仍不明确。Kyriacou等对转运Ag+的MexA-MexB-OprM系统进行基因敲除研究,发现胞内积累AgNPs的量显著增加,表明AgNPs的排出可以借助外排泵系统实 现[41],为研究者探索AuNPs的外排途径提供借鉴。
有些微生物由于自身的生长和代谢特点,其合成AuNPs的过程比较特殊。例如,硫酸盐还原菌通过硫代谢途径,可以利用Au(S2O3)23-中的硫代硫酸根,使得Au(I)在细胞内还原形成AuNPs,最终AuNPs释放到溶液中形成微米级别的金颗粒[8]。Konishi等发现厌氧菌Shewanella algae还原Au3+依赖于特殊电子供体H2的存在,并由此推测氢化酶参与了Au3+的生物还原过程[9]。
此外,为获得光电特性和物理化学性质良好的纳米颗粒,AuNPs的尺寸和形貌的调控机制也是研究热点[14]。较低的pH使微生物表面的氨基、羧基、巯基等官能团携带更多正电荷,导致细胞还原能力减弱,反应速率下降,而AuCl4-与微生物表面官能团静电相互作用增强,AuCl4-可以更接近这些结合位点,因此AuCl4-被还原为Au原子后大量聚集形成纳米片;而较高的pH使微生物的还原能力增强、还原速率加快,相应地生成热力学更稳定的球形纳米颗粒[14]。He等利用细胞提取物与较低浓度 (250 μmol/L) Au3+反应,得到10-20 nm的球形AuNPs,高浓度(500 μmol/L) Au3+下得到网状结构的金纳米线[15]。此外,生物有机分子也可以对AuNPs的形貌调控起到作用。Bacillus megatherium D01成功合成硫醇包被的单分散球形AuNPs,粒径为1.9±0.8 nm[16];香茅醇和香叶醇则可以作为AuNPs的稳定剂[23]。但小分子对AuNPs的具体调控机制还有待进一步研究。因此,pH[9, 14]、Au3+浓度[15]以及外源小分子[16, 23]均可作为调控生物合成AuNPs特性的重要因素。
3 微生物合成AuNPs的特性表征多种技术可以应用于微生物合成AuNPs的特性表征及合成场所的亚细胞定位。实际分析过程中,通常需要将不同表征手段进行结合[3]。在常用的表征手段中,紫外-可见光谱(UV-vis spectroscopy,UV-vis)应用最为广泛。由于微生物合成AuNPs尺寸存在差异,导致AuNPs表面等离子体共振(Surface plasmon resonance,SPR)不同,反应体系呈现出宝石红色[15]、粉色[26]或紫色[26, 30, 42]等不同颜色,可以通过UV-vis进行分析[43]。多数AuNPs在500-550 nm范围内出现特征吸收谱带,其最大吸收波长可反映粒径大小[3]。本实验室对菌株Cupriavidus sp. SHE合成的AuNPs进行紫外全波表征,AuNPs的最大吸收峰在550 nm左右[31],这与其他细菌合成的AuNPs类似。傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)被用 于分析微生物还原Au3+过程中官能团变化情况。Thermomonospora sp.还原氯金酸120 h后,FTIR图谱中出现蛋白质酰胺I (1 660 cm-1)和II (1 530 cm-1)的吸收峰[32],Rhodopseudomonas capsulata细胞提取物合成的AuNPs在1 450 cm-1处出现对应蛋白质分子亚甲基剪切振动的吸收峰[15],这些研究表明蛋白质很可能起到结合并稳定AuNPs的作用。 X射线衍射光谱(X-ray diffraction spectroscopy,XRD)可以对生物合成的AuNPs的晶相、相组成及平均尺寸进行分析。Yarrowia lipolytica还原Au3+的产物XRD图谱中出现了典型的[111]面心立方金晶面结构衍射峰,证明AuNPs以金纳米晶的形态存在,并根据Scherrer公式估测出纳米颗粒尺寸为15 nm[26]。X射线光电子能谱技术(X-ray photoelectron spectral techniques,XPS)、能量色散X射线光谱仪(Energy dispersive X-ray,EDX/Energy dispersive spectrum,EDS)、XANES能够对微生物的合成产物进行元素和价态分析。Wen等对Bacillus megatherium D01合成AuNPs的XPS谱图进行分析,两个结合能为84.0 eV和87.7 eV的峰分别归属于Au 4f7/2和 Au 4f5/2[16]。真菌Rhizopus oryzae还原氯金酸后形成的AuNPs-生物共轭体材料可以对有机磷农药进行吸附,EDX分析表明这种AuNPs-生物共轭体材料表面有S和P元素的吸收峰,表明有机磷农药分子吸附在材料表面[42]。XANES谱图说明Shewanella algae休眠细胞可以将溶液中的Au(III)还原为金单质[9]。μXRF可用于高精度、小面积的元素分析。Reith等利用μXRF分析发现,随着反应时间增长,Au元素首先在Cupriavidus metallidurans CH34细胞质中逐渐积累,随后部分迁移至细胞周质并形成AuNPs[38]。
AuNPs的形貌也是研究者们关注的重点。透射电子显微镜(Transmission electron microscopy,TEM)可以观察AuNPs的形貌并分析粒径大小。Konishi等利用TEM图像得到AuNPs在Shewanella algae细胞中的合成位置及其形状尺寸[9],Lengke等观察到AuNPs附着在Plectonema boryanum UTEX 485膜囊表面[13]。图2展示了微生物合成AuNPs的几种形貌[13, 14, 15]。Cupriavidus sp. SHE合成的AuNPs大多为球状形貌,尺寸大约为20 nm[31]。原子力显微镜(Atomic force microscopy,AFM)则可以从三维角度呈现AuNPs表面微观形貌。例如Das等通过AFM图像直观立体的呈现吸附不同农药分子后AuNPs-生物共轭体结构和表面形态变化[42]。其他常用的显微表征技术包括扫描电子显微镜(Scanning electron microscopy,SEM)、场发射扫描电子显微镜(Field emission scanning electron microscopy,FESEM)、高分辨透射电镜(High resonance transmission electron microscopy,HRTEM),均可对AuNPs形貌进行表征[3, 11]。
AuNPs凭借优越的光学、电学和热学特性,在生物技术、工业、电气、药物、医学和农业领域具有广泛的应用前景[3]。目前关于微生物合成AuNPs的应用报道主要集中于生物医学、生物催化以及污染物检测领域,并且绝大多数都是由真菌合成的AuNPs。相比于其他微生物,真菌合成的AuNPs产量大、尺寸较为均一、分散性好、易于分离,奠定了其在AuNPs合成应用方面的基础。Mishra等考察了真菌Penicillium brevicompactum合成的AuNPs对小鼠胚胎成肌细胞株C2C12癌细胞的毒性效应。随着Au3+浓度和反应时间的增加,C2C12癌细胞死亡率随之增加。但是,这种有效的毒性作用能否应用于抗癌剂的开发还需要深入研究[44]。Chauhan等将酵母菌Candida albicans细胞质提取物合成的AuNPs与肝癌抗体结合,得到的抗 体-AuNPs复合物可以与肝癌细胞表面抗原进行特异性结合,成功从正常细胞群体中区分出癌细胞,证明微生物合成的AuNPs在生物医学检测上具有应用潜力[28]。同时,研究表明生物合成的AuNPs具有特定催化功能。Escherichia coli K12、Trichoderma viride以及Hypocrea lixii合成的AuNPs能够催化对硝基酚降解生成对氨基酚[6, 34]。Trichoderma viride和Hypocrea lixii合成的AuNPs同时还具有杀灭致病微生物Pseudomonas syringae、Escherichia coli和Shigella sonnei的性能[34]。在有痕量Hg2+(低至2.6 nmol/L)存在下,Trichoderma harzianum合成的AuNPs由于结合Hg2+从而发生聚合使得粒径增大,反应体系很快从宝石红色变为灰蓝色,SPR吸收峰从532 nm红移至540 nm,并在720 nm处出现第二个吸收峰,通过依赖于Hg2+浓度的吸光度及吸收波长的变化实现了生物合成AuNPs对溶液中Hg2+简单、灵敏、快速的检测[45]。
尽管微生物合成AuNPs具有安全、生态友好、经济高效等优点,但是目前还处于实验研究阶段,尚存在拟解决的关键技术问题。例如,微生物合成的AuNPs大小形貌相对不均一、合成效率低、不易于扩大化应用等。因此,在今后的研究中应进一步开展如下工作,以期早日实现微生物合成AuNPs的工业化应用。(1) 纳米颗粒的形貌对其光学性质影响很大[23],明确微生物还原Au3+合成特定形貌AuNPs的条件可以使AuNPs在相应领域得到更好的应用。通过系统解析pH、生物小分子以及蛋白浓度对于AuNPs形貌的影响机制,将有助于合成形貌可控,性能优良的AuNPs。(2) 微生物合成AuNPs 的分子层面相关机制还不明晰,有待于从微生物的基因和相关酶入手,利用微生物全基因组测序以及基因敲除等手段挖掘更深层次的机制。(3) 合金纳米颗粒通常比纯金属纳米颗粒具有更优越的物理稳定性、磁性和催化性能[3],而目前微生物合成合金纳米颗粒的相关文献相对较少,因此合金纳米颗粒的微生物合成是一个值得关注的领域。(4) 目前研究涉及的微生物资源绝大多数为纯培养微生物,而近来有报道表明天然存在的厌氧活性污泥可以合成AuNPs,并在没有任何外加能源的情况下实现原位产氢[46],这一研究表明天然微生物群落合成AuNPs的性能及其应用是潜在的研究热点。
| [1] | Yang R, Pan Y, Wang T, et al. Preparation of nanogold and investigation of shape control[J]. Journal of Zhejiang Sci-Tech University, 2014, 31(2):171-174 (in Chinese). 杨荣, 潘月, 王騊, 等. 纳米金的制备及形态控制研究[J]. 浙江理工大学学报, 2014, 31(2): 171-174 |
| [2] | Narayanan KB, Sakthivel N. Biological synthesis of metal nanoparticles by microbes[J]. Advances in Colloid and Interface Science, 2010, 156(1/2):1-13 |
| [3] | Shedbalkar U, Singh R, Wadhwani S, et al. Microbial synthesis of gold nanoparticles:current status and future prospects[J]. Advances in Colloid and Interface Science, 2014, 209:40-48 |
| [4] | Das SK, Das AR, Guha AK. Microbial synthesis of multishaped gold nanostructures[J]. Small, 2010, 6(9):1012-1021 |
| [5] | K SK, RA, Arumugam P, et al. Synthesis of gold nanoparticles:an ecofriendly approach using Hansenula anomala[J]. ACS Applied Materials & Interfaces, 2011, 3(5):1418-1425 |
| [6] | Srivastava SK, Yamada R, Ogino C, et al. Biogenic synthesis and characterization of gold nanoparticles by Escherichia coli K12 and its heterogeneous catalysis in degradation of 4-nitrophenol[J]. Nanoscale Research Letters, 2013, 8(1):70-78 |
| [7] | Govindaraju K, Basha SK, Kumar VG, et al. Silver, gold and bimetallic nanoparticles production using single-cell protein (Spirulina platensis) Geitler[J]. Journal of Materials Science, 2008, 43(15):5115-5122 |
| [8] | Lengke M, Southam G. Bioaccumulation of gold by sulfate-reducing bacteria cultured in the presence of gold(I)-thiosulfate complex[J]. Geochimica et Cosmochimica Acta, 2006, 70(14):3646-3661 |
| [9] | Konishi Y, Tsukiyama T, Tachimi T, et al. Microbial deposition of gold nanoparticles by the metal-reducing bacterium Shewanella algae[J]. Electrochimica Acta, 2007, 53(1):186-192 |
| [10] | Beveridge TJ, Murray RG. Sites of metal deposition in the cell wall of Bacillus subtilis[J]. Journal of Bacteriology, 1980, 141(2):876-887 |
| [11] | Kalishwaralal K, Deepak V, Ram Kumar Pandian S, et al. Biological synthesis of gold nanocubes from Bacillus licheniformis[J]. Bioresource Technology, 2009, 100(21):5356-5358 |
| [12] | Feng Y, Yu Y, Wang Y, et al. Biosorption and bioreduction of trivalent aurum by photosynthetic bacteria Rhodobacter capsulatus[J]. Current Microbiology, 2007, 55(5):402-408 |
| [13] | Lengke MF, Fleet ME, Southam G. Morphology of gold nanoparticles synthesized by filamentous cyanobacteria from gold(I)-thiosulfate and gold(Ⅲ)-chloride complexes[J]. Langmuir, 2006, 22(6):2780-2787 |
| [14] | He S, Guo Z, Zhang Y, et al. Biosynthesis of gold nanoparticles using the bacteria Rhodopseudomonas capsulata[J]. Materials Letters, 2007, 61(18):3984-3987 |
| [15] | He S, Zhang Y, Guo Z, et al. Biological synthesis of gold nanowires using extract of Rhodopseudomonas capsulata[J]. Biotechnology Progress, 2008, 24(2):476-480 |
| [16] | Wen L, Lin Z, Gu P, et al. Extracellular biosynthesis of monodispersed gold nanoparticles by a SAM capping route[J]. Journal of Nanoparticle Research, 2009, 11(2):279-288 |
| [17] | Ahmad A, Senapati S, Khan MI, et al. Extracellular biosynthesis of monodisperse gold nanoparticles by a novel extremophilic actinomycete, Thermomonospora sp.[J]. Langmuir, 2003, 19(8):3550-3553 |
| [18] | Ahmad A, Senapati S, Khan MI, et al. Intracellular synthesis of gold nanoparticles by a novel alkalotolerant actinomycete, Rhodococcus species[J]. Nanotechnology, 2003, 14(7):824-828 |
| [19] | Kalabegishvili TL, Kirkesali EI, Rcheulishvili AN, et al. Synthesis of gold nanoparticles by some strains of Arthrobacter genera[J]. Journal of Materials Science and Engineering A, 2012, 2(2):164-173 |
| [20] | Balagurunathan R, Radhakrishnan M, Rajendran RB, et al. Biosynthesis of gold nanoparticles by actinomycete Streptomyces viridogens strain HM10[J]. Indian Journal of Biochemistry & Biophysics, 2011, 48(5):331-335 |
| [21] | Verma VC, Anand S, Ulrichs C, et al. Biogenic gold nanotriangles from Saccharomonospora sp., an endophytic actinomycetes of Azadirachta indica A. Juss[J]. International Nano Letters, 2013, 3:21-27 |
| [22] | Castro-Longoria E, Vilchis-Nestor AR, Avalos-Borja M. Biosynthesis of silver, gold and bimetallic nanoparticles using the filamentous fungus Neurospora crassa[J]. Colloids and Surfaces B, 2011, 83(1):42-48 |
| [23] | Shankar SS, Ahmad A, Pasricha R, et al. Bioreduction of chloroaurate ions by geranium leaves and its endophytic fungus yields gold nanoparticles of different shapes[J]. Journal of Materials Chemistry, 2003, 13(7):1822-1826 |
| [24] | Lin Z, Wu J, Xue R, et al. Spectroscopic characterization of Au3+ biosorption by waste biomass of Saccharomyces cerevisiae[J]. Spectrochimica Acta A, 2005, 61(4):761-765 |
| [25] | Mishra A, Tripathy SK, Yun SI. Bio-synthesis of gold and silver nanoparticles from Canadia guilliermondii and their antimicrobial effect against pathogenic bacteria[J]. Journal of Nanoscience and Nanotechnology, 2011, 11(1):243-248 |
| [26] | Agnihotri M, Joshi S, Kumar AR, et al. Biosynthesis of gold nanoparticles by the tropical marine yeast Yarrowia lipolytica NCIM 3589[J]. Materials Letters, 2009, 63(15):1231-1234 |
| [27] | Du L, Xian L, Feng JX. Rapid extra-/intracellular biosynthesis of gold nanoparticles by the fungus Penicillium sp.[J]. Journal of Nanoparticle Research, 2011, 13(3):921-930 |
| [28] | Chauhan A, Zubair S, Tufail S, et al. Fungus-mediated biological synthesis of gold nanoparticles:potential in detection of liver cancer[J]. International Journal of Nanomedicine, 2011, 6:2305-2319 |
| [29] | Slocik JM, Naik RR, Stone MO, et al. Viral templates for gold nanoparticle synthesis[J]. Journal of Materials Chemistry, 2005, 15(7):749-753 |
| [30] | Lengke MF, Ravel B, Fleet ME, et al. Mechanisms of gold bioaccumulation by filamentous cyanobacteria from gold(Ⅲ)-chloride complex[J]. Environmental Science & Technology, 2006, 40(20):6304-6309 |
| [31] | Qu YY, Shen E, Ma Q, et al. A strain of Cupriavidus sp. and its application in gold synthesis:China, 201410352091.5[P]. 2014-07-24 (in Chinese).曲媛媛, 沈娥, 马桥, 等.一株贪铜菌及其在金合成中的应用:中国, 201410352091.5[P]. 2014-07-24 |
| [32] | Sastry M, Ahmad A, Khan MI, et al. Biosynthesis of metal nanoparticles using fungi and actinomycete[J]. Current Science, 2003, 85(2):162-170 |
| [33] | Shi J, Fan SM, Wu J, et al. Research progress in biosynthesis of gold nnanoparticles[J]. Journal of Jishou University, 2012, 33(3):71-75 (in Chinese).石杰, 范淑敏, 吴静, 等.生物法合成纳米金的研究进展[J].吉首大学学报, 2012, 33(3):71-75 |
| [34] | Mishra A, Kumari M, Pandey S, et al. Biocatalytic and antimicrobial activities of gold nanoparticles synthesized by Trichoderma sp.[J]. Bioresource Technology, 2014, 166:235-242 |
| [35] | Das SK, Marsili E. A green chemical approach for the synthesis of gold nanoparticles:characterization and mechanistic aspect[J]. Reviews in Environmental Science and Biotechnology, 2010, 9(3):199-204 |
| [36] | Shenton W, Douglas T, Young M, et al. Inorganic-organic nanotube composites from template mineralization of tobacco mosaic virus[J]. Advanced Materials, 1999, 11(3):253-256 |
| [37] | Ober CK. Persistence pays off[J]. Science, 2002, 296(5569):859-861 |
| [38] | Reith F, Etschmann B, Grosse C, et al. Mechanisms of gold biomineralization in the bacterium Cupriavidus metallidurans[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(42):17757-17762 |
| [39] | Das SK, Liang J, Schmidt M, et al. Biomineralization mechanism of gold by zygomycete fungi Rhizopous oryzae[J]. ACS Nano, 2012, 6(7):6165-6173 |
| [40] | Pontel LB, Audero ME, Espariz M, et al. GolS controls the response to gold by the hierarchical induction of Salmonella-specific genes that include a CBA efflux-coding operon[J]. Molecular Microbiology, 2007, 66(3):814-825 |
| [41] | Kyriacou SV, Brownlow WJ, Xu XH. Using nanoparticle optics assay for direct observation of the function of antimicrobial agents in single live bacterial cells[J]. Biochemistry, 2004, 43(1):140-147 |
| [42] | Das SK, Das AR, Guha AK. Gold nanoparticles:microbial synthesis and application in water hygiene management[J]. Langmuir, 2009, 25(14):8192-8199 |
| [43] | Yang YD, Xu JH, Yang LM, et al. Optical properties of gold nanorod and its application in biological imaging and photothermal therapy[J].Laser & Optoelectronicss Progress, 2010(7):55-62 (in Chinese).杨玉东, 徐菁华, 杨林梅, 等.金纳米棒的光学性质及其在生物医学成像和光热疗法中的应用[J].激光与光电子学进展, 2010(7):55-62 |
| [44] | Mishra A, Tripathy SK, Wahab R, et al. Microbial synthesis of gold nanoparticles using the fungus Penicillium brevicompactum and their cytotoxic effects against mouse mayo blast cancer C2C12 cells[J]. Applied Microbiology and Biotechnology, 2011, 92(3):617-630 |
| [45] | Tripathi RM, Gupta R, Singh P, et al. Ultra-sensitive detection of mercury(Ⅱ) ions in water sample using gold nanoparticles synthesized by Trichoderma harzianum and their mechanistic approach[J]. Sensors and Actuators B, 2014, 204:637-646 |
| [46] | Khan MM, Lee J, Cho MH. Electrochemically active biofilm mediated bio-hydrogen production catalyzed by positively charged gold nanoparticles[J]. International Journal of Hydrogen Energy, 2013, 38(13):5243-5250 |
 2015, Vol. 42
2015, Vol. 42