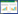扩展功能
文章信息
- 王芳, 蒋卉, 朱良全, 王楠, 张阁, 鑫婷, 朱鸿飞, 丁家波
- WANG Fang, JIANG Hui, ZHU Liang-Quan, WANG Nan, ZHANG Ge, XIN Ting, ZHU Hong-Fei, DING Jia-Bo
- 检测OMP28 抗体不能有效诊断羊布鲁氏菌病
- Antibody against OMP28 is not a reliable diagnostic target for brucellosis infected in sheep and goats
- 微生物学通报, 2015, 42(8): 1512-1519
- Microbiology China, 2015, 42(8): 1512-1519
- 10.13344/j.microbiol.china.140753
-
文章历史
- 收稿日期: 2014-10-08
- 接受日期: 2014-11-21
- 优先数字出版日期(www.cnki.net): 2014-12-15
2. 中国农业科学院北京畜牧兽医研究所 北京 100194
2. Institute of Animal Sciences, Chinese Academy of Agricultural Sciences, Beijing 100194, China
布鲁氏菌是一种革兰氏阴性、细胞内寄生菌,可引起严重的人畜共患病,包括人流产和马耳他热[1, 2]。本属细菌包括羊种布鲁氏菌、牛种布鲁氏菌、绵羊附睾种布鲁氏菌、猪种布鲁氏菌、犬种布鲁氏菌和沙漠森林鼠种布鲁氏菌以及一些感染海洋哺乳动物的布鲁氏菌。目前布鲁氏菌病在世界范围内呈反弹趋势,包括拉丁美洲、中东地区、亚洲、非洲、地中海地区等,每年新增病例50余万人。我国也是布鲁氏菌病流行极为严重的国家之一,根据卫生部网站公布的布鲁氏菌病疫情,2013年我国布鲁氏菌病发病人数46 089人,为历年新高,布鲁氏菌病防控形势十分严峻。
准确可靠的诊断是控制布鲁氏菌病的前提,传统的布鲁氏菌病诊断方法主要有凝集试验和补体结合试验,其主要是检测抗布鲁氏菌LPS-O链的抗体;然而,针对LPS抗体的血清学方法无法鉴别诊断免疫动物与感染动物[3],此外,布鲁氏菌的LPS-O链是多种革兰氏阴性菌的共同抗原,因此布鲁氏菌与其他革兰氏阴性菌如大肠杆菌O:157和小肠结肠炎耶尔森菌O:9存在的交叉反应,采用针对LPS抗体的血清学方法无法鉴别[4],这也是布鲁氏菌病诊断存在的一大难题。迄今为止,基于血清学对于布鲁氏菌病的诊断,尚未报道能够有效区分布鲁氏菌抗血清和小肠结肠炎耶尔森菌O:9抗血清的方法。
因此,研究者致力于开发特异性更高的诊断方法来克服LPS诊断方法的不足。1996年,Debbarh等发现羊布鲁氏菌外膜蛋白28 kD蛋白(OMP28)在布鲁氏菌感染绵羊表现出较高的免疫原性,可用于鉴别羊布鲁氏菌Rev. 1免疫的绵羊和羊布鲁氏菌H38强毒株感染的绵羊。随后,研究者建立并评价了OMP28蛋白作为包被抗原的间接ELISA (i-ELISA)和竞争ELISA (c-ELISA)方法[5, 6]。根据之前的研究结果,OMP28 ELISA的敏感性介于88.7%到100%,特异性介于85.59%到98.41%[7, 8, 9]。已有的研究表明基于OMP28建立的ELISA方法可用于诊断山羊布鲁氏菌或绵羊布鲁氏菌感染的绵羊或山羊[5, 6, 7, 8, 9, 10, 11, 12],但无对其它种属布鲁氏菌感染山羊和绵羊的报道[6, 7, 8, 9, 10, 11, 12, 13]。为了进一步研究基于OMP28蛋白建立的间接ELISA诊断方法对不同种属布鲁氏菌感染山羊和绵羊的诊断适用性,本研究采用3种不同种属的4株布鲁氏菌强毒参考株(羊种布鲁氏菌16M和M28,猪种布鲁氏菌S1330,牛种布鲁氏菌2308)分别感染山羊和绵羊,同时以LPS方法作为对照,评价了用OMP28 间接ELISA方法对山羊和绵羊诊断的可靠性。
1 材料与方法 1.1 材料 1.1.1 菌株和载体:布鲁氏菌国际参考强毒株Brucella melitensis 16M (生物1型)、B. melitensis M28 (生物1型)、B. abortus 2308 (生物1型)及B. suis S1330 (生物1型)均由本实验室保存。表达载体pET32a(+)以及表达菌株Escherichia coli BL21 (DE3)均由本实验室保存。 1.1.2 试剂及仪器:细菌基因组提取试剂盒购自博大泰克生物科技有限公司;Pfu DNA Polymerase、BCA蛋白定量试剂盒购自Thermo公司;dNTPs、Hind Ⅲ和BamHⅠ购自TaKaRa公司;胶回收试剂盒购自OMEGA公司;蛋白纯化柱购自GE公司;HRP标记的鼠抗山羊/绵阳单克隆抗体购自Sigma公司;Pourquier ELISA Brucellosis Individual and Pool Serum Screening购自IDEXX公司;4700 proteomics analyzer 7044购自Applied Biosystems公司。 1.2 方法 1.2.1 OMP28重组蛋白的表达、纯化及鉴定:布鲁氏菌B. melitensis 16M (GenBank No.:AE008918)、B. melitensis M28 (GenBank No.:CP002459.1)、B.abortus 2308 (GenBank No.:AM040264.1)以及B. suis S1330 (GenBank No.:AE014291.4)的OMP28氨基酸序列完全一致,本研究采用细菌基因组提取试剂盒提取B.abortus 2308的全基因组,并以其为模板扩增OMP28基因片段。上游引物序列为5′-CgCggATCCAtgAACACTCgTgCTAgCAAT-3′,下游引物序列为5′-CCCAagCTTTTACTTgATTTC AAAAACgAC-3′。PCR反应体系为:0.4 μmol/L引物1 μL,dNTPs 0.2 mmol,2×GC buffer 25 μL,PfuDNA polymerase 1.25 U,补充双蒸水至50 μL。反应程序为:95 °C 10 min;95 °C 45 s,54 °C 45 s,72 °C 45 s,共30个循环;72 °C 10 min。PCR产物经Hind Ⅲ和BamHⅠ双酶切后,用胶回收试剂盒回收片段,酶切后的PCR片段定向连接至pET-32a(+)表达载体上,连接产物转化至E. coli DH5α菌株中,筛选测序正确的重组质粒,并将其命名为pET32a-omp28。将重组质粒pET32a-omp28转化至E. coli BL21(DE3)中,涂布在含有50 μg/L氨苄青霉素的LB平板上,37 °C培养12–16 h。挑取单个菌落转接至100 mL LB液体培养基(含有50 μg/L氨苄青霉素),待菌液的OD600达到0.6–0.8时,加入100 μL 1 mol/L的IPTG,22 °C、160 r/min振荡培养12 h。将菌液在4 °C下4 000xg离心10 min,倾去上清,并用PBS (pH 7.4)清洗沉淀2次,菌体沉淀用10 mL PBS (pH 7.4)重悬,并进行超声裂解,将裂解液于4 °C、12 000xg离心30 min,收集上清并用φ 0.45 μm的滤膜过滤,收集滤液。滤液用镍柱(HisTrap FF Crude,1 mL,GE Healthcare)进行纯化,纯化后的蛋白用脱盐柱(HiTrap 26/10 Desalting column,GE Healthcare)进行脱盐,将纯化后的蛋白置换到PBS (pH 7.4)缓冲体系中。纯化后的蛋白用12%的SDS-PAGE进行检测,并用BCA蛋白定量试剂盒进行定量。
为了对重组蛋白进行鉴定,将重组蛋白用Thrombin在22 °C酶切1 h,并用12% SDS-PAGE进行检测,切下26 kD大小的条带,送至上海生化研究所进行MS/MS鉴定。
1.2.2 OMP28间接ELISA检测方法的建立:通过对间接ELISA的抗原包被浓度、封闭液、反应时间、样品稀释液等条件的优化,OMP28 i-ELISA反应条件确定如下:用碳酸盐包被缓冲液稀释重组蛋白OMP28至1 mg/L,100 μL/孔,4 °C包被过夜;TBST洗涤6次后,用5%的鸡血清(TBST配制) 200 μL/孔37 °C封闭2 h;TBST洗涤6次后,每孔加入100 μL 1:100 TBST稀释的血清样本,37 °C反应1 h;TBST洗涤6次,每孔加入100 μL的用TBST 1:30 000稀释的HRP标记的鼠抗山羊/绵阳单克隆抗体,37 °C反应1 h;TBST洗涤6次,每孔加入100 μL TMB显色液,室温避光反应15 min,加入100 μL 2 mol/L H2SO4终止反应,用酶标仪检测OD450读值。为验证OMP28 i-ELISA的有效性,将2份健康绵羊阴性血清和2份感染B. melitensis 16M的绵羊阳性血清分别用TBST倍比稀释成1:20、1:40、1:80、1:160和1:320,用该方法检测梯度稀释血清的OD450值。用优化后的OMP28间接ELISA方法检测20份布鲁氏菌病阴性的健康山羊血清和20份布鲁氏菌病阴性的健康绵羊血清,以山羊/绵羊样品OD450的平均值+3s作为临界值。 1.2.3 LPS抗体检测方法:用间接ELISA检测试剂盒(Pourquier ELISA Brucellosis Individual and Pool Serum Screening,P04130/10)检测实验动物不同感染阶段血清中针对布鲁氏菌LPS的IgG抗体水平。该试剂盒能够检测牛、山羊和绵羊体内针对LPS的抗体,但是说明书只提供了牛布鲁氏菌病诊断的临界值。因此,从无布鲁氏菌病的羊场分别采集10头健康绵羊(虎红平板试验和补体结合试验均为阴性)和10头健康山羊(虎红板试验和补体结合试验均为阴性)的静脉血,制备血清作为临床阴性样品;分别采集20份人工感染布鲁氏菌山羊和20份人工感染布鲁氏菌绵羊的静脉血并制备血清作为阳性样本。用间接ELISA试剂盒检测阴性和阳性样本,按说明书计算阴性和阳性样本的S/P值,并用ROC方法分别计算山羊和绵阳的临界值。 1.2.4人工感染实验动物及血清样本采集: 从布鲁氏菌病阴性养殖场筛选15头健康1–2岁雌性小尾寒羊和15头健康1–2岁雌性波尔山羊,将小尾寒羊和波尔山羊分别随机分为5组,每组3头实验动物,经结膜接种3种不同种属的布鲁氏菌菌株(分组情况详见表 1),其中包含了猪种布鲁氏菌S1330株,羊种布鲁氏菌16M和M28株,以及牛种布鲁氏菌2 308株。每2–4周采集静脉血,制备血清,用间接ELISA检测方法检测各实验动物体内针对LPS和OMP28的IgG抗体水平,直至感染后42周。| Animal | B. melitensis 16M (1011 CFU/animal) |
B. melitensis M28 (1011 CFU/animal) |
B. abortus 2308 (1011 CFU/animal) |
B. suis S1330 (1011 CFU/animal) |
PBS control |
| 绵羊 Sheep | 3 | 3 | 3 | 3 | 3 |
| 山羊 Goats | 3 | 3 | 3 | 3 | 3 |
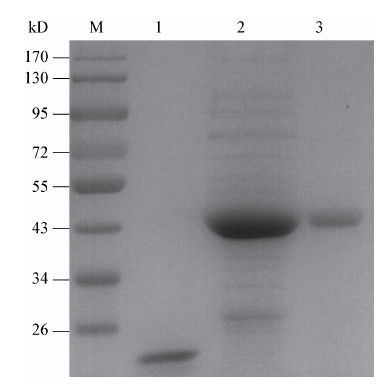
SDS-PAGE检测结果表明,OMP28重组蛋白获得了良好表达,其大小与预测一致(44.5 kD),经纯化后的重组蛋白纯度大于90% (图 1),利用BCA方法对纯化的蛋白进行定量,结果为0.6 g/L。串联质谱分析(MS/MS)表明该重组蛋白为布鲁氏菌OMP28特异性蛋白(图 2)。
|
|
图 1 重组蛋白OMP28 的SDS-PAGE 结果
Figure 1 SDS-PAGE analysis of recombinant OMP28
注:M:蛋白分子量标准;1:纯化后的标签蛋白(载体对照);2:OMP28总蛋白;3:纯化后的OMP28蛋白. Note: M: Prestained protein ladder (Ferments); 1: Purified pET32a(+) tag; 2: OMP28 expressed in E. coli BL21(DE3); 3: Purified recombinant OMP28. |
|
| 图 2 重组蛋白OMP28 的MS/MS 鉴定结果 Figure 2 The tandem mass spectrometry (MS/MS) analysis of the OMP28 |
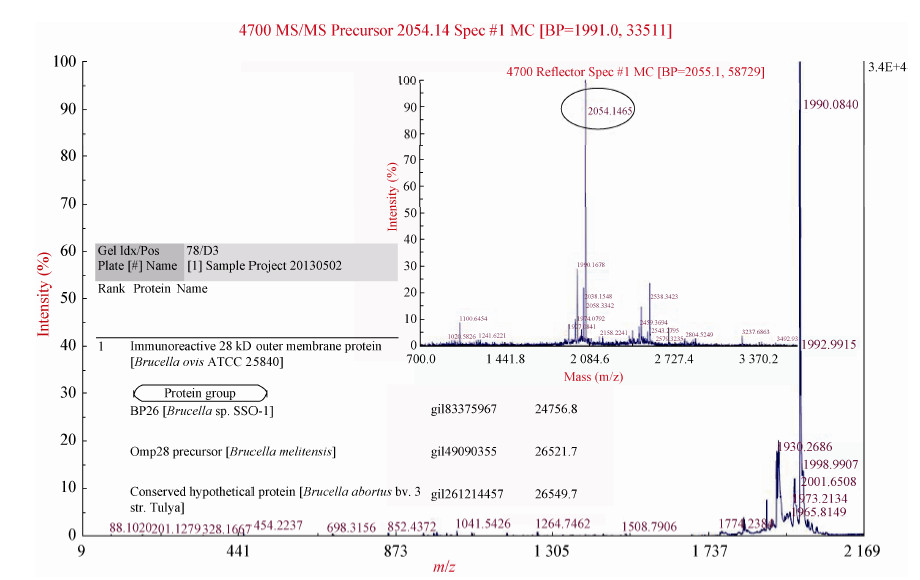
为了评价优化后的OMP28间接ELISA检测方法,分别将B. melitensis 16M感染后的阳性羊血清和阴性健康羊血清梯度稀释,并用该方法检测梯度稀释的各血清(以OD450值表示),检测结果显示该方法可以区分5个不同稀释度(1:20、1:40、1:80、1:160、1:320)的阳性和阴性血清样本(图 3),其OD450检测值与血清中针对OMP28 IgG抗体浓度具有良好的线性关系,证明研究建立的OMP28间接ELISA可用来检测血清样本中针对OMP28的IgG抗体水平。
|
| 图 3 OMP28 间接ELISA 检测方法的初步评价 Figure 3 The efficacy of OMP28-based i-ELISA |
用优化后的OMP28间接ELISA检测20份布鲁氏菌病阴性健康山羊血清和20份布鲁氏菌病阴性健康绵羊血清,山羊的临界值设为0.22,绵羊的临界值设为0.20。
2.3 LPS间接ELISA检测方法诊断人工感染动物采用ROC方法确定基于LPS的间接ELISA方法检测绵羊血清时的临界值为75%,检测山羊血清时的临界值为84%,利用LPS间接ELISA检测人工感染后不同阶段山羊和绵羊血清中的布鲁氏菌抗体(图 4),其中感染B. melitensis 16M、B . melitensis M28和B. suis S1330的绵羊血清, 感染B. melitensis 16M和B. abortus 2308的山羊血清中均能检测到较高水平的布鲁氏菌LPS抗体,且可持续到42周以后,表明基于LPS的ELISA对于检测不同属布鲁氏菌感染不同品种的羊所产生的抗体都是有效的。然而,随着时间推移,B. abortus 2308感染的绵羊和B. melitensis M28、B. suis S1330感染的山羊血清中LPS抗体水平逐渐下降,特别是B. abortus 2308感染的绵羊血清中抗LPS的IgG仅能持续到12–16周,而B. abortus 2308感染的山羊血清中此抗体持续时间可超过42周,这可能是因为B. abortus 2308对绵羊的毒力低于山羊,所以与山羊相比,绵羊机体可以更快地清除细菌。
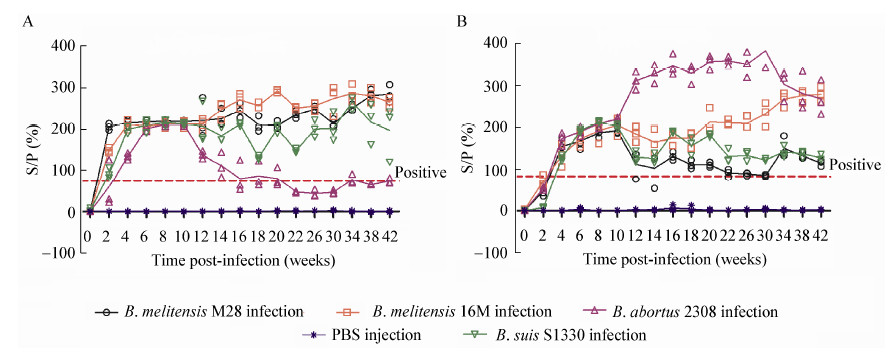
|
|
图 4 LPS ELISA 检测人工感染绵羊/山羊的抗体水平
Figure 4 The levels of antibodies against LPS in serum samples of experimental infected-sheep and goats
注:A:LPS间接ELSIA检测不同种属布鲁氏菌感染的绵羊抗体水平;B:LPS间接ELSIA检测不同种属布鲁氏菌感染的山羊抗体水平. Note: A: The antibody level for sheep infected by different Brucella strains (detected by LPS based i-ELSIA); B: The antibody level for goats infected by different Brucella strains (detected by LPS based i-ELSIA). |
用优化后的OMP28间接ELISA检测方法检测人工感染后不同感染阶段的山羊/绵羊血清,其检测结果如图 5所示。结果表明,不同种属布鲁氏菌感染绵羊和山羊的OMP28抗体水平并不一致,仅B. melitensis M28和B. melitensis 16M感染的绵羊,以及B. melitensis 16M和B.abortus 2308感染的山羊能在试验阶段(42周)持续检测到OMP28抗体。B. suis S1330感染的山羊和绵羊,B. abortus 2308感染的绵羊在整个实验阶段均检测不到抗OMP28的抗体。
2.5 临床样品检测同时用LPS间接ELISA试剂盒和OMP28间接ELISA检测方法对从临床采集的58份山羊血清和55份绵羊血清进行检测。结果表明(表 2),对于绵羊,OMP28间接ELISA对LPS间接ELISA的特异性和敏感性分别为90%和82.2%。对于山羊,OMP28间接ELISA对LPS间接ELISA的特异性和敏感性分别为100%和80%。
| OMP-28间接ELISA OMP-28 i-ELISA |
绵羊 Sheep | 山羊 Goats | ||
| 阳性 Positive | 阴性 Negative | 阳性 Positive | 阴性 Negative | |
| 阳性 Positive | 37 | 1 | 40 | 0 |
| 阴性 Negative | 8 | 9 | 10 | 8 |
基于LPS的ELISA方法具有较高的敏感性和特异性,被认为是诊断布鲁氏菌病最有效的方法[13, 14]。本研究中,感染布鲁氏菌的动物在感染后2–4周可以检测到布鲁氏菌病阳性,抗LPS抗体可以持续近42周。然而,B.abortus 2308感染的绵羊,B.melitensis M28和B.suis S1330感染的山羊,在感染16周后,LPS的抗体下降至阴性,提示对布鲁氏菌长期感染的绵阳或山羊,存在漏检的风险。Çelik等[15]曾报道了两例经细菌培养或穿刺活检诊断为阳性的布鲁氏菌病,经血清学诊断却为阴性,同样也证明该风险的存在。
本研究发现,基于OMP28的间接ELISA表现出了细菌种属特异性(表 1,图 5)。仅有B. melitensis 16M感染的绵羊和山羊血清可以持续检测到OMP28抗体,而B.suis S1330感染的无论绵羊还是山羊均不能检测到OMP28抗体阳性。研究结果同时还表明,OMP28间接ELISA也表现出了宿主动物特异性,B. abortus 2308感染的绵羊和山羊对OMP28的体液免疫应答较弱,仅有感染后的山羊血清可以与OMP28反应。此外,感染B.melitensis 28M的绵羊可以产生良好OMP28的抗体,但感染山羊却为OMP28抗体阴性。对自然感染动物血清的检测结果进一步证实了基于OMP28的间接ELISA不能有效检测到所有布鲁氏菌感染的动物。
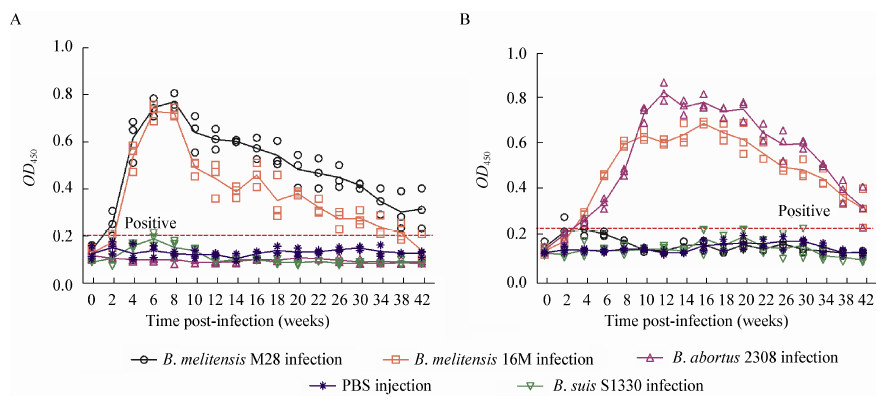
|
|
图 5 OMP28 间接ELISA 检测人工感染绵羊/山羊的抗体水平
Figure 5 The levels of antibodies against OMP28 in serum samples of experimental infected-sheep and goats
注:A:OMP28间接ELSIA检测不同种属布鲁氏菌感染的绵羊抗体水平;B:OMP28间接ELSIA检测不同种属布鲁氏菌感染的山羊抗体水平. Note: A: The antibody level for sheep infected by different Brucella strains (detected by OMP28 based i-ELISA); B: The antibody level for goats infected by different Brucella strains (detected by OMP28 based i-ELISA). |
有研究者认为,基于OMP28的ELISA在诊断绵羊、山羊、牛和人类的布鲁氏菌病具有高度特异性和敏感性[5, 7, 8, 9]。Chaudhuri等发现基于OMP28的ELISA在诊断牛布鲁氏菌病的敏感性和特异性分别为88.7%和93.8%[8]。2011年,Tiwari等发现B. abortus的OMP28区的10 kD重组蛋白可用于牛布鲁氏菌病诊断[16]。不同菌株感染不同宿主动物所产生的针对OMP28的抗体水平不同可能是由于不同布鲁氏菌感染不同宿主时,OMP28蛋白存在的位点和数量不同有关。然而,对OMP28的定位缺乏深入研究,Rossetti等[17]发现OMP28位于布鲁氏菌的外膜和圆泡,将该蛋白定位于布鲁氏菌的周质中,而Cloeckaert等[10]采用单克隆抗体发现该蛋白是严格定位于细胞内的可溶性蛋白。这些研究结果的差异可能是由于在布鲁氏菌的整个感染过程中,布鲁氏菌的蛋白表达谱会随着宿主、环境等因素发生改变[18]。在实验条件下,一些蛋白可能不表达,即使在同样实验条件下,B.melitensis 与B. abortus的蛋白表达谱也不同[19]。因此,我们推测在不同的布鲁氏菌感染不同种动物后,OMP28蛋白可能以多种状态存在[18, 20],被感染动物体内针对OMP28产生抗体的水平也因此存有差异。此外,机体产生针对胞内或胞外抗原的抗体还取决于巨噬细胞对细菌捕获、加工以及细菌的致病性。因此,本研究认为基于OMP28的间接ELISA作为诊断布鲁氏菌病的诊断方法存在风险。
4 结论本研究表明基于OMP28间接ELISA检测方法具有布鲁氏菌种属特异性以及感染宿主特异性,明确了基于OMP28间接ELISA用于山羊和绵羊布鲁氏菌病的诊断谱,并且阐明了OMP28用于诊断羊布鲁氏菌病的局限性。
| [1] | de Jong MF,Tsolis RM. Brucellosis and type IV secretion[J]. Future Microbiology,2012,7(1):47-58 |
| [2] | Christopher S,Umapathy BL,Ravikumar KL. Brucellosis: review on the recent trends in pathogenicity and laboratory diagnosis[J]. Journal of Laboratory Physicians,2010,2(2): 55-60 |
| [3] | Barrio MB,Grilló MJ,Muñoz PM,et al. Rough mutants defective in core and O-polysaccharide synthesis and export induce antibodies reacting in an indirect ELISA with smooth lipopolysaccharide and are less effective than Rev 1 vaccine against Brucella melitensis infection of sheep[J]. Vaccine, 2009,27(11):1741-1749 |
| [4] | Nielsen K,Smith P,Widdison J,et al. Serological relationship between cattle exposed to Brucella abortus,Yersinia enterocolitica O:9 and Escherichia coli O157:H7[J]. Veterinary Microbiology,2004,100(1/2):25-30 |
| [5] | Debbarh HS,Zygmunt MS,Dubray G,et al. Competitive enzyme-linked immunosorbent assay using monoclonal antibodies to the Brucella melitensis BP26 protein to evaluate antibody responses in infected and B. melitensisi Rev.1 vaccinated sheep[J]. Veterinary Microbiology,1996,53(3/4): 325-337 |
| [6] | Lindler LE,Hadfield TL,Tall BD,et al. Cloning of a Brucella melitensis group 3 antigen gene encoding Omp28,a protein recognized by the humoral immune response during human brucellosis[J]. Infection and Immunity,1996,64(7): 2490-2499 |
| [7] | Zygmunt MS,Baucheron S,Vizcaino N,et al. Single-step purification and evaluation of recombinant BP26 protein for serological diagnosis of Brucella ovis infection in rams[J]. Veterinary Microbiology,2002,87(3):213-220 |
| [8] | Chaudhuri P,Prasad R,Kumar V,et al. Recombinant OMP28 antigen-based indirect ELISA for serodiagnosis of bovine brucellosis[J]. Molecular and Cellular Probes,2010,24(3): 142-145 |
| [9] | Thavaselvam D,Kumar A,Tiwari S,et al. Cloning and expression of the immunoreactive Brucella melitensis 28 kD outer-membrane protein (Omp28) encoding gene and evaluation of the potential of Omp28 for clinical diagnosis of brucellosis[J]. Journal of Medical Microbiology,2010,59(Pt 4):421-428 |
| [10] | Cloeckaert A,Debbarh HS,Vizcaíno N,et al. Cloning, nucleotide sequence,and expression of the Brucella melitensis bp26 gene coding for a protein immunogenic in infected sheep[J]. FEMS Microbiology Letters,1996,140(2/3): 139-144 |
| [11] | Seco-Mediavilla P,Verger JM,Grayon M,et al. Epitope mapping of the Brucella melitensis BP26 immunogenic protein:usefulness for diagnosis of sheep brucellosis[J]. Clinical and Diagnostic Laboratory Immunology,2003,10(4): 647-651 |
| [12] | Cloeckaert A,Jacques I,Grilló MJ,et al. Development and evaluation as vaccines in mice of Brucella melitensis Rev.1 single and double deletion mutants of the bp26 and omp31 genes coding for antigens of diagnostic significance in ovine brucellosis[J]. Vaccine,2004,22(21/22):2827-2835 |
| [13] | Perrett LL,McGiven JA,Brew SD,et al. Evaluation of competitive ELISA for detection of antibodies to Brucella infection in domestic animals[J]. Croatian Medical Journal, 2010,51(4):314-319 |
| [14] | Chand P,Rajpurohit BS,Malhotra AK,et al. Comparison of milk-ELISA and serum-ELISA for the diagnosis of Brucella melitensis infection in sheep[J]. Veterinary Microbiology, 2005,108(3/4):305-311 |
| [15] | Çelik AD,Yulugkural Z,Kilincer C,et al. Negative serology: could exclude the diagnosis of brucellosis?[J]. Rheumatology International,2012,32(8):2547-2549 |
| [16] | Tiwari AK,Kumar S,Pal V,et al. Evaluation of the recombinant 10-kilodalton immunodominant region of the BP26 protein of Brucella abortus for specific diagnosis of bovine brucellosis[J]. Clinical and Vaccine Immunology,2011, 18(10):1760-1764 |
| [17] | Rossetti OL,Arese AI,Boschiroli ML,et al. Cloning of Brucella abortus gene and characterization of expressed 26-kilodalton periplasmic protein:potential use for diagnosis[J]. Journal of Clinical Microbiology,1996,34(1):165-169 |
| [18] | Rafie-Kolpin M,Essenberg RC,Wyckoff JH 3rd. Identification and comparison of macrophage-induced proteins and proteins induced under various stress conditions in Brucella abortus[J]. Infection and Immunity,1996,64(12):5274-5283 |
| [19] | Eschenbrenner M,Horn TA,Wagner MA,et al. Comparative proteome analysis of laboratory grown Brucella abortus 2308 and Brucella melitensis 16M[J]. Journal of Proteome Research, 2006,5(7):1731-1740 |
| [20] | Zhao Z,Yan F,Ji W,et al. Identification of immunoreactive proteins of Brucella melitensis by immunoproteomics[J]. Science China-Life Sciences,2011,54(9):880-887 |
 2015, Vol. 42
2015, Vol. 42