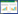扩展功能
文章信息
- 焦海华, 边高鹏, 崔丙健, 白志辉, 黄占斌
- JIAO Hai-Hua, BIAN Gao-Peng, CUI Bing-Jian, BAI Zhi-Hui, HUANG Zhan-Bin
- 石油污染盐碱土壤棉花根际微生物与石油烃降解关系
- Correlation between rhizosphere microbial community of Gossypium spp. and petroleum hydrocarbon degradation in the petroleum contaminated saline-alkali soil
- 微生物学通报, 2015, 42(8): 1501-1511
- Microbiology China, 2015, 42(8): 1501-1511
- 10.13344/j.microbiol.china.150177
-
文章历史
- 收稿日期: 2015-03-07
- 接受日期: 2015-06-02
- 优先数字出版日期(www.cnki.net): 2015-06-17
2. 中国科学院生态环境研究中心 北京 100085;
3. 中国矿业大学(北京) 化学与环境工程学院 北京 100083
2. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China;
3. School of Chemical and Environmental Engineering, China University of Mining and Technology-Beijing, Beijing 100083, China
磷脂脂肪酸(phospholipid fatty acid,PLFA)分析方法是基于PLFAs发展起来的现代生物化学技术。虽然具有一定的局限性,但与传统的培养基分离技术、生理学及分子生物学方法相比,具有许多优点:(1) PLFAs不受培养体系的影响,对细胞生理活性没有特殊的要求;(2) PLFAs是活性微生物膜结构物质,细胞一旦死亡PLFAs将迅速分解。在自然生理条件下,其含量相对恒定(约占细胞干重的5%)[1];(3) PLFAs可通过不同的代谢途径合成,具有结构多样性和生物多样性。不同的微生物具有不同的种类和含量。某些PLFAs特异性地存在于某类(种)微生物的细胞膜中[2]。(4) PLFAs提取不受质粒损失或增加,或有机体变化的影响,实验结果更为客观、可靠;(5) 试验条件要求低、操作难度小、样品测试价格相对较低并能反应多种功能。鉴于PLFAs的生理特征,PLFAs的存在及其丰富度可以作为微生物群落结构和生物量变化的生物标记分子,能有效提供微生物群落的信息,直接反应微生物群落的动态变化,揭示特定微生物种群的存在及其丰富度的动态变化[3]。研究[4]认为,PLFAs不但可以用来区分革兰氏阳性(G+)细菌、革兰氏阴性(G−)细菌、好氧细菌、厌氧细菌、真菌和放线菌等,还可以根据具有种属特异性的PLFAs来指示特定的微生物,如Ludvigsen等[5]以环丙基脂肪酸作为硫酸盐还原菌的生物指示物。Albrechtsen等[6]基于PLFAs方法在受燃料油污染的土壤发现了大量的硫酸盐还原细菌。Ibekwe等[7]用19:1ω8、16:1ω6c、15:2ω2,14等指示诺卡氏菌(Nocardia),取得较好的研究效果。
土壤微生物是土壤有机物质(包括有机污染物)的分解者,在物质循环和能量流动中具有极其重要的作用[8]。此外,土壤微生物对环境的变化极为敏感,容易受污染物的浓度、土壤理化因子等的影响。因此,土壤微生物不仅是土壤肥力的源和库,而且还能够作为灵敏的生物学指标指示土壤受干扰的程度[9]。土壤微生物量已成为土壤生物学、土壤生态学等领域研究的热点问题之一[10]。根际土壤环境是微生物活跃区域,根际土壤形成具有不同结构与功能特征的微生物群落[11]。Lynch等[12]和Reilley等[13]认为地表植被是土壤微生物多样性发展的重要推动力。
棉花(Gossypium spp.)属于锦葵科,棉属(Gossypium hirsulum L.)植物,是全球种植最广泛的经济作物之一。具有发达的直根,能吸收较深土层的水分和养分,具有较强的耐盐碱、耐干旱能力。关于棉花的育种、栽培、田间管理等方面的研究很多,但关于棉花生长对石油污染盐碱土壤微生物群落结构与功能特征的影响研究报道还较少。
本研究通过PLFAs指纹图谱法分析根际土壤活性微生物的种类和生物量的动态变化情况,揭示棉花生长对土壤微生物群落和TPH降解功能的影响,以期为石油污染盐碱土壤的植物修复技术研究提供科学依据。
1 材料与方法 1.1 实验设计和土壤样品采集实验土壤类型为石油污染盐碱性土壤,取自天津大港油田区。石油烃含量6.36±1.80 g/kg、pH 8.930±0.485 (pHs-3C)、电导率306±2.53 µs/cm、总氮0.521±0.101 g/kg、总碳3.710±0.421 g/kg、有效磷(26.600±0.523) mg/kg、有效钾7.930±0.105 mg/kg。
盆栽实验,棉花(Gossypium spp.) (中棉16号),购买于中国农业科学院农业花卉研究所。盆径 25 cm×30 cm,共30盆,其中10盆为未种植棉花的对照(CK)。棉花于2013年4月1日播种,每盆5粒,长出第一片真叶后间苗,每盆留苗2株,整个生长期180 d,采用自然光源,温度为15−35 °C,湿度保持在50%−60%。分别在棉花生长的苗期、蕾期、吐絮期分别取3次样,整个生长期共取9次样。采用打孔器分别在根区周围0−20 cm取40个根际土样,然后混合均匀,先去除石块、动植物残体等杂质,用四分法取需用量的土样,装入密封袋运送实验室。其中,PLFAs提取采用鲜土。石油烃含量分析采用冷冻干燥土样,研磨过100目金属筛。文中3个生长期所列数据均为该生长期3次取样测定的平均值。
1.2 测定指标及方法土壤总碳、氮测定采用元素分析仪测定;pH和电导率(EC)用pH计和电导仪测定;有效磷采用钼锑抗比色法测定[14];石油烃含量根据Riser-Roberts等[15]文献测定。参照Bligh和Dyer的方法提取PLFAs[16],PLFAs样品利用气相色谱-气相质谱联用仪(GC-MS)测定。
1.3 PLFAs命名与生物量的确定PLFAs命名采用“ω”系统,分子通式:(i/a/me/cy)X:YωZ(c/t),其中,X:主链碳原子的个数;Y:碳链中双键的个数;ω:双键;Z:双键的位置(距离分子末端碳原子的个数);i或a:甲基支链的位置(分别在距离分子末端第2、3个碳原子上);me:甲基支链的位置(距离分子始端碳原子的个数);cy:分子中的环丙基;c或t:分子的顺、反式结构[17]。
根据文献[18,19],不同PLFAs标记的微生物类型分别为:饱和型脂肪酸(SAT)如C14:0、C15:0、C16:0、C18:0、n16:0标识除放线菌之外的细菌(以下相同);单不饱和型脂肪酸(MONO)如16:1ω7t、i16:1ω5、18:1ω9c、18:1ω9t和环丙脂肪酸(CYCLO)如cy16:0、cy18:0等标识革兰氏阴性(G−)细菌;支链末端型脂肪酸(TBSAT)如i13:0、i15:0、i16:0、a14:0、a16:0等标识除放线菌之外的革兰氏阳性(G+)细菌(以下相同);多不饱和型脂肪酸(PUFA)如18:2ω6,9等标识真菌;支链中间型脂肪酸(MBSAT)如10me18:0、9me14:0、9me16:0、2me14:0等标识放线菌;以SAT、MONO、CYCLO、TBSAT总和表征细菌总生物量;以PUFA表征真菌生物量;以MBSAT表征放线菌生物量;以TBSAT表征G+菌生物量;以MONO和 CYCLO之和表征G−菌生物量。特征PLFAs的相对含量为该PLFAs的量占土壤样品中所有提取量的百分比。
1.4 数据分析对PLFAs的GC-MS测定结果,利用NEST 5.0图谱库进行解析;利用SPSS 17.0软件对数据进行主成分和相关性分析。PLFAs与土壤TPH降解相关性分析采用Spearman方法。
2 结果与分析 2.1 棉花根际土壤微生物PLFAs指纹图谱将提取的微生物PLFAs利用GC-MS分析得到谱图,以吐絮期为例(图1)。其中,横坐标表示各PLFAs在气相色谱中出现特征峰的时间,纵坐标则表示各PLFAs的峰高。
|
| 图 1 棉花吐絮期根际土壤样品微生物磷脂脂肪酸(PLFAs)气相色谱图 Figure 1 Chromatogram profiles of phospholipids fatty acids (PLFAs) of soil microbial community at opening period of Gossypium spp. |
将GC-MS图谱信息量化,转化成数据形式,不同特征PLFAs的类型及其相对含量见表1。由表1可知,PLFAs根据分子结构可分为:SAT、TBSAT、MBSAT、MONO、PUFA、CYCLO等6大类型。棉花根际土壤先后共出现了21种PLFAs,其中,苗期16种,蕾期11种,吐絮期12种;CK土壤中先后检测到14种PLFAs,在对应的3个时期分别为8种、6种和10种。两者相比,根际土壤PLFAs种类分别增加了100%、83.3%和20.0%。增加的PLFAs类型包括:i16:0 (0.294%)、16:1ω5 (0.807%)和a14:0 (7.11%)等。根际土壤微生物PLFAs的优势类群是TBSAT,其中,3个时期的相对含量分别为38.8%、68.1%、28.9%,其次是MONO,相对含量分别为30.1%、11.9%、37.3%。其中,优势PLFAs种类是iC15:0 (18.9%)、a16:0 (12.4%)、18:1ω7t (10.2%)、16:1ω7t (11.0%)(表1)。同时,不同生长期群落组成差异较大,SAT的相对含量在苗期、吐絮期与CK相比分别增加了3.83倍与12.9倍,但蕾期均减少了62.4%;TBSAT相对含量在苗期、蕾期均表现为增加,但吐絮期表现为减少;MONO、PUFA和MBSAT的相对含量在3个时期均表现为减少趋势。
| 序号 Number |
名称 Name |
苗期 Seeding | 蕾期 Bud | 吐絮 Opening | |||
| Control | Rhizosphere | Control | Rhizosphere | Control | Rhizospher | ||
| 1 | c14:0 | 0 | 1.030 | 0 | 1.320 | 0.887 | 2.270 |
| 2 | c15:0 | 3.190 | 11.600 | 0 | 0 | 9.990 | 0.709 |
| 3 | c16:0 | 0 | 2.810 | 7.450 | 0 | 23.200 | 0 |
| 4 | c18:0 | 0 | 1.180 | 0 | 1.470 | 10.200 | 0 |
| 5 | i13:0 | 0 | 0 | 0 | 0 | 5.420 | 0 |
| 6 | i15:0 | 23.000 | 23.700 | 27.400 | 30.200 | 2.830 | 22.100 |
| 7 | i16:0 | 0 | 0.882 | 0 | 0 | 0 | 0 |
| 8 | a14:0 | 0 | 5.920 | 0 | 15.400 | 0 | 0 |
| 9 | a16:0 | 7.580 | 8.270 | 30.500 | 22.500 | 6.560 | 6.780 |
| 10 | n16:0 | 0 | 0 | 0 | 0 | 2.770 | 3.340 |
| 11 | 2me14:0 | 0 | 0 | 0 | 0.982 | 0 | 0 |
| 12 | 9me14:0 | 0 | 1.110 | 0 | 13.200 | 0 | 16.500 |
| 13 | 10me18:0 | 17.200 | 1.650 | 0 | 0 | 0 | 0 |
| 14 | 9me16:0 | 0 | 0 | 21.900 | 0 | 0 | 0 |
| 15 | i16:1ω5 | 0 | 2.420 | 0 | 0 | 0 | 0 |
| 16 | 16:1ω7t | 0 | 11.800 | 10.800 | 6.130 | 15.200 | 15.700 |
| 17 | 18:1ω9c | 16.100 | 15.900 | 0 | 4.160 | 10.600 | 0 |
| 18 | 18:1ω9t | 21.900 | 0 | 1.940 | 1.580 | 7.490 | 21.600 |
| 19 | 18:2ω6,9 | 8.150 | 0.891 | 0 | 0 | 4.810 | 8.080 |
| 20 | cy16:0 | 2.840 | 4.920 | 0 | 3.140 | 0 | 2.820 |
| 21 | cy18:0 | 0 | 5.900 | 0 | 0 | 0 | 0 |
| SAT | 3.19 | 16.70 | 7.45 | 2.79 | 44.30 | 2.98 | |
| TBSAT | 30.60 | 38.80 | 57.90 | 68.10 | 14.80 | 28.90 | |
| MONO | 38.00 | 30.10 | 12.70 | 11.90 | 33.30 | 37.30 | |
| PUFA | 2.270 | 0.892 | 0 | 0 | 4.820 | 8.080 | |
| CYCLO | 2.84 | 10.80 | 0 | 3.14 | 0 | 2.82 | |
| MBSAT | 17.20 | 2.75 | 21.90 | 14.20 | 0 | 16.50 | |
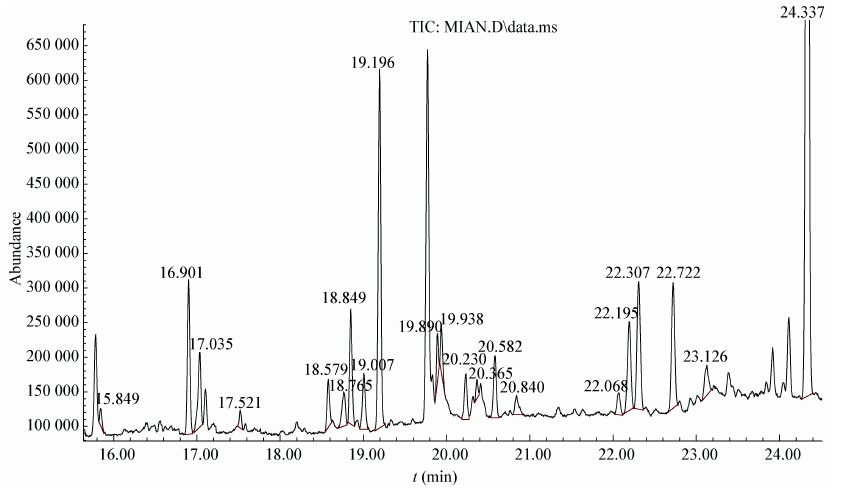
因子分析(图2A)表明根际与CK土壤微生物群落组成的差异性。对不同生长期土壤微生物PLFAs相对含量进行PCA分析(图2B)。根据主成分个数提取原则(特征值>1的前n个主成分),提取土壤微生物PLFAs主成分的特征根及方差贡献率,选取方差贡献率最高的主成分1 (PC1)可解释变量的29.0%和主成分2 (PC2)可解释变量的24.8%。由图2可知,苗期根际土壤与CK土壤微生物的差异主要是c16:0、c15:0、c18:0标识的细菌和16:1ω7、18:1w9c标识受环境营养胁迫的G−菌[20];蕾期微生物种类的差异较多,主要表现为cy18:0、cy16:0、i16:1w5标识受环境营养胁迫的G−细菌和i16:0、a14:0、9me16:0、2me14:0等标识的具有较高TPH降解功能的G+细菌[21];吐絮期的差异主要表现为i15:0、a16:0标识的G+细菌和18:1w9t、18:2w6,9标识的真菌类型。
|
| 图 2 土壤微生物PLFAs的主成分分析(PCA)及因子分析 Figure 2 Principal component analysis (PCA) of PLFAs of the soils microorganism and the factors Note: A: PLFAs of soil microbe. B: soils sample; seeding-CK,bud-CK,opening-CK indicated soil sample in seeding,bud,and opening periods among the control without growth of cotton; seeding-root,bud-root,opening-root represent of the sample soils in seeding,bud,and opening periods cotton growth. |
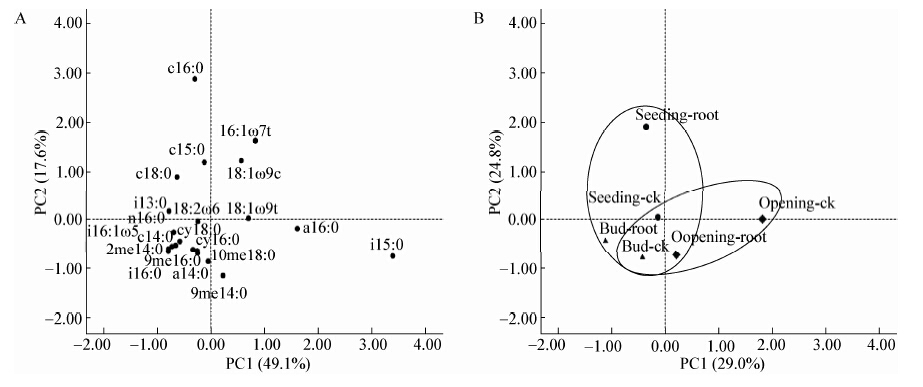
由图3可知,棉花生长的苗期、蕾期、吐絮期,根际土壤活性微生物生物量(∑PLFAs)分别为25.700、6.350和36.000 nmol/g,其中,细菌∑PLFAs分别为24.800、5.410和27.000 nmol/g;真菌∑PLFAs分别为0.215、0和2.680 nmol/g;放线菌∑PLFAs分别为0.681、0.949和6.310 nmol/g;CK土壤,相应的3个时期活性微生物生物量分别为:16.700、0.840、22.400 nmol/g,其中,细菌∑PLFAs分别为12.700、0.660和21.400 nmol/g;真菌∑PLFAs分别为:1.340、0和1.010 nmol/g;放线菌∑PLFAs分别为:2.670、0.180和0 nmol/g。
|
| 图 3 棉花根际与对照土壤活性微生物生物量变化情况 Figure 3 Changes of different microbial biomass in cotton rhizosphere and the control soil |
从图4可知,棉花生长对根际土壤TPH的降解具有明显的促进作用。整个生长期根际土壤石油烃的总降解率为72.3%,其中,苗期为22.6%,蕾期为38.2%,吐絮期为42.2%;CK土壤中石油烃的总降解率为28.3%,与棉花生长相对应的3个时期,石油烃的降解率分别为9.64%、10.2%和11.6%。

|
| 图 4 棉花根际与对照土壤石油烃浓度变化情况 Figure 4 Changes of TPH concentration in the cotton rhizosphere and the control soil |
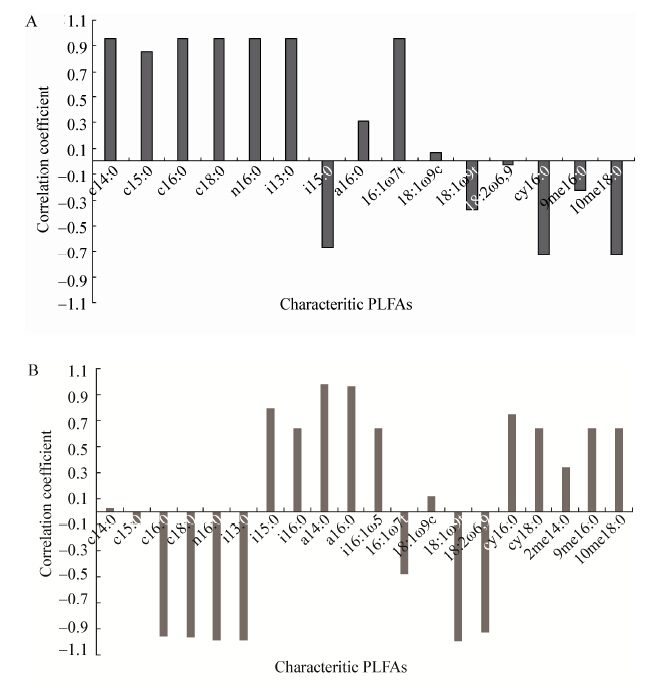
|
|
图 5
石油烃降解与特征PLFAs相对含量的相关系数
Figure 5
Pearson correlation coefficient of the ratio of the TPH degradation to the relative content of microbial PLFAs
注:A:没植物的对照组;B:棉花根际. Note: A: control soil (CK); B: cotton rhizosphere soil. |
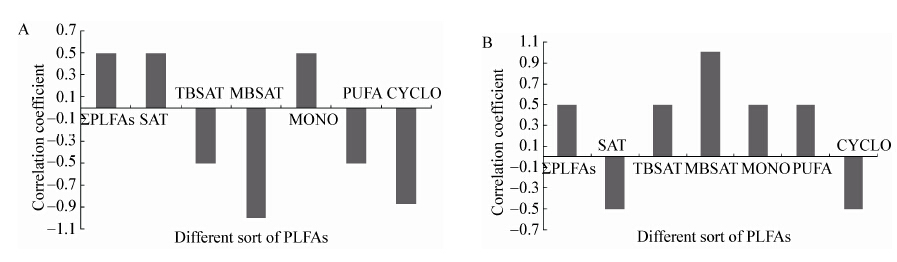
|
|
图 6
石油烃降解率与不同土壤微生物类群生物量的相关系数
Figure 6
Pearson correlation coefficient of TPH degradation to the biomass of soil microbial varieties
注:A:没植物的对照组;B:棉花根际. Note: A: control soil (CK); B: cotton rhizosphere soil. |
在棉花的整个生长期内,根际土壤的pH在 3个生长期分别为9.05、9.04、8.45,降低6.63%;EC在3个生长期分别为306、306、292 µs/cm,降低4.52%。CK土壤pH 8.93±0.50,EC 306.00± 2.53 µs/cm均没有明显(P>0.05)变化。
3 讨论 3.1 棉花生长对石油污染盐碱土壤微生物群落结构的影响结果表明,棉花根际土壤微生物群落的种群结构及其生物量均有很大程度的变化。与CK相比,不同生长期棉花根际土壤微生物PLFAs种类分别增加了100%、83.3%和20.0%,生物量(∑PLFAs)分别增加了53.9%、6.6倍和60.7%。整个生长期,棉花根际土壤细菌、真菌和放线菌∑PLFAs分别增加64.4%,23.9%和1.79倍。主成分分析表明,苗期土壤中标识环境胁迫的类群较多,随着生长期的延长具有TPH降解功能的i15:0、a14:0、a16:0标识的G+菌类群增加。根际土壤微生物群落种类和生物量增加的主要原因,可以归结为根系的分泌物不断增加土壤有机质含量。Reilley等[13]研究发现PAHs污染土壤中,根际土壤微生物数量比非根际土壤高10−100倍。颜家保等[22]认为土壤中营养物质较多时,真菌具有高的活性和生长率,而在营养不足时,真菌的量较少。棉花生长对根际土壤中不同物质的代谢与吸收作用改善了土壤环境条件,降低了TPH和盐碱等对环境的胁迫作用是不同生长期微生物的不同类群发生改变的主要因素。Hegde等[23]和Fletcher等[24]研究表明,植物种类和植物发育阶段不同,根系分泌物的类型与分泌量将有很大差异,因此,选择性地促进了某些类型微生物的生长。涂书新等[25]研究表明植物种类不同根系分泌物相差很大,不同植物根系分泌物对根际微生物的种类、种属、品种及其生理特征产生很大影响。研究[26]表明真菌具有降解各种有机污染物的巨大能力。
3.2 棉花根际微生物与土壤TPH降解的相关性Spearman分析表明:CK土壤TPH降解与46.7%的特征PLFAs类型呈高度正相关关系,根际土壤与15.0%的特征PLFAs类型呈高度正相关关系。CK土壤TPH的降解率与土壤微生物生物总量(∑PLFAs)、细菌(SAT)和革兰氏阴性菌(MONO)的生物量有中度正相关关系,相关系数均为|r|=0.50;棉花根际TPH降解率与放线菌(MBSAT)的生物量高度正相关(|r|=1.0),与真菌(PUFA)、G+菌(TBSAT)和G−菌(MONO)的生物量有中度正相关关系0.3≤|r|<0.8。表明根际土壤TPH的降解取决于多种群微生物的联合作用。Zhang等[27]认为大多数情况下,污染物的降解往往有一组微生物联合进行。由于根际土壤微生物种类多样性和生物量的增加,尤其是真菌、放线菌的增加,使根际土壤TPH的降解明显提高。整个生长期,根际土壤与CK相比TPH降解率提高了44.0%。同时,由于不同生长期棉花根系分泌物性质与分泌量会有一定的差异,不同的分泌物选择性地促进了降解菌的生长,提高了降解菌的代谢机能。根际土壤苗期、蕾期、吐絮期TPH的降解量分别提高了13.0%、28.0%和30.5%。Kirk等[28]报道,在TPH类污染物胁迫下,植物根际具有降解功能的菌群数量比对照土壤中增加,TPH的降解速率随微生物群落组成与生物量的增加而提高。Gao等[29]和Lu等[30]认为,根的表面能为微生物的生长提供更大的生存空间,根的分泌物能不断刺激根际微生物的种类、数量与代谢活性发生改变,不同根际环境形成特定的微生物群落,从而加速污染物的生物代谢降解过程。黄建等[31]报道4种盐生植物生长在不同浓度TPH污染土壤。生长4个月后,土壤石油烃降解率在鞑靼滨藜根际土壤为32.3%−63.5%,盐地碱蓬根际为25.3%−61.0%,野榆钱菠菜根际土壤为33.3%−58.5%,盐角草根际土壤为49.0%−54.0%。棉花根际土壤TPH的降解率(72.3%)与其相比较高。分析其原因可概括为棉花生长对土壤pH (降低6.63%)和EC (降低4.52%)产生了较大的影响,从而改变污染物的可降解性。Reid等[32]认为土壤的pH和氧化还原电位是影响土壤有机污染物可吸收性的主要因素。另一方面,棉花属直根系植物,根系发达,能深入较深的土层吸收水分和营养物质,耐盐性和抗旱能力较强,生物量比野榆钱菠菜等大,通过代谢、生长活动对根际微生物产生更大的影响。杨勇等[33]认为植物对有机污染物的修复作用,其中80%的污染物被根际微生物降解,而约有20%被植物同化。棉花是否对TPH具有同化作用及其作用大小,还有待今后进一步深入研究。
4 结论(1) 棉花生长对根际土壤微生物群落结构具有显著的影响,不同生长期根际土壤微生物种类与生物量均高于对照组。微生物PLFAs种类,苗期增长幅度最大(100%),蕾期(83.3%)、吐絮期最小(20.0%);微生物∑PLFAs在苗期、蕾期和吐絮期分别增加了53.9%、6.6倍和60.7%。
(2) 棉花生长对土壤TPH降解及其相关菌群具有显著影响。根际土壤TPH降解率提高44.0%,且随生长期的延长呈现梯度性增加,苗期(13.0%)<蕾期(28.0%)<吐絮期(30.6%)。根际土壤TPH的降解与MBSAT标记的放线菌、TBSAT标记的G+菌、MONO标记的G−菌、PUFA标记的真菌等菌群的共同作用相关(0.5≤|r|≤1.0)。其中,i15:0、a14:0 、a16:0标记的G+菌是主要的降解菌(|r|≥0.8)。
| [1] | Madigan MT, Martinko JM, Parkerer J. Brock-Biology of microorganisms[M]. 9th edition. London: Prentice Hall, 1999: 53-55 |
| [2] | Tunlid A, Barid BH, Trexler MB, et al. Determination of phospholipid ester linked fatty acid and polyβ- hydroxybuty rate for the stimulation of bacterial biomass and activity in the rhizosphere of the rape plant Brassicanapus[J]. Canadian Journal of microbiology, 1985, 31(12): 1113-1119 |
| [3] | Vestal JR, White DC. Lipid analysis in microbial ecology: quantitative approaches to the study of microbial communities[J]. Bioscience, 1989, 39(8): 535-541 |
| [4] | Wu JS, Lin QM, Huang QY, et al. Measurement methods and application of soil microbial biomass[M]. Beijing: Meteorological Press, 2006: 102-116 (in Chinese) 吴金水, 林琦美, 黄巧云, 等. 土壤微生物生物量测定方法及应用[M]. 北京: 气象出版社, 2006: 102-116 |
| [5] | Ludvigsen L, Albrechtsen H, Ringelberg DB, et al. Distribution and composition of microbial populations in a landfill leachate contaminated aquifer (Grindsted, Denmark)[J]. Microbial Ecology, 1999, 37(3): 197-207 |
| [6] | Albrechtsen HJ, Heron G, Christensen TH. Limiting factors for microbial Fe(Ⅲ) reduction in a landfill leachate polluted aquifer (Vejen, Denmark)[J]. FEMS Microbiol Ecology, 1995, 16(3): 233-247 |
| [7] | Ibekwe AM, Kennedy AC. Fatty acid methyl ester (FAME) profiles as a tool to investigate community structure of two agricultural soils[J]. Plant and soil, 1999, 206(2): 151-161 |
| [8] | Romaniuk R, Giuffre L, Costantini A, et al. Assessment of soil microbial diversity measurements as indicators of soil functioning in organic and conventional horticulture systems[J]. Ecological Indicators, 2011, 11(5): 1345-1353 |
| [9] | Shi Y, Wang ZQ, Zhang XY, et al. Effects of nitrogen and phosphorus addition on soil microbial community composition in temperate typical grassland in Inner Mongolia[J]. ActaEcologica Sinica, 2014, 34(17): 4943-4949 (in Chinese) 施瑶, 王忠强, 张心昱, 等. 氮磷添加对内蒙古温带典型草原土壤微生物群落结构的影响[J]. 生态学报, 2014, 34(17): 4943-4949 |
| [10] | Kong WD, Zhu YG, Fu BJ, et al. A review on microbial gene and community diversity in agricultural soil[J]. Acta Ecologica Sinica, 2004, 24(12): 2894-2900 (in Chinese) 孔维栋, 朱永官, 傅伯杰, 等. 农业土壤微生物基因与群落多样性研究进展[J]. 生态学报, 2004, 24(12): 2894-2900 |
| [11] | Grayston SJ, Prescott CE. Microbial communities in forest floors under four tree species in coastal British Columbia[J]. Soil Biology and Biochemistry, 2005, 37(6): 1157-1167 |
| [12] | Lynch JM, Whipps JM. Substrate flow in the rhizosphere[J]. Plant and Soil, 1990, 12(9): 1-10 |
| [13] | Reilley KA, Banks MK, Schwab AP. Dissipation of polycyclic aromatic hydrocarbons in the rhizosphere[J]. Journal of Environmental Quality, 1996, 25(2): 212-219 |
| [14] | Lu RK. Method of analysis in soil and agro-chemistry[M]. Beijing: Agricultural Science and Technology Press, 2000: 145-149 (in Chinese) 鲁如坤. 土壤农化分析[M]. 北京: 农业科学与技术出版社, 2000: 145-149 |
| [15] | Riser-Roberts E. Remediation of petroleum contaminated soils: biological, physical, and chemical process[M]. Boca Raton London New York Washington, DC: Lewis Publishers, 1998: 213-218 |
| [16] | Bligh EG, Dyer WJ. A rapid method for total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917 |
| [17] | Zhang HX, Wang XY, Qi HY. Development in research methods of microbial ecology[J]. Acta Ecologica Sinica, 2003, 29(5): 988-995 (in Chinese) 张洪勋, 王晓谊, 齐鸿雁. 微生物生态学研究方法进展[J]. 生态学报, 2003, 29(5): 988-995 |
| [18] | Jiao HH, Liu, Y, Jin DC, et al. Effect of Pharbitisnil (Linn.) Choisy growth on the microbial community and petroleum hydrocarbon degradation in petroleum contaminated saline-alkali soil[J]. Acta Scientiae Circumstantiae, 2013, 33(12): 1-8 (in Chinese) 焦海华, 刘颖, 金德才, 等. 牵牛花对石油污染盐碱土壤微生物群落与石油烃降解的影响[J]. 环境科学学报, 2013, 33(12): 1-8 |
| [19] | Liu C, Liu YK, Jin GZ. Seasonal dynamics of soil microbial biomass in six forest types in Xiaoxing-an Mountains, China[J]. Acta Ecologica Sinica. 2014, 34(2): 451-459 (in Chinese) 刘纯, 刘延坤, 金光泽. 小兴安岭6 种森林类型土壤微生物量的季节变化特征[J]. 生态学报, 2014, 34(2): 451-459 |
| [20] | Wang XJ, Zhou YM, Jiang XJ, et al. Effects of warming on soil microbial community structure in Changbai Mountain Tundra[J]. Acta Ecologica Sinica, 2014, 34 (20): 5706-5713 (in Chinese) 王学娟, 周玉梅, 江肖洁, 等. 增温对长白山苔原土壤微生物群落结构的影响[J]. 生态学报, 2014, 34(20): 5706-5713 |
| [21] | Fang J, Barcelona MJ. Structural determination and quantitative analysis of bacterial phospholipids using liquid chromatography/ electrospray ionization/ mass spectrometry[J]. Journal of Microbiological Methods, 1998, 33(1): 23-35 |
| [22] | Yan JB, Wang QF, Wei X. Biodegradation Characteritics of DBP by Elizabethkingia sp. DBP-WUST[J]. Journal of Xuzhou institute of technology (Natural science edition), 2012, 27(3): 16-20 (in Chinese) 颜家保, 王巧凤, 魏鑫, 等. Elizabethkingia sp. DBP-WUST对令苯二甲酸二丁脂的降解特性研究[J]. 徐州工学院学报: 自然科学版, 2012, 27(3): 16-20 |
| [23] | Hegde RS, Fletcher JS. Influence of plant growth wage and season on the release of root phenolics by mulberry as related to development of phytoremediation technology[J]. Chemosphere, 1997, 32(13): 2471-2479 |
| [24] | Fletcher JS, Hedge RS. Release of phenols by perennial plant roots and their potential importance in bioremediation[J]. Chemosphere, 1995, 31(4): 3009-3016 |
| [25] | Tu SX, Sun JH, Guo ZF, et al. On relationship between root exudates and plant nutrition in rhizosphere[J]. Soil and Environmental Sciences, 2000, 9(1): 64-67 (in Chinese) 涂书新, 孙锦荷, 郭智芬. 植物根系分泌物与根际营养关系评述[J]. 土壤与环境, 2000, 9(1): 64-67 |
| [26] | Lin L, Cui J, Chen XP, et al. Effects of reclamation on tidal flat and land use on soil microbial community[J]. Acta Ecologica Sinica, 2014, 34(4): 899-906 (in Chinese) 林黎, 崔军, 陈学萍, 等. 滩涂围垦和土地利用对土壤微生物群落的影响[J]. 生态学报, 2014, 34(4): 899-906 |
| [27] | Zhang YX, Tao S. Global atmospheric emission inventory of polycyclic aromatic hydrocarbons (PAHs) for 2004[J]. Atmospheric Environment, 2009, 43(4): 812-819 |
| [28] | Kirk JL, Beaudette LA, Hart M. Methods of studying soil microbial diversity[J]. Journal of Microbiological Methods, 2004, 58(2): 169-188 |
| [29] | Gao YZ, Zhu LZ. Plant uptake, accumulation and translocation of phenanthrene and pyrene in soils[J]. Chemosphere, 2004, 55(9): 1169-1178 |
| [30] | Lu H, Zhang Y, Liu B, et al. Rhizodegradation gradients of phenanthrene and pyrene in sediment of mangrove (Kandelia candel (L.) Druce)[J]. Journal of Hazardous Materials, 2011, 196(20): 263-269 |
| [31] | Huang J, Tian CY, Bian WG, et al. Response of growth of four halophyte species in oil contaminated soil[J]. Arid zone research, 2014, 31(1): 100-104 (in Chinese) 黄建, 田长彦, 卞卫国, 等. 4种盐生植物生长对土壤石油污染的响应[J]. 干旱区研究, 2014, 31(1): 100-104 |
| [32] | Reid BJ, Jones KC, Semple KT. Bioavailability of persistent pollutants in soils and sediments-a perspective on mechanisms, consequences and assessment[J]. Environmental Pollution, 2000, 108(1): 103-112 |
| [33] | Yang Y, He YM, Luan JL, et al. Comprehensive analysis on soil remediation technologies of international contaminated sites[J]. Environmental Science & Technology, 2012, 35(10): 92-98 (in Chinese) 杨勇, 何艳明, 栾景丽, 等. 国际污染场地土壤修复技术综合分析[J]. 环境科学与技术, 2012, 35(10): 92-98 |
 2015, Vol. 42
2015, Vol. 42