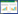扩展功能
文章信息
- 李亮, 武洪庆, 马朝阳, 任亮, 王璐欣, 齐树亭
- LI Liang, WU Hong-Qing, MA Chao-Yang, REN Liang, WANG Lu-Xin, QI Shu-Ting
- 印度梨形孢促进蒺藜苜蓿生长及其提高耐盐性研究
- Growth promotion and salt tolerance induction by Piriformospora indica colonization in Medicago truncatula
- 微生物学通报, 2015, 42(8): 1492-1500
- Microbiology China, 2015, 42(8): 1492-1500
- 10.13344/j.microbiol.china.140749
-
文章历史
- 收稿日期: 2014-10-04
- 接受日期: 2015-04-07
- 优先数字出版日期(www.cnki.net): 2015-05-08
土壤盐碱化是威胁农业生产的主要问题之一。植物在盐碱化土壤中生长,会在根部积累过多的钠离子,造成植物根际损害,进而波及到地上部分,严重影响植物新陈代谢,减缓生长速率,最终降低生物产量。植物在长期进化过程中形成了自我保护机制以抵御盐害胁迫[1]。另外,植物还可以通过与根部内生真菌形成互惠共生的菌根体,从而抵御盐胁迫并能提高生物产量[2]。
印度梨形孢(Piriformospora indica)由印度科学家于1998年首次在印度西北地区的塔尔沙漠中发现[3]。该菌是一种能够定殖在多种植物根部的内生真菌,属担子菌门(Basidiomycota),层菌纲(Hymenomycetes),蜡壳耳目(Sebacinales),梨形孢属(Piriformospora)[4]。印度梨形孢的优点是可以在人工培养基上生长并能顺利完成其生活史,无性繁殖形成包含8−25个核的厚垣孢子。该菌的寄主范围极其广泛,包括大麦、小麦、水稻等单子叶植物和拟南芥等双子叶植物[5,6,7]。印度梨形孢能促进植物对养分的吸收,显著提高大麦,拟南芥等植物根、茎的生物量[6,8,9]。Yadav等[10]发现,印度梨形孢体内包含一种磷转运蛋白,可促进植物根部对磷元素的吸收,为植物提供必需的养分。印度梨形孢与拟南芥的互作研究显示,该菌可提高硝酸还原酶活性,并能固定土壤中氮元素[11]。另外,研究表明印度梨形孢可增强植物对腐生真菌黄色镰孢(Fusarium culmorum)和禾旋孢腔菌(Cochliobolus sativus)的抗性[12,13],并诱导大麦及拟南芥对白粉菌(Erysiphe)的系统抗性[14]。印度梨形孢作为一种生物防治因子和土壤改良因子,其生物学效应及其作用机制是当前研究的热点[15]。如何利用植物与印度梨形孢的互惠共生关系提高植物在盐渍土壤中的生产力是盐渍化土壤改良方向的一个新课题。
蒺藜苜蓿是重要的优良栽培牧草,具有很强的科研价值:如倍性小(2n=16)、基因组小(全基因组470 Mb)、自花授粉、植株再生时间较短、遗传转化效率高等特点[16]。该植物是豆科植物遗传学的模式生物,因其所具有的特点受到科研工作者的青睐。然而面对不断恶化的土壤环境,如何提高该类牧草在高盐度土壤中的适应性,是确保动物饲料品质、产量以及进行盐碱地改良亟待解决的课题。
植物在长期的进化过程中形成了一系列的防御机制以抵御外界不良环境。盐胁迫、干旱和极端温度都会诱导活性氧(过氧化物、过氧化氢和羟基自由基)[17]的积累,植物体则可通过提高抗氧化物酶活性来分解这些氧自由基。但如果氧自由基的数量超过植物能承受的范围,植物细胞就会受到损 害[18,19,20]。在抵御外界环境胁迫时,植物体通常会累积渗透调节物质以减轻胁迫压力。如正常条件下植物的游离脯氨酸含量很低,但在干旱、高温、低温、盐碱、水涝等不良环境下则会大量积累[21]。甜菜碱作为另一种非毒性的渗透调节剂,在盐碱或缺水的环境下能在植物细胞中大量积累[22]。在植物中,甜菜碱通过胆碱单氧化物酶及甜菜碱醛脱氢酶(Betaine aldehyde dehydrogenase,BADH)催化胆碱而合成。综上所述,渗透调节剂不但能调节植物细胞的渗透压,还在稳定生物大分子结构、降低细胞酸性、解除氨毒以及作为能量库调节细胞氧化还原势等方面发挥重要作用。本研究通过检测抗氧化物酶活性、脯氨酸含量以及甜菜碱合成途径关键基因BADH的表达等生理生化指标,初步探讨印度梨形孢介导蒺藜苜蓿耐盐性机制。
1 材料与方法 1.1 材料蒺藜苜蓿(Medicago truncatula)种子由美国华盛顿州立大学作物及土壤科学系(Washington State University,Department of Crop and Soil Sciences) Diter Von Wettstein教授惠赠。
印度梨形孢(Piriformospora indica)由德国吉森大学植物病理研究所(Institute of Pathology and Applied Zoology,IPAZ,Giessen) Karl-Heinz Kogel教授惠赠。
1.2 主要试剂和仪器印度梨形孢CM培养基(complete medium),购自美国Sigma公司;蒺藜苜蓿种子培养基(FM)、麦胚凝集素(Wheat Germ Agglutinin,WGA Alexa Fluor® 488)、氮蓝四唑(Nitroblue tetrazolium)、愈创木酚(uaiacol)、酸性茚三酮(ninhydrin),购自北京鼎国昌盛生物技术有限责任公司;甘油(Glycerol)、乙醇(ethanol)、30% H2O2、次氯酸钠(Sodium hypochlorite),购自天津市南开试剂公司六厂。
光学显微镜,奥林巴斯公司(日本);恒温恒湿培养箱(DHP-16-270),上海精密仪器仪表有限公司;721分光光度计,北京普析通用仪器有限责任公司;琼脂糖凝胶电泳仪,北京鼎国昌盛生物技术有限责任公司。
1.3 方法 1.3.1 蒺藜苜蓿种子的处理:吸胀的蒺藜苜蓿种子用3 mL无水浓硫酸浸泡,间歇式搅拌5−12 min,每个种子表面大概有5个斑点时,小心移除浓硫酸,无菌水冲洗5次。酸处理后的种子,用75%的乙醇灭菌3 min,再用20%的次氯酸钠灭菌15 min,无菌水冲洗5−7次。处理1:经表面消毒的种子转入含FM培养基[23]的方形培养皿(12 cm×12 cm)中。用铝箔纸将培养皿避光包好以利于根的萌发,放入恒温恒湿培养箱,培养条件为24°C,16 h光期、8 h暗期,湿度60%,用于印度梨形孢侵染及盐胁迫处理;处理2:经表面消毒的种子转入含灭菌滤纸的培养皿中,保持湿润,24°C萌发,用于印度梨形孢侵染及盆栽盐胁迫处理。 1.3.2 印度梨形孢孢子收集与植物侵染:印度梨形孢接种到CM (complete medium)培养基(一种改良的曲霉培养基)[24],23°C培养3−4周,待菌丝体铺满培养基后,加入0.05% Tween-20溶液3 mL,用无菌玻璃棒反复刮取培养皿表面的菌体,获取孢子悬浮液。用25 μm的微孔膜过滤孢子悬浮液中的菌丝体,3 500 r/min离心7 min,0.05% Tween-20重悬菌体,重复3次。0.05% Tween-20重悬菌体,并在超声波下打散孢子,显微镜下计数,获得孢子浓度为5×105个/mL的孢子悬浮液。待1.3.1中处理1所述的种子萌发后,根长约7 cm时(1周左右),无菌条件下,将上述1 mL孢子悬浮液均匀的滴落在蒺藜苜蓿根表面,对照处理为0.05% Tween-20水溶液。待1.3.1中处理2所述的种子萌发后,用上述的孢子悬浮液对萌发的幼苗进行浸泡(25°C,45 min),对照为0.05% Tween-20水溶液。然后将浸泡后的幼苗转移至蛭石:珍珠岩(2:1)的土壤中进行培养,对照和处理各10盆。 1.3.3 盐胁迫处理:培养皿的处理:待印度梨形孢侵染5 d后,用不同浓度的NaCl溶液(50、75、100、125、150、175 mmol/L)对蒺藜苜蓿根部进行盐胁迫处理:每个培养皿中加入3 mL NaCl溶液;1 d后再加强一次盐胁迫处理。每个处理设置3个重复。所有植株均放置于培养箱,培养条件为24°C,16 h光期、8 h暗期,湿度60%。NaCl溶液处理后的 48 h取样,迅速放入液氮中冷冻后,保存在−80°C备用。实验设计如表1所示。| 处理时间 Treatment time (d) |
1 | 2 | 3 | 4 |
| 7 | − | P. indica* | − | P. indica |
| 12 | − | − | NaCl** | NaCl |
| 13 | − | − | NaCl | NaCl |
| 15 | 酶活性及基因表达分析 | |||
Note: −: Non-treatment; *: P. indica inoculation; **: 3 mL NaCl treatment.
盆栽处理:土培4周后,在接种和未接种印度梨形孢的蒺藜苜蓿根部,每天定时定量浇灌NaCl浓度分别为100、150、200、250 mmol/L的盐溶液200 mL,对照为无菌水。用于分析盐胁迫下印度梨形孢的生物学效应。
1.3.4 根样的固定、染色与显微镜观察:用固定液(20%氯仿,体积比;80%酒精,体积比;0.15%三氯乙酸,质量体积比)固定菌根24 h,无菌水冲洗3次,每次间隔5 min。固定后的菌根在10% KOH溶液中煮沸30 s,然后用PBS缓冲液(pH 7.4)冲洗3次,每次间隔5 min。随后将菌根浸泡在含有10 mg/L麦胚凝集素(Wheat Germ Agglutinin,WGA Alexa Fluor® 488)和0.02% 硅表面活性剂(Silwet L-77)的PBS (pH 7.4)缓冲液中,通过真空侵染的方法使根部染色(侵染条件:25 mmHg持续1 min,反复3次)。染色后的菌根在染色液中再浸泡10 min,用PBS缓冲液冲洗3次。菌根放在载玻片上,通过荧光显微镜检测WGA Alexa Fluor® 488发光(激发波长:470 nm,检测波长:505−530 nm)。 1.3.5 抗氧化物酶活性测定:粗酶液的制备:称取每个处理的植物根部组织0.3 g,加入3.0 mL PBS (pH 7.4)缓冲液研磨匀浆,4°C、10 000 r/min离心15 min,取上清液即为粗酶液。过氧化氢酶(CAT)活性测定通过测定240 nm波长下过氧化氢的消耗作为酶活性单位[25]。超氧化物歧化酶(SOD)活性采用氮蓝四唑光化还原法[26]。过氧化物酶(POD)的活性测定采用愈创木酚法[26]。
1.3.6 酸性茚三酮法测定植物体内脯氨酸含量:样品制备:分别称取各个处理的蒺藜苜蓿幼苗根部组织0.5 g,剪碎后加入适量80%乙醇和少量石英砂,研磨匀浆。匀浆液全部转移至刻度试管中,用80%乙醇洗研钵,将洗液移入相应的刻度试管中,用80%乙醇定容至25 mL,混匀。80°C水浴中提取20 min。向每个提取液中加入0.2 g活性碳和0.4 g的人造沸石,强烈振荡5 min以除去氨基酸的干扰。抽滤,滤液备用。脯氨酸标准曲线制作及脯氨酸含量的测定方法参照文献[26]。
1.3.7 RNA提取、RT-PCR以及目的基因扩增:将不同处理的蒺藜苜蓿分别进行组织研磨。RNA提取方法见参考文献[27]。RT-PCR体系及各物质含量见表2。RT-PCR反应条件:42°C 60 min,95°C 5 min,4°C 5 min,反转录得到的cDNA用于PCR。PCR体系及各物质含量见表3。PCR过程:95°C 5 min;95°C 30 s,55°C 30 s,72°C 1 min,35个循环;72°C 2 min。反应中的内参为Actin (F:5′-AGCAAAAGATGGCAGATGCT-3′;R:5′-ACCTC TTTTGGATTGGGCTT-3′)。特异性BADH引物(F:5′-CACGTGGAAGGTTGTTCCCT-3′;R:5′-CCCA TTCCGCAGCCTTATCA-3′)由北京鼎国生物科技有限公司合成。| 成分及浓度 Composition and concentration |
含量 Content (μl) | |
| Total RNA/mRNA (0.2 g/l) | 12 | |
| Oligo (dT) (10 μmol/L) | 1 | |
| dNTPs (10 mmol/L) | 1 | |
| 5×First-stand synthesis buffer | 4 | |
| Super M-MLV reverse transcriptase RNase (100 U/μl) | 1 | |
| RNase inhibitor (40 U/μl) | 1 | |
| 成分及浓度 Composition and concentration |
含量 Content (μl) | |
| cDNA (0.12 g/l) | 5 | |
| F′ BADH (10 μmol/L) | 1 | |
| R′ BADH (10 μmol/L) | 1 | |
| 10×Taq buffer | 5 | |
| dNTPs (10 mmol/L) | 1 | |
| Taq (2 U/μl) | 1 | |
| ddH2O | 36 | |
印度梨形孢接种蒺藜苜蓿5 d后,经WGA Alexa Fluor® 488染色,在荧光显微镜下可清晰看见印度梨形孢在蒺藜苜蓿根部的定殖,该真菌的厚垣孢子主要集中在根毛和根的表皮细胞中(图1)。

|
|
图 1
印度梨形孢在蒺藜苜蓿根部的定殖
Figure 1
Colonization of Piriformospora indica in the root of Medicago truncatula
注:A:菌丝体(箭头所示),bar=4 mm;B:厚垣孢子(箭头所示),bar=0.1 mm. Note:A:Mycelium (indicated by the arrows),bar=4 mm; B: Chlamydospore (indicated by the arrows),bar=0.1 mm. |
盆栽蒺藜苜蓿盐胁迫实验表明,用盐浓度250 mmol/L NaCl溶液处理1 d后,未经印度梨形孢侵染的蒺藜苜蓿出现轻微的萎蔫症状,而经印度梨形孢侵染的蒺藜苜蓿生长正常。盐胁迫7 d后,对照和接种印度梨形孢的蒺藜苜蓿幼苗均表现出生长迟滞,并伴随一定程度的早衰现象如泛黄、萎蔫。
培养皿培养的蒺藜苜蓿盐胁迫实验表明,用NaCl浓度分别为100、175、250 mmol/L的盐溶液处理7 d后,接种印度梨形孢的蒺藜苜蓿在根长上显著高于未接种的(P<0.01);另外,接种印度梨形孢使茎鲜重分别提高1.17、1.35和1.09倍;而在根鲜重上,仅在NaCl为100 mmol/L和175 mmol/L的浓度下,接种印度梨形孢的蒺藜苜蓿表现出显著性(P<0.01),而当施以250 mmol/L的NaCl时,印度梨形孢介导的根鲜重提高并不明显(图2)。同时,纵观图2,在没有盐害条件下,接种印度梨形孢能显著提高蒺藜苜蓿的根长、根鲜重以及茎鲜重,其提高倍数分别为:1.9、2.2和2.7。
|
| 图 2 盐胁迫下印度梨形孢定殖对蒺藜苜蓿生长的影响 Figure 2 Effect of P. indica colonization on the biomass of Medicago truncatula under salt stress Note: **: P < 0.01; *: P < 0.05. |
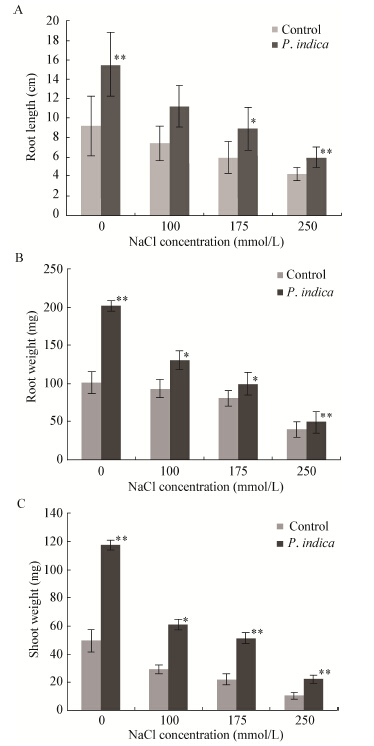
在175 mmol/L中等盐害条件下,分析印度梨形孢定殖对蒺藜苜蓿根部抗氧化物酶活性的影响。实验结果显示其受影响程度分别为:POD > CAT > SOD,相对空白对照,印度梨形孢的定殖在一定程度上诱导了POD、CAT和SOD的活性,并呈现出低程度的诱导,当施加175 mmol/L中盐浓度处理后,接种印度梨形孢的植株其体内POD、CAT和SOD活性比盐胁迫条件下分别提高了42.85%、25%和20%。而POD活性无论是在盐胁迫处理还是在接种印度梨形孢后,酶活性都得到显著提升(图3)。
|
| 图 3 盐胁迫下印度梨形孢定殖对蒺藜苜蓿抗氧化物酶活性的影响 Figure 3 Effect of P. indica colonization on the antioxidant enzyme activities of Medicago truncatula under salt stress Note: *: P < 0.01. |
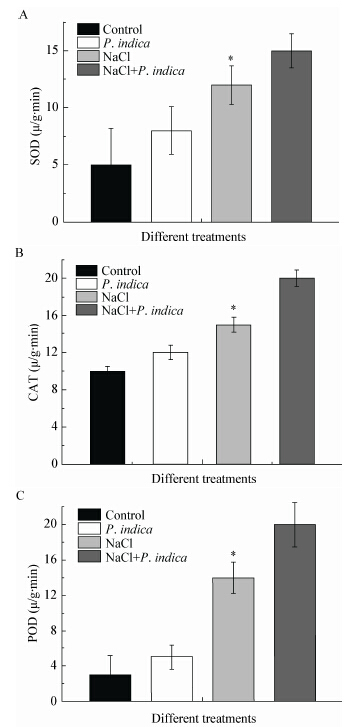
盐胁迫下,比较了接种和未接种印度梨形孢对蒺藜苜蓿根部脯氨酸含量变化的影响。实验结果表明,蒺藜苜蓿根部组织脯氨酸含量随NaCl浓度的升高呈现上升趋势(0−175 mmol/L);相同盐浓度下,接种印度梨形孢的植株根部脯氨酸含量明显高于未接种植株,并且在盐浓度达到125 mmol/L时,脯氨酸含量急剧上升(图4)。该结果显示盐害胁迫下印度梨形孢能促进脯氨酸的进一步积累。
|
| 图 4 盐胁迫下接种印度梨形孢对蒺藜苜蓿脯氨酸含量的影响 Figure 4 Effect of P. indica inoculation on the proline content of Medicago truncatula under salt stress 注解 |
为了检测盐胁迫下接种印度梨形孢对BADH基因表达的影响,通过设计引物并对BADH基因进行了部分片段扩增。实验以Actin基因为内参,通过RT-PCR技术对BADH基因的表达进行半定量分析。结果显示(图5):正常条件下,蒺藜苜蓿并不表达BADH基因(图5B和图5C,泳道0)。当受到盐害胁迫后,BADH基因在未定殖印度梨形孢的蒺藜苜蓿中均有表达,但不同NaCl浓度下的表达差异并不明显(图5B),低盐浓度下(≤100 mmol/L),在接种和未接种印度梨形孢的蒺藜苜蓿体内BADH基因的表达差异并不明显;当盐浓度达到125 mmol/L后,BADH基因的表达量明显提高并显著高于同浓度下的未侵染组。这些结果表明在盐浓 度≥125 mmol/L条件下,印度梨形孢可诱导BADH的高效表达。
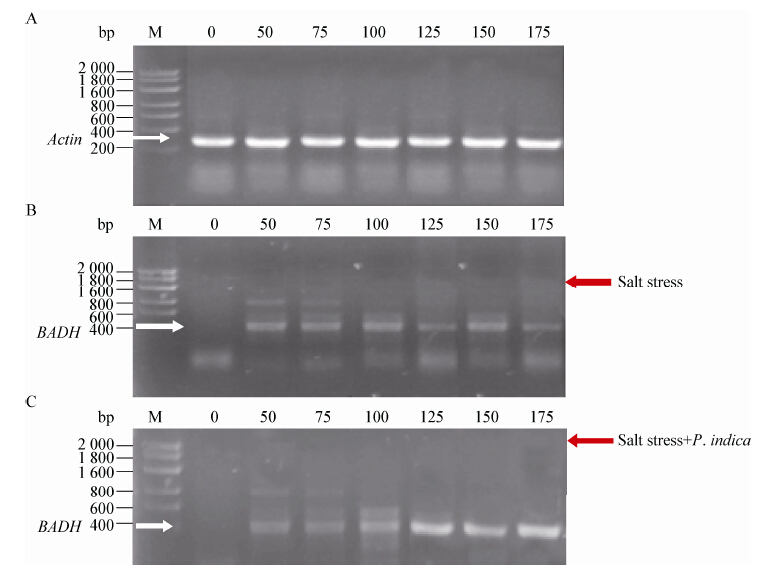
|
| 图 5 盐胁迫下接种印度梨形孢对蒺藜苜蓿BADH基因表达的影响 Figure 5 Effect of P. indica inoculation on the BADH expression of Medicago truncatula under salt stress |
植物体在遭受外界环境胁迫时,通常会累积渗透调节物质以减轻胁迫压力。盐胁迫下,拟南芥和番茄会加强对蔗糖、甘露醇、肌醇、脯氨酸和四氢嘧啶等多种物质的积累[28],而烟草植物除累积蔗糖和肌醇外,还累积葡萄糖和果糖等糖类物质[29]。脯氨酸是最基本的渗透调节物质之一,在逆境条件下,植物体内游离脯氨酸会大量积累,并且积累指数与抗逆性相关[30]。本研究中,当NaCl浓度达到125 mmol/L时,印度梨形孢能促进蒺藜苜蓿中脯氨酸含量的快速积累。分析原因认为125 mmol/L可能是蒺藜苜蓿的盐胁迫耐受点,而印度梨形孢则可激活植物体内免疫系统,通过释放大量脯氨酸以减少盐胁迫对植物细胞结构和功能造成的伤害,从而维持细胞正常的代谢活动。
3.2 印度梨形孢促进甜菜碱醛脱氢酶基因的表达甜菜碱作为另一种非毒性渗透调节剂,在植物遭受盐害胁迫等逆境胁迫下,对植物起到保护作用。催化甜菜碱合成的甜菜碱醛脱氢酶在马铃薯及烟草中表达能提高植物的耐盐性[31,32]。过量表达BADH基因,可增加甜菜碱醛脱氢酶的含量,从而增加甜菜碱的合成这是过表达该基因提高植物耐盐性的原因。本研究中发现,该基因在正常条件下未见表达。当NaCl浓度达到50−175 mmol/L范围时,半定量分析结果显示该基因受到诱导表达,但表达量并没有显著差异。然而,当接种印度梨形孢后,在盐浓度达到125 mmol/L时,BADH基因表达量显著上调。由此表明,盐胁迫下,印度梨形孢可通过诱导蒺藜苜蓿BADH基因的进一步表达。孙超[33]研究结果显示一类抗旱相关转录因子(DREB2A,ANAC072)和干旱相关蛋白(CBL1,RD29A)在接种印度梨形孢后表达量明显上调。本实验中接种印度梨形孢能诱导BADH基因的高效表达,这也给我们启发:干旱同时也伴随着土壤盐含量升高,推测印度梨形孢提高植物耐盐性是通过诱导某种或某些逆境基因的协同表达而实现的,此方面工作还有待于进一步研究。
3.3 印度梨形孢提高抗氧化物酶活性植物处于逆境条件(干旱、盐胁迫和极端温度)下,体内会产生大量活性氧:如O2−、H2O2和OH。当植物体内堆叠大量的有害自由基时,体内抗氧化物酶如超氧歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)会移除掉自由基和氧化中间产物,以此减少对细胞的损害。Ghorbani等[34]发现盐胁迫下,菌根植物体内SOD和POD活性比非菌根植物显著提高。在本实验中,我们检测到抗氧化物酶活性受到印度梨形孢的诱导。因而推测SOD和POD等抗氧化酶活性的提高是印度梨形孢介导植物耐盐的机制之一。
3.4 印度梨形孢抑制根对钠离子的吸收盐胁迫下,钠离子过多往往排斥植物对其他离子的吸收。植物对离子的不平衡吸收,会使植物营养失调,抑制生长[35]。有报道称印度梨形孢可以增强植物对营养物质特别是对磷的吸收,调节植物体内元素平衡,抑制过量钠盐在植株体内的积累[36]。我们通过对蒺藜苜蓿根长、根鲜重以及茎鲜重的统计分析,发现该真菌能显著提高蒺藜苜蓿的生物产量,并能缓解由于盐胁迫带来的生长抑制。进一步的,通过分析蒺藜苜蓿根部细胞液中钠离子含量,发现接种印度梨形孢的根组织,钠离子含量小于对照组(实验数据未显示)。综合上述实验结果,推测印度梨形孢和植物互作过程中,该真菌或通过分泌多种酶类和某些活性物质促进培养基中有机物质的分解,或通过改变植物体内碳水化合物和氨基酸等物质的含量和组成,调节根组织中的渗透平衡,以此减少植物对Na+和Cl−离子的吸收,减轻由钠盐引起的毒害。
3.5 展望改善植物吸水能力或提高水分利用效率,能间接提高植物耐盐性[35]。另外,根系形态直接影响着植物对矿质营养的吸收,也是决定植物对环境能否适应的因素之一。研究显示[37]丛枝菌与植物形成共生体的过程中,根系分生组织活性受到抑制,根形态发生改变,导致不定根和侧根数量的增加,增强根系的活力。有理由推想印度梨形孢和丛枝菌根真菌介导植物吸水能力方面有异曲同工之妙。今后可开展印度梨形孢介导植物水分吸收及根部形态改变的研究工作。
有研究表明大麦在受到盐害胁迫时,代谢缓慢且呼吸速率下降,因此,热量输出可成为植物耐盐性的一个检测指标[38];同时,盐胁迫下细胞膜受到损害,会引起脂质过氧化,检测脂质过氧化速率也可作为研究印度梨形孢介导植物耐盐反应的一个参数[39]。另外,蒺藜苜蓿为豆科模式植物,豆科植物的根瘤是常见的共生现象,进一步工作可开展印度梨形孢定殖对根瘤着生的影响或促进作用。因此,印度梨形孢如何在生理生化和抗性基因水平方面促进植物耐盐性还有待深入阐明。
4 结论印度梨形孢是一种寄主范围广泛的根部内生真菌,不仅显著促进植物生长,还可有效提高寄主抗生物和非生物胁迫能力。本实验首次研究了印度梨形孢在蒺藜苜蓿中的定殖以及盐胁迫下,印度梨形孢对蒺藜苜蓿生长发育的影响。通过真菌与植物根部互作染色,证明该真菌可以在蒺藜苜蓿根表皮细胞中定殖,能促进植物的生长发育,并且该真菌可有效缓解盐胁迫造成的生长抑制,进一步可促进植物体内抗氧化物酶活性及脯氨酸含量的提高,并诱导BADH基因高效表达。
印度梨形孢是一种可离体培养的根部内生真菌,该菌可从植物体内获取光合产物,同时将其从土壤中吸收的营养物质和水分传递给寄主植物,调节植物的生理生化代谢,减缓盐胁迫对植物的影响,从而促进盐渍化生境下植物的生长,如果可尝试大规模应用,对于间接改良土壤,指导农业生产具有实际意义。
| [1] | Munns R, Tester M. Mechanisms of salinity tolerance[J]. Annual Review of Plant Biology, 2008, 59: 651-681 |
| [2] | Rodriguez RJ, Redman RS, Henson J. The role of fungal symbioses in the adaptation of plants to high stress environments[A]//Dixon RK. Mitigation and Adaptation Strategies for Global Change[M]. Berlin: Springer, 2004: 261-272 |
| [3] | Verma S, Varma A, Rexer KH, et al. Piriformospora indica, gen. et sp. nov., a new root-colonizing fungus[J]. Mycologia, 1998, 90(5): 896-903 |
| [4] | Hibbett DS. A phylogenetic overview of the Agaricomycotina[J]. Mycologia, 2006, 98(6): 917-925 |
| [5] | Qiang X, Weiss M, Kogel KH, et al. Piriformospora indica-a mutualistic basidiomycete with an exceptionally large plant host range[J]. Molecular Plant Pathology, 2012, 13(5): 508-518 |
| [6] | Waller F, Achatz B, Baltruschat H, et al. The endophytic fungus Piriformospora indica reprograms barley to salt-stress tolerance, disease resistance, and higher yield[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(38): 13386-13391 |
| [7] | Schäfer P, Pfiffi S, Voll LM, et al. Manipulation of plant innate immunity and gibberellin as factor of compatibility in the mutualistic association of barley roots with Piriformospora indica[J]. The Plant Journal, 2009, 59(3): 461-474 |
| [8] | Das A, Kamal S, Shakil NA, et al. The root endophyte fungus Piriformospora indica leads to early flowering, higher biomass and altered secondary metabolites of the medicinal plant, Coleus forskohlii[J]. Plant Signaling & Behavior, 2012, 7(1): 103-112 |
| [9] | Peškan-Berghöfer T, Shahollaria B, Giong PH, et al. Association of Piriformospora indica with Arabidopsis thaliana roots represents a novel system to study beneficial plant-microbe interactions and involves early plant protein modifications in the endoplasmatic reticulum and at the plasma membrane[J]. Physiologia Plantarum, 2004, 122(4): 465-477 |
| [10] | Yadav V, Kumar M, Deep DK, et al. A phosphate transporter from the root endophytic fungus Piriformospora indica plays a role in phosphate transport to the host plant[J]. The Journal of Biological Chemistry, 2010, 285(34): 26532-26544 |
| [11] | Sherameti I, Shahollari B, Venus YL, et al. The endophytic fungus Piriformospora indica stimulates the expression of nitrate reductase and the starch-degrading enzyme glucan-water dikinase in tobacco and arabidopsis roots through a homeodomain transcription factor that binds to a conserved motif in their promoters[J]. The Journal of Biological Chemistry, 2005, 280(28): 26241-26247 |
| [12] | Sahay NS, Varma A. Piriformospora indica: a new biological hardening tool for micropropagated plants[J]. FEMS Microbiology Letters, 1999, 181(2): 297-302 |
| [13] | Deshmukh SD, Kogel KH. Piriformospora indica protects barley from root rot disease caused by Fusarium graminearum[J]. Journal of Plant Diseases and Protection, 2007, 114(6): 263-268 |
| [14] | Stein E, Molitor A, Kogel KH, et al. Systemic resistance in Arabidopsis conferred by the mycorrhizal fungus Piriformospora indica requires jasmonic acid signaling and the cytoplasmic function of NPR1[J]. Plant & Cell Physiology, 2008, 49(11): 1747-1751 |
| [15] | Song FM, Mao KK, Wu CC, et al. Biological functions of Piriformospora indica and its action mechanisms[J]. Journal of Zhejiang University, 2011, 37(1): 1-6 (in Chinese) 宋凤鸣, 毛克克, 吴铖铖, 等. 印度梨形孢的生物学效应及其作用机制[J]. 浙江大学学报, 2011, 37(1): 1-6 |
| [16] | Chen AM, Lian RL, Sun J, et al. Leguminous model plant—Medicago truncatula[J]. Plant Physiology and Molecular Biology, 2006, 42(5): 997-1003 ( in Chinese) 陈爱民, 连瑞丽, 孙杰, 等. 豆科模式植物―蒺藜苜蓿[J]. 植物生理学通讯, 2006, 42(5): 997-1003 |
| [17] | Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J]. Annual Review of Plant Biology, 2004, 55: 373-399 |
| [18] | Foyer CH, Noctor G. Oxygen processing in photosynthesis: regulation and signaling[J]. New Phytologist, 2000, 146(3): 359-388 |
| [19] | Hernández JA, Jiménez A, Mullineaux P, et al. Tolerance of pea (Pisum sativum L.) to long-term salt stress is associated with induction of antioxidant defenses[J]. Plant, Cell & Environment, 2000, 23(8): 853-862 |
| [20] | Mittova V, Guy M, Tal M, et al. Salinity up-regulates the antioxidative system in root mitochondria and peroxisomes of the wild salt-tolerant tomato species Lycopersicon pennellii[J]. Journal of Experimental Botany, 2004, 55(399): 1105-1113 |
| [21] | Dun RP, Sharma SK. Suitable genotypes of gram (Cicer arietinum) and mechanism of their tolerance to salinity[J]. The Indian Journal of Agricultural Sciences, 1997, 67(10): 440-443 |
| [22] | Gavaghan CL, Li JV, Hadfield ST, et al. Application of NMR-based metabolomics to the investigation of salt stress in maize (Zea mays)[J]. Phytochemical Analysis, 2011, 22(3): 214-224 |
| [23] | Liu W, Cao LP, Chen AM, et al. Cloning and expression analysis of small GTPase MtROP9 gene in Medicago truncatula[J]. Journal of Northwest A & F University (Natural Science Edition), 2009, 37(6): 210-216 (in Chinese) 刘伟, 曹连莆, 陈爱民, 等. 蒺藜苜蓿小G蛋白MtROP9基因的克隆与表达分析[J]. 西北农林科技大学学报: 自然科学版, 2009, 37(6): 210-216 |
| [24] | Peškan-Berghöfer T, Shahollari B, Giong PH, et al. Association of Piriformospora indica with Arabidopsis thaliana roots represents a novel system to study beneficial plant-microbe interactions and involves early plant protein modifications in the endoplasmic reticulum and at the plasma membrane[J]. Physiologia Plantarum , 2004, 122(4): 465-477 |
| [25] | Gao JF. Plant physiology experiment instruction[M]. Beijing: Higher Education Press, 2006: 214-215 (in Chinese) 高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 214-215 |
| [26] | Li HS. Nitroblue tetrazolium (NBT) method for determining superoxide dismutase (SOD) activity[A]//Principle and technology of plant physiological and biochemical experiments[M]. Beijing: Higher Education Press, 2000: 164-169, 258-260 (in Chinese) 李合生. 氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活力[A]//植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 164-169,258-260 |
| [27] | Qiang X, Zechmann B, Reitz MU, et al. The mutualistic fungus Piriformospora indica colonizes Arabidopsis roots by inducing an endoplasmic reticulum stress-triggered caspase-dependent cell death[J]. The Plant Cell, 2012, 24(2): 794-809 |
| [28] | Zhu JK. Plant salt tolerance[J]. Trends in Plant Science, 2001, 6(2): 66-71 |
| [29] | Zhang J, Zhang Y, Du Y, et al. Dynamic metabonomic responses of tobacco (Nicotiana tabacum) plants to salt stress[J]. Journal of Proteome Research, 2011, 10(4): 1904-1914 |
| [30] | Ashraf M, Foolad MR. Roles of glycine betaine and proline in improving plant abiotic stress resistance[J]. Environmental and Experimental Botany, 2007, 59(2): 206-216 |
| [31] | Si HJ, Zhang N, Wang D. Enhancement of drought and salt resistances in tobacco by transformation of Betaine Aldehyde Dehydrogenase gene[J]. Acta Agronomica Sinica, 2007, 33 (8): 1335-1339 (in Chinese) 司怀军, 张宁, 王蒂. 转甜菜碱醛脱氢酶基因提高烟草抗旱及耐盐性[J]. 作物学报, 2007, 33(8): 1335-1339 |
| [32] | Zhang N, Si HJ, Li L, et al. Drought and salinity tolerance in transgenic potato expressing the betaine aldehyde dehydrogenase gene[J]. Acta Agronomica Sinica, 2009, 35(6): 1146-1150 (in Chinese) 张宁, 司怀军, 栗亮, 等. 转甜菜碱醛脱氢酶基因马铃薯的抗旱耐盐性[J]. 作物学报, 2009, 35(6): 1146-1150 |
| [33] | Sun C. Disease resistance, growth promotion and stress tolerance in Chinese Cabbage conferred by Piriformospora indica and the preliminary study of mechanism[D]. Hangzhou: Master’s Thesis of Zhejiang University, 2010 (in Chinese) 孙超. 印度梨形孢诱导小白菜抗病、促生、抗逆的作用及其机理的初步研究[D]. 杭州: 浙江大学硕士学位论文, 2010 |
| [34] | Ghorbani M, Ebrahimzdeh H, Sharifi M. Effects of NaCl and mycorrhizal fungi on antioxidative enzymes in soybean[J]. Biologia Plantarum, 2004, 48(4): 575-581 |
| [35] | Jin L, Chen GL, Zhao Y, et al. Response of arbuscular mycorrhizal fungi to salt stressed condition and the interrelation between AMF and host plant[J]. Ecology and Enironment, 2007, 16(1): 228-233 (in Chinese) 金樑, 陈国良, 赵银, 等. 丛枝菌根对盐胁迫的响应及其与宿主植物的互作[J]. 生态环境, 2007, 16(1): 228-233 |
| [36] | Wang FR, Mao KK, Li GJ, et al. Piriformospora indica and its related species Sebacina vermifera promote growth and development and phosphorus nutrition in tomato[J]. Journal of Zhejiang University (Agriculture & Life Sciences Edition), 2011, 37(1): 61-68 (in Chinese) 王风让, 毛克克, 李国钧, 等. 印度梨形孢及其近似种Sebacina vermifera促进番茄生长发育及磷吸收[J]. 浙江大学学报: 农业与生命科学版, 2011, 37(1): 61-68 |
| [37] | Gupta R, Krishnamurthy KV. Response of mycorrhizal and nonmycorrhizal Arachis hypogaea to NaCl and acid stress[J]. Mycorrhiza, 1996, 6(2): 145-149 |
| [38] | Schabes FI, Sigstad EE. Calorimetric studies of quinoa (Chenopodium quinoa Willd) seed germination under saline stress conditions[J]. Thermochimica Acta, 2004, 428(1/2): 71-75 |
| [39] | Fadzilla NM, Finch RP, Burdon RH. Salinity, oxidative stress and antioxidant responses in shoot cultures of rice[J]. Journal of Experimental Botany, 1997, 48(2): 325-331 |
 2015, Vol. 42
2015, Vol. 42