扩展功能
文章信息
- 王正荣, 生吉萍, 申琳
- WANG Zheng-Rong, SHENG Ji-Ping, SHEN Lin
- 沙漠生物结皮芽孢杆菌产胞外多糖的纯化及其絮凝性的研究
- Purification and bioflocculant activity characterization of exoploysaccharide from Bacillus thuringiensis in sand biological soil crust
- 微生物学通报, 2015, 42(8): 1453-1457
- Microbiology China, 2015, 42(8): 1453-1457
- 10.13344/j.microbiol.china.140905
-
文章历史
- 收稿日期: 2014-11-12
- 接受日期: 2015-01-20
- 优先数字出版日期(www.cnki.net): 2015-03-06
2. 中国农业大学 食品科学与营养学院 北京 100083
2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China
沙漠生物结皮是在沙漠藻类拓殖作用下由活的微小生物及其代谢产物(胞外多糖)与沙粒组成,是土壤颗粒与有机物紧密结合在土壤表层形成的一种壳状体,是沙漠地区最具特色的微自然景观,遍布于沙漠或荒漠地区,在促进土壤演替、改善表层土壤水分状况,防止土壤侵蚀方面起着重要的作用。在沙漠生物结皮形成过程中,微生物的活动及其分泌的代谢产物,尤其是胞外多糖起到了非常重要的作用[1,2]。微生物胞外多糖指由特定微生物代谢产生的,分泌到培养基中的生物聚合物。目前已大量工业化生产的有黄原胶(Xanthan gum)、结冷胶(Gellangum)、热凝多糖(Curdlan)等,而胞外多糖作为絮凝剂的有效成分也在很多研究中被报道[3,4,5]。
本研究从新疆古尔班通古特沙漠生物结皮中分离筛选到具有絮凝活性的高产胞外多糖的菌株[6],分离纯化其胞外多糖,并对絮凝性进行了测定,为寻找新的微生物絮凝剂提供新的材料来源。
1 材料与方法 1.1 材料不同分子量葡聚糖标准品Dextran,美国Fluka公司;树脂DEAE sepharose CL-6B、Sephadex G100,法玛西亚普强公司;蔗糖、牛肉膏、蛋白胨、NaCl、CaCl2、无水乙醇、氯仿、正丁醇、苯酚、硫酸,国产分析纯试剂。
1.2 主要仪器Sartorius PB-10酸度计,赛多利斯科学仪器(北京)有限公司;UV-1800紫外可见分光光度计,岛津(中国)有限公司;恒流泵,北京博医实验仪器有限公司;BSZ-100自动部分收集器,上海嘉鹏科技有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;1200 series高效液相色谱,安捷伦生命科技有限公司。
1.3 菌株鉴定及胞外多糖的提取菌株在牛肉膏蛋白胨培养基[7]上培养24 h后,呈现黄色不透明的单菌落,表面光滑,凸起,边缘整齐,菌落直径约为2 mm,呈现粘稠状,革兰氏阳性菌,芽孢呈椭圆形。将XJ-27菌株的16S rRNA基因的PCR反应产物送样测序后,得到其序列长度 1 452 bp。使用BLASTn在GenBank基因库中进行同源性搜索,并通过相似性比对,发现菌株与苏云金芽孢杆菌的相似度达到99%以上,初步确定该菌为苏云金芽孢杆菌[6]。
菌株发酵液经4 000 r/min离心15 min,去除菌体,准确吸取上清液,再将预冷2 h的95%乙醇缓慢加入到浓缩液中(体积比4:1),边加边搅拌,有沉淀析出,把醇沉后的溶液放入冰箱中静置过夜。以4 000 r/min离心15 min,弃去上清液。残渣用80%乙醇溶液洗涤,离心后弃去上清液,反复操作3次。残渣用水定容至10 mL,混匀。
1.4 胞外多糖脱蛋白及粗多糖的制备采用改进的Sevage法进行脱蛋白[8,9],具体步骤如下:首先配置Sevage试剂,氯仿:正丁醇=5:1,再将粗多糖制品与sevage试剂以5:1的形式混合,以上均为体积比,混合后,剧烈振荡,静置20−30 min,使混合液完全分层,除去下层的有机溶剂和界面处的蛋白变性胶状物,保留上清液,再按上述比例加入Sevage试剂,如此反复处理4次。脱蛋白后的糖溶液4 °C透析48 h去小分子杂质,浓缩、真空冷冻干燥后获得粗多糖。粗多糖进行蛋白质含量的测定,采用Folin-酚试剂法测定[10],用结晶牛血清白蛋白作标准。
1.5 DEAE sepharose CL-6B 阴离子交换树脂层析纯化参考文献[11]并进行改进,将粗多糖溶于少量的水中,加入到DEAE阴离子层析交换柱中,以浓度为0.5 mol/l的NaCl进行洗脱,流速为0.8 ml/min。用部分收集器进行收集,其中每管收集大约10 ml,通过苯酚硫酸法进行糖含量的测定,并收集多糖部分,进行透析,冷冻干燥后留待下一步纯化,该部分共收集到2个峰,根据收集时间的前后,分别命名为EPS-I和EPS-II。
1.6 凝胶柱Sephadex G100的纯化参考文献[12],选取样品EPS-I,利用Sephadex G100凝胶柱进一步纯化,上样量:1 ml,流速 0.8 ml/min,每隔8 min收集一管,每管约6 ml,洗脱液为0.1 mol/l NH4Ac,自动部分收集,以苯酚-硫酸法跟踪检测。合并峰部的洗脱液,透析后浓缩冻干。采用紫外分光光度法进行扫描,初步确定其纯度。
1.7 胞外多糖EPS-I分子量的测定参考文献[13],采用高效凝胶渗透色谱法(HP-GPC)测定胞外多糖EPS-I的分子量。分析条件:Shodex Sugar KS-805色谱柱;流动相0.1 mol/l NaCl溶液,流速5 ml/min;柱温60 °C,示差折光检测器检测。以标准Dextran T系列葡聚糖作标准曲线,计算分子量。
1.8 多糖含量的测定发酵液经7 000 r/min离心15 min,取2 ml上清液加3倍体积的95%乙醇。4 °C沉淀过夜,7 000 r/min离心15 min去上清液,所得沉淀加入蒸馏水溶解,透析24 h,定容至20 ml,以葡萄糖作为标准曲线,用苯酚硫酸法[14]测定多糖的含量。
1.9 絮凝率的测定[15]在100 ml烧杯中配置4 g/l的高岭土悬浊液50 ml快速搅拌1 min,加入90 mmol/l的CaCl2溶液1 ml,快速搅拌1 min,然后加入1 ml发酵液搅拌0.5 min,静置4 min,小心取上清液测OD550,记为B。同上用空白样操作,不加入发酵液,OD550值记为A,则絮凝率按下式计算:η=(A−B)/A×100%。
2 结果与讨论 2.1 胞外多糖的分离纯化通过第一步醇沉后粗多糖的产量为10.51 g/l,然后利用Sevage法去除蛋白,Folin-酚试剂法测定蛋白质含量为0.142%,相对于其他去除蛋白的方法,Sevage法能很好地除去蛋白,且方法简单,条件温和,不会破坏样品的活性。去除蛋白后的多糖经过透析冷冻干燥后,得到纯白色粉末。
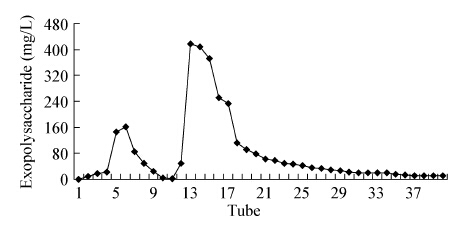
将粗多糖,经DEAE sepharose CL-6B离子交换层析,通过条件摸索,确定洗脱液为0.5 mol/l NaCl,初步分离后,可获得2个洗脱峰,见图 1。从图 1中可见第1个峰出现在5−7管中,第2个峰出现在第15−18管中,其中第2个峰的多糖含量高于第1个。将这两个峰得到的组分依据时间先后分别命名为EPS-I和EPS-II (图 1)。
|
| 图 1 胞外粗多糖DEAE sepharose CL-6B离子交换洗脱图 Figure 1 Elution graph of crude polycaccharide in DEAE sepharose CL-6B column |
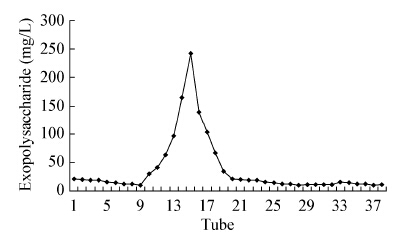
经过DEAE sepharose CL-6B离子交换层析后得到的ESP-I进行收集,浓缩干燥后,再进一步进行Sephadex G100层析纯化,发现EPS-I呈现单一峰,且峰形基本对称,如图 2所示。
|
| 图 2 EPS-I的Sephadex G100凝胶洗脱图 Figure 2 Elution graph of the EPS-I in Sephadex G100 column |
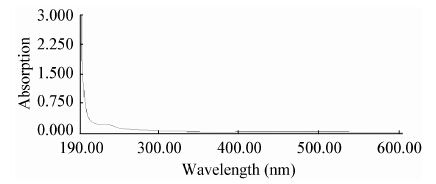
胞外多糖 EPS-I经过α-萘酚显色后,呈阳性反应,表明样品是糖组分。胞外多糖EPS-I溶液经紫外扫描在260 nm和280 nm处未见吸收峰,说明样品中不含蛋白质、多肽和核酸,见图 3。
|
| 图 3 EPS-I的全波长扫描图谱 Figure 3 Result of absorption spectrum of EPS-I |
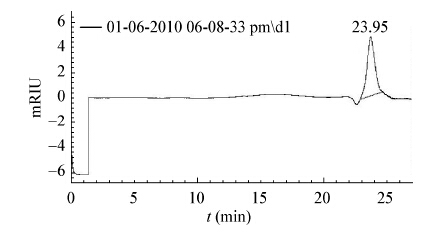
EPS-I经过高效液相凝胶渗透色谱分析显示为单一对称峰,出峰时间为23.95 min,如图 4所示,根据标准葡聚糖洗脱结果,以标准葡聚糖的保留时间为x轴,以分子量的对数为y轴制作标准曲线,所得方程为:y=−0.210 1x+10.794 (R2=0.983 2),y为分子量的对数值,计算得到EPS-I的分子量为575 kD。
|
| 图 4 EPS-I高效液相色谱分析 Figure 4 HPLC analysis of EPS-I |
以高岭土为体系,研究该菌株的絮凝性,经过絮凝活性实验测得微生物胞外多糖对高岭土悬液的絮凝率为80.4%。
3 结论本文通过传统的分离、筛选和纯化方法,得到一株高产胞外多糖的菌株,经鉴定为苏云金芽孢杆菌,对该胞外多糖分别进行DEAE sepharose CL-6B和Sephadex G100层析分离纯化后,共得到2个组分,对其中一个组分EPS-I进行纯度和分子量的分析后,表明组分EPS-I的分子量为575 kD;而且发现了该胞外多糖的一个有效的功能,即具备一定的絮凝效果,絮凝率为80.4%。众所周知,微生物絮凝剂因其无毒、无害、没有二次污染,是一种非常好的污水处理剂,在本研究中发现新的微生物絮凝剂的筛选来源,不仅为沙漠生物结皮微生物的筛选和利用提供了可参考的科学依据,同时也为水资源的污染处理带来了新的研究对象。
| [1] | Redfield E, Barns SM, Belnap J, et al. Comparative diversity and composition of Cyanobacteria in three predominant soil crusts of the Colorado Plateau[J]. FEMS Microbiology Ecology, 2002, 40(1): 55-63 |
| [2] | Wu J, Ye H. Characterization and flocculating properties of an extracellular biopolymer produced from a Bacillus subtilis DYU1 isolate[J]. Process Biochemistry, 2007, 42(7): 1114-1123 |
| [3] | Brabender M, Kiss áK, Domonell A, et al. Phylogenetic and morphological diversity of novel soil Cercomonad species with a description of two new genera (Nucleocercomonas and metabolomonas)[J]. Protist, 2012, 163(4): 495-528 |
| [4] | Liu C, Wang K, Jiang J, et al. A novel bioflocculant produced by a salt-tolerant, alkaliphilic and biofilm-forming strain Bacillus agaradhaerens C9 and its application in harvesting Chlorella minutissima UTEX2341[J]. Biochemical Engineering Journal, 2015, 93: 166-172 |
| [5] | Liu W, Yuan H, Yang J, et al. Characterization of bioflocculants from biologically aerated filter backwashed sludge and its application in dying wastewater treatment[J]. Bioresource Technology, 2009, 100(9): 2629-2632 |
| [6] | Wang ZR, Shen JP, Tian XL, et al. Optimization the production of exopolysaccharides by Bacillus thuringiensis 27 in sand biological soil crust and its bioflocculant activity[J]. African Journal of Microbiology Research, 2011, 16(5): 2359-2366 |
| [7] | Quan GJ. Laboratory Experiments in Microbiology[M]. Beijing: Chemical Industry Press, 2010: 122 (in Chinese)全桂静. 微生物学实验[M]. 北京: 化学工业出版社, 2010: 122 |
| [8] | Dong YW, Miao JZ, Cao ZH, et al. The Influence of different technique condition on the extracting of Lappa polysauharides by double enzymes[J]. Journal of Xuzhou Institute of Technology, 2007, 22(12): 20-23 (in Chinese) 董玉玮, 苗敬芝, 曹泽虹, 等. 不同工艺条件对酶法提取牛蒡多糖的影响[J]. 徐州工程学院学报, 2007, 22(12): 20-23 |
| [9] | Guo YD, Shan B, Li MY. Study on the removal of protein from polysaccharides of Momordica charantia L.[J]. Journal of Anhui Agricultural Sciences, 2009, 37(7): 3225-3227 (in Chinese) 郭育东, 单斌, 李敏仪. 苦瓜多糖脱蛋白方法的比较研究[J]. 安徽农业科学, 2009, 37(7): 3225-3227 |
| [10] | Zhang LX, Zhang TF, Li LY, et al. Method and Technique of Biochemical Experiment[M]. Beijing: Higher Educaiton Press, 1997: 94 (in Chinese) 张龙翔, 张庭芳, 李令媛, 等. 生化实验方法和技术[M]. 北京: 高等教育出版社, 1997: 94 |
| [11] | Han YZ, Liu EQ, Li YY, et al. Separation and purification of exopolysaccharides from Bacillus amyloliquefaciens and bioinformatic analysis of exopolysaccharide biosynthesis[J]. Food Science, 2014, 35(11): 179-184 (in Chinese) 韩玉竹, 刘恩岐, 李彦岩, 等. 芽孢杆菌活性多糖的分离纯化及合成基因研究[J]. 食品科学, 2014, 35(11): 179-184 |
| [12] | Li J, Song GQ, Chen KS, et al. Separation, purification and structure analysis of an extracellular polysaccharides from antarctic Bacterium Pseudoalteromonas sp. S-15-13[J]. Chemical Journal of Chinese Universities, 2008, 29(6): 1149-1152 (in Chinese) 李江, 宋国强, 陈靠山, 等. 南极适冷菌Pseudoalteromonas sp. S-15-13胞外多糖的分离、纯化和结构分析[J]. 高等学校化学学报, 2008, 29(6): 1149-1152 |
| [13] | Singh RP, Shukla MK, Mishra A, et al. Isolation and characterization of exopolysaccharides from seaweed associated bacteria Bacillus licheniformis[J]. Carbohydrate Polymers, 2011, 84(3): 1019-1026 |
| [14] | Liu CJ, Gu WY. Fractionation of extracellular polysaccharides from Agaricus blazei Murill and its antitumor activity[J]. Food and Fermentation Industries, 2001, 27(11): 27-29 (in Chinese) 刘常金, 文英. 巴西蘑菇胞外多糖的分离及抗肿瘤活性研究[J]. 食品与发酵工业, 2001, 27(11): 27-29 |
| [15] | Yin Y, Tian Z, Tang W, et al. Production and characterization of high efficiency bioflocculant isolated from Klebsiella sp. ZZ-3[J]. Bioresource Technology, 2014, 171: 336-342 |
 2015, Vol. 42
2015, Vol. 42